El problema clínico
El cáncer de próstata es actualmente el cáncer más diagnosticado (excluyendo el cáncer de piel no melanoma) y la segunda causa principal de muerte por cáncer entre los hombres estadounidenses. El cáncer de próstata se diagnosticó en aproximadamente 268 500 hombres en 2022, y aproximadamente 34 500 murieron a causa de él.
La enfermedad ocurre principalmente en personas mayores, con la mayor incidencia entre los hombres de 70 años y la mortalidad más alta entre los hombres de 80 años.
=> Recibir por Whatsapp las noticias destacadas
La incidencia entre los hombres negros no hispanos es 1,7 veces mayor que entre los hombres blancos no hispanos, y la mortalidad es 2,1 veces mayor; la incidencia y la mortalidad son más bajas entre los hombres hispanos y asiáticos que entre los hombres blancos y los hombres negros no hispanos.
PUNTOS CLÍNICOS CLAVE
Detección del cáncer de próstata
El cáncer de próstata es el cáncer más diagnosticado (excluyendo el cáncer de piel no melanoma) y es el cáncer con la segunda mortalidad más alta entre los hombres en los Estados Unidos. La supervivencia específica del cáncer de próstata a los 10 años es del 95% entre los hombres con enfermedad localizada.
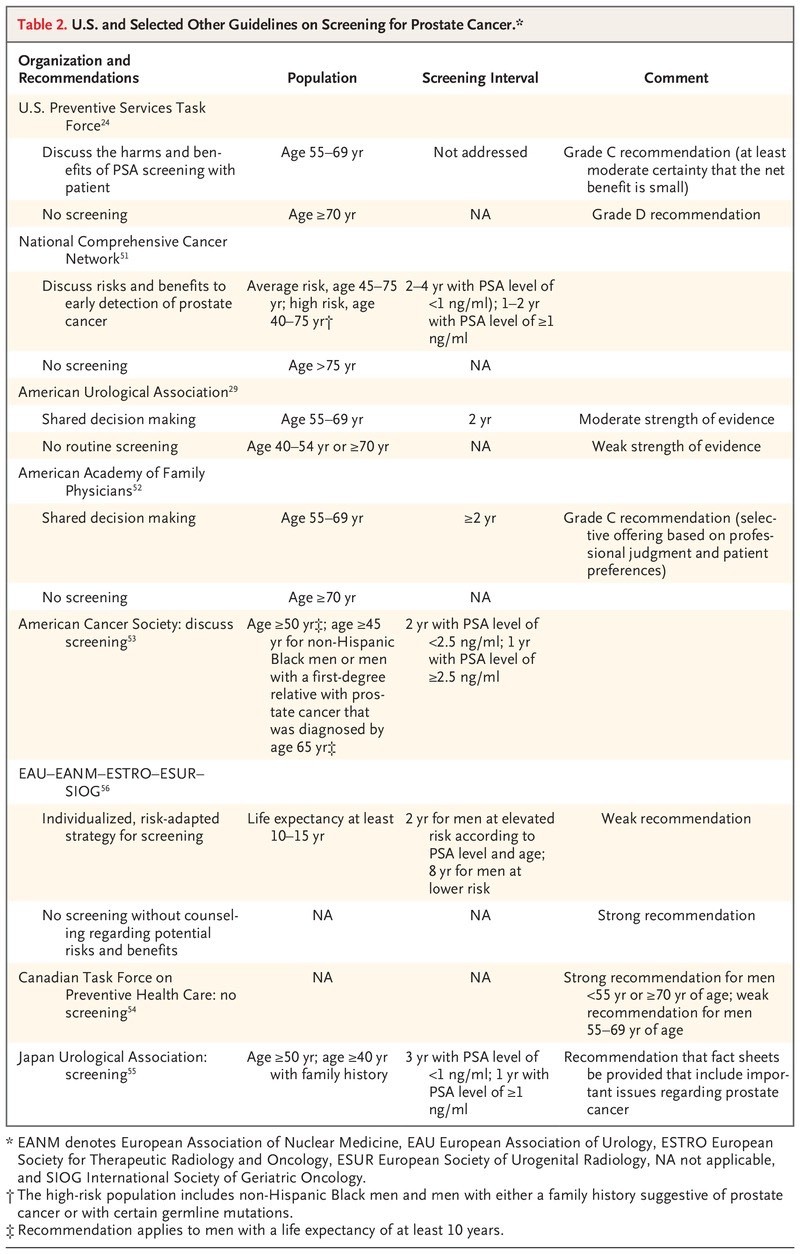
La detección del antígeno prostático específico (PSA, por sus siglas en inglés) debe implicar una toma de decisiones compartida considerando los riesgos y beneficios de la detección y las preferencias del paciente.
Los resultados de los ensayos aleatorizados respaldan una modesta reducción de la mortalidad por cáncer de próstata con la detección del PSA; la detección de 1000 hombres puede prevenir las muertes por cáncer de próstata en 1,3 hombres en los 13 años posteriores a la detección inicial.
Las personas con niveles elevados de PSA en el examen de detección pueden optar por someterse a más pruebas para informar la necesidad de una biopsia, resonancia magnética nuclear (RMN) multiparamétrica para identificar los objetivos de la biopsia, o ambas.
Las personas con cáncer de próstata de riesgo bajo o riesgo intermedio favorable pueden optar por someterse a vigilancia activa (pruebas periódicas de PSA y biópsias) en lugar de tratamiento curativo inmediato (cirugía o radioterapia).
Por lo general, la cirugía y la radioterapia brindan resultados excelentes en el cáncer de próstata, pero pueden provocar daños, como incontinencia urinaria y disfunción eréctil con la cirugía, y disfunción intestinal y disfunción eréctil con la radioterapia.
La medición del antígeno prostático específico (PSA), una proteína secretada por las células epiteliales prostáticas tanto normales como malignas, fue aprobada por la Administración de Alimentos y Medicamentos (FDA) en 1986 para su uso en el seguimiento de pacientes con cáncer de próstata conocido y más tarde (en 1994) como una ayuda en la detección del cáncer de próstata junto con el examen rectal digital en pacientes de 50 años de edad o más. En particular, esta aprobación se produjo en ausencia de evidencia de que la detección temprana del cáncer de próstata conduzca a mejores resultados para los pacientes.
Se reconoce ampliamente que el inicio de la detección generalizada de PSA a fines de la década de 1980 es la causa principal del fuerte aumento en la incidencia de cáncer de próstata que se observó en la próxima década; las tasas cayeron más tarde, comenzando aproximadamente en 2009 . Desde un pico a principios de la década de 1990, la mortalidad por cáncer de próstata disminuyó constantemente durante los siguientes dos décadas en aproximadamente un 50% y posteriormente ha permanecido esencialmente constante .
La asociación entre la detección del PSA y la mortalidad es menos clara que la asociación entre la detección y la incidencia, y se han realizado varios análisis para evaluar la contribución relativa de la detección (en comparación con otros factores, incluidas las mejoras en el tratamiento) a la reducción de la mortalidad. La estimación con el uso de un modelo cuantitativo mostró que algo menos de la mitad de la reducción de la mortalidad se debió al cribado.
En la mayoría de los casos de cáncer de próstata actualmente diagnosticados en los Estados Unidos, la enfermedad está localizada, y solo aproximadamente el 7 % de los pacientes presentan enfermedad metastásica. La enfermedad localizada se clasifica según el riesgo de progresión o muerte en función del estadio del tumor, nivel de PSA y grado del tumor.
El grado del tumor se ha resumido tradicionalmente por la puntuación de Gleason, pero más recientemente se ha informado en términos de grupo de grado, que varía de 1 (puntuación de Gleason, 6) a 5 (puntuación de Gleason, 9 o 10). La nomenclatura de grupos de grado clasifica una puntuación de Gleason de 6 como el grado más bajo de cáncer de próstata.
La puntuación de Gleason se compone de un grado primario (el más predominante) más un grado secundario (el más alto no predominante). En personas con enfermedad localizada, el cáncer de próstata clínicamente significativo generalmente se define como grupo de grado 2 o superior (puntuación de Gleason, ≥3+4) o grupo de grado 3 o superior (puntuación de Gleason, ≥4+3).
Para la enfermedad localizada, la supervivencia específica del cáncer de próstata a 10 años es de aproximadamente 95 %. Por el contrario, la supervivencia a 5 años es de aproximadamente 35 % para la enfermedad metastásica.
El tratamiento definitivo para la enfermedad localizada suele implicar radioterapia o prostatectomía radical. En la última década, la vigilancia activa surgió como una alternativa a la terapia inmediata y definitiva para personas con enfermedad localizada de bajo riesgo y para personas seleccionadas con enfermedad favorable de riesgo intermedio. La vigilancia activa incluye biópsias de vigilancia periódicas además de monitoreo de PSA, con un plan para iniciar terapia local con intención curativa si hay evidencia de progresión de la enfermedad. Aquí, revisamos la comprensión actual de los beneficios y daños de la prueba de PSA.
Estrategias y Evidencia
Interpretación de los niveles de PSA
En los Estados Unidos, un nivel de PSA de 4,0 ng por mililitro ha sido el umbral generalmente aceptado en el que los proveedores recomiendan la biópsia de próstata; en Europa, se ha utilizado más comúnmente un límite de 3,0 ng por mililitro. Sin embargo, no existe un nivel de PSA por debajo del cual se pueda descartar definitivamente el cáncer de próstata.
En el Ensayo de prevención del cáncer de próstata, se detectó cáncer de próstata en el 15,2 % de los hombres cuyos niveles de PSA se mantuvieron por debajo de 4,0 ng por mililitro durante los 7 años del ensayo y en el 6,6 % de los hombres con un nivel de PSA de 0,5 ng por mililitro o menos en el final del ensayo. Sin embargo, solo el 2,3 % de los hombres con un nivel de PSA de 4,0 ng por mililitro o menos tenían la enfermedad con una puntuación de grupo de grado de 2 o más, como se muestra en la biópsia al final del estudio.
Los datos del Physicians Health Study mostraron un riesgo acumulativo de cáncer de próstata letal de solo 0,3 % durante 15 años entre hombres de 55 a 59 años de edad con niveles iniciales de PSA inferiores a la mediana de 1,0 ng por mililitro.
ENSAYOS ALEATORIZADOS Y CONTROLADOS DE DETECCIÓN DE PSA
El Estudio Europeo Aleatorizado de Detección de Cáncer de Próstata (ERSPC) fué un ensayo multicéntrico, aleatorizado y controlado que se inició a principios de la década de 1990 para evaluar el efecto de la detección de PSA en la mortalidad por cáncer de próstata entre 162,388 hombres de 55 a 69 años de edad.
El cribado planificado implicó la evaluación del PSA cada 4 años con un umbral de recomendación de biópsia de 3,0 ng por mililitro, aunque hubo alguna variación entre los centros de estudio; al grupo de control no se le ofreció la detección como parte del ensayo (y se creía que las tasas de detección eran bajas, aunque las tasas no se evaluaron rigurosamente en los sitios del ensayo).
Entre los hombres del grupo de intervención, el número medio de exámenes, resultados positivos y biópsias por participante fue de 1,9, 0,33 y 0,27, respectivamente. El valor predictivo positivo de la biópsia fue del 24,8%. Los diagnósticos de cáncer de próstata fueron más comunes en el grupo de cribado que en el grupo de control (razón de tasas, 1,90 a los 9 años y 1,41 a los 16 años).
A los 16 años de seguimiento, el cociente de tasas de mortalidad por cáncer de próstata en el grupo de detección fue de 0,80 (intervalo de confianza [IC] del 95 %, 0,72 a 0,90); las proporciones de tasas fueron similares a los 11 y 13 años.
Las diferencias de riesgo por cada 1000 hombres fueron de 1,28 a los 3 años y de 1,76 a los 16 años, lo que da como resultado los números necesarios para invitar a la detección para prevenir una muerte por cáncer de próstata de 781 y 570, respectivamente.
En un análisis ajustado para los participantes que fueron invitados a someterse a un examen de detección pero no aceptaron, la razón de tasas de mortalidad por cáncer de próstata (durante 16 años) fue de 0,75.
En el ensayo Prostate, Lung, Colorrectal and Ovarian (PLCO), que comenzó en 1993, un total de 76683 hombres de 55 a 74 años de edad se aleatorizaron para la detección (intervención) o la atención habitual (control). La detección incluyó seis pruebas anuales de PSA mediciones y cuatro tactos rectales anuales; el umbral de recomendación de biópsia de PSA fue de 4,0 ng por mililitro.
La adherencia del grupo de intervención a la prueba de PSA osciló entre el 85 y el 89 % en las rondas de detección. Sin embargo, la prueba de PSA también fué común en el grupo de control, y los participantes en ese grupo se sometieron a aproximadamente la mitad de las pruebas que los participantes en el grupo de intervención. La incidencia de biópsia después de resultados positivos en la detección fue sustancialmente menor en el ensayo PLCO que en el Ensayo ERSPC.
La incidencia de cáncer de próstata fue ligeramente mayor en el grupo de intervención que en el grupo de control (razón de tasas, 1,12 a los 13 años). A los 15 y 17 años de seguimiento, los cocientes de tasas de mortalidad por cáncer de próstata fueron 1,04 (IC del 95 %, 0,87 a 1,24) y 0,93 (IC del 95 %, 0,81 a 1,08), respectivamente; el cociente de tasas para la enfermedad de los grupos de grado 4 o superior a los 17 años fue de 0,89 (IC del 95 %, 0,80 a 0,99).
El ensayo aleatorizado por grupos del Reino Unido de pruebas de PSA para el cáncer de próstata (CAP) fué un ensayo controlado, aleatorizado y basado en la atención primaria en el que se asignó a 419582 hombres de 55 a 69 años de edad para recibir una invitación para una prueba de detección de PSA por única vez (con biópsia de próstata recomendada en personas con niveles de PSA >3,0 ng por mililitro) o que no se les ofrezca la prueba de detección.
En la mediana de seguimiento de 10 años, el cociente de tasas para el diagnóstico de cáncer de próstata fué de 1,19 (IC del 95 %, 1,14 a 1,25). La mortalidad por cáncer de próstata no difirió significativamente entre los grupos (0,30 en el grupo de intervención frente a 0,31 en el grupo de control por 1000 años-persona; razón de tasas, 0,96; IC del 95 %, 0,85 a 1,08). Un análisis que tuvo en cuenta la adherencia al cribado mostró resultados similares (razón de tasas, 0,93; IC del 95 %, 0,67 a 1,29).
Las revisiones sistemáticas de los ensayos de detección de PSA han observado un alto riesgo de sesgo en el ensayo PLCO debido a la contaminación del grupo de control y en el ensayo CAP debido a la baja adherencia a la detección. Una revisión realizada por el Grupo de Trabajo de Servicios Preventivos de EE. UU. (USPSTF ) también señalaron que había dudas sobre la aplicabilidad de los resultados del ensayo ERSPC en los Estados Unidos debido a un umbral de positividad del PSA más bajo (3 ng por mililitro) y una mayor incidencia de biópsias de lo habitual en la práctica estadounidense, y señalaron un mayor uso de prostatectomía radical en el grupo de intervención que en el grupo de control.
La revisión del USPSTF dió como resultado una estimación, basada en datos de ensayos controlados aleatorios, de que la detección de 1000 hombres estadounidenses de 55 a 69 años de edad puede prevenir las muertes por cáncer de próstata en 1,3 hombres en los 13 años posteriores al cribado inicial.
ENSAYOS CONTROLADOS Y ALEATORIZADOS DE MANEJO CONSERVADOR O TRATAMIENTO CURATIVO
El ensayo Scandinavian Prostate Study Group (SPCG)–4 y el U.S. Prostate Intervention versus Observation Trial (PIVOT) asignaron aleatoriamente a hombres para someterse a una prostatectomía o recibir observación sin intención curativa. Ambos ensayos mostraron una menor incidencia de muerte por cáncer de próstata con cirugía que con observación, aunque la diferencia entre cirugía y observación no fue significativa en el ensayo PIVOT (razón de tasas de SPCG-4, 0,56; IC del 95 %, 0,41 a 0,77; y razón de tasas de PIVOT, 0,63; IC del 95 %, 0,36 a 1.09).
La mayor diferencia absoluta en la incidencia de muerte por cáncer de próstata entre la observación y la cirugía en el ensayo SPCG-4 en comparación con el ensayo PIVOT (12 puntos porcentuales frente a 4 puntos porcentuales) reflejó un mayor riesgo inicial entre los hombres del ensayo SPCG-4, entre los que se detectaron menos cánceres mediante el cribado de PSA (12 % en el ensayo SPCG-4 frente a 75 % en el ensayo PIVOT).
El ensayo Prostate Testing for Cancer and Treatment (ProtecT) inscribió solo a participantes que tenían cáncer que fue diagnosticado después de que la prueba de detección revelara un PSA elevado, el 77 % de los cuales tenía una enfermedad del grupo de grado 1 (enfermedad clínicamente insignificante).
Hombres en el ensayo ProtecT fueron asignados al azar a prostatectomía, radioterapia o monitoreo activo (es decir, pruebas de PSA en serie, con aumentos en el nivel de PSA que desencadenaron la consideración de una biópsia).
En la mediana de seguimiento de 10 años, la mortalidad por cáncer de próstata por 1000 años-persona fue baja (1,5 en el grupo de prostatectomía, 0,9 en el grupo de radioterapia y 0,7 en el grupo de monitorización activa) y no difirió significativamente entre los grupos.
Sin embargo, la tasa de metástasis por 1000 años-persona fue significativamente mayor con la monitorización activa (6,3) que con la prostatectomía radical (2,4) o la radioterapia (3,0), y al final del seguimiento, el 55 % de los hombres en el grupo de seguimiento activo había cruzado al tratamiento activo.
Un informe actualizado con una mediana de 15 años de seguimiento tampoco mostró diferencias significativas en la mortalidad por cáncer de próstata entre los grupos; el porcentaje de hombres con enfermedad metastásica fue del 9,4 % en el grupo de seguimiento activo en comparación con el 4,7 % y el 5,0 % en los grupos de prostatectomía radical y radioterapia, respectivamente.
DAÑOS DE LA DETECCIÓN
Entre los daños asociados con la prueba de PSA se encuentra la realización de biópsias innecesarias y los riesgos asociados con esos procedimientos. Se estima que el porcentaje acumulativo de resultados falsos positivos de PSA está entre el 10 % y el 15 % en varias (tres o cuatro) rondas de pruebas de detección. , con aproximadamente un 5 % de riesgo de un resultado positivo falso con una biópsia negativa posterior.
Según datos de una base de datos de aseguradoras privadas de EE. UU., desde 2008 hasta 2014, se realizaron una media de 1,8 biópsias por cada 100 pruebas de PSA, con un porcentaje de positividad del 37 %. El mayor riesgo asociado con la biópsia de próstata es la infección, que ocurre en 5 a 7% de los pacientes y resulta en hospitalización en 1 a 3%.
Otras complicaciones incluyen hematuria (incidencia, <1%), sangrado rectal que conduce a una intervención médica (incidencia, aproximadamente 2.5%) y, con menos frecuencia, obstrucción urinaria o retención o disfunción eréctil transitoria. Además, la biópsia de próstata puede estar asociada con una incomodidad sustancial.
La detección da como resultado un sobrediagnóstico sustancial (definido como la identificación de un caso de cáncer de próstata que de otro modo no se habría diagnosticado durante la vida del paciente sin la detección).
Un análisis que se realizó con el uso de tres modelos de historia natural estimó que en el período 1985-2000, del 23 al 42% de los casos de cáncer de próstata detectados por tamizaje fueron sobrediagnosticados. A la luz de esta estimación, los riesgos asociados con el tratamiento son de preocupación particular.
Un metanálisis mostró que la prostatectomía radical se asoció con riesgos sustancialmente elevados tanto de disfunción eréctil como de incontinencia urinaria. Aunque los datos no fueron concluyentes en cuanto a si el riesgo de estos eventos adversos fué mayor después de la radioterapia que con el tratamiento conservador, hubo algunas pruebas de riesgo elevado de disfunción eréctil. En el ensayo ProtecT, la radioterapia, pero no la prostatectomía radical, se asoció con una peor función intestinal que la monitorización activa.
GESTIÓN DE EXÁMENES POSITIVOS
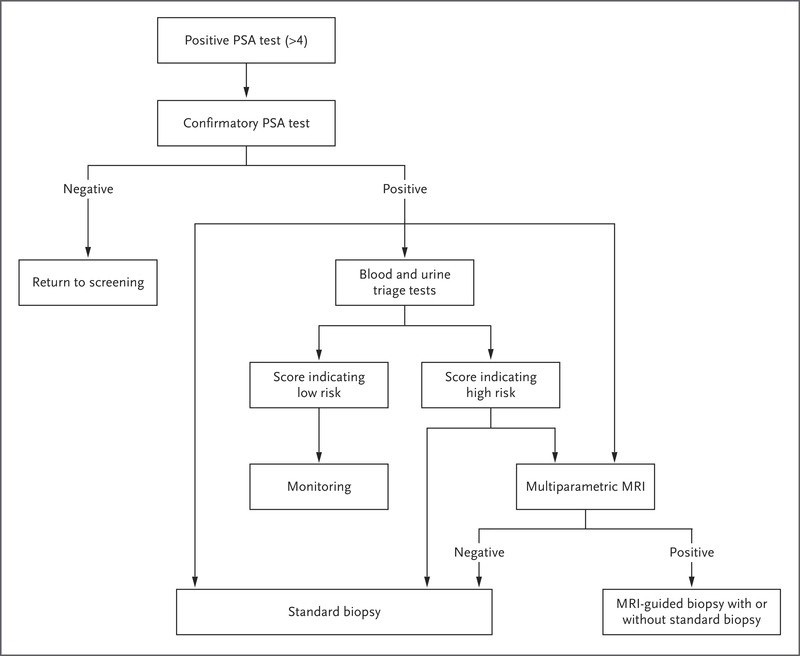
Ver Figura 1.
Seguimiento después de la prueba de detección de PSA.
La figura 1 muestra las estrategias de manejo después de una prueba de PSA positiva. Los pasos iniciales incluyen una repetición de la prueba de detección para descartar un error de laboratorio y la evaluación de la posibilidad de causas transitorias o tratables de elevación del PSA (p. ej., prostatitis, hiperplasia prostática benigna, eyaculación reciente o ejercicio vigoroso).
Los agentes antibióticos no se recomiendan para el tratamiento de los niveles elevados de PSA en ausencia de síntomas. Después de la confirmación de un aumento inexplicable en el nivel de PSA, las evaluaciones adicionales que pueden reducir las biópsias innecesarias incluyen la cinética del PSA (cambio con el tiempo) y la orina o la sangre[ pruebas moleculares de base (Figura 1)]; sin embargo, ninguna de estas evaluaciones puede descartar definitivamente el cáncer de próstata.
Un artículo de revisión describió seis pruebas basadas en sangre u orina que fueron diseñadas para evaluar el riesgo de enfermedad del grupo de grado 2 o superior en hombres con un nivel elevado de PSA. Todas las pruebas tuvieron un rendimiento similar; el área bajo la curva (AUC) osciló entre 0,77 y 0,82 para el uso de la prueba sola o junto con variables clínicas.
Para el contexto, con una incidencia de fondo de la enfermedad del grupo de grado 2 o superior del 36 % entre los hombres remitidos para biópsia, un AUC de 0,81 se tradujo en la evitación del 22 al 37 % de las biópsias, dependiendo de los puntos de corte que se usaron, con el correspondiente posibilidades de diagnósticos perdidos del grupo de grado 2 o superior en 1 a 5% de los hombres.
El método estándar de diagnóstico tisular del cáncer de próstata es el procedimiento de biópsia sistemática guiada por ultrasonografía de 12 núcleos.
Sin embargo, se ha demostrado que las biópsias estándar guiadas por ultrasonografía subestiman el grado del tumor, determinado en la prostatectomía, en 30 a 50 % de los hombres. Se ha demostrado que el uso de plataformas de resonancia magnética (RM) multiparamétrica para guiar la biópsia reduce la incidencia de clasificación errónea y para aumentar la incidencia de detección de enfermedad clínicamente significativa. Una puntuación de 3 o más en la escala del Sistema de datos e informes de imágenes de la próstata (PI-RADS) (las puntuaciones varían de 1 a 5, y las puntuaciones más altas indican una mayor incidencia de cáncer riesgo) para cualquier lesión solicita una biópsia guiada por resonancia magnética de la lesión.
La biópsia sistemática también se realiza típicamente, aunque el rendimiento adicional parece ser muy bajo en personas con lesiones con una puntuación de 5 en la escala PI-RADS. y tienen un nivel elevado de PSA y resultados no sospechosos en la resonancia magnética.
Una desventaja potencial de la mayor sensibilidad de la resonancia magnética en la identificación de lesiones pequeñas de mayor grado es el riesgo de sobrediagnóstico. Por ejemplo, un estudio mostró que entre 999 hombres con biópsias estándar negativas, la adición de biópsias dirigidas por resonancia magnética condujo a la detección de enfermedad del grupo de grado 1 y del grupo de grado 2 en el 7,4 % y el 7,5 % de los hombres, respectivamente, la gran mayoría de los cuales habría tenido una enfermedad clínicamente insignificante.
Toma de decisiones compartida y ayudas para la toma de decisiones
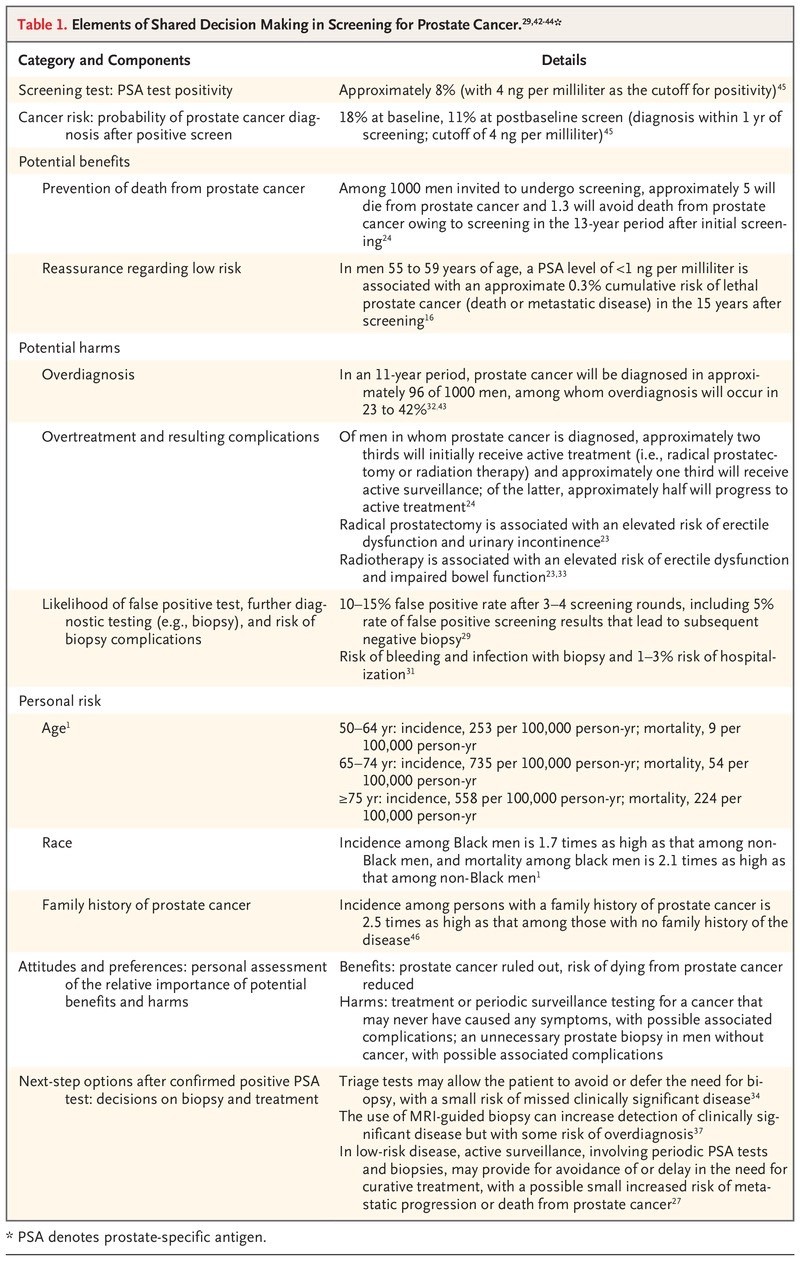
Ver Tabla 1.
Elementos de la toma de decisiones compartida en la detección del cáncer de próstata.
La toma de decisiones que implique el intercambio de información entre el paciente y el médico y la participación conjunta en el proceso de toma de decisiones debe ser un componente integral de una oferta de detección de PSA.
El médico debe discutir con pacientes individuales los posibles beneficios y daños de la detección y revise las opciones posteriores en el caso de una pantalla positiva, y los pacientes deben compartir con el médico sus valores y preferencias. La Tabla 1 describe las consideraciones recomendadas para estas discusiones.
El uso de ayudas para la toma de decisiones, herramientas que ayudan a los pacientes a comprender los beneficios y los daños de someterse a exámenes de detección, puede facilitar la toma de decisiones compartida.
Los resultados de un metanálisis de ensayos controlados aleatorios que evaluaron las ayudas para la toma de decisiones en comparación con la atención habitual sin el uso de ayudas para la toma de decisiones mostraron mejoras modestas en el conocimiento del paciente y una pequeña disminución en el conflicto de decisiones (es decir, incertidumbre personal sobre qué curso de acción tomar), pero no hubo diferencias significativas en la frecuencia de las discusiones de detección con los médicos o en la proporción de pacientes que decidieron someterse a la detección.4
Otro metanálisis mostró hallazgos similares con respecto al conocimiento y el conflicto decisional, pero también mostró una pequeña reducción en la proporción de hombres que planeaban someterse a pruebas de detección. Sin embargo, no hubo un efecto significativo en el número de pacientes que realmente se sometieron a pruebas de detección de PSA en el próximo año. También se han desarrollado ayudas para la toma de decisiones diseñadas específicamente para pacientes negros.
Áreas de incertidumbre
Aunque numerosas series han demostrado la seguridad de la vigilancia activa con respecto a la mortalidad por cáncer de próstata, persisten dudas sobre los criterios de selección de pacientes apropiados (p. ej., qué pacientes con enfermedad de grado 2 pueden diferir con seguridad la terapia definitiva y el uso apropiado de biomarcadores), estrategias de monitoreo ( p. ej., la frecuencia de la biópsia de vigilancia y la necesidad de control del PSA) y factores desencadenantes de la intervención (p. ej., qué grado de progresión del grado tumoral es aceptable). Se desconoce si la adaptación de la detección según la etnia, las puntuaciones de riesgo poligénico u otros factores da como resultado mejores resultados.