Ronald Palacios Castrillo
Resumen
Un trazador de tomografía por emisión de positrones (PET) que detecte la patología de la α-sinucleína mejorará el diagnóstico y, en última instancia, el tratamiento de las enfermedades relacionadas con la α-sinucleína. Smith y colaboradores ((Nature Communications 14, Número de artículo: 6750 ,2023), muestran que el ligando PET, [18F]ACI-12589, tiene buena afinidad y especificidad in vitro por la α-sinucleína patológica en tejidos de pacientes con diferentes trastornos relacionados con la α-sinucleína, incluida la enfermedad de Parkinson (EP) y la atrofia multisistémica(MSA), utilizando técnicas de autorradiografía y radiounión.
En la evaluación clínica inicial incluyeron 23 participantes con trastornos relacionados con la α-sinucleína, 11 con otros trastornos neurodegenerativos y ocho controles. In vivo, [18F]ACI-12589 demuestra una unión clara en la sustancia blanca cerebelosa y los pedúnculos cerebelosos medios de pacientes con MSA, regiones que se sabe que están muy afectadas por la patología de la α-sinucleína, pero muestra una unión limitada en la EP.
La unión separa estadísticamente a los pacientes con MSA de los controles sanos y de los sujetos con otros trastornos neurodegenerativos, incluidas otras sinucleinopatías. Los resultados indican que la patología de la α-sinucleína en MSA se puede identificar utilizando imágenes PET con [18F]ACI-12589, lo que potencialmente mejora el diagnóstico de MSA y permite la detección de la participación del fármaco en el objetivo in vivo de nuevas terapias dirigidas a la α-sinucleína.
=> Recibir por Whatsapp las noticias destacadas
Introducción
Las enfermedades neurodegenerativas comparten la característica común de la agregación patológica de proteínas, siendo el β-amiloide (Αβ), tau y α-sinucleína (α-syn) las proteínas agregantes más prevalentes. Si bien se han logrado avances significativos para el diagnóstico de Aβ y tau, hasta ahora no se dispone de ningún biomarcador de imagen confiable para α-syn.
Los trastornos relacionados con α-syn más destacados, la enfermedad de Parkinson (EP), la demencia con cuerpos de Lewy (DLB) y la atrofia sistémica múltiple (MSA), muestran manifestaciones clínicas distintas que corresponden a las diferencias en las distribuciones regionales de la patología α-syn subyacente. .Clínicamente, la EP se caracteriza por rigidez, bradicinesia y temblor en reposo.
La DLB comparte estos síntomas del parkinsonismo y aparece en paralelo con el deterioro cognitivo caracterizado por alucinaciones y anomalías cognitivas ejecutivas y visoespaciales fluctuantes.
La MSA se caracteriza por insuficiencia autonómica en combinación con parkinsonismo y/o ataxia y con frecuencia progresa hasta involucrar síntomas del tronco encefálico como disartria y dificultades para tragar.
La MSA puede presentarse con un fenotipo dominado por el parkinsonismo (MSA-P) o uno dominado por la ataxia cerebelosa (MSA-C), pero también es común una combinación de los dos fenotipos.
El diagnóstico de MSA puede ser difícil, particularmente en las primeras etapas de la enfermedad, porque se basa principalmente en síntomas clínicos que se comparten con otros trastornos del movimiento como la EP, la parálisis supranuclear progresiva (PSP) y la degeneración corticobasal(DCB). Por tanto, disponer de herramientas que ayuden en el diagnóstico diferencial precoz de la MSA supondría un avance muy significativo.
Los depósitos que contienen α-syn son el sello histopatológico de las sinucleinopatías, pero la acumulación de α-syn es, no obstante, heterogénea en diferentes enfermedades en términos de su distribución, conformación y capacidad de siembra.
En la EP, la patología se presenta principalmente como inclusiones neuronales en forma de cuerpos de Lewy o neuritas, que suelen aparecer primero en el tronco del encéfalo y se extienden a través del mesencéfalo/sustancia negra hasta la corteza temporal medial y, a través de la mesocorteza, hasta la neocorteza. La DLB presenta una patología celular similar a la de la EP, pero con una distribución más amplia en regiones corticales.
En la MSA, la patología distintiva α-syn se manifiesta principalmente en los oligodendrocitos como inclusiones citoplásmicas gliales, que son especialmente prominentes en la sustancia blanca del tronco del encéfalo y el cerebelo.
También se observan diferencias entre las sinucleinopatías a nivel ultraestructural y funcional. La microscopía crioelectrónica de alta resolución (crio-EM) revela que las estructuras de plegamiento del α-syn fibrilar demuestran diferencias en la EP y la DLB en comparación con la MSA.
Además, las técnicas de amplificación cíclica recientemente establecidas (por ejemplo, RT-QuIC) también demuestran diferencias en las capacidades de siembra de α-syn del líquido cefalorraquídeo (LCR) de pacientes con EP versus MSA.
Se han desarrollado con éxito radiotrazadores de tomografía por emisión de positrones (PET) para especies patológicas de Αβ y tau, proporcionando conocimientos sin precedentes sobre la correlación de la patología molecular en desarrollo en el cerebro vivo con la evolución de los síntomas clínicos.
Además, las imágenes PET con Αβ se han utilizado recientemente como medida única de eficacia sustituta primaria en un ensayo de inmunoterapia para la enfermedad de Alzheimer. Asímismo, los trazadores de tau han demostrado su capacidad no sólo para detectar inclusiones de tau en el cerebro sino también para respaldar el diagnóstico diferencial basado en la distribución de la señal.
Por lo tanto, el primer objetivo de Smith y colegas fue aprovechar la biblioteca Morphomer® patentada de AC Immune para identificar una pequeña molécula penetrante en el cerebro con alta afinidad por los agregados α-syn y buena selectividad sobre otras posibles patologías (o copatologías) cerebrales. En segundo lugar, necesitábamos determinar si el radiotrazador α-syn candidato seleccionado, [18F]ACI-12589, podría proporcionar una señal sólida y significativa para revelar la neuropatología de sinucleína específica de la enfermedad in vivo.
Aquí, reportan los datos de PET [18F]ACI-12589 de sujetos de control sanos y pacientes con α-sinucleinopatías y otros diagnósticos neurológicos, que muestran un patrón de retención específico y reproducible en pacientes con MSA. Por lo tanto, el radiotrazador [18F]ACI-12589 puede constituir una herramienta de diagnóstico importante para identificar, caracterizar y rastrear clínicamente la patología α-syn en MSA. Como tal, esto puede considerarse un avance muy esperado en los biomarcadores estatales de las α-sinucleinopatías.
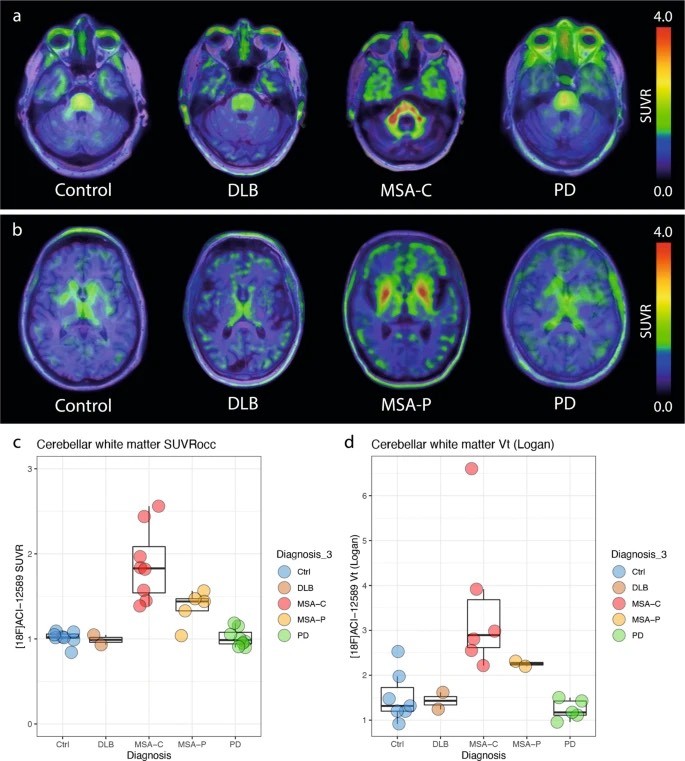
Figura 1.
a. Imágenes transversales a nivel de los pedúnculos cerebelosos medios en un participante control y pacientes con DLB, MSA-C y EP. b Imágenes transversales a nivel de los ganglios basales en un participante control y pacientes con DLB, MSA-P y EP.
Las imágenes SUVR para (a, b) se crearon utilizando la corteza occipital como región de referencia. c Valores de SUVR en la sustancia blanca cerebelosa en los diferentes grupos de enfermedades (Ctrl n = 8, DLB n = 2, MSA-C n = 8, MSA-P n = 5, PD n = 8). d Valores de VT derivados del modelado de análisis gráfico de Logan en la sustancia blanca cerebelosa en los diferentes grupos de enfermedades con sangre disponible y datos PET dinámicos.
Los diagramas de caja muestran la mediana, el IQR (cuadro) y los bigotes (Q1 − 1,5*IQR/Q3 + 1,5*IQR o valor mínimo/máximo, valores atípicos no incluidos) (Ctrl n = 7, DLB n = 2, MSA-C n = 6, MSA-P n = 2, PD n = 5). Demencia DLB con cuerpos de Lewy, atrofia sistémica múltiple MSA-C con fenotipo cerebeloso, atrofia sistémica múltiple MSA-P con fenotipo parkinsoniano, región de referencia de la corteza occipital occ, enfermedad de Parkinson EP, índice de valores de captación estandarizados de SUVR, volumen de distribución de VT.
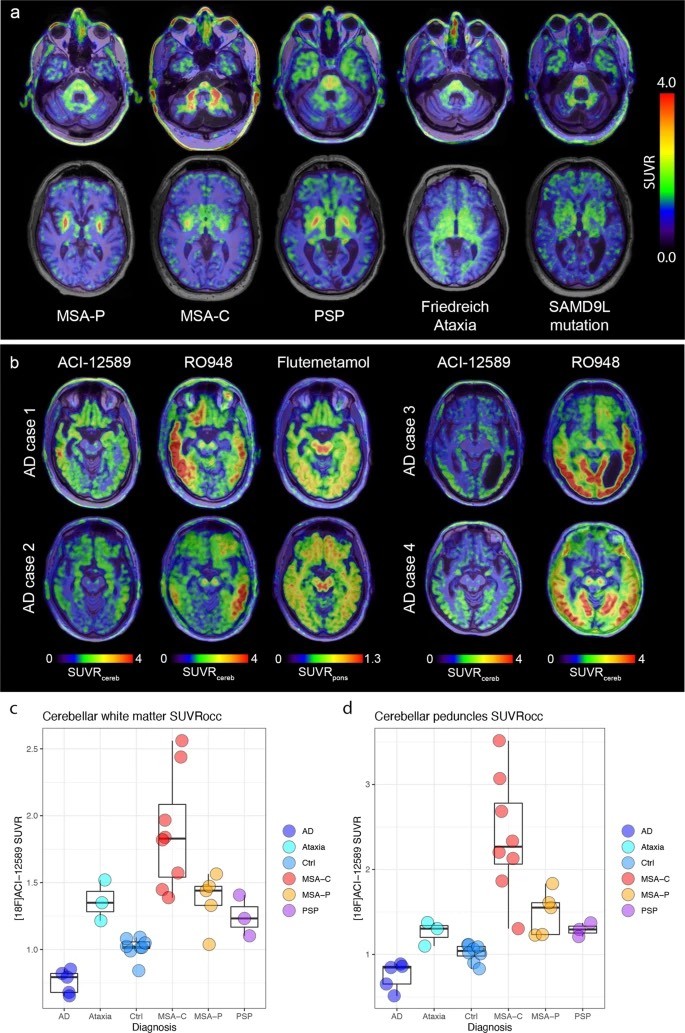
Figura 2.
Imágenes transversales a nivel de los pedúnculos cerebelosos medios (fila superior) y los ganglios basales (fila inferior) en pacientes representativos con MSA-C, MSA-P, PSP, ataxia de Friedreich y ataxia cerebelosa debida a una mutación SAMD9L.
Las imágenes SUVR en (a) se crearon utilizando la corteza occipital como región de referencia. b) imágenes transversales a nivel de la sustancia negra en pacientes con EA usando [18F]ACI-12589, [18F]RO948 (tau) y [18F]Flutemetamol (β-amiloide) como se indicó anteriormente.
Las imágenes SUVR se generaron utilizando una región de referencia del cerebelo (ACI-12589 y RO948) o de la protuberancia (Flutemetamol). c) Valores de SUVRocc en la sustancia blanca cerebelosa en los diferentes grupos de enfermedades. d) Valores de SUVRocc en los pedúnculos cerebelosos medios en los diferentes grupos de enfermedades.
Los diagramas de caja muestran la mediana, el IQR (cuadro) y los bigotes (Q1 − 1,5*IQR/Q3 + 1,5*IQR o valor mínimo/máximo, no se incluyen los valores atípicos). N: números para (c, d): AD n = 5, Ataxia n = 3, Ctrl n = 8, MSA-C n = 8, MSA-P n = 5, PSP n = 3).
Enfermedad de Alzheimer AD, ataxias cerebelosas Ataxia (ataxia de Friedreich y ataxia cerebelosa debido a una mutación SAMD9L), región de referencia de materia gris cerebelocerebosa, sujetos control Ctrl, atrofia sistémica múltiple MSA-C con fenotipo cerebeloso, atrofia sistémica múltiple MSA-P con fenotipo parkinsoniano, parálisis supranuclear progresiva PSP, SUVRocc SUVR con una región de referencia de la corteza occipital, relación de valores de captación estandarizados de SUVR.
Discusión
Un ligando de PET para detectar patología α-syn in vivo ha sido durante mucho tiempo una necesidad clínica insatisfecha.
El principal obstáculo para este logro ha sido la identificación de ligandos capaces de detectar selectivamente inclusiones α-syn, que están presentes en una densidad mucho menor que otros objetivos, como el β-amiloide patológico o tau. Smith y colegas reportan la caracterización clínica preclínica e inicial de ACI-12589, que ha demostrado: (i) que es posible visualizar la patología α-syn cerebral en pacientes mediante PET y, (ii) que esta señal puede diferenciar los casos de MSA de los controles y otros casos de enfermedades neurodegenerativas( NDD).
Las propiedades in vitro de ACI-12589 indican que el trazador se une específicamente a α-syn con valores de Kd de 33,5 ± 17,4 nM, al tiempo que muestra una buena selectividad frente a β-amiloide y tau.
Ex vivo, se demostró la participación del objetivo en las inclusiones α-syn presentes como patología primaria, como en los tejidos MSA, PD, DLB y PDD, pero también como copatología, como en los tejidos AD y PSP. Finalmente, en pacientes, se observó una señal PET alta para [18F]ACI-12589 en la sustancia blanca cerebelosa y los pedúnculos cerebelosos medios en participantes con MSA dominada por ataxia cerebelosa (MSA-C) y MSA dominada por parkinsonismo (MSA-P). ). La retención en las estructuras cerebelosas fue mayor en los participantes con síntomas cerebelosos y del tronco encefálico (MSA-C) en comparación con MSA-P.
También se observó captación del trazador en los núcleos lenticulares de los participantes con MSA-P, lo que indica una afectación de los ganglios basales. Por lo tanto, la captación se correlacionó bien con la distribución esperada de la patología α-syn en ambos subtipos de MSA.
Los resultados actuales son congruentes con un breve informe que describe patrones de unión diferenciales del radiotrazador α-syn [18F]SPAL-T-06 en un estudio limitado de cuatro participantes, tres con MSA y un control.
A diferencia del informe anterior, el presente estudio describe una gran cantidad de trabajo que amplía nuestras observaciones iniciales presentadas en las actas de la conferencia y establece el uso de trazadores de focalización α-syn, como [18F]ACI-12589, para demostrar una función específica y patrón reproducible de patología en pacientes con subtipos MSA-P y MSA-C.
[18F]La retención de ACI-12589 en la sustancia blanca cerebelosa y los pedúnculos cerebelosos distinguió claramente a los participantes con MSA de los controles y a los participantes con EP o DLB. No se observó retención específica de región en EP o DLB.
Existen varias explicaciones potenciales para la falta de una retención clara de [18F]ACI-12589 en la EP y la DLB. Una razón probable es la menor densidad de patología α-syn en estos trastornos en comparación con MSA.
Esta noción está respaldada por la retención elevada de [18F]ACI-12589 encontrada en los casos de EP familiar debido a la duplicación del gen α-syn (SNCA), que se espera que presenten una patología α-syn más densa y extendida en comparación con los casos de EP idiopática.
Curiosamente, uno de los casos de EP monogénicos con duplicación de SNCA que exhibió deterioro cognitivo también mostró cierta retención cortical de [18F]ACI-12589, lo que es consistente con la carga patológica esperada subyacente a este fenotipo.
No obstante, se necesitarán estudios en casos adicionales de sinucleinopatía no MSA con diferentes cargas y patrones de distribución de α-syn esperados para sacar conclusiones firmes.
Otra posible explicación para la baja unión en PD/DLB son las diferencias potenciales en la conformación de los agregados α-syn en PD/DLB idiopática en comparación con MSA. Estas diferencias se han descrito recientemente a nivel molecular mediante crio-EM, y también se informan en base a los ensayos de amplificación de siembra RT-QuIC desarrollados recientemente.
Además, las diferencias en la expresión de la isoforma α-syn y las modificaciones postraduccionales entre las diferentes sinucleinopatías20 podrían explicar potencialmente las diferencias en la retención de [18F]ACI-12589.
Al comparar los casos de MSA con participantes con otras NDD, como ataxias hereditarias, PSP y AD, se observó cierta retención de trazadores en áreas del cerebro afectadas por la enfermedad, incluso en los casos sin MSA.
Las razones de esta retención no están completamente claras y la unión fuera del objetivo a otro proceso neurodegenerativo o la presencia de copatologías α-syn son explicaciones potenciales y no mutuamente excluyentes.
La presencia de múltiples copatologías es una característica conocida en los NDD21, y los depósitos de α-syn se encuentran con frecuencia en la EA, pero también se informan en la PSP, entre otros. La premisa de que la señal de PET observada podría estar relacionada en parte con α-syn está respaldada por datos que muestran que ACI-12589 puede unirse a la copatología α-syn en tejidos de AD y PSP ex vivo.
Aunque ACI-12589 tiene un perfil limpio fuera del objetivo in vitro, no podemos descartar que algunas de las señales relacionadas con la enfermedad in vivo representen una unión fuera del objetivo. Sin embargo, hemos considerado algunos de los contribuyentes más probables asociados con procesos neuroinflamatorios o neurodegenerativos.
Un paradigma in vivo establecido de bloqueo de MAO-B con selegilina no mostró interferencia con la retención de [18F]ACI-12589 en la sustancia blanca cerebelosa en MSA, lo que habla en contra de una contribución significativa de la unión de MAO-B a la señal de PET observada en esta región.
Los datos in vitro también caracterizaron la posible unión de MAO-B como limitada. No obstante, no podemos descartar una contribución de MAO-B a la retención de [18F]ACI-12589, particularmente en áreas con alta expresión de MAO-B, como los ganglios basales.
Encontramos una colocalización y una correlación significativa entre [18F]ACI-12589 y [18F]RO948 (un ligando tau-PET) in vivo en la EA.
De manera similar, en PSP, la retención de [18F]ACI-12589 coincidió con la distribución esperada de la patología tau. Como no se informó ex vivo sobre la unión del objetivo de ACI-12589 a los ovillos neurofibrilares de tau, es poco probable que la unión a tau patológica sea la fuente principal de esta señal de PET. Posiblemente, la co-localización de las señales [18F]ACI-12589 y [18F]RO948 podría reflejar una unión fuera del objetivo a un proceso neurodegenerativo aguas abajo de tau. La naturaleza exacta de la unión de este ligando de PET en diferentes NDD será un tema de trabajo futuro.
Al ser las primeras exploraciones en humanos, el objetivo del presente trabajo fue comprender la utilidad de [18F]ACI-12589 como trazador PET para NDD mediadas por α-syn, lo que llevó al descubrimiento de su capacidad para discriminar significativamente casos de MSA.
La principal limitación de este estudio es el número relativamente bajo de participantes, particularmente para sinucleinopatías distintas de MSA y otras NDD. Por lo tanto, los resultados sobre la vinculación en estas enfermedades deben considerarse preliminares. De manera similar, la unión baja y variable en la EP esporádica merece estudios más profundos con cohortes de pacientes más grandes.
Los puntos fuertes del estudio son la caracterización preclínica exhaustiva de ACI-12589 y los datos in vitro que respaldan la especificidad y selectividad de α-syn, el escaneo dinámico con muestreo de sangre arterial y el modelado cinético del rendimiento in vivo del radiotrazador, así como la gran cohorte de participantes de MSA reclutados.
En conclusión, los resultados actuales indican que [18F]ACI-12589 podría usarse para mejorar el diagnóstico de MSA, lo que conduciría a un diagnóstico más temprano. Además, estos hallazgos indican que los trazadores de α-syn podrían permitir la detección de la participación del fármaco en el objetivo in vivo en ensayos clínicos de nuevas terapias dirigidas a α-syn.