Introducción
La esclerosis múltiple (MS) es una enfermedad autoinmune crónica del sistema nervioso central (SNC) caracterizada por neuroinflamación y neurodegeneración. En 2020, el atlas de MS informó que una persona con una edad promedio de 32 años es diagnosticada con MS cada 5 minutos en todo el mundo, lo que se suma a aproximadamente 2,8 millones de personas que actualmente viven con la enfermedad. Sorprendentemente, la prevalencia de la MS en todo el mundo ha aumentado un 30 % desde 2013. Este aumento puede atribuirse en parte a una mejor notificación y diagnóstico, pero muchos de sus factores subyacentes siguen sin conocerse. En cuanto a las terapias para la MS, a pesar de una mejora en la eficacia y las opciones, en su mayoría siguen estando limitadas a la MS con recaídas y remisiones. En esta revisión, resumimos la comprensión actual de los factores predisponentes de la MS, los mecanismos de la patología de la enfermedad y las intervenciones terapéuticas.
Presentación de la enfermedad y patología.
Los registros históricos describen una enfermedad que recuerda a la MS ya en el siglo XIV. En 1868, Jean-Martin Charcot llamó a esta enfermedad sclérose en plaques, que luego se adaptó a la esclerosis múltiple. Charcot y colaboradores establecieron que las características patológicas de la MS incluyen lesiones en Áreas de materia gris y blanca del SNC con grados variables de desmielinización, infiltración de células inmunitarias perivasculares, gliosis reactiva y/o neurodegeneración.La transección axonal y las alteraciones de la barrera hematoencefálica (BHE) se describieron más tarde como características adicionales de estas lesiones.
=> Recibir por Whatsapp las noticias destacadas
Diagnóstico y seguimiento de la MS
La MS se diagnostica con base en características clínicas, bioquímicas y radiológicas que indican una diseminación en el tiempo y en el espacio de las lesiones del SNC. Estas características incluyen síntomas de disfunción motora, sensorial y/o cognitiva; la presencia de bandas oligoclonales (OCB) en el líquido cefalorraquídeo (LCR) -anticuerpos indicativos de inflamación del SNC-; y la detección de lesiones del SNC mediante imágenes por resonancia magnética (MRI) utilizando exploraciones ponderadas en T2 para proporcionar información sobre la carga de la lesión; o el agente de contraste gadolinio para detectar lesiones inflamatorias activas. Los avances en resonancia magnética han mejorado el control del daño del SNC y, en consecuencia, la actividad de la enfermedad, la progresión y la respuesta a la terapia. Además, los desarrollos recientes en la tomografía por emisión de positrones (PET) han permitido el examen de las respuestas microgliales y astrocíticas relacionadas con la progresión de MS.
Un desafío persistente en el diagnóstico y manejo de la MS es la necesidad de biomarcadores sanguíneos. Sin embargo, estudios recientes de gran población y la identificación de factores de confusión relevantes pueden permitir el uso clínico de la cadena ligera de neurofilamentos séricos (sNfL), un marcador de daño neuronal sNfL, para el seguimiento de la enfermedad. Otros biomarcadores como la proteína ácida fibrilar glial sérica (GFAP), los anticuerpos,y los metabolitos pueden proporcionar herramientas adicionales para monitorear la progresión de la enfermedad y la respuesta a la terapia.
Formas de la enfermedad de MS
La MS remitente-recurrente (MSRR) es la forma clínica más común de MS diagnosticada en el 85 % al 90 % de los pacientes entre 20 y 40 años de edad, y se caracteriza por ataques sintomáticos (recaídas) seguidos de períodos de recuperación (remisiones). El síndrome clínicamente aislado (CIS) se refiere a un primer episodio de síntomas neurológicos seguido de una recuperación completa o parcial. La detección incidental de lesiones del SNC similares a la MS en ausencia de síntomas a menudo conduce a un diagnóstico de síndrome radiológicamente aislado, considerado una forma pre o subclínica de MS.
La MSRR a menudo se convierte en MS progresiva secundaria (SPMS), caracterizada por la acumulación progresiva e irreversible de discapacidad neurológica. Además, entre el 10 % y el 15 % de los pacientes muestran un curso progresivo de la enfermedad desde el diagnóstico (MS progresiva primaria, MSPP). Sin embargo, los primeros síntomas subclínicos pueden interferir con la diferenciación de SPMS y PPMS. Además, las recaídas pueden ocultar la progresión de la enfermedad, que puede estar presente incluso durante las primeras etapas de la MS. Por lo tanto, se ha sugerido que los resultados específicos de la enfermedad, como la progresión independiente de la actividad de la recaída, podrían ser más útiles clínicamente. Mientras que la MSRR es 2–4 veces más frecuente en mujeres que en hombres, la MSPP muestra una mayor prevalencia en hombres, lo que sugiere que los factores específicos del sexo (p. ej., hormonas) influyen en el inicio y la progresión de la enfermedad.
Patología de la MS
Las lesiones del SNC en su etapa más temprana se denominan lesiones activas y presentan pérdida de mielina, restos de mielina, infiltración de células inmunitarias (particularmente en el espacio perivascular), interrupción de la BBB, gliosis reactiva y daño axonal. Las lesiones activas se relacionan principalmente con la enfermedad temprana en pacientes con MSRR. Las lesiones inactivas representan áreas de lesiones desmielinizantes antiguas con presencia y actividad mínima de glía y células inmunitarias; se vuelven más abundantes en pacientes con duración prolongada de la enfermedad.
Las lesiones mixtas activas/inactivas, también conocidas como lesiones crónicas activas o latentes, también están desmielinizadas, pero muestran un borde de microglía/macrófagos activados con fenotipos fagocíticos espumosos o ramificados, daño axonal, alteración sutil de la BBB y cierta infiltración de células inmunitarias adyacentes a un tejido en gran parte centro hipocelular con presencia mínima de microglía/macrófagos e infiltración moderada de células T. Curiosamente, las lesiones activas/inactivas se han asociado con la progresión de la MS y son más frecuentes en pacientes mayores. Estos y otros hallazgos sugieren un papel de la edad como determinante de la progression de la enfermedad, probablemente debido a deficiencias en los mecanismos de reparación del SNC y/o vías que regulan la inflamación del SNC periférica . Estos hallazgos también sugieren que las lesiones activas/inactivas pueden ser útiles para controlar la respuesta de las terapias destinadas a detener la progresión de la MS.
Tenga en cuenta que la patología del SNC en la MS no se limita a lesiones focales. Se detectan lesiones difusas, atrofia, desregulación de la BBB, astrogliosis perivascular y/o inflamación no desmielinizante tanto en la sustancia blanca como en la gris. Además, se detectan infiltrados de células inmunitarias inflamatorias y folículos linfoides ectópicos en las meninges de pacientes con MS, en asociación con patología cortical severa, neurodegeneración y un curso progresivo de la enfermedad. Por lo tanto, múltiples regiones del SNC y microambientes tisulares están involucrados en la patología de la MS, incluso dentro del mismo paciente, lo que refleja la contribución de múltiples mecanismos a la patología de la enfermedad.
Factores predisponentes de la MS
La MS se desarrolla como resultado de una interacción dinámica entre factores genéticos, ambientales y de estilo de vida (Figura 1). Estos factores modulan los procesos patogénicos incluso antes del diagnóstico de MS, en una fase prodrómica que puede mostrar depresión, ansiedad, problemas gastrointestinales y niveles elevados de sNfL indicativos de degeneración neuroaxonal.
Genética
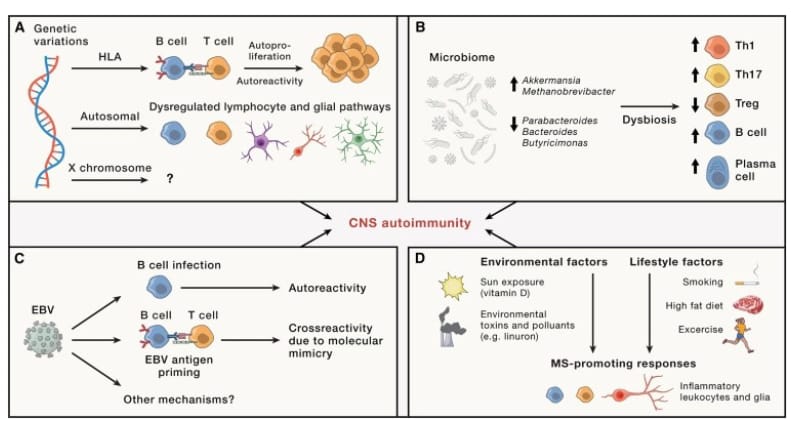
Se calculó que el riesgo de por vida de desarrollar MS en familiares de primer grado y gemelos monocigóticos de individuos afectados era más de 7 y 100 veces mayor que en la población general, respectivamente, lo que sugiere que los factores genéticos controlan la susceptibilidad a la MS. Los estudios iniciales vincularon la susceptibilidad a la MS con el locus MHC, allanando el camino para la identificación de factores genéticos adicionales (Tabla 1). El grupo de genes HLA en el locus MHC polimórfico se considera un factor de riesgo genético importante para la MS, con variantes notables en los genes HLA-DRB1 de clase II (p. ej., HLA-DRB1∗15:01) y HLA-DPB1 y HLA-A y Genes HLA-B.25 Además, un gran estudio reciente identificó 233 variantes genéticas vinculadas a la susceptibilidad a la MS, 200 de las cuales están ubicadas fuera de la región MHC y una en el cromosoma X (Figura 1A). Varios de estos genes de susceptibilidad a la MS que no pertenecen al MHC desempeñan funciones inmunitarias (p. ej., IL2RA, IL7RA y CD58) y están enriquecidos en células inmunitarias innatas y adaptativas (p. ej., células T y microglía). Curiosamente, las variantes genéticas conocidas solo explican ~48 % de predisposición genética a la MS, lo que sugiere que aún faltan por identificar otros factores genéticos predisponentes adicionales. Los estudios en curso tienen como objetivo dilucidar los mecanismos a través de los cuales las variantes genéticas vinculadas a la MS contribuyen a la patogénesis y progresión de la enfermedad. Por ejemplo, se demostró que el haplotipo HLA-DR15 promueve la activación de las células T autorreactivas por parte de las células B presentadoras de antígenos, mientras que las variantes de riesgo de MS vinculadas a la señalización de NF-κB29 y MERTK30 se vincularon a respuestas de astrocitos y microgliales vinculadas a la progresión de MS.
Microbioma
El microbioma ha ganado gran atención en la MS. En particular, se ha demostrado que el microbioma intestinal promueve el desarrollo de células T patógenas reactivas del SNC y modula la actividad de las células residentes del SNC. Curiosamente, el trasplante de microbiota intestinal de pacientes con MS empeoró la encefalomielitis autoinmune experimental (EAE), un modelo preclínico de MS. De hecho, los análisis del microbioma intestinal de la MS revelaron alteraciones relacionadas con respuestas proinflamatorias y antiinflamatorias (Figura 1B). En particular, se encontró que los géneros Akkermansia están elevados en la MSRR y la MS progresiva y promueven las respuestas de las células T helper 1(TH1). Sin embargo, otros estudios vincularon a Akkermansia con una discapacidad clínica más baja de la MS y mostraron que la administración de cepas específicas de Akkermansia mejora la EAE. Estos hallazgos sugieren efectos específicos de la cepa de Akkermansia sobre los mecanismos de la patogénesis de la MS.
También se han descrito asociaciones entre el microbioma intestinal de la MS y las células T reguladoras (Tregs). Se demostró que el género Parabacteroides, que está reducido en pacientes con MS, estimula las células Treg IL-10+. Además, el trasplante de microbiota de pacientes con MS reduce la producción de IL-10 en la EAE. Las células plasmáticas productoras de IgA reactivas con el microbioma intestinal se detectaron recientemente en lesiones activas de MS. En conjunto, estos estudios destacan el papel del microbioma en el control de la patología de la MS. Los estudios futuros deberían traducir estos hallazgos en intervenciones terapéuticas, mientras se extienden estas investigaciones al microbioma en otros tejidos. Por ejemplo, recientemente se demostró que el microbioma pulmonar regula la inflamación del SNC en la EAE de rata, pero, en general, se sabe poco sobre las perturbaciones del microbioma pulmonar en la MS.
Infecciones microbianas
El asociado de Charcot, Pierre Marie, señaló que la MS a menudo se produce durante una infección. La infección por el virus de Epstein-Barr (EBV) está asociada con la MS, como lo destaca el análisis reciente de una gran cohorte de muestras de sangre obtenidas antes del diagnóstico de MS, que estableció que el riesgo de MS aumenta 32 veces después de la infección con EBV pero no con otros virus. Los mecanismos a través de los cuales el EBV puede contribuir al desarrollo de MS son muchos, incluido el desencadenamiento de la autoinmunidad del SNC debido a la activación desregulada de las células T y/o mimetismo molecular con antígenos de EBV (Figura 1C). Debido a su tropismo por las células B, el EBV puede aumentar su capacidad para activar las células T patógenas. Además, las células T reactivas al EBV pueden reaccionar de forma cruzada con los antígenos del SNC, y también se descubrió que el EBV induce una respuesta inmunitaria de células B autorreactiva dirigida al antígeno de oligodendrocitos y astrocitos GlialCAM. Sin embargo, estos hallazgos no implican que el EBV causa la MS, sino que los mecanismos inmunitarios vinculados a la infección por el EBV podrían cooperar con otros factores ambientales y/o genéticos para desencadenar el inicio de la enfermedad en individuos susceptibles. Las nuevas vacunas pueden permitir intervenciones preventivas dirigidas al EBV en la MS y otras enfermedades, con la advertencia principal de que la vacunación debe realizarse a una edad temprana, lo que representa un desafío importante para el diseño de ensayos clínicos y la viabilidad general.
Otros factores
También se cree que la raza, el origen étnico, la latitud, la dieta, la obesidad, el tabaquismo y la exposición ambiental (p. ej., luz solar, contaminantes) contribuyen al desarrollo de la MS. Los estudios de los mecanismos involucrados en la regulación ambiental de la MS mostraron, por ejemplo, que el nutriente metionina promueve la inflamación del SNC a través de la reprogramación epigenética de los linfocitos T CD4+, y que el herbicida linurón aumenta las actividades patogénicas de los astrocitos impulsadas por el factor de transcripción XBP1. Por lo tanto, los estudios epidemiológicos y mecanísticos combinados pueden identificar tanto los nuevos factores y mecanismos de predisposición a la MS de la patogenia de la enfermedad.
Mecanismos de la patología de la enfermedad.
Análisis exhaustivos de muestras de pacientes, ensayos clínicos de intervención y estudios de modelos preclínicos establecieron un papel central para los leucocitos periféricos (células T, células B, células mieloides) en la patología de la MS. Sus respuestas aberrantes dañan los oligodendrocitos y las neuronas, al tiempo que activan células residentes en el SNC, como la microglía y los astrocitos. Por lo tanto, la patología de la MS se puede vincular a cuatro procesos interdependientes controlados por factores genéticos y ambientales: (1) activación de linfocitos autorreactivos, (2) invasión inmunitaria del SNC, (3) inmunorregulación y (4) neurodegeneración progresiva. Es necesario abordar estos diversos procesos con enfoques combinatorios para el manejo terapéutico eficaz de la MS.
Activación de linfocitos autorreactivos
Décadas de investigación básica, traslacional y clínica establecieron la MS como una enfermedad autoinmune. Los informes seminales sobre la inducción de EAE mediante la inmunización con antígenos del SNC respaldaron el papel de la autoinmunidad de las células T en la patogénesis de la MS, al tiempo que proporcionaron modelos preclínicos útiles. Debe tenerse en cuenta que diferentes modelos de EAE recapitulan aspectos específicos de la MS, incluido un ataque autoinmune agudo aislado del SNC inducido en la cepa de ratón C57BL/6 por inmunización con glicoproteína de oligodendrocitos de mielina (MOG)35-55, un curso recurrente-remitente inducido en ratones SJL por inmunización con proteína proteolipídica (PLP) 139-151, o enfermedad progresiva secundaria inducida en ratones diabéticos no obesos (NOD) por inmunización con MOG35-55. Otros modelos de EAE se basan en la transferencia adoptiva de células T específicas de mielina, o la expresión transgénica del receptor de células T específico de mielina, lo que da como resultado el desarrollo espontáneo de EAE. De hecho, ningún modelo de EAE captura todos los procesos inflamatorios y neurodegenerativos relacionados con la MS. Una limitación adicional es que la mayoría de los modelos de EAE son impulsados por células T CD4+ que se dirigen a uno o unos pocos antígenos del SNC, y es posible que no recapitulen las respuestas autoinmunes complejas impulsadas por células CD4+, células T CD8+ y células B en la MS.
Linfocitos autorreactivos
Los linfocitos T CD8+ y CD4+ reactivos con la mielina y otros antígenos se detectan en las lesiones activas de la MS. Los informes sobre la inducción de EAE en animales sin tratamiento previo mediante la transferencia adoptiva de linfocitos T reactivos con la mielina proporcionaron información importante sobre el papel de los linfocitos T en la MS. Aunque las células T CD8+ son dominantes en las lesiones de la MS, se sabe más sobre la regulación y la especificidad de las células T CD4+ en la MS, lo que refleja las limitaciones técnicas para el análisis de las células T CD8+ humanas y la escasez de modelos preclínicos para su investigación. Sin embargo, desarrollos recientes han revitalizado el estudio de las células T CD8+ en EAE.
Las células auxiliares CD4+ T (TH) se clasifican en función de la expresión de citocinas, factores de transcripción y funciones efectoras. Las células IFNγ+ TH1 controladas por el factor de transcripción Tbet y las células IL-17+ TH17 controladas por el factor de transcripción RORγt desempeñan un papel fundamental en la patología de la MS y la EAE (Figura 2A). Es importante destacar que estos subtipos de TH incluyen subconjuntos funcionalmente diferentes controlados por reguladores transcripcionales adicionales. Por ejemplo, las células TH17 no patógenas muestran una capacidad limitada para inducir patología tisular y expresar módulos transcripcionales vinculados a la regulación inmunitaria, que incluyen Il10 y Ahr. Por el contrario, las células TH17 patógenas promueven la destrucción tisular y expresan módulos transcripcionales impulsados por IL-23, programas que incluyen Csf2, Ifng y Tbx entre otros genes. Curiosamente, el aumento de las respuestas de las células TH1 y TH17 en la MS se ha relacionado con recaídas agudas y otros resultados de la enfermedad. Al analizar estos hallazgos en el contexto de la monitorización y el tratamiento de la enfermedad, se debe tener en cuenta que estos subconjuntos TH17 pueden ser interconvertibles in vivo, como sugiere la conversión inducida por AHR de células TH17 patógenas en células T antiinflamatorias IL-10+, y la conversión impulsada por IL-23 de células TH17 no patógenas intestinales en células CXCR6+ TH17 patógenas promotoras de EAE. Por lo tanto, el análisis de algunas citoquinas o la transcripción es posible que los factores no asignen las células TH a un subtipo específico y es posible que se necesiten análisis más profundos, por ejemplo, el rastreo de linaje basado en la epigenética de una sola célula.
La transferencia adoptiva de células TH1 o TH17 específicas del SNC induce la EAE, pero diferentes subtipos de TH inducen patología en diferentes ubicaciones del SNC, lo que sugiere diferencias en las interacciones entre los tejidos y el alojamiento. De hecho, los mecanismos utilizados por las células TH1 y TH17 para promover la patología del SNC son diversos., que implica diafonía con células inmunitarias periféricas y células residentes en el SNC. Por ejemplo, las células TH1 estimulan los macrófagos y la microglía y dificultan la supervivencia y diferenciación de las células precursoras de oligodendrocitos. Las células TH17 interrumpen la BBB, promueven la infiltración de fagocitos inflamatorios, modulan las funciones gliales e interactúan con los oligodendrocitos y las neuronas para promover el daño axonal y la neurodegeneración.
Las interacciones entre las células T CD4+ y mieloides contribuyen de manera importante a la patogenia de la MS (Figura 2A). Las células T patógenas en la MS y la EAE producen factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) que desencadena la liberación de monocitos clásicos de la médula ósea y potencia sus actividades patógenas, destacando el papel de las interacciones entre células T CD4+ y monocitos en la patología del SNC. Dentro del SNC, GM-CSF promueve la activación microglial y, en combinación con IFNγ, diferencia los monocitos Ly6Chi en macrófagos inflamatorios.
Curiosamente, la inflamación crónica induce la producción de GM-CSF por parte de los astrocitos, lo que sugiere un bucle de retroalimentación positiva que perpetúa las respuestas de astrocitos y células mieloides patógenas en la MS progresiva.
Los linfocitos T CD8+ constituyen la población predominante de linfocitos T en las lesiones de MS (Figura 2A). Se detectaron linfocitos T CD8+ con fenotipos de memoria residentes en tejidos en lesiones mixtas activas/inactivas y se demostró que se expandían clonalmente en el LCR de pacientes con MS. Por lo tanto, nuevos enfoques experimentales y modelos preclínicos deberían permitir una mejor caracterización de las respuestas de las células T CD8+ y su desregulación en la MS.
Las células B contribuyen a la patología de la MS a través de múltiples mecanismos (Figura 2A). Los OCB son una característica clásica de la MS, pero aún se debate la contribución de los anticuerpos a la patología de la enfermedad. Curiosamente, la acumulación de células B en los folículos ectópicos meníngeos está relacionada con la patología cortical en la MS, probablemente reflejando la contribución del GM-CSF, TNFα, IL-6, IL-12, IL-15 y otros factores solubles producidos por las células B. en la promoción de la inflamación y la neurotoxicidad. Además, las células B desempeñan funciones importantes como células presentadoras de antígenos (APC). De hecho, los efectos beneficiosos de los anticuerpos dirigidos contra las células B en la MS se han relacionado con la supresión de la activación de las células T. Sin embargo, aún no está claro si estas terapias dirigidas a las células B interfieren con la activación de las células T en los folículos ectópicos del SNC, y si se deben identificar dianas terapéuticas adicionales para dirigirse a poblaciones de células B específicas.
Presentación de antígeno
El cebado periférico de las células T vírgenes y su reactivación en el SNC son pasos esenciales en la patología de la EAE y la MS (Figuras 2A y 2B). El análisis de muestras clínicas identificó antígenos reconocidos por la respuesta de células T autoinmunes en la MS, incluida la proteína básica de mielina (MBP), MOG y PLP, entre otros (Tabla 2). La amplitud de la respuesta autoinmune distingue a la MS de otras enfermedades desmielinizantes del SNC más focalizadas, como la neuromielitis óptica (caracterizada por anticuerpos contra la acuaporina 4), la enfermedad por anticuerpos contra MOG y la encefalomielitis aguda diseminada (ambas caracterizadas por anticuerpos contra MOG) (tabla 2).
Los autoantígenos específicos a los que se dirige la respuesta inmunitaria cambian durante el curso de la MS como resultado de los mecanismos de propagación del epítopo intramolecular e intermolecular. De hecho, el análisis de muestras pediátricas de MS con micromatrices de antígenos estableció la propagación del epítopo como un evento patogénico temprano, probablemente impulsada por la autoinmunización contra los antígenos liberados del tejido dañado por la respuesta autoinmune. Además, las infecciones y el microbioma comensal también influyen en la especificidad de la respuesta autoinmune de la MS a través del mimetismo molecular, promoviendo aún más la heterogeneidad de paciente a paciente. Sin embargo, se han identificado dianas autoinmunes vinculadas a procesos patogénicos específicos de la MS, lo que sugiere que los nuevos métodos de identificación de antígenos pueden permitir la estadificación y el seguimiento del paciente, y guiar el desarrollo de terapias inmunomoduladoras específicas de antígeno.
Los estudios preclínicos y el análisis de muestras de pacientes detectaron el drenaje de antígenos y células dendríticas desde el SNC hacia los ganglios linfáticos cervicales (CLN), donde inician respuestas de células T. Informes sobre vasos linfáticos meníngeos que drenan antígenos y células inmunitarias desde el el LCR y las meninges en los CLN respaldan aún más estos hallazgos. Sin embargo, una publicación reciente informó un papel central de las APC en las leptomeninges, pero no en la duramadre ni en los CLN, en la activación de las células T en la EAE y la MS. Por lo tanto, los estudios futuros deben evaluar la contribución relativa de estas ubicaciones anatómicas en la activación aguda y crónica de las células T reactivas del SNC en la MS y en otras enfermedades neurológicas.
Sorprendentemente, los sitios anatómicamente distantes participan en el control de las células T reactivas del SNC. Por ejemplo, en la EAE, las células T se alojan en diferentes ubicaciones del SNC en función de su cebado en los ganglios linfáticos inguinales o mesentéricos. De hecho, las bacterias comensales en los compartimentos de las mucosas, como el intestino, la piel y los pulmones, modulan las actividades efectoras o reguladoras de linfocitos T reactivos en la mielina. Estos hallazgos resaltan las funciones potenciales del microbioma en el control de las respuestas autoinmunes a través de la producción de factores que modulan la activación y polarización de los linfocitos T, y a través de la expresión de antígenos microbianos con reactividad cruzada que pueden activar células T
APC (células presentadoras de antígeno)
Las células dendríticas (DC), los macrófagos y las células B se consideran las principales APC involucradas en la activación de las células T en la MS y la EAE. Sorprendentemente, datos recientes sugieren que la microglía no juega un papel central en la APC, al menos en los modelos de EAE aguda.
Los monocitos periféricos que cruzan la BBB se diferencian en DC perivasculares que promueven las respuestas TH1 y TH17. Las DC que contienen restos de mielina se detectan en el espacio perivascular de las lesiones activas de MS y en las meninges cerca de los linfocitos T infiltrantes. En la EAE, las DC convencionales de tipo 2 ( cDC2s) habitan en las meninges y reactivan las células T patógenas. Las DC también se detectan en el plexo coroideo en la EAE y la MS, pero queda por determinar su capacidad para reactivar las células T encefalitogénicas. De hecho, algunas de estas interacciones entre células T y APC pueden amortiguar la autoinmunidad de las células T, en lugar de aumentarla.
Se identificó un subconjunto de macrófagos capaz de presentar antígenos a las células T en el lado abluminal de los vasos sanguíneos BBB y también en lesiones de MS activas y latentes. y promover la infiltración de células T del SNC. En la MS, los macrófagos leptomeníngeos se asociaron con lesiones corticales y con estructuras similares a los linfoides meníngeos vinculadas a un peor resultado de la enfermedad. Más recientemente, se demostró que los macrófagos MHC-II+ en los senos durales presentan antígenos del SNC a T células durante la vigilancia homeostática del SNC, además de cDC2s. Las CD y los macrófagos también están presentes en el plexo coroideo. Por lo tanto, queda por definir la contribución relativa de las APC durales y coroideas a la patogenia de la MS.
Los estudios mecánicos sobre las terapias modificadoras de la enfermedad (DMT) dirigidas a las células B subrayan el papel de las células B como APC en la MS. De hecho, las células B inducen la proliferación de células TH1 y TH17 reclutadas en el SNC en la MS, se detectan células en el espacio perivascular y en estructuras meníngeas de tipo linfoide adyacentes a las lesiones corticales subpiales. En conjunto, estos hallazgos resaltan el potencial de las CD, los macrófagos y las células B como objetivos para la inducción terapéutica de tolerancia específica de antígeno. Sin embargo, los informes sobre la activación de las células T por parte de las células linfoides innatas de tipo 3 y los neutrófilos en la neuroinflamación autoinmune sugieren que las APC adicionales también pueden desempeñar funciones importantes en el control de las células T autoinmunes en la MS; pero se sabe poco sobre su contribución a las diferentes etapas de la enfermedad y su potencial terapéutico.
Invasión inmune del SNC
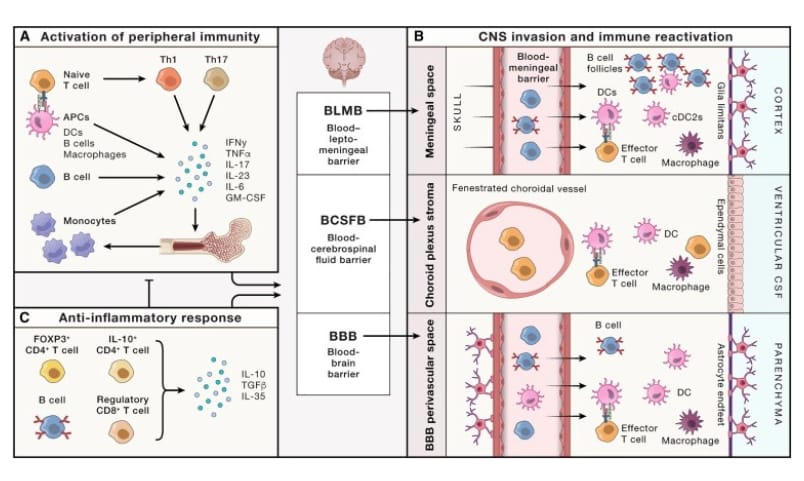
La infiltración de células T del SNC implica tres barreras principales del SNC (Figura 2B); una cuarta capa meníngea denominada membrana subaracnoidea similar a la linfática se identificó recientemente en el espacio subaracnoideo del ratón y del ser humano, pero aún no se ha determinado su papel en la EAE y la MS: (1) la BHE es la principal puerta de entrada al parénquima del SNC. (2) La barrera hematomeníngea (BLMB, por sus siglas en inglés) brinda acceso a las regiones del SNC subpial y, hasta cierto punto, al LCR. Más recientemente, se describió el tráfico de células inmunitarias desde la médula ósea del cráneo hacia las meninges, posiblemente a través de canales cuya participación en la patogenia de la enfermedad no están claramente definidos. (3) El plexo coroideo representa el portal principal que une la sangre periférica con el LCR.
La migración a través de estas barreras del SNC implica interacciones célula-célula mediadas por moléculas de adhesión celular, quimiocinas y sus receptores. Estas interacciones están mediadas por moléculas clásicas como ICAM-1/LFA-1 y VCAM-1/VLA-4, y más recientemente identificadas como DICAM, MCAM, ALCAM y JAML. Es importante destacar que estas moléculas son posibles dianas terapéuticas. para bloquear el acceso de los linfocitos periféricos al SNC, como lo ejemplifica el anticuerpo bloqueador de VLA-4 natalizumab. Sin embargo, enfoques terapéuticos inespecíficos, como el natalizumab, también interfieren con los mecanismos fisiológicos de vigilancia inmunológica del SNC que limitan la reactivación de virus comunes y, por lo tanto, podrían permitir el desarrollo de leucoencefalopatía multifocal progresiva.
Inmunorregulación
Múltiples mecanismos previenen el daño tisular causado por respuestas inmunitarias desreguladas. Las células Treg CD4+ FoxP3+ y las células reguladoras de tipo 1 (Tr1) productoras de IL-10 se han estudiado ampliamente en la MS y la EAE Y se les asignó un papel más dominante en la resolución de la inflamación del SNC, por ejemplo a través de su capacidad para suprimir las respuestas microgliales y de astrocitos a través de la producción de IL-10 en MS. De manera similar, se informa que la IL-4 es neuroprotectora en la EAE, lo que sugiere su potencial para el tratamiento de la MS.
Varias observaciones sugieren disfunción Treg en la MS, incluidos informes de disminución de la abundancia de Treg, función supresora, estabilidad, capacidad migratoria y/o la resistencia relativa de las células T efectoras. Además, se ha sugerido que la propagación del epítopo da lugar a células T patógenas, clones que evaden la regulación por Tregs específicas de antígeno y pueden estar asociados con recaídas de MS. Curiosamente, las variantes genéticas vinculadas a la MS se asignan a genes asociados con la inmunorregulación, como IL2RA y CTLA4.
También se han descrito linfocitos T CD8+ dotados de función reguladora. Se ha informado una disminución de su frecuencia y función en pacientes con MS durante las recaídas y, en cierta medida, en pacientes con MS progresiva. Sin embargo, se sabe menos sobre los mecanismos reguladores que utilizan los linfocitos T CD8+, las células T reguladoras y su relevancia clínica, en parte debido a la falta de marcadores específicos para definirlas, caracterizarlas y estudiarlas de forma inequívoca. Es probable que la reciente caracterización de las células T reguladoras CD8+ caracterizadas por la expresión de receptores inhibidores tipo inmunoglobulina (KIR) abra nuevos caminos para su investigación en la MS.
Las células B también limitan la inflamación del SNC, mientras promueven la oligodendrogénesis y la remielinización, pero aún no está claro si los defectos en la regulación inmunitaria impulsada por las células B están relacionados con etapas específicas de la MS. Sin embargo, recientemente se informó que las células B IL-10+ controladas por el microbioma intestinal migran al SNC y suprimen la patogénesis de la MS. La caracterización de estos y otros mecanismos inmunorreguladores puede guiar el desarrollo de terapias específicas de antígeno para la MS y otras enfermedades autoinmunes.
Inflamación del SNC y progresión de la MS
Un desafío apremiante en la investigación de la MS es la identificación de los mecanismos de progresión de la enfermedad y los objetivos terapéuticos para detenerla. De hecho, la mayoría de las terapias dirigidas a las células inmunitarias periféricas muestran una eficacia limitada en la MS progresiva, lo que sugiere que la inflamación del SNC compartimentada impulsa la progresión de la enfermedad. Es importante destacar que cada uno de estos tipos de células gliales se compone de subconjuntos de células especializadas. Por lo tanto, el desarrollo de terapias para la MS progresiva requiere la identificación de subconjuntos de células y objetivos relevantes para su modulación específica.
Los astrocitos son las células gliales más abundantes en el SNC, brindan soporte trófico y metabólico para las neuronas, mientras reciclan neurotransmisores del espacio extracelular , junto con los astrocitos, la modulación de la inflamación. Finalmente, los oligodendrocitos mielinizan los axones neuronales del SNC para asegurar la conducción adecuada de los potenciales de acción, al mismo tiempo que brindan apoyo adicional para el metabolismo de las neuronas. Los oligodendrocitos también son el objetivo principal de la respuesta autoinmune en la MS. Estudios recientes han resaltado no solo la heterogeneidad de estos tipos de células en diferentes regiones del SNC y estados de activación, sino también sus interacciones funcionales.
Diafonía neuroinmune dentro del SNC en la MS
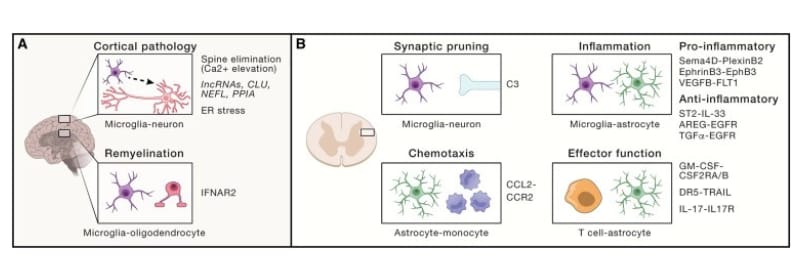
Los astrocitos, los oligodendrocitos, la microglía y las neuronas controlan el desarrollo, la inflamación, el metabolismo y la actividad neuronal a través de complejas interacciones célula-célula (Figura 3). Los estudios en pacientes con MS y modelos animales identificaron vulnerabilidades en subconjuntos neuronales definidos (Figura 3A). Un análisis de las lesiones corticales identificó una población de neuronas corticales de capa 2-capa 3 que degeneran en la MS, que mostró la activación de vías vinculadas al estrés celular y al metabolismo interrumpido, incluidos CLU, NEFL, PPIA y RNA largos no codificantes. Estos hallazgos sugieren que los programas asociados al estrés en las neuronas están vinculados a la patología de la enfermedad, aunque queda por determinar si estos programas promueven o limitan la patología. Además, los estudios en un modelo animal de lesión cortical sugieren que la activación de la actividad neuronal precede a la neurodegeneración. Por ejemplo, la señalización elevada de calcio en las espinas dendríticas precede a su eliminación por macrófagos o microglia. De acuerdo con estos datos, la disfunción de la red neuronal se detecta en EAE (incluso en su fase de remisión) y en pacientes con MS. Estos hallazgos sugieren que las perturbaciones en las redes neuronales impulsan programas que promueven la neurodegeneración. Sin embargo, todavía no está claro en qué medida la neurodegeneración de la médula espinal en los modelos preclínicos recapitula los hallazgos en la corteza de los pacientes con MS.
Las células inmunitarias que se infiltran en el SNC y las células gliales residentes promueven la neurodegeneración y contribuyen a la progresión de la MS (Figura 3B). De hecho, el reclutamiento de monocitos proinflamatorios en el SNC se correlaciona con la gravedad de la EAE; los astrocitos promueven el reclutamiento de monocitos al SNC. Además, las perturbaciones inducidas por la inflamación en el metabolismo de los astrocitos interfieren con el apoyo metabólico neuronal. Curiosamente, el metabolismo redox disfuncional activa la respuesta proteica desplegada (UPR), que puede impulsar las respuestas de los astrocitos que promueven la patología en múltiples contextos. La activación del factor de transcripción XBP1 asociado a UPR aumenta la producción de citocinas y quimiocinas proinflamatorias por parte de los astrocitos. Por el contrario, la ablación específica de XBP1 o sus activadores aguas arriba IRE1α o SigmaR1 en los astrocitos, mejora la EAE, disminuyendo la activación microglial y la infiltración del SNC por monocitos proinflamatorios. En conjunto, estos datos sugieren que la modulación terapéutica de las células residentes en el SNC y sus interacciones pueden identificar nuevos objetivos terapéuticos para la MS progresiva.
Los astrocitos y las interacciones célula-célula son candidatos atractivos para la intervención terapéutica en la MS y otras enfermedades neurológicas, pero primero se deben identificar las respuestas y los subconjuntos de astrocitos específicos. Por ejemplo, la ablación de astrocitos reactivos durante la fase temprana de NOD EAE empeora la enfermedad, pero la ablación de astrocitos en la fase crónica progresiva conduce a la mejora de la enfermedad, lo que sugiere la necesidad de apuntar a actividades patógenas de astrocitos específicos y/o subconjuntos funcionales. De hecho , estas funciones patogénicas de los astrocitos fueron impulsadas por la desregulación del metabolismo de los esfingolípidos a través de una vía de señalización que involucra a cPLA2 y la proteína MAVS, clásicamente involucrada en las respuestas inmunitarias antivirales. La señalización de cPLA2-MAVS aumentó la señalización proinflamatoria de NF-κB y disminuyó la producción de lactato, que apoya el metabolismo neuronal. Curiosamente, los astrocitos MAVS+ también expresan complemento C3, un marcador de un subconjunto de astrocitos que secreta lípidos neurotóxicos. C3 también puede contribuir a la patología de la MS al participar en la poda sináptica microglial.
Las funciones microgliales y de astrocitos adicionales también se han relacionado con la patología de la enfermedad en análisis unicelulares de muestras del SNC con MS. Estos estudios concuerdan con los análisis de scRNA-seq de microglia en pacientes con MS y los informes de comunicación regulada por microbiomas entre subconjuntos específicos de astrocitos y microgliales. Es importante destacar que las subpoblaciones microgliales asociadas con la MS tienen firmas transcripcionales similares a las que se encuentran en otras enfermedades neurológicas.
Finalmente, debe tenerse en cuenta que algunos subconjuntos gliales limitan activamente la patología del SNC. Por ejemplo, se ha descubierto que los subconjuntos microgliales protegen la integridad de la mielina, limitan la neurodegeneración impulsada por la fosfatidilcolina oxidada y engullen activamente las células TH17 patógenas. De manera similar, se ha demostrado que un subconjunto de astrocitos TRAIL+ induce la apoptosis en las células T patógenas. En conjunto, los datos destacan la diversidad de las respuestas gliales relevantes para la patología de la MS y la necesidad de desarrollar enfoques para el control y la modulación terapéutica de subconjuntos gliales específicos.
Investigación de subconjuntos de células residentes en el SNC en la MS
La medida en que los subconjuntos de microgliales y astrocitos asociados con la enfermedad interactúan para coordinar y regular sus respuestas aún no se comprende por completo. Sin embargo, las nuevas herramientas han permitido el estudio de las interacciones de los subconjuntos gliales en la salud y la enfermedad. Por ejemplo, los métodos de secuenciación avanzados han proporcionado nuevos conocimientos. Un ejemplo es PIC-seq, una herramienta basada en scRNA-seq para el análisis de células que interactúan aisladas en función de marcadores de superficie definidos. PIC-seq se implementó inicialmente para estudiar la biología de las células DC-T, pero recientemente se ha utilizado para estudiar Interacciones neuroinmunes del SNC.
Del mismo modo, los nuevos enfoques de códigos de barras han permitido la investigación exhaustiva de las interacciones célula-célula en el SNC. Por ejemplo, RABID-seq marca las células que interactúan in vivo utilizando un código de barras codificado por RNA administrado por el virus que puede detectarse mediante scRNA-seq. RABID-seq descubrió recientemente múltiples interacciones y mecanismos de comunicación entre los astrocitos y la microglía en el contexto de la inflamación del SNC , identificando la señalización de Sema4D-PlexinB1/2 y EphrinB3-EphB3 como dianas terapéuticas candidatas para la EM.
Estos y otros enfoques para el estudio de las interacciones célula-célula in vivo se complementan con plataformas novedosas para la investigación integral de los mecanismos de comunicación celular en las pantallas genéticas directas, enfoques clásicos para primero detectar fenotipos después de perturbaciones genéticas sistemáticas o aleatorias y luego identificar las perturbaciones en los genes responsable. En particular, la necesidad de habilitar pantallas genéticas directas de los mecanismos de interacción célula-célula condujo al desarrollo de SPEAC-seq (perturbación sistemática de células asociadas encapsuladas seguida de secuenciación). SPEAC-seq se basa en la coencapsulación en gotitas de dos células: la célula 1 alberga un único RNA guía aleatorio derivado de una biblioteca CRISPR de todo el genoma, mientras que la célula 2 expresa un indicador que indica el efecto que tiene la inactivación del gene en la célula 1 sobre la célula 2. Al combinar SPEAC-seq con una pantalla Perturb-seq in vivo, recientemente identificaron la anfiregulina producida por microglía como un supresor de las respuestas de astrocitos que promueven EAE. La producción microglial de anfirregulina fue inducida por la señalización de ST2 desencadenada por la IL-33 liberada de los astrocitos durante la EAE. Este bucle regulador también fue funcional en astrocitos humanos y microglía. Es probable que estas y otras herramientas para el estudio de las interacciones célula-célula, sus perturbaciones y la caracterización en profundidad de los subconjuntos implicados identifiquen nuevos mecanismos de patogenia de la enfermedad y dianas terapéuticas para la MS progresiva.
De manera similar, los subconjuntos microgliales inhiben la remielinización a través de sus interacciones con los oligodendrocitos, como a través del receptor 2 de interferón alfa y beta (Figura 3A). Es posible que estos subconjuntos microgliales interactúen con los subconjuntos de oligodendrocitos previamente identificados en EAE y MS, que expresan CDH20, MHC-II y otras moléculas que facilitan las interacciones con las células inmunitarias. Aunque el papel específico de MHC-II expresado por este subconjunto de oligodendrocitos Aún queda por investigar más a fondo, la modulación de la interacción entre los oligodendrocitos y las células inmunitarias puede permitir terapias de remielinización efectivas para la MS. De hecho, los factores secretados, incluidos el IGF-1, los anticuerpos y las señales de guía del axón, independientemente de su origen celular, controlan la remielinización en modelos preclínicos de MS y pueden guiar el desarrollo de nuevas terapias.
Finalmente, un concepto importante es la distinción entre poblaciones celulares auténticas y estados de activación transcripcional. Por ejemplo, se han identificado múltiples subconjuntos de astrocitos en EAE y MS, pero aún se desconoce si constituyen poblaciones con funciones definidas. Análogamente, se han identificado subconjuntos microgliales en MS y otros trastornos basados en firmas transcripcionales scRNA-seq,148,167 pero estudios recientes sugieren que algunos de estos subconjuntos incluyen células mieloides de diferentes orígenes, con funciones opuestas en la patología del SNC. Se necesitan estudios de seguimiento sobre el origen, la regulación y la función de los subconjuntos gliales identificados en los análisis de scRNA-seq. En este contexto, FIND-seq (interrogación enfocada de células mediante detección y secuenciación de ácidos nucleicos) integra la citometría de ácidos nucleicos y la microfluídica para permitir análisis en profundidad de subconjuntos celulares de interés basados en marcadores de ácidos nucleicos (RNA o ADN). En combinación con enfoques genéticos y de perturbaciones, FIND-seq puede revelar el papel de estos subconjuntos en la patología de la MS y otras enfermedades neurológicas.
Intervenciones terapéuticas
El desarrollo de terapias modificadoras de la enfermedad (DMT, por sus siglas en inglés) para la MS ha sido espectacular durante las últimas tres décadas. Tras la aprobación de IFN-β-1b en 1993, se aprobaron más de 15 DMT176 (Tabla 3). La mayoría de los DMT se dirigen al sistema inmunitario periférico, con mecanismos de acción ampliamente definidos como inmunomoduladores, contra el tráfico o inmunodepresores.
Las terapias inmunomoduladoras representan los primeros DMT aprobados para la MS. Su eficacia clínica resulta de dirigirse a múltiples subconjuntos de células inmunitarias (principalmente células T) para reequilibrar la proporción de respuestas proinflamatorias y antiinflamatorias. Estos agentes terapéuticos incluyen IFN-β, acetato de glatiramer, teriflunomida y dimetilfumarato.
Las terapias contra el tráfico interfieren con la migración de células inmunitarias al SNC en dos etapas diferentes. Los moduladores del receptor de esfingosina-1-fosfato (S1P) fingolimod y siponimod secuestran linfocitos dentro de los ganglios linfáticos, aunque la señalización de S1P también afecta a las células residentes del SNC, como los astrocitos. Por el contrario, natalizumab inhibe directamente el reclutamiento de leucocitos circulantes en el SNC al bloquear VLA-4. Cabe señalar que este mecanismo de acción interfiere con el control inmunitario fisiológico del SNC y se ha relacionado con la reactivación del virus John Cunningham y la leucoencefalopatía multifocal progresiva en pacientes tratados con natalizumab.
Las terapias de inmunodepleción se dirigen a las células inmunitarias adaptativas. Aprobados para tratar la MSRR y la MS progresiva activa, la cladribina (análogo de purina) y el alemtuzumab (anti-CD52) se dirigen a las células T y las células B, mientras que el ocrelizumab, ofatumumab y ublituximab (anti-CD20) reducen específicamente las células B. En 2017, ocrelizumab se convirtió en el primer DMT aprobado para PPMS. Las terapias dirigidas a células B dirigidas a CD20 muestran fuertes efectos supresores en las respuestas de células T patógenas. Sin embargo, debe tenerse en cuenta que los pacientes en terapia anti-CD20 y fingolimod muestran respuestas reducidas a la vacunación contra COVID-19. Además, la proteína recombinante atacicept, que bloquea la función y proliferación de las células B, no logró controlar las recaídas de la MS y provocó exacerbaciones de la enfermedad, probablemente debido a su actividad contra las células B IgA+ antiinflamatorias IL-10+, que no son el objetivo de los anticuerpos anti-CD20. Estos hallazgos destacan el papel de las células B en el control de la autoinmunidad de las células T en la MS, así como los desafíos relacionados con su orientación terapéutica.
Nuevos enfoques y dianas terapéuticas
Los DMT actualmente disponibles muestran un éxito limitado para detener la progresión de la MS. Sin embargo, numerosos tratamientos prometedores se encuentran actualmente en ensayos clínicos avanzados. Un ejemplo es el de los inhibidores de la tirosina quinasa (BTK) de Bruton, que se dirigen a las células B y las células mieloides periféricas, lo que limita su interacción patogénica con las células T. Además, debido a su capacidad para cruzar la BBB, algunos inhibidores de BTK pueden suprimir funciones patogénicas microgliales y promover la remielinización, ofreciendo esperanza para el tratamiento de la MS progresiva.
Una característica deseada de las nuevas terapias para la MS y otras enfermedades autoinmunes es el restablecimiento de la tolerancia específica de antígeno, sin afectar la inmunidad protectora contra agentes infecciosos y tumores. Sin embargo, el desarrollo de estos enfoques tolerogénicos no está exento de riesgos, como lo indica la exacerbación de la enfermedad en pacientes con MS tratados con un péptido de mielina modificado que se cree que está dotado de actividad tolerogénica. Los enfoques prometedores para la inducción de tolerancia específica de antígeno implican métodos basados en nanopartículas. El primero incluye la administración de DC tolerogénicas cargadas de antígeno, células Treg específicas de autoantígeno o enfoques basados en células T con receptor de antígeno quimérico. Sin embargo, los desafíos logísticos limitan la implementación clínica de las terapias basadas en células.
Alternativamente, se ha inducido tolerancia inmunológica específica de antígeno con nanopartículas cargadas con antígenos de mielina y adyuvantes tolerogénicos como agonistas de receptores de hidrocarburos arílicos y otros factores. Más recientemente, se demostró que las vacunas de mRNA modificadas para prevenir la activación inmunológica inducen tolerancia inmunológica en EAE, recapitulando observaciones previas realizadas con vacunas de DNA.Curiosamente, estos enfoques basados en nanopartículas y mRNA inducen la supresión del espectador, una característica importante considerando el desafío impuesto por la propagación del epítopo y la heterogeneidad de los autoantígenos objetivo en diferentes pacientes con MS. Queda por ver si la falta de un adyuvante que refuerza la tolerancia en las vacunas de mRNA induce respuestas tolerogénicas lo suficientemente fuertes como para detener la respuesta inflamatoria en curso en la MS.
Finalmente, la identificación de factores ambientales asociados con el desarrollo de la MS abre nuevas vías terapéuticas que van desde las vacunas contra el EBV hasta la suplementación con probióticos específicos, sus metabolitos o incluso probióticos sintéticos diseñados para producir moléculas terapéuticas. Otras vías terapéuticas para la MS podrían surgir de estudios centrados en biología circadiana y contaminación. Por ejemplo, los efectos informados de la melatonina y los contaminantes sobre las respuestas reguladoras y proinflamatorias, pueden proporcionar más información sobre las vías controladas por el medio ambiente que desempeñan funciones importantes pero menos comprendidas en la patogenia de la MS.
Conclusiones
Detener la progresión de la MS sigue siendo una necesidad clínica no satisfecha. Estudios recientes de una sola célula han brindado información única sobre la patología de la MS, descubriendo firmas genómicas del SNC asociadas conla enfermedad. La integración de estos hallazgos con métodos de perfilado in situ permitirá la identificación de interacciones neuroinmunes perturbadas relevantes para la progresión de la MS susceptibles de orientación terapéutica . Sin embargo, debe tenerse en cuenta que la edad está fuertemente asociada con la progresión de la MS, lo que refleja el impacto de la senescencia en las respuestas proinflamatorias, neurodegenerativas y de reparación de tejidos. maduración celular y remielinización. Por lo tanto, el estudio del envejecimiento puede proporcionar nuevos conocimientos sobre la biología de la progresión de la MS.
En resumen, hemos sido testigos de un progreso notable en nuestra comprensión de la patogenia de la MS y el desarrollo de DMT. Además, estudios innovadores han descubierto factores ambientales y genéticos relevantes en la patogenia de la MS. La identificación de mecanismos de progresión de la enfermedad y biomarcadores para monitorear y apuntar a subconjuntos de células específicas involucradas en la MS puede proporcionar nuevas estrategias terapéuticas para la MS.
Figura 1 Factores genéticos y ambientales que dan forma a la patogenia de la MS
(A) Los estudios genéticos vincularon la susceptibilidad a la MS con genes autosómicos y del cromosoma X. Se demostró que las variantes de HLA promueven la diafonía patógena entre los linfocitos B y T. Las variaciones autosómicas son comparativamente poco estudiadas, pero la evidencia creciente sugiere su participación en las respuestas gliales y de linfocitos desregulados. Queda por determinar el impacto de las variantes genéticas ligadas al cromosoma X.
(B) El microbioma intestinal está alterado en la MS. Se ha demostrado que especies bacterianas específicas promueven respuestas de células T y B patógenas mientras limitan las Treg.
(C) Se ha postulado que la infección por EBV es un desencadenante de la autoinmunidad del SNC en la MS al aumentar la producción de factores patógenos por parte de las células B, al aumentar la función APC de las células B y al desencadenar respuestas de reacción cruzada con antígenos del SNC por mimetismo molecular. .
(D) Las respuestas de promoción de la MS de las células inmunitarias y gliales están influenciadas por factores ambientales (p. ej., exposición a sustancias químicas) y opciones de estilo de vida (p. ej., dieta).
Figura 2Mecanismos inmunitarios e invasión del SNC en la MS
(A) Las APC (DC, macrófagos, células B) y las células T primero interactúan en la periferia, lo que lleva a la activación y desregulación de la inmunidad periférica y la secreción de moléculas inflamatorias.
(B) Las células inmunitarias periféricas invaden el SNC a través de BLMB, BCSFB y BBB, donde pueden interactuar con los subconjuntos locales de APC.
(C) La actividad supresora de Treg deteriorada contribuye a la patogénesis de la MS.
Figura 3 Interacciones célula-célula en el SNC
(A) Mecanismos que impulsan la patología cortical identificada en modelos preclínicos y muestras clínicas. Los déficits de remielinización se han relacionado con la diafonía microglia-oligodendrocitos mediada a través de una respuesta de interferón tipo I. Los mecanismos adicionales relacionados con la disfunción neuronal incluyen RNA largos no codificantes, vías de señalización asociadas al retículo endoplásmico y mitocondrial, y poda sináptica controlada por la señalización del calcio.
(B) Mecanismos que median la diafonía entre células inmunitarias residentes en el SNC y reclutadas por el SNC. C3 se ha implicado en la poda microglial de las sinapsis neuronales (arriba a la izquierda). Las quimiocinas producidas por astrocitos promueven el reclutamiento de monocitos CCR2+ proinflamatorios a través de CCL2 (extremo inferior izquierdo). Los pares de ligando-receptor implicados en la interacción entre los astrocitos residentes en el SNC y la microglía promueven señales reguladoras o proinflamatorias (arriba a la derecha). La modulación bidireccional de las respuestas de células T de astrocitos puede impulsar o limitar la patogénesis de la MS a través de modificaciones epigenéticas, apoptosis y señalización de citoquinas proinflamatorias (abajo a la derecha).
Table 3 Terápias actuales para MS
| Drug | Indication | Main Impact | Mechanism of Action |
| IFN-β-1a | Relapsing MS | Immunomodulation | Inhibits T cell division and CNS infiltration; Induces Tregs and suppressor B cells |
| Glatiramer acetate | Relapsing MS | Immunomodulation | Competes with peptide binding to MHC |
| Teriflunomide | Relapsing MS | Immunomodulation | Pyrimidine synthesis inhibitor |
| Dimethyl fumarate | Relapsing MS | Immunomodulation | NRF2 activation/antioxidant signaling |
| Diroximel fumarate | Relapsing MS | Immunomodulation | NRF2 activation/antioxidant signaling |
| Fingolimod | Relapsing MS | Inhibition of immune cell trafficking | Sphingosine-1-phosphate (S1P) receptor modulator |
| Siponimod | Relapsing MS
SPMS |
Inhibition of immune cell trafficking | Sphingosine-1-phosphate (S1P) receptor modulator |
| Ozanimod | Relapsing MS | Inhibition of immune cell trafficking | Sphingosine-1-phosphate (S1P) receptor agonist |
| Ponesimod | Relapsing MS | Inhibition of immune cell trafficking | Sphingosine-1-phosphate receptor 1 (S1PR1) modulator |
| Natalizumab | RRMS | Inhibition of immune cell trafficking | Anti-VLA-4 monoclonal antibody |
| Cladribine | Relapsing MS | Immunodepletion | Purine analog |
| Alemtuzumab | Relapsing MS | Immunodepletion | Anti-CD52 monoclonal antibody |
| Ocrelizumab | Relapsing MS
PPMS |
Immunodepletion | Anti-CD20 monoclonal antibody |
| Ofatumumab | Relapsing MS | Immunodepletion | Anti-CD20 monoclonal antibody |
Table 1Genes relacionados/riesgo con MS
| Chromosome | Key Susceptibility Loci | Function(s) | Expression | Mechanism | p-value of Genome Wide Significancea |
| 6 | HLA Class II and I regions (E.g. HLA-DRB1, HLA-DPB1, HLA-A, HLA-B) | Adaptive immune regulation and function | Ubiquitous | Antigen presentation | 1.62E-1916 – 4.95E-08 |
| 16 | CLEC16A (C-type lectin domain containing 16) | Regulator of mitophagy | Ubiquitous | Antigen presentation; inflammatory response | 3.70E-71 – 4.09E-09 |
| 1 | CD58 (lymphocyte function-associated antigen 3, LFA3) | CD2 ligand; cell adhesion molecule; costimulatory molecule | Macrophages; dendritic cells | T cell activation | 4.55E-70 |
| 10 | IL2RA (IL-2 receptor alpha or CD25) | High affinity receptor for cytokine IL-2 | T and B cells | T cell activation | 2.96E-65 – 1.76E-15 |
| 12 | TNFRSF1A (TNF receptor superfamily member 1A, CD120a) | TNFα receptor | Ubiquitous | Inflammatory response | 2.24E-47 – 4.13E-10 |
| 3 | CD86 (B7-2) | Ligand for CD28 and CTLA-4; costimulatory molecule | Macrophages; dendritic cells; B cells | T cell activation | 6.98E-43 – 8.32E-10 |
| 1 | EVI5 (ecotropic viral integration Site 5) | Regulator of cell cycle and cell division | Ubiquitous | Unclear | 2.95E-30 |
| 11 | CD6 | ALCAM ligand; costimulatory receptor | T cells | T cell activation; cell trafficking | 2.00E-29 |
| 5 | IL7R (IL-7 receptor, CD127) | IL-7 receptor | Ubiquitous | T cell proliferation | 1.58E-28 |
| 17 | STAT3 (signal transducer and activator of transcription 3) | Transcription factor | Ubiquitous | T cell polarization | 2.32E-28 |
| 11 | CXCR5 (C-X-C motif chemokine receptor 5, CD185) | CXCL13 receptor | B cells | Cell trafficking | 4.53E-26 – 2.10E-19 |
| 1 | Vascular cell adhesion molecule 1 (VCAM1) | VLA-4 ligand; cell trafficking molecule | Ubiquitous | Cell trafficking | 1.11E-22 |
| 20 | CYP24A1 (Cytochrome P450 24A1) | Mitochondrial enzyme | Ubiquitous | Vitamin D metabolism | 1.92E-19 – 3.13E-10 |
| 20 | CD40 | Receptor for CD40L; costimulatory molecule | Macrophages; dendritic cells; B cells | T cell activation | 5.28E-19 |
| 16 | IRF8 (interferon regulatory factor 8) | Transcription factor | Macrophages; dendritic cells; B cells | Transcription control | 2.83E-17 |
| 3 | EOMES (Eomesodermin, TBR2) | Transcription factor | T lymphocytes and NK cells | T cell response | 1.55E-16 |
| 6 | ATXN1 (ataxin 1) | DNA binding protein | Ubiquitous | B-cell modulation | 1.62E-13 |
| 2 | MERTK (MER proto-oncogene tyrosine kinase) | Kinase | Microglia | Phagocytosis | 1.11E-11 |
| X | VGLL1 (vestigial like family member 1) | Transcription cofactor | Unclear | Unclear | 6.86E-09 |
Table2 el empeoramiento funcional continuado en ausencia de representative MS autoantígenos
| Autoantigen | Expression | Function | Reacting Cell Types |
| Myelin basic protein (MBP)a | Oligodendrocytes | Myelin-associated | T and B cells |
| Myelin oligodendrocyte glycoprotein (MOG)b | Oligodendrocytes | Myelin-associated | T and B cells |
| Proteolipid protein (PLP) | Oligodendrocytes | Myelin-associated | T and B cells |
| Myelin-associated glycoprotein (MAG) | Oligodendrocytes | Myelin-associated | T and B cells |
| Myelin-associated oligodendrocyte basic protein (MOBP) | Oligodendrocytes | Myelin-associated | T cells |
| 2′,3′-cyclic nucleotide 3′-phosphodiesterase (CNPase) | Oligodendrocytes | Myelin-associated | T and B cells |
| Transaldolase | Oligodendrocytes | Enzyme | T and B cells |
| Transketolase | Oligodendrocytes | Enzyme | B cells |
| KIR4.1 | Oligodendrocyte; astrocytes | Potassium channel | B cells |
| GlialCAM (HEPACAM)a | Oligodendrocytes; astrocytes | Cell adhesion | B cells |
| Reticulon 4 (NOGO-A) | Oligodendrocytes; neurons | Inhibitor of neurite outgrowth | B cells |
| Contactin-2 | Neurons | Cell adhesion | T cells |
| Neurofilament light chain | Neurons | Cytoskeleton | B cells |
| Tubulin | Neurons | Cytoskeleton | B cells |
| Neurofascin | Neurons | Cell adhesion | B cells |
| RAS guanyl-releasing protein 2 (RASGRP2) | Neurons | Nucleotide exchange factor | T cells |
| β-synuclein (SNCB) | Neurons | Synaptic protein | T cells |
| Prokineticin 2 (PROK2) | Neurons | Circadian clock | T cells |
| Reticulon 3 (RTN3) | Neurons | Protein transporter | T cells |
| Synaptosome associated protein 91 (CALM) | Neurons | Vesicle transport | T cells |
| Anoctamin 2 (TMEM16B)a | Neurons; astrocytes | Chlorine channel | B cells |
| S100β | Astrocytes | Ca2+ binding protein | T cells |
| Aquaporin 4c | Astrocytes | Water channel | B cells |
| Fatty acid. binding protein 7 (FABP7) | Astrocytes | Hydrophobic ligand transporter | T cells |
| GDP-l-fucose synthase (GFUS) | Ubiquitous | Enzyme | T cells |
| αB-crystallin (CRYAB) | Ubiquitous | Small heat shock protein | T and B cells |
a.un autoantígeno reacciona de forma cruzada con antígenos de EBV.
b también en la enfermedad por anticuerpos MOG y la encefalomielitis diseminada aguda.
c también en trastornos del espectro de la neuromielitis óptica.