Ronald Palacios Castrillo
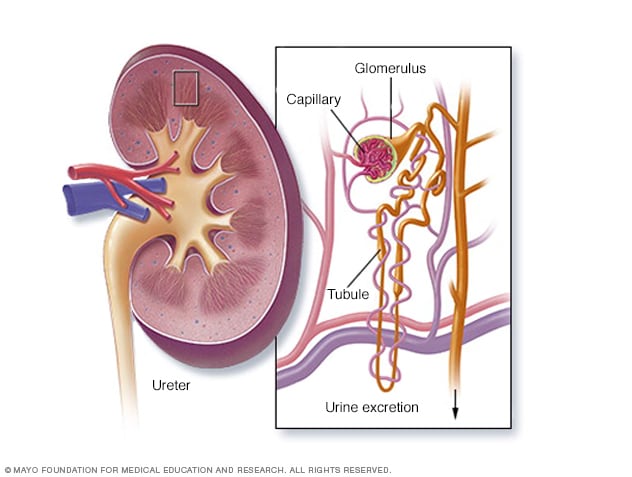
La nefropatía por IgA es la glomerulonefritis primaria más común en la mayor parte del mundo. Por lo general, se manifiesta en la niñez o en la edad adulta temprana.
Aunque tiene una heterogeneidad clínica sustancial, se ha considerado una enfermedad de progresión lenta(1), entre pacientes sin indicadores de riesgo como proteinuria de alto grado, hipertensión marcada y hallazgos específicos en la biopsia.
Después de realizar una evaluación de riesgos sobre la base de una biopsia de riñón (con el uso de la puntuación MEST-C de la Clasificación de Oxford, que se basa en la presencia de hipercelularidad mesangial [M] y endocapilar [E], esclerosis segmentaria [S], fibrosis intersticial o atrofia tubular [T] y semilunas [C]) y una herramienta de predicción clínica multivariable, el tratamiento inicial de la nefropatía IgA2 típica es en gran medida de apoyo e inespecífico: tratamiento con bloqueo del sistema renina-angiotensina-aldosterona (SRAA) (cada vez más, combinado con un inhibidor del cotransportador 2 de sodio-glucosa), si el nivel de proteína en la orina excede los 0,5 g por día.
=> Recibir por Whatsapp las noticias destacadas
Los pacientes con marcadores de riesgo persistentes, como un nivel de proteína urinaria superior a 1 g por día, a pesar de recibir el tratamiento de atención estándar (es decir, la dosis más alta de tratamiento sin efectos secundarios inaceptables), pueden recibir una terapia adicional que incorpore el antagonismo de la endotelina (sparsentan) o glucocorticoides: budesonida de liberación lenta, ya sea sistémicamente activa o dirigida al intestino. Un gran ensayo controlado aleatorio(3) reporta que dosis moderadas de glucocorticoides disminuyeron significativamente el riesgo de muerte o pérdida de la función renal, pero también aumentaron el riesgo de infección grave. Junto con los efectos tóxicos asociados con la exposición a largo plazo, estos resultados generan un entusiasmo limitado por el tratamiento con glucocorticoides sistémicos.
La patogénesis de la nefropatía por IgA se ha vuelto más clara durante la última década.4. La nefropatía por IgA típica parece ser el resultado de un mecanismo de múltiples impactos, que comienza con la producción de IgA1 que es deficiente en residuos de galactosa en su región bisagra (IgA1 deficiente en galactosa), seguido del desarrollo de autoanticuerpos contra la IgA1 deficiente en galactosa y la posterior formación de complejos inmunes circulantes. Estos complejos inmunes se depositan en la matriz mesangial, lo que provoca lesión glomerular.
La forma en que ocurre la lesión renal progresiva no se comprende completamente, aunque la producción de mediadores proinflamatorios por las células mesangiales, la activación del complemento y la posible interacción entre las células mesangiales y los podocitos pueden ser importantes. Una comprensión de los detalles de la patogénesis de la enfermedad podría conducir a posibles nuevas terapias con más eficacia y menos efectos secundarios que las que se utilizan actualmente.
Actualmente se están evaluando en ensayos clínicos varias terapias dirigidas a células B para la nefropatía por IgA.5. Una de estas terapias, que se dirige a un ligando inductor de proliferación (APRIL), un miembro de la familia del factor de necrosis tumoral α, puede alterar esta cadena patogénica. . El anticuerpo monoclonal humanizado IgG2 sibeprenlimab se une a APRIL y lo neutraliza, y se ha demostrado que disminuye reversiblemente los niveles circulantes de IgA y de IgA1 deficiente en galactosa en voluntarios sanos.6.
Mathur et al.(7), informan los resultados de un ensayo de dosis múltiples, doble ciego, aleatorizado, controlado con placebo y de fase 2 de 12 meses de duración en el que participaron 155 adultos con nefropatía primaria por IgA confirmada por biopsia, que de diversas regiones geográficas y que tenían un alto riesgo de progresión de la enfermedad (definido por un nivel de proteína urinaria de ≥1 g por día, a pesar de recibir el tratamiento de atención estándar). Los pacientes fueron asignados aleatoriamente en una proporción 1:1:1:1 para recibir sibeprenlimab intravenoso en una dosis de 2, 4 u 8 mg por kilogramo de peso corporal o placebo una vez al mes, además de la atención de apoyo estándar (principalmente bloqueo del SRAA pero no un inhibidor del cotransportador 2 de sodio-glucosa) durante 12 meses.
El criterio de valoración principal de eficacia del ensayo fue el cambio desde el valor inicial en la relación proteína-creatinina en orina de 24 horas a los 12 meses. Los criterios de valoración secundarios y exploratorios incluyeron la remisión clínica (nivel de excreción de proteínas en la orina <300 mg por día) y el cambio desde el inicio en la tasa de filtración glomerular estimada (TFGe), en los niveles de inmunoglobulinas totales y en la IgA1 deficiente en galactosa y en la libre.
Niveles de ABRIL a 12 meses.
El cambio en el nivel de excreción urinaria de proteínas se considera un criterio de valoración sustituto válido para la progresión a insuficiencia renal en pacientes con nefropatía por IgA. Los puntos finales también se evaluaron a los 16 meses. Un criterio de exclusión clave fue un nivel avanzado de atrofia tubular o fibrosis intersticial o semilunas glomerulares (puntuación MEST-C de T2 o C2).
Las características demográficas y clínicas de los grupos fueron generalmente similares al inicio del estudio y fueron consistentes con las expectativas de una amplia cohorte global de nefropatía por IgA. No se realizaron biopsias repetidas para evaluar los efectos de sibeprenlimab sobre los indicadores histopatológicos, ni se examinaron los efectos del tratamiento sobre la hematuria o los autoanticuerpos contra la IgA1 deficiente en galactosa.
Sibeprenlimab fue eficaz con respecto a múltiples criterios de valoración planificados previamente. La proteinuria disminuyó de manera dependiente de la dosis, independientemente de la gravedad de la proteinuria al inicio del estudio, y estas reducciones en la relación proteína-creatinina en orina persistieron a los 16 meses entre los pacientes que recibían dosis más altas de sibeprenlimab (4 mg por kilogramo y 8 mg por kilogramo). La incidencia de remisión clínica fue mayor con sibeprenlimab que con placebo.
La eGFR media de se mantuvo estadísticamente sin cambios a los 12 meses en el grupo de sibeprenlimab, pero disminuyó en el grupo de placebo (cambio medio de mínimos cuadrados [±SE], −7,4±1,8 ml por minuto por 1,73 m2 de superficie corporal). Los niveles séricos totales de IgA1 y de IgA1 deficiente en galactosa disminuyeron a la mitad con respecto a los niveles iniciales con los tres niveles de dosis de sibeprenlimab a los 12 meses, pero aumentaron hacia los niveles iniciales a los 16 meses. Los niveles libres de ABRIL, muy suprimidos, también se recuperaron en 16 meses. La incidencia de eventos adversos graves que ocurrieron después del inicio de la administración de sibeprenlimab o placebo fue similar entre los grupos.
El grado de reducción de la proteinuria con sibeprenlimab fue consistente con una protección sustancial de la función renal(8), que está respaldada por la estabilización de la TFGe, al menos durante el transcurso del ensayo. El hecho de que los niveles reducidos de APRIL no se mantuvieran después de suspender sibeprenlimab sugiere que la mayoría de los pacientes necesitarían un tratamiento a largo plazo. Por tanto, persiste la posibilidad del eventual desarrollo de anticuerpos contra sibeprenlimab.
La falta de una revisión central de la biopsia en este ensayo reflejó condiciones del “mundo real”; sin embargo, dada la exclusión de pacientes según la puntuación MEST-C, un ensayo de fase 3 probablemente debería incorporar una revisión central. Los ensayos futuros de sibeprenlimab probablemente también deberían incluir el inhibidor del cotransportador 2 de sodio-glucosa como componente del tratamiento no específico(9).
El desfase entre el retorno de los niveles de APRIL y de IgA1 deficiente en galactosa a los niveles iniciales en 16 meses a pesar de la persistencia de una reducción de la proteinuria ofrece la posibilidad de explorar biomarcadores de los componentes posteriores del proceso de lesión renal inducido por el depósito mesangial de complejos inmunes IgA1 deficientes en galactosa (p. ej., marcadores de eliminación de podocitos urinarios).
En general, los hallazgos de este ensayo de fase 2 son muy alentadores; por lo tanto, se espera con impaciencia un ensayo de fase 3. Todavía no sabemos dónde encajará la inhibición de APRIL dentro del panorama en rápida evolución de las terapias para la nefropatía por IgA(5), pero este ensayo ofrece esperanzas de una primavera brillante para el tratamiento de esta irritante enfermedad.
Referencias Bibilográficas
- Wyatt RJ, Julian BA. IgA nephropathy. N Engl J Med 2013;368:2402-2414.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int 2021;100(4):Suppl:S1-S276.
- Lv J, Wong MG, Hladunewich MA, et al. Effect of oral methylprednisolone on decline in kidney function or kidney failure in patients with IgA nephropathy: the TESTING randomized clinical trial. JAMA 2022;327:1888-1898.
- Suzuki H, Kiryluk K, Novak J, et al. The pathophysiology of IgA nephropathy. J Am Soc Nephrol 2011;22:1795-1803.
- El Karoui K, Fervenza FC, De Vriese AS. Treatment of IgA nephropathy: a rapidly evolving field. J Am Soc Nephrol 2023 September 29 (Epub ahead of print).
- Mathur M, Barratt J, Suzuki Y, et al. Safety, tolerability, pharmacokinetics, and pharmacodynamics of VIS649 (sibeprenlimab), an APRIL-neutralizing IgG2 monoclonal antibody, in healthy volunteers. Kidney Int Rep 2022;7:993-1003.
- Mathur M, Barratt J, Chacko B, et al. A phase 2 trial of sibeprenlimab in patients with IgA nephropathy. N Engl J Med 2024;390:20-31.
- Inker LA, Heerspink HJL, Tighiouart H, et al. Association of treatment effect on early change in urine protein and treatment effects on GFR slope in IgA nephropathy: an individual participant meta-analysis. Am J Kidney Dis 2021;78(3):340-349.e1.
- Barratt J, Floege J. SGLT-2 inhibition in IgA nephropathy: the new standard of care? Kidney Int 2021;100:24-26.