Ronald Palacios Castrillo
Prevenir, interceptar y tratar el adenocarcinoma ductal pancreático esporádico (PDAC) es notoriamente difícil, al menos en parte debido a una comprensión incompleta de sus causas.
La adiposidad general notoria es un factor de riesgo bien conocido para PDAC, pero no es específico y también se asocia con cáncer en otros órganos (p. ej., esófago, colon, riñón y mama).
La grasa local discreta dentro del páncreas (depósito de grasa intrapancreática (IPFD)) podría ser un determinante específico del PDAC, y esta fue la premisa del estudio de Yamazaki et al. en Cell Reports Medicine(ver artículo adjunto).
El vínculo entre la IPFD en tejido de páncreas no canceroso y el PDAC (un cáncer caracterizado por una abundante reacción desmoplásica a un volumen relativamente pequeño de células cancerosas) se investigó en varios estudios anteriores.
=> Recibir por Whatsapp las noticias destacadas
Una revisión sistemática y un metanálisis mostraron que más de la mitad de los pacientes con cáncer de páncreas o lesiones premalignas tenían cambios grasos en el páncreas (es decir, un trastorno caracterizado por un exceso de IPFD).
Además, estos pacientes tenían una probabilidad casi 3 veces mayor de sufrir cambios grasos en el páncreas en comparación con los controles.
Algunos estudios también encontraron que el cambio graso del páncreas se asoció significativamente con el PDAC después de tener en cuenta el índice de masa corporal, lo que sugiere que el cambio graso del páncreas no es necesariamente una función de la adiposidad general en pacientes con PDAC.
Sin embargo, todas las investigaciones primarias en humanos hasta la fecha han sido invariablemente estudios observacionales convencionales.
Esta es una barrera clave para comprender el papel de la IPFD en el PDAC, ya que la dirección de la causalidad no se puede determinar a partir de estos estudios.
Más específicamente, es posible que el PDAC provoque un cambio graso del páncreas (p. ej., a través de la obstrucción del conducto pancreático asociado al PDAC que conduce a un aumento de la IPFD), en cuyo caso reflexionar sobre el cambio graso del páncreas tendría implicaciones clínicas limitadas.
El uso de variantes genéticas como experimentos naturales (aleatorización mendeliana) ha surgido como una forma aceptable de establecer una relación causal entre un factor de riesgo modificable y una enfermedad porque las variantes genéticas se fijan en el momento de la concepción.
Es mucho menos probable que este método se vea influenciado por la causalidad inversa y los factores de confusión (tanto medidos como no medidos) que los estudios observacionales convencionales. Yamazaki et al. aprovechó la aleatorización mendeliana para investigar el vínculo entre IPFD y PDAC.
Los autores emplearon un total de ocho polimorfismos de un solo nucleótido previamente identificados de IPFD (por debajo del umbral de valor p de significancia convencional para todo el genoma de 5 × 10-8) y encontraron una relación estadísticamente significativa entre el aumento de IPFD y PDAC.
Esto se mantuvo consistentemente en una serie de análisis de sensibilidad y de subgrupos. En particular, cuando se excluyeron las tres variantes genéticas nominalmente asociadas con el índice de masa corporal, la relación siguió siendo significativa (de hecho, se volvió aún más fuerte).
Los autores también utilizaron un diseño de estudio adicional (un modelo de regresión de Cox multivariable aplicado a una cohorte prospectiva con un período de seguimiento relativamente largo) que arrojó un resultado similar al análisis de aleatorización mendeliana de dos muestras y, por lo tanto, demostró la coherencia de la relación entre el aumento IPFD y PDAC en diferentes diseños de estudio.
Este conjunto de trabajos representa una contribución importante, ya que proporciona la primera evidencia causal, más que asociativa, del papel de la IPFD en el desarrollo de PDAC en humanos.
Idealmente, dicha evidencia habría provenido de un ensayo controlado aleatorio con suficiente poder estadístico. Sin embargo, como el uso de este diseño de estudio para investigar el efecto de IPFD en PDAC no es factible en humanos, la solidez de la evidencia obtenida por los autores solo podrá igualarse, pero no superarse, en los próximos años.
Los hallazgos principales presentados por Yamazaki et al. de alguna manera confirma la hipótesis de PANDORA (Enfermedades PANcreáticas Originadas por grasa intrapancreática).
Postula que el cambio graso del páncreas es la anomalía estructural no genética más importante que subyace a todas las enfermedades comunes del páncreas (como la diabetes tipo 2, la diabetes del páncreas exocrino, la pancreatitis aguda, la pancreatitis crónica y el PDAC).
En particular, la quinta predicción de la hipótesis PANDORA está específicamente relacionada con un aumento de la IPFD que aumenta el riesgo de cáncer de páncreas esporádico.
El cambio graso del páncreas podría facilitar la reprogramación celular impulsada por la hipoxia, la liberación de citocinas proinflamatorias, el aumento de la presencia de progenitores de células cancerosas y dar como resultado el desarrollo de un microambiente pancreático ventajoso para la formación de PDAC.
Es apropiado mencionar en este punto que El cambio graso del páncreas también predispone a la pancreatitis, que es uno de los factores de riesgo a largo plazo más fuertes conocidos para PDAC.
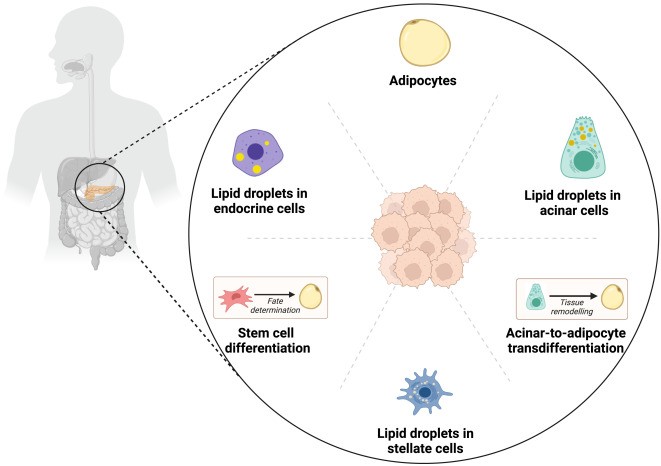
Si bien las interacciones celulares detalladas que involucran los lípidos y la carcinogénesis en el páncreas aún no se han dilucidado, es probable que el PDAC se desarrolle a través del efecto combinado de múltiples rutas (a menudo durante décadas) que reflejan la naturaleza múltiple de la IPFD (Figura 1).
Los adipocitos entre los lóbulos pancreáticos son los sospechosos más obvios de la carcinogénesis pancreática, ya que la grasa retroperitoneal puede invaginar el páncreas.
Pero hay varias otras células residentes en el páncreas y procesos que involucran a estas células, que también contribuyen a la IPFD y pueden desempeñar un papel en Carcinogénesis pancreática.
Tanto las células acinares como las células endocrinas del páncreas humano pueden contener gotitas de lípidos: los orgánulos dinámicos que almacenan ácidos grasos (en forma de triglicéridos y ésteres) y los dirigen a diversas vías, especialmente en condiciones hipóxicas.
Las células acinares altamente plásticas también pueden cambiar su identidad y, por ejemplo, convertirse en adipocitos mediante la transdiferenciación de acinares a adipocitos.
Las células madre mesenquimales (ubicadas en la adventicia de las arterias y venas pancreáticas) sustentan el reemplazo graso de las células parenquimatosas después de su muerte por peroxidación lipídica u otras vías. Por último, se sabe que las células estrelladas del páncreas, normalmente ubicadas cerca de los conductillos pancreáticos, contienen gotitas de lípidos (que acumulan ésteres de retinilo y ácido palmítico) en estado de reposo.
La pérdida de gotitas de lípidos cuando las células estrelladas del páncreas se activan en fibroblastos asociados al cáncer puede desempeñar un papel en el tráfico intercelular que prepara el escenario para el PDAC.
Independientemente de los mecanismos celulares exactos, la evidencia acumulada obliga a considerar los trastornos de los lípidos en el páncreas como el objetivo fundamental para la prevención o interceptación del PDAC esporádico.
El modelo PANDORA integrado “mueve la aguja” al pensar por qué se desarrolla el cáncer de páncreas. La próxima vez que alguien le diga que el destino le depara muchas curvas a una persona con cáncer de páncreas, pregúntese si en realidad será grasa (en su páncreas).