Resumen
Esta revisión integral explora los intrincados mecanismos de la PANoptosis ( muerte celular )y sus implicaciones en el cáncer. La PANoptosis, una convergencia de apoptosis, piroptosis y necroptosis, desempeña un papel crucial en la muerte celular y la regulación de la respuesta inmune. El estudio profundiza en las vías moleculares de cada mecanismo de muerte celular y su interacción dentro de la PANoptosis, enfatizando los componentes compartidos como las caspasas y el complejo PANoptosoma. Destaca el papel importante de la PANoptosis en diversos cánceres, incluidos los cánceres respiratorio, digestivo, genitourinario, gliomas y de mama, y muestra su impacto en la tumorigénesis y las tasas de supervivencia de los pacientes. Además, analizamos la relación entretejida entre la PANoptosis y el microambiente tumoral (TME), que ilustra cómo la PANoptosis influye en el comportamiento de las células inmunitarias y la progresión del tumor. Subraya la interacción dinámica entre los tumores y sus microambientes, centrándose en las funciones de las diferentes células inmunitarias y sus interacciones con las células cancerosas. Además, la revisión presenta nuevos avances en la terapia del cáncer, enfatizando el potencial de atacar la PANoptosis para mejorar la inmunidad antitumoral. Describe varias estrategias para manipular las vías de PANoptosis con fines terapéuticos, como apuntar a moléculas de señalización clave como caspasas, NLRP3, RIPK1 y RIPK3. También se explora el potencial de tratamientos novedosos como las terapias inmunogénicas iniciadas por PANoptosis y las estrategias basadas en nanopartículas.
=> Recibir por Whatsapp las noticias destacadas
Introducción
Numerosos estudios han demostrado consistentemente que controlar la proliferación celular y eliminar células innecesarias o potencialmente dañinas es esencial para mantener la homeostasis para el crecimiento y desarrollo de organismos multicelulares in vivo . La muerte celular programada (PCD) es un mecanismo eficaz para regular estos procesos, diseñado para esculpir, controlar y ayudar activamente en el desarrollo y la supervivencia del cuerpo . La PCD abarca tanto la apoptosis clásica dentro del contexto de la homeostasis tisular y del desarrollo, como también formas alternativas que surgen en respuesta a perturbaciones del microambiente exógenas o endógenas, como la apoptosis, piroptosis, necroptosis, ferroptosis, autofagia y otras .
El estudio de las vías de piroptosis, apoptosis y necroptosis de PCD más clásicas y bien definidas y, lo más importante, la interacción entre estas tres vías, ha llevado al establecimiento y desarrollo del concepto de «PANoptosis». La evidencia de PANoptosis se proporcionó por primera vez en un estudio de macrófagos infectados por el virus de la influenza A (IAV), que demostró que la activación de caspasa-1, caspasa-3 y caspasa-8, así como la fosforilación de MLKL, eran eventos moleculares clave en piroptosis, apoptosis y necroptosis . Vale la pena señalar que la PANoptosis tiene características clave de las vías anteriores, pero no puede explicarse por ninguna de ellas por sí sola. Más bien, están interconectados y mantienen el equilibrio dinámico al compartir un complejo proteico mortal, a saber, el «PANoptosoma», que se cree que es una plataforma que puede activar múltiples modos de muerte celular . Como tal, se produce una importante interferencia en la ejecución y regulación de las numerosas vías en la PANoptosis.
Estudios recientes se han centrado en los complejos mecanismos moleculares subyacentes a la PANoptosis y sus implicaciones en las enfermedades humanas, particularmente el cáncer . La progresión del cáncer se ha relacionado con mecanismos que permiten a las células cancerosas evitar la PANoptosis. Por lo tanto, comprender la conexión entre la PANoptosis y el cáncer puede proporcionar conocimientos más profundos sobre la aparición y el tratamiento del cáncer, y puede ser fundamental para explorar nuevas estrategias terapéuticas al interferir con el mecanismo de escape de la PANoptosis en las células cancerosas. Además, dentro del TME, la PANoptosis puede combatir la progresión tumoral mediante regulación local y respuestas inmunitarias, incluido el efecto letal de las células inmunitarias. Sin embargo, los estudios sobre estos mecanismos aún están en sus inicios y requieren mayor exploración.
En este estudio, nos centraremos en los mecanismos moleculares de cada vía de PCD, los importantes eventos de interferencia presentes en la PANoptosis e investigaremos su relación con la TME y el cáncer, así como estrategias terapéuticas específicas.
Mecanismos y eventos de diafonía en PANoptosis.
PANoptosis: apoptosis, piroptosis y necroptosis
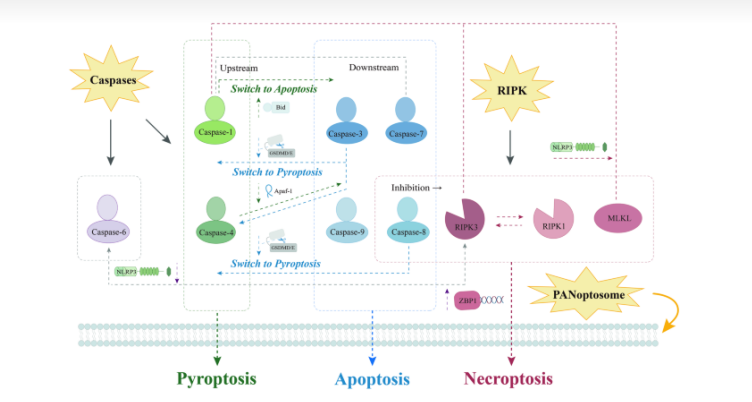
Hasta la fecha, la apoptosis, la piroptosis y la necroptosis son las tres vías de PCD que se han estudiado y caracterizado más exhaustivamente en respuesta a la lesión celular, pero su maquinaria molecular es bastante diferente (Fig. 1).
La apoptosis se puede dividir en dos vías: intrínseca y extrínseca. La vía intrínseca ocurre dentro de las mitocondrias y puede ser desencadenada por diversos estímulos como toxinas, hipoxia, factores de crecimiento e infecciones virales , mientras que la vía extrínseca involucra a la superfamilia del gen TNF, que está mediada por receptores de muerte. La vía intrínseca está regulada por miembros de la familia BCL-2 proapoptóticos (BAK, BAX, Bid, etc.), que promueven la permeabilización de la membrana externa mitocondrial (MOMP) y la liberación de citocromo c (Cyt. c) . Cit. c luego forma un complejo con Apaf-1 y dATP en el citoplasma, conocido como apoptosoma, que activa la procaspasa-9 . En la vía extrínseca, están implicados los receptores de muerte que contienen dominios de muerte (DD) (p. ej., FADD, TRADD). Estos receptores de muerte reconocen ligandos específicos y activan el reclutamiento y la activación de caspasa-8, lo que lleva a la formación de un complejo de señalización inductor de muerte (DISC). Luego, la caspasa-8 activa las caspasas ejecutoras o induce la vía intrínseca. Ambas vías convergen en la activación de caspasa-3 y caspasa-7, que llevan a cabo la escisión proteolítica y una mayor activación de objetivos posteriores .
La piroptosis es una forma de muerte celular mediada por el complejo inflamasómico, que consta principalmente de un sensor, un adaptador y un zimógeno procaspasa-1. Se han identificado algunos tipos de inflamasomas, de los cuales NLRP3 es el miembro mejor estudiado. Los sensores de inflamasoma generalmente se agrupan en NLR, AIM2 (ausente en el melanoma 2) o pirina, que poseen la capacidad de ensamblar inflamasomas y activar directa o indirectamente la caspasa-1 cuando se los somete a varios patrones moleculares asociados a patógenos (PAMP) y Patrones moleculares asociados a daños (DAMP). La ASC, una proteína adaptadora, se compone de dos dominios de muerte: un dominio de pirina (PYD) y un dominio de reclutamiento de caspasa (CARD), que permiten a la ASC unir y acoplar la molécula sensora del inflamasoma aguas arriba a la proteasa efectora caspasa. 1 . La caspasa-1 activada escinde GSDMD (gasdermina D), lo que conduce a la formación de poros en la membrana plasmática y la liberación de citoquinas IL-1β e IL-18 . De manera diferente, la caspasa-4 y -5 en humanos media la señalización del inflamasoma no canónico al reconocer directamente los LPS (lipopolisacáridos) bacterianos gramnegativos, lo que desencadena la activación proteolítica del GSDMD formador de poros, que impulsa la piroptosis .
La necroptosis, como se define, se caracteriza tanto por necrosis como por apoptosis. Aunque muestra rasgos morfológicos similares a la necrosis, en realidad es parte de la vía de la apoptosis, que induce la muerte celular ordenada mediante la activación de vías de señalización de muerte específicas . La vía de señalización TNF/TNFR es un inductor de necroptosis bien estudiado . Se cree que RIPK1, un regulador ascendente, es un nodo de señalización clave en la vía de transducción de señales de TNF, que regula activamente el equilibrio entre la activación genética y la inducción de la muerte celular en forma de apoptosis y necroptosis . En ausencia de apoptosis, es decir, cuando se inhibe la actividad de la caspasa-8, el ensamblaje del necrosoma RIPK1/RIPK3 promueve la necrosis programada . Posteriormente, el necrosoma fosforila el bucle de activación del efector obligado más terminal MLKL (proteína similar al dominio de quinasa de linaje mixto), lo que lleva a su translocación a la membrana plasmática, donde altera la integridad de la membrana, lo que resulta en necroptosis .
Diafonía y regulación en PANoptosis.
Un creciente conjunto de investigaciones ha enfatizado que las vías de apoptosis, piroptosis y necroptosis involucradas en la PANoptosis pueden coactivarse dentro de la misma célula, y se ha demostrado que estas tres vías, aunque operan en paralelo, pueden regularse entre sí mediado por un complejo multiproteico conocido como PANoptosoma. El concepto de PANoptosoma fue introducido por Christgen et al. . Sus hallazgos sugirieron interacciones directas entre las moléculas PANoptóticas y la formación del PANoptosoma, y confirmaron la existencia de eventos cruzados amplios en el mecanismo de la PANoptosis (Fig. 2). Hasta el momento, se han identificado más especies diferentes de PANoptosomas, incluido el ZBP1-PANoptosoma, el AIM2-PANoptosoma, el RIPK1-PANoptosoma y el NLRP12-PANoptosoma.
Las caspasas son una clase de proteasas con funciones bien definidas en la apoptosis , así como actores centrales en la piroptosis. Varios estudios han revelado claramente el papel crítico de la activación e inactivación mediada por caspasas de la familia de proteínas gasdermina, así como su importante papel en la lisis de la membrana celular y la posterior muerte celular inflamatoria . Además, las caspasas convergen en la activación del inflamasoma, la muerte celular y la inmunidad innata , lo que proporciona pruebas sólidas de la existencia de eventos de interferencia en la PANoptosis . Si bien la caspasa-1 se ha considerado durante mucho tiempo un componente clave en la mediación de la piroptosis, también funciona a través del eje Bid-caspasa-9-caspasa-3 en células que carecen de Gasdermina para iniciar la apoptosis . La caspasa-3, el ejecutor de la apoptosis, puede apuntar a la membrana plasmática para inducir necrosis secundaria o piroptosis después de la escisión de la proteína DFNA5 relacionada con Gasdermina . Mientras tanto, también se ha demostrado que GSDME/DFNA5 cambia la apoptosis mediada por caspasa-3 inducida por TNF o fármacos de quimioterapia a piroptosis , lo que indica líneas cruzadas inevitables entre la apoptosis y la piroptosis asociada a inflamación. Además, esta interferencia puede ser bidireccional, como se verifica en la apoptosis, donde la caspasa-3 puede escindir Gasdermina para bloquear potencialmente la piroptosis a través de un sitio diferente al de las caspasas inflamatorias que inactivan la proteína .
De manera similar, la caspasa-4 es otro actor en la vía no clásica de la piroptosis. Se ha demostrado que la caspasa-4, activada en el piroptosoma Apaf-1 mediado por Apaf-1 (un actor importante en la apoptosis), puede continuar escindiendo la caspasa-3, lo que a su vez conduce a la piroptosis inducida por Gasdermina . Otros estudios han propuesto que la caspasa-6 es necesaria para la activación del inflamasoma NLRP3 mediada por ZBP1 y la PCD de forma independiente de la actividad de la proteasa. Aunque funcionalmente categorizada como una caspasa ejecutora apoptótica, la caspasa-6 no posee la misma especificidad de sustrato que las caspasas-3 y -7, sino que se parece a las caspasas-8 y -9 iniciadoras. Además, durante la infección por IAV, la caspasa-6 interactúa con RIPK3 y facilita la unión de RIPK3 y ZBP1, mejorando así la activación del inflamasoma mediada por ZBP1 y la muerte celular inflamatoria . La caspasa-7, identificada como un nuevo sustrato de la caspasa-1, se ha convertido en un factor interesante. Se ha demostrado que el inflamasoma caspasa-1 desempeña un papel en la activación de caspasa-7 in vivo, y esta activación se ha validado in vitro y en macrófagos knock-out .
En particular, la caspasa-8 no solo es un componente clave de la vía de la apoptosis exógena, sino que también sirve como un interruptor molecular común para la apoptosis, la necroptosis y la piroptosis, funcionando como un centro de señalización para el mecanismo general . Progresivamente se está descubriendo su papel en la activación del inflamasoma y en el procesamiento de pro-IL-1β. Por ejemplo, se ha observado que en los macrófagos, la apoptosis inducida por BAX/BAK desencadena la activación de caspasa-8 y ayuda en la maduración de IL-1β, una citocina proinflamatoria central . Otros estudios han indicado que la caspasa-8 es un componente esencial necesario tanto para el cebado transcripcional como para la activación de los inflamasomas NLRP3 típicos y atípicos en ratones , y que su activación durante la inhibición de TAK1 puede conducir a la escisión de Gasdermina y GSDME en macrófagos murinos . La caspasa-8 media la apoptosis inducida por receptores de muerte e inhibe la necroptosis mediada por RIPK3 y MLKL. La caspasa-8 mutante induce la formación de motas de ASC y la escisión de Gasdermina dependiente de caspasa-1 y caspasa-3 y 7 en ratones con deficiencia de MKKL . La investigación de Zhang et al. descubrieron que la quinasa p90 ribosoma S6 (RSK) se reclutaba en el necrosoma fosforilada pro-caspasa-8 en Thr265, eliminando la actividad de la caspasa-8 y provocando la aparición de necroptosis . Esto también fue respaldado por otro estudio en el que la caspasa-8 controla naturalmente las vías de muerte dependientes de RIPK3 además de promover la apoptosis . Además, la caspasa-8 también desempeñó un papel promocional para la activación del inflamasoma NLRP3, y su función de andamiaje y MLKL fueron necesarios para regular la activación del inflamasoma NLRP3 aguas abajo de TLR3 .
Las proteínas quinasas que interactúan con el receptor (RIPK), específicamente RIPK1 y RIPK3, sirven como sustratos para la caspasa-8 y desempeñan funciones reguladoras fundamentales en la vía de señalización de la PANoptosis. RIPK1 participa en vías de señalización tanto dependientes como no dependientes de RIPK3 que conducen a la muerte celular y/o la inflamación. Los estudios han demostrado que RIPK1 bloquea la letalidad posnatal temprana mediada por caspasa-8 y RIPK3, así como regula la señalización de FADD-caspasa-8 y RIPK3-MLKL . Otra idea más novedosa que ha llamado la atención es el hallazgo de que cuando el nivel de RIP1 excede aproximadamente 1000 moléculas por célula (mpc), tanto caspasa-8 como RIPK3 pueden reclutarse en el necrosoma, lo que resulta en el inicio simultáneo de apoptosis y necroptosis, respectivamente. Por el contrario, cuando está presente una cantidad mayor de RIP1 (>~46.000 mpc), se inhibe la apoptosis y solo se produce necroptosis . Esto sugiere que el nivel de RIP1 puede indicar diferentes resultados para el destino de la muerte celular, que se logra principalmente regulando su expresión de manera diferente.
Además, a medida que avanzaba el estudio, los investigadores confirmaron que la actividad del inflamasoma NLRP3 es un factor de inflamación en las enfermedades dependientes de MLKL. Bajo ciertas condiciones, la señalización de necroptosis podría desencadenar el eje RIPK3-MLKL-NLRP3-Caspasa-1, lo que resultaría en la maduración y liberación de IL-1β independientemente de Gasdermina [63,64,65].
La asociación de la PANoptosis con el cáncer.
Hasta ahora, evidencia sustancial ha demostrado que las subrutinas de PCD, incluidas la apoptosis, piroptosis, necroptosis y ferroptosis, son fundamentales en la tumorigénesis. La pérdida de control sobre las subrutinas de PCD individuales o combinadas puede contribuir al desarrollo de cáncer . Se ha observado una expresión aberrante de genes relacionados con la PANoptosis (PRG), como NLRP3, caspasa-8 y TNFAIP3, en varios tipos de cáncer, y se han detectado mutaciones notables. En particular, muchos PRG sirven como factores de riesgo de tumores en diferentes tipos de cáncer. Además, los genes de PANoptosis y las puntuaciones de PANoptosis se han relacionado significativamente con la supervivencia de los pacientes en 21 y 14 tipos de cáncer, respectivamente . En el contexto del cáncer, se ha demostrado que el aumento de la expresión de A ADAR1-p150 restringe la unión de ZBP1 y RIPK3, suprimiendo en consecuencia la PANoptosis mediada por ZBP1 para facilitar el crecimiento tumoral . Estos hallazgos sugieren que la PANoptosis puede ejercer una influencia positiva en tipos de cáncer específicos, y la inducción de PANoptosis podría ayudar a inhibir el desarrollo y la progresión del cáncer.
PANoptosis en cánceres respiratorios.
Actualmente se está investigando el papel de la PANoptosis en el cáncer de pulmón. FADD sirve como un adaptador clave en la PANoptosis y es uno de los factores de riesgo destacados para el cáncer de pulmón. Los experimentos in vitro han indicado que la eliminación de FADD promueve la apoptosis y la piroptosis y reduce significativamente la capacidad proliferativa de las células pulmonares cancerosas, lo que sugiere que la identificación de rasgos pronósticos basados en los genes regulados por FADD puede proporcionar una nueva dirección para el tratamiento del cáncer de pulmón. Además, TRADD, NLRC4, RIPK1, MLKL y PSTPIP son PRG asociados con el pronóstico en adenocarcinomas de pulmón (LUAD) y son esenciales en la PANoptosis que implica apoptosis y piroptosis. Las expresiones elevadas de TRADD, NLRC4, RIPK1 y PSTPIP2 en pacientes se correlacionaron con un mejor pronóstico, mientras que las expresiones elevadas de FADD y MLKL se relacionaron con un mal pronóstico . Varios genes de PANoptosis se asociaron significativamente con la supervivencia de LUAD . Este hallazgo implica fuertemente la participación de la PANoptosis en el microambiente tumoral (TME) y la regulación inmune en LUAD.
PANoptosis en cánceres del sistema digestivo.
Actualmente, la PANoptosis se está estudiando ampliamente en los cánceres del sistema digestivo. En el cáncer gástrico (CG), el papel de la PANoptosis se exploró anteriormente y se encontró que está estrechamente relacionado. Se observó que los patrones de PANoptosis en pacientes con GC predicen la supervivencia y la respuesta a la inmunoterapia . Se ha propuesto la puntuación de riesgo relacionada con la PANoptosis (PANS), una puntuación de riesgo derivada de genes asociados con la PANoptosis. Con base en esta puntuación, los académicos han investigado a fondo la correlación entre PANS y pronóstico de GC, TME, eficacia de la inmunoterapia y sensibilidad a los fármacos quimioterapéuticos, ofreciendo una base más teórica para la terapia antitumoral .
En el carcinoma hepatocelular (CHC), un estudio posterior exploró la expresión de los PRG y su pronóstico, revelando diferencias significativas en el 86,15% (56/65) de los PRG. Entre ellos, 33 PRG estaban regulados positivamente en muestras de CHC (incluidos 20 genes relacionados con la apoptosis, 11 genes relacionados con la piroptosis y 2 genes relacionados con la necroptosis), mientras que los 23 restantes mostraron una regulación negativa (incluidos 7 genes relacionados con la apoptosis, 12 genes relacionados con la piroptosis) genes y 4 genes relacionados con la necroptosis). Más importante aún, los niveles de expresión de la mayoría de los PRG se correlacionaron con la supervivencia general (SG) en pacientes con CHC . Cancón y col. predijeron la respuesta al tratamiento y la supervivencia del CHC basándose en un subtipo molecular compatible con la PANoptosis y el índice HPAN , mientras que Shi et al. y Galluzzi et al. con sus respectivos equipos también evaluaron un modelo de pronóstico basado en PANoptosis como un biomarcador de pronóstico potencial para pacientes con CHC y validaron la caracterización de subtipos moleculares de la presencia de PRG en CHC . Casualmente, los estudios han demostrado que la PANoptosis está estrechamente asociada con la supervivencia y la inmunidad asociadas al carcinoma hepatocelular de hígado (LIHC), y que la agregación molecular y las características pronósticas encontradas en la PANoptosis podrían predecir las condiciones inmunológicas y pronósticas de los pacientes con LIHC .
El papel que puede desempeñar la activación de la PANoptosis en el cáncer de colon y colorrectal también ha sido respaldado en estudios recientes. En el panorama de la variación genética de los PRG en pacientes con cáncer de colon, se pudieron encontrar alteraciones en el número de copias somáticas en 19 PRG, siendo ZBP1, GSDMD, AIM2 y NLRP3 los que tuvieron la mayor variación en el número de copias (CNV). Además, se observó que genes como capase-8, MLKL, FADD y TRADD estaban regulados positivamente en las muestras de tumores, mientras que caspasa-7, NLRP3, RIPK1 y RIRP3 estaban regulados negativamente en su expresión . Otro hallazgo interesante proviene del NLRP3, uno de los factores clave que median la vía de señalización de la PANoptosis, que ahora se ha demostrado que está fuertemente asociado con el cáncer. En experimentos en modelos de ratón con cáncer de colon, los investigadores descubrieron que los ratones con deficiencia de NLRP3 eran muy sensibles al cáncer asociado a la colitis (CAC) inducido por el sulfato de dextrano sódico (DSS) y el azoximetano (AOM). Los ratones que carecían de la proteína adaptadora del inflamasoma PYCARD (ASC) y caspasa-1 también mostraron una mayor prevalencia de tumores en comparación con los ratones de tipo salvaje, y el aumento de la carga tumoral se asoció con niveles reducidos de IL-1β e IL-18 en el sitio del tumor . El factor regulador de interferón 1 (IRF1) también se ha identificado como un regulador ascendente de la PANoptosis que previene la tumorigénesis en un modelo de ratón espontáneo de CCR al inducir la muerte celular durante la tumorigénesis asociada a la colitis . Además, se ha demostrado que la terapia combinada con IFN y un inhibidor de la exportación nuclear (p. ej., KPT-330) inhibe la tumorigénesis y la progresión en el CCR al inducir la PANoptosis dependiente de ZBP1 mediante la modulación de la relación reguladora entre ADAR1 y ZBP1 .
PANoptosis en cáncer genitourinario
Un estudio reciente ha indicado una fuerte asociación entre la PANoptosis y el carcinoma de células renales de células claras (ccRCC). Los investigadores establecieron un modelo característico utilizando tres miARN específicos (hsa-miR-21-5p, hsa-miR-223-3p y hsa-miR-200a-5p) para predecir la SG de los pacientes con ccRCC. El estudio reveló que una firma compuesta por tres miARN relacionados con PANoptosis podría servir como un marcador molecular de pronóstico independiente para ccRCC .
En el contexto del adenocarcinoma de próstata (PRAD), también se han identificado alteraciones e interconexiones de la PANoptosis, incluidas mutaciones genéticas, alteraciones transcripcionales, cambios de metilación y características clínicas. A través de una comparación de múltiples vías de PANoptosis enriquecidas diferencialmente entre tumores y tejidos normales adyacentes, Yi et al. demostró la interconexión de la apoptosis, piroptosis y necroptosis a través de un conjunto de genes como ZBP1, RIPK1, caspasa-1, caspasa-6, caspasa-8 y FADD en PRAD. En consecuencia, al construir una firma de PANoptosis, se pueden hacer predicciones precisas sobre el pronóstico y la respuesta inmunoterapéutica de los pacientes con PRAD .
PANoptosis en gliomas
La observación de la PANoptosis en la lesión cerebral isquémica respalda aún más la idea de que la PANoptosis puede servir como objetivo para la regulación de una variedad de trastornos que afectan al sistema nervioso central . Varios investigadores examinaron la conexión entre la PANoptosis y los gliomas y descubrieron que la PANoptosis se ha convertido en un factor importante en el pronóstico de los gliomas. El análisis comparativo ha revelado factores genéticos y moleculares asociados con grupos de pronóstico de PANoptosis en gliomas, allanando el camino para un mejor pronóstico en poblaciones de pacientes estratificadas por riesgo según el fenotipo de PANoptosis . Actualmente, se ha desarrollado un modelo de red neuronal artificial (ANN) basado en aprendizaje automático para discriminar subgrupos relacionados con PANoptosis con implicaciones importantes en la predicción del pronóstico en gliomas . En un estudio de Song et al., la puntuación PANoptotic se identificó como un factor pronóstico independiente del glioma. Los investigadores construyeron la puntuación PANoptotic utilizando diferentes características clínicas de inmunidad antitumoral basadas en subtipos moleculares de genes relacionados con PANoptosoma en gliomas. Observaron alteraciones significativas en la expresión de cinco genes incluidos en la puntuación PANoptotic en muestras de glioma, lo que sugiere un posible vínculo intrínseco entre la PANoptosis y el glioma .
PANoptosis en cáncer de mama
Cada vez hay más evidencia que sugiere que la PANoptosis, como nueva forma de PCD, puede ser un factor crucial en el desarrollo del cáncer de mama , lo que ha llevado a mayores avances en las estrategias para inducir la PANoptosis como parte del tratamiento del cáncer de mama. Las interacciones entre la PANoptosis y el cáncer de mama se pueden agrupar en tres categorías: inducción de apoptosis para promover la muerte celular en el cáncer de mama, efectos sinérgicos de la piroptosis y necroptosis para promover la muerte celular e inhibición de la muerte celular inducida por apoptosis mediante necroptosis en el cáncer de mama . . También se centró en la relación entre la PANoptosis y el cáncer de mama. Mediante un análisis exhaustivo de los perfiles genéticos en el cáncer de mama, determinaron el porcentaje de PRG en cada célula de cáncer de mama, lo que sugiere que la alta expresión de PANoptosis es beneficiosa para reducir la incidencia de cáncer de mama . Un estudio reciente construyó y validó un modelo de pronóstico basado en PANoptosis, que es valioso para predecir los resultados de supervivencia de pacientes con cáncer de mama. El estudio confirmó además la importancia de la firma genética relacionada con la PANoptosis en la modulación de la TME y la sensibilidad a los fármacos en el cáncer de mama, proporcionando información fundamental para la investigación mecánica posterior y las decisiones de tratamiento personalizadas .
PANoptosis y TME(microambiente celular)
La interacción dinámica entre el tumor y el microambiente.
La relación entre un tumor y su microambiente es dinámica, como lo demuestra la influencia del tumor en el microambiente y el equilibrio entre los factores protumorales y antitumorales dentro de él, que colectivamente regulan el crecimiento del tumor . El tumor en sí puede provocar una respuesta inmune innata a factores de crecimiento, factores proangiogénicos y otras sustancias que promueven el crecimiento y la invasión del tumor. La inflamación crónica en el TME y la evasión de las respuestas inmunes antitumorales son los principales factores que afectan la aparición y el desarrollo del tumor .
TME es una red compleja de componentes celulares y no celulares dentro y alrededor de una masa tumoral, que abarca diversos tipos de células (como células cancerosas, células inmunes, fibroblastos y células endoteliales), vasos vasculares y linfáticos, así como elementos mieloides y linfoides dentro de los tumores. Funciona como un ecosistema dinámico y muy complejo que afecta significativamente el crecimiento, la progresión y la metástasis del tumor y, en última instancia, determina el destino del tumor y mantiene su equilibrio. La teoría clásica sugiere que las mutaciones oncogénicas de las células malignas conducen al inicio del cáncer. Posteriormente, las células circundantes no transformadas son reclutadas y adaptadas, acompañadas de la liberación de citocinas, quimiocinas y vesículas. Las consecuencias son la formación de TME y una estrecha interacción con las células cancerosas. Se puede suponer que las células cancerosas moldean y entrenan la TME para ayudar en el desarrollo de las características del cáncer . Por un lado, las células cancerosas pueden comunicarse directamente con las células estromales o inflamatorias en el TME para adquirir efectos protectores y de apoyo. Por otro lado, las células cancerosas pueden reclutar células estromales o inmunitarias secretando activamente factores inflamatorios y de crecimiento para inducir la angiogénesis y la linfogénesis, creando un entorno propicio para el crecimiento, la invasión y la evasión de la vigilancia inmunitaria de las células tumorales.
Las células inmunes son actores que juegan un papel crucial en el TME. Coexisten con las células cancerosas y establecen intrincadas interacciones con ellas. El microambiente inmunológico dentro de los tumores es muy complejo, con casi todos los tipos de células inmunes, incluidos macrófagos, mastocitos, células asesinas naturales (NK), células dendríticas (DC) y linfocitos T y B, que se infiltran en los tejidos cancerosos . Entre ellos, subgrupos específicos como los linfocitos T citotóxicos (CTL) y las NK pueden eliminar las células cancerosas en el TME e impedir el crecimiento del tumor. En los tumores sólidos, los macrófagos asociados a tumores (TAM) son las células infiltrantes inmunitarias más abundantes y surgen de la proliferación local de macrófagos residentes y la infiltración de macrófagos derivados de monocitos. El aumento del número de TAM generalmente se asocia con un mal pronóstico y resistencia al tratamiento .
PANoptosis en relación con TME
Papel de las citocinas productoras de PANoptosis en el TME
Múltiples componentes intracelulares liberados durante el proceso de PANoptosis pueden estar involucrados en la reestructuración de la composición y función del TME, siendo las sustancias inflamatorias las que tienen el impacto más notable en la influencia y regulación del TME. Como modos inflamatorios de PCD, tanto la piroptosis como la necroptosis liberan una gran cantidad de factores inflamatorios y DAMP específicos, induciendo la generación de reacciones inflamatorias. La liberación de factores inflamatorios puede influir aún más en la inmunogenicidad de las células tumorales y la actividad de las células inmunes en el TME, afectando en última instancia el crecimiento y la metástasis del tumor y desempeñando un papel protumoral o antitumoral. Varios de los mediadores inflamatorios más representativos, IL-18, IL-1β, IL-1α y TNF-α, son esenciales para las vías de señalización que causan respuestas inflamatorias. Es razonable creer que la liberación de este producto final puede contribuir a dar forma al panorama inmunológico de un TME inflamatorio.
IL-18, IL-1β e IL-1α tienen una función variada y al mismo tiempo forman parte de la familia IL-1. Existe consenso en que la IL-1 es un mediador central de las interacciones entre las células en el TME inflamatorio, activando las respuestas inflamatorias y orquestando la diversidad de las respuestas inmunes. El papel protumoral de la IL-1β ha sido respaldado durante muchos años, y también se ha demostrado que su asociación con la angiogénesis tiene una clara correlación en una amplia gama de tumores, que se manifiesta como una mayor angiogénesis y promoción de la progresión tumoral. El papel desempeñado por la IL-18 en la TME puede ser de naturaleza dual. Los niveles elevados de IL-18 ejercen efectos protumorales al participar en la angiogénesis, la invasión de células tumorales y la metástasis. Además, la IL-18 evade la respuesta inmune antitumoral, como lo refleja el posible papel inmunosupresor de la IL-18 en los tumores controlados por células NK. Sin embargo, la IL-18 también muestra capacidad antitumoral para inhibir el crecimiento y la metástasis de muchos tipos de células tumorales mediante la activación de la respuesta inmune de las células T CD4+ y/o las células NK en el TME . Otros estudios también han propuesto que la IL-18 es un potente inductor de respuestas de tipo 1 en linfocitos innatos y adaptativos .
La IL-1α es también una citoquina de doble función. Se ha demostrado que en el TME, las células tumorales moribundas liberan el precursor inflamatorio IL-1α, que, de manera similar a la IL-1β, aumenta la invasividad del tumor y la angiogénesis . TNF-α es miembro de la superfamilia de citocinas TNF/TNFR y también es un mediador clave implicado en los cánceres relacionados con la inflamación. Existe evidencia sustancial de que el TNF-α puede estar involucrado en la promoción y progresión de cánceres experimentales y humanos. Las dosis altas de TNF-α loco-regional pueden causar necrosis hemorrágica al destruir selectivamente la vasculatura tumoral y generar inmunidad antitumoral de células T específica. Sin embargo, cuando se produce en el TME, actúa como promotor tumoral endógeno . En otro hallazgo contradictorio, basado en el hecho de que la expresión de citocinas inflamatorias clave varía según los linajes del cáncer, Malireddi et al. propuso que la activación de TNF-α e IFN-γ podría matar las células cancerosas mediante la inducción de PANoptosis . En conjunto, estos estudios sugieren que los efectos de los potentes mediadores inflamatorios presentes en el TME que actúan sobre los tumores son complejos y variados, y que los mecanismos de destrucción, especialmente cuando están mediados por PANoptosis, merecen una mayor exploración.
Efectos de la PANoptosis sobre el microambiente inmunológico del tumor.
Es importante señalar que se ha descubierto que la PANoptosis afecta el TME inmunosupresor , lo que puede afectar la forma en que la vía de señalización de la PANoptosis regula el cáncer de varias maneras. En estudios recientes se han destacado las funciones de la apoptosis, la piroptosis y la necroptosis en la regulación del TME inmunosupresor y en la determinación de los resultados clínicos de la terapia tumoral, además de revelar cierta interferencia mutua entre los diferentes mecanismos de muerte celular implicados en la PANoptosis . Por ejemplo, se identificaron 9 lncRNA relacionados con la PANoptosis y la metástasis del adenocarcinoma de colon (COAD), que se asociaron significativamente con la infiltración inmune, lo que indica que la PANoptosis juega un papel crucial en el microambiente inmunológico del tumor . De manera más intuitiva, se propuso que la puntuación de PANoptosis se correlacionaba significativamente con el TME, los niveles de infiltración de la mayoría de las células inmunitarias (DC, NK, células T CD8+ y células T CD4+) y genes relacionados con el sistema inmunitario .
Los macrófagos son una subpoblación de células inmunitarias del sistema inmunológico que han mostrado una gran moldeabilidad en su participación en las respuestas inmunitarias y la progresión del cáncer, respaldadas por la TME. Los macrófagos se dividen en dos subtipos principales, tipo M1 y tipo M2. Los M1 son macrófagos proinflamatorios que actúan como supresores de tumores mediante la liberación de grandes cantidades de citocinas proinflamatorias (p. ej., IL-1β, TNF-α e IFN-β), acompañadas de la activación de la respuesta inmunitaria de potentes células T y células citotóxicas. Los tipos M2, por otro lado, exhiben propiedades antiinflamatorias para promover el crecimiento tumoral y los TME de inmunosupresión, incluida la invasión del cáncer, la metástasis tumoral y la proliferación vascular . En un estudio sobre el cáncer de cuello uterino, los académicos encontraron que los macrófagos estaban involucrados en la regulación de las respuestas inmunes bajo las características comunes del microambiente inmunológico y la PANoptosis . Un estudio más profundo que evaluó 33 tipos de cáncer en la infiltración de células inmunes encontró que PANscore tenía una correlación significativamente negativa con los macrófagos tipo M1 y una correlación significativamente positiva con los macrófagos tipo M2 . Esto sugiere que los macrófagos no solo son actores centrales en la respuesta a la TME, sino que también tienen una relación reguladora recíproca con el microambiente inmune tumoral mediado por PANoptosis.
Las CD(células dendríticas) son células que fagocitan células muertas y tienen una interacción compleja con TME en un mecanismo PANoptótico. Se sabe desde hace mucho tiempo que las células moribundas inician la inmunidad adaptativa proporcionando antígenos a las CD. Cuando las células tumorales sufren PANoptosis, las CD pueden reconocer moléculas de señalización específicas y fagocitar estas células portadoras de señales, presentando antígenos tumorales para activar otras células inmunes no infectadas, como las células T y B, dirigiendo la aparición de respuestas inmunes. Las respuestas antitumorales efectivas requieren un subconjunto de CD que se infiltran en el tumor y una comunicación cruzada entre células T y CD que involucra las citocinas IFN-γ, que potencian la destrucción del tumor mediada por células T CD8+ . Los primeros estudios han demostrado que la activación de NLRP3 induce inmunidad adaptativa a los tumores, y que la IL-1β liberada durante este proceso es necesaria para la preparación de células T CD8+ específicas de antígeno tumoral productoras de IFN-γ . De manera similar, un estudio reciente también ha dilucidado la citotoxicidad de las CD contra la destrucción de células tumorales. La muerte inducida por DC es, al menos en parte, un proceso dependiente de RIPK1, y la elevada fosforilación de RIPK1 y el aumento de la interacción RIPK1-caspasa-8 en las células diana también sugieren que las señales mediadas por RIPK1 contribuyen a la muerte celular inducida por DC. Así, se ha documentado bien el papel que desempeña la activación y el estado funcional de las CD en la respuesta inmune y el desarrollo tumoral en TME y PANoptosis. Sin embargo, la red de factores inmunosupresores contenidos en el TME inhibe la infiltración de DC y suprime su actividad antitumoral, lo que a su vez modula la función de las DC en la inmunidad contra el cáncer . Un estudio más profundo de la relación entre las CD, la TME y la PANoptosis podría ayudar a obtener una comprensión más profunda del mecanismo de escape inmunológico del tumor y proporcionar nuevas ideas para el desarrollo de estrategias de inmunoterapia tumoral.
Las células T (principalmente células T CD4+, CD8+ y CTL) pueden identificar células cancerosas durante el desarrollo del cáncer y matarlas directamente mediante la liberación de citotoxinas, o pueden atacar las células cancerosas estimulando otras células inmunitarias. Se liberan moléculas de señalización únicas, como el IFN-γ, cuando otros antígenos activan las células T. Esto conduce a la promoción de la PANoptosis, que participa en la respuesta inmune y la eliminación del tumor durante el proceso de PANoptosis. Los CTL son una de las clases más específicas, generalmente se diferencian de las células T CD8+ después de la activación y pueden tener una citotoxicidad más potente que conduce a la apoptosis o necrosis de las células tumorales. En el contexto de la TME, se ha descubierto que los mediadores inflamatorios liberados por las células moribundas no son suficientes para sensibilizar cruzadamente a las células T CD8+, y su activación requiere NF-κB mediada por RIPK1 y la transcripción intracelular inducida por sus genes diana posteriores. Esto implica que el NF-κB inducido por RIPK1 es un factor decisivo en la inmunidad de las células T CD8+ a los antígenos asociados a células . Además, los investigadores han calculado y comparado las asociaciones entre la infiltración de células T CD8+ y la expresión de marcadores básicos de distintos tipos de muerte celular y varios cánceres comunes. Descubrieron que las características de propiroptosis y pronecroptosis estaban ampliamente relacionadas con una mayor infiltración de células T CD8+ . Al explorar el papel de la PANoptosis en la patogénesis y el microambiente inmune tumoral del cáncer de páncreas (PC), también se encontró que los pacientes tenían un aumento significativo en la infiltración de células T CD8+ y células B vírgenes . Esto respalda aún más la existencia de un cierto grado de correlación entre las células inmunes, la PANoptosis y la TME.
Otro tipo especial de células son las células NK. Las células NK son un grupo de población heterogénea que exhibe propiedades citotóxicas, inmunomoduladoras, de destrucción de células tumorales y productoras de IFN-γ, y pueden fomentar un microambiente favorable para las respuestas inmunes de células T específicas de antígeno . A través de receptores de superficie, las células NK pueden identificar y matar selectivamente células tumorales. También pueden activar otras células inmunes, fortaleciendo el efecto de la respuesta inmune combinada y aumentando la efectividad de la destrucción del tumor. Chow et al. propusieron que NLRP3 inhibe la metástasis tumoral mediada por células NK inducida por carcinógenos. Los datos experimentales indicaron que NLRP3 es un inhibidor importante del control de la carcinogénesis y la metástasis en el TME de pulmón mediado por células NK, que se manifiesta por una mayor activación de las células NK en la invasión tumoral y una mayor respuesta antimetástasis. El punto clave es que las células NK desempeñan un papel mayor en la inhibición de la metástasis tumoral que los tumores primarios . Además, las células NK desempeñan un papel destacado en la lucha contra el CHC. Se demostró que la tasa de recurrencia de las células NK infiltradas en el tumor y de las células NK circulantes se correlaciona positivamente con los beneficios de supervivencia del CHC, lo que tiene importancia pronóstica . Al construir además un modelo genético de CHC relacionado con la PANoptosis, el nuevo estudio cuantificó las células inmunitarias infiltrantes de tumores utilizando el algoritmo CIBERSORT y encontró que la abundancia de células NK en el grupo de PANscore alto era significativamente mayor en el TME . También se ha demostrado que RIPK3 modula la función de las células NKT a través de un proceso independiente de la vía de necroptosis, al tiempo que promueve respuestas inmunes antitumorales mediadas por células NKT .
Una comprensión completa de la interacción entre PANoptosis y TME nos ayuda a comprender mejor cómo las células tumorales sobreviven y proliferan dentro de los tumores. Es crucial investigar los distintos tipos de células inmunes y su capacidad para mediar antitumorales o protumorales, particularmente sus mecanismos subyacentes de interacción con la PANoptosis. Además, una comprensión profunda de los procesos dinámicos que causan la heterogeneidad y la plasticidad metabólica en la TME podría mejorar la reactividad de los pacientes al tratamiento inmunológico . Evidentemente, la implementación de intervenciones específicas para regular estos procesos de acuerdo con los cambios en el microambiente es de gran importancia para el campo de la investigación en terapia tumoral.
Nuevos avances en la terapia del cáncer: PANoptosis
El cáncer sigue siendo un desafío enorme, con tasas de incidencia y mortalidad persistentemente altas e incluso en aumento en todo el mundo. Como tal, la búsqueda de mejores estrategias de tratamiento del cáncer se ha convertido en una prioridad urgente.
Mejora de la inmunidad antitumoral mediante PANoptosis: una estrategia prometedora para la terapia del cáncer
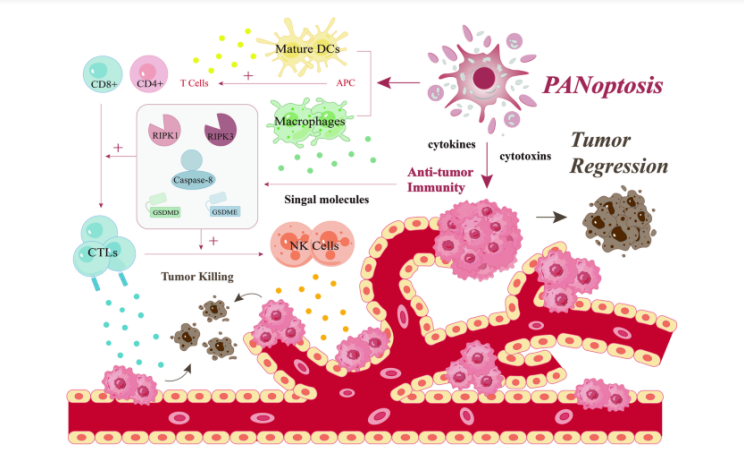
La apoptosis, la piroptosis y la necroptosis son algunos de los tipos más clásicos de PCD, que pueden equilibrar la población celular regulando la muerte celular, mientras que la naturaleza del cáncer es la proliferación maligna de células. Por lo tanto, la promoción de la muerte de células tumorales mediada por PANoptosis como medio terapéutico para controlar el crecimiento del cáncer se ha convertido en uno de los puntos críticos de investigación durante mucho tiempo. Dentro del TME y bajo la regulación de la PANoptosis, la inmunidad antitumoral determina en cierta medida el destino final del desarrollo de las células tumorales (Fig. 3). Por un lado, las células inmunitarias presentes en el TME pueden desempeñar funciones de vigilancia inmunitaria y eliminación inmunitaria al inducir la muerte de las células tumorales; por otro lado, las células tumorales pueden evadir la PCD estableciendo tolerancia inmune. La mayoría de los estudios sugieren que la PANoptosis desempeña un papel beneficioso en el cáncer al mediar una fuerte inmunidad antitumoral. Por ejemplo, en un experimento que analiza las características de expresión de los moduladores de PANoptosis entre sujetos normales y pacientes con cáncer gástrico (GC), al comparar los niveles de infiltración de células inmunes entre los dos, se encontró que los pacientes con GC exhibían proporciones más abundantes de células B vírgenes , células T CD4 vírgenes, células T CD4 de memoria activadas, células T auxiliares foliculares, células NK activadas, lo que sugiere que la PANoptosis estimula una poderosa inmunidad antitumoral. En consecuencia, facilitar la PANoptosis podría tener importantes implicaciones terapéuticas para la GC . Por lo tanto, la activación de la muerte específica de las células tumorales en TME a través de la vía PANoptosis puede desencadenar una respuesta inmune antitumoral para mejorar la función inmune y así promover la regresión del tumor, lo que proporciona una perspectiva prometedora para la terapia contra el cáncer.
Se ha demostrado que la muerte programada de las células tumorales puede ser inducida directamente por ciertas células inmunes, o puede participar en un circuito de retroalimentación positiva de la inmunidad antitumoral al desencadenar espontáneamente un cambio de apoptosis a piroptosis . Dado que los CTL desempeñan un papel clave en la protección de las células contra los tumores, otro ejemplo más intuitivo proviene del estudio del papel de Gasdermina, un regulador clave en la PANoptosis, en los CTL. Los resultados mostraron que en muestras de tumores, la expresión de Gasdermina se correlacionaba positivamente con el nivel de marcadores de células T CD8+ en las cohortes del Atlas del Genoma del Cáncer (TCGA), y que Gasdermina estaba regulado positivamente en células T CD8+ activadas, mientras que su deficiencia reduciría la capacidad citolítica de las células T CD8+. Resulta que Gasdermina es un componente necesario para la inmunidad antitumoral al mediar en una respuesta CTL óptima a las células cancerosas . También se ha demostrado que Gasdermina E, como miembro clave de los eventos de interferencia de apoptosis y piroptosis, tiene efectos antitumorales. En un estudio de 22 mutaciones de Gasdermina E asociadas al cáncer, se encontró que 20 reducían la función de Gasdermina E. De hecho, se demostró que la expresión de Gasdermina E estaba suprimida en una variedad de cánceres (melanoma, cáncer colorrectal y cáncer de mama triple negativo, etc.), y esta supresión tumoral también estaba mediada por linfocitos citotóxicos asesinos. No solo eso, sino que la expresión de Gasdermina E también mejoró la fagocitosis por parte de TAM, así como la infiltración de células NK, lo que implica que los efectos antitumorales de Gasdermina E están estrechamente relacionados con NK y CD8+ T .
Otro aspecto de la PANoptosis que puede ejercer inmunidad antitumoral está representado por RIPK3 y RIPK1, que son componentes esenciales para la activación de la necroptosis y una parte central de las interacciones entre las diversas vías de señalización de la PANoptosis. Un nuevo estudio muestra que la expresión de RIPK3 tiene una correlación positiva significativa con poblaciones de células inmunes tumorales en varios tipos de tumores. Por lo tanto, la activación de RIPK3, por un lado, puede inducir a TRIM28 en las células cancerosas para reprimir y estimular el aumento de citoquinas inmunoestimuladoras para mejorar el TME. Por otro lado, puede contribuir a una sólida inmunidad anticancerígena citotóxica . Al mismo tiempo, la activación ectópica de RIPK3 para promover la carga de antígenos tumorales en APC tumoral se asocia con respuestas antitumorales mediadas por leucocitos CD8+ mejoradas . Además, la sensibilización cruzada de las células T CD8+ en células moribundas requiere una combinación de señalización de RIPK1 y transcripción intracelular inducida por NF-κB. Cuando la señal de NF-κB se desacopla de la necroptosis, la eficiencia y la inmunidad tumoral se reducen . La muerte celular mediada por RIPK1 también puede aumentar la activación de las células NK infiltrantes y las células T CD8+ y mejorar el beneficio de supervivencia del bloqueo de los puntos de control inmunológico .
En conjunto, estos estudios subrayan el punto crucial de que la inducción de PANoptosis en células tumorales puede mejorar la inmunidad antitumoral, ejerciendo un efecto supresor de tumores eficaz y proporcionando un enfoque factible para mejorar la eficacia de la inmunoterapia contra el cáncer.
Dirigirse a la PANoptosis para la terapia del cáncer: objetivos de señalización clave y sus posibles efectos terapéuticos
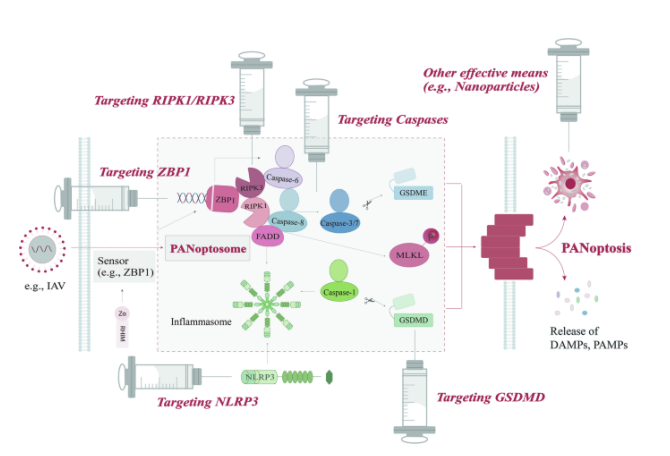
Nos hemos dado cuenta de que la muerte celular inducida por PCD puede convertirse en una de las características importantes de los fármacos antitumorales citotóxicos, que pueden inhibir el crecimiento y la propagación del tumor mediante la regulación de las vías de señalización de la apoptosis, la piroptosis o la necroptosis . Encontrar sensores y agonistas o inhibidores apropiados de moléculas señal en la vía de señalización de la PANoptosis como fármacos dirigidos se está convirtiendo en un nuevo enfoque para la terapia contra el cáncer. Ya existe evidencia de que el factor de necrosis tumoral α (TNF-α) más interferón-γ (IFN-γ) fue eficaz contra una amplia gama de tipos de células tumorales, lo que destaca su potencial para aplicación clínica. En diversos linajes de cáncer (cáncer de colon y pulmón, melanoma y leucemia), la acción sinérgica de TNF-α e IFN-γ puede desencadenar la activación de una variedad de interruptores de señalización como Saderminas D y E, caspasa-8 y MLKL. Se ha demostrado que la inducción de PANoptosis de células tumorales de esta manera es un mecanismo importante para prevenir la tumorigénesis e inhibir el crecimiento tumoral, con efectos terapéuticos específicos . Sin embargo, debido a su complejo mecanismo, además de su efecto anticancerígeno, la PANoptosis también puede promover el crecimiento de células cancerosas en determinadas condiciones. Como ejemplo simple, se ha informado que la caspasa-8 tiene efectos tanto pro como antitumorales. Por un lado, la alta expresión de caspasa-8 en el núcleo de las células tumorales evitó la apoptosis endógena típica e indujo la mitosis, promoviendo así la progresión del tumor. Por otro lado, también se ha demostrado que la caspasa-8 actúa como una cadena descendente de las granzimas, induciendo específicamente la escisión de Gasdermina E e induciendo la piroptosis, activando así aún más la respuesta inmune antitumoral e inhibiendo el crecimiento tumoral . Por lo tanto, es necesario encontrar vías dirigidas a los correguladores en la PANoptosis en un intento de activar una vía (apoptosis, piroptosis o necroptosis) o múltiples vías al mismo tiempo para el tratamiento del cáncer (Fig. 4).
Apuntando a ZBP1
Como se mencionó anteriormente, ZBP1 actúa como un receptor inmunológico innato para la infección por IAV y es responsable de desencadenar el ensamblaje del PANoptosoma e inducir la PANoptosis al detectar estímulos específicos. Recientemente, se ha identificado como un interruptor maestro crucial para la PANoptosis y un nodo de señalización clave para la muerte celular, ya que es un regulador coprimario de la piroptosis, la apoptosis y la necroptosis . En los tumores necróticos, la expresión de ZBP1 está notablemente elevada y su eliminación impide la necrosis y la apoptosis tumorales, inhibiendo en última instancia la proliferación de células tumorales, lo que sugiere que ZBP1 proporciona un objetivo farmacológico de referencia para controlar la metástasis tumoral . En un estudio que explora la relación entre ADAR1 y ZBP1 en el cáncer, Zhang et al. describieron una pequeña molécula, la curaxina CBL0137, que desencadenó la formación de ADN Z en fibroblastos de TME para activar eficientemente la necroptosis nuclear dependiente de ZBP1 y revertir fuertemente la falta de respuesta del bloqueo de puntos de control inmunológico (ICB) en modelos de melanoma en ratones. Su argumento de que la PCD mediada por ZBP1 sirvió como un nuevo determinante de la inmunogenicidad tumoral enmascarada por ADAR1 flanquea la posibilidad de que ZBP1 tenga el potencial de impulsar la inmunidad contra el cáncer . Por lo tanto, no sorprende que ZBP1 se considere ahora un importante objetivo de señalización en las estrategias terapéuticas tumorales.
Apuntando a caspasas
Las caspasas son proteínas clave comunes en las vías de señalización de apoptosis y piroptosis. La centralidad de las caspasas en la regulación de los mecanismos de muerte celular PANoptótica las convierte sin duda en objetivos clave para la terapia contra el cáncer. Actualmente, los académicos han identificado el papel potencial de la muerte celular dependiente de caspasa-3 en el cáncer. En la vía de señalización caspasa-3/Gasdermina E, los fármacos citotóxicos inducen la muerte de las células tumorales mediante piroptosis o apoptosis dependiente de caspasa-3 bajo la expresión de niveles altos o bajos de Gasdermina E. Al tomar esto como punto de partida, se ha logrado un gran avance en el tratamiento del cáncer . Los estudios han demostrado que los inhibidores de caspasa modulan la muerte celular inducida por radio-quimio-inmuno-terapia en células de melanoma B16, induciendo una inmunidad antitumoral de manera dependiente de las células T HMGB1, nucleótidos y CD8+. Los experimentos in vivo demostraron que los inhibidores de la pancaspasa como Zvad-fmk e IDN-6556 (F-03491390) inducían la apoptosis (y también la necroptosis) en una terapia tumoral multimodal con radioterapia (RT), dacarbazina (DTIC) e hipertermia (HT). ) combinado con medicamentos, lo que resultó en una inmunidad antitumoral significativa, que se manifestó por una infiltración notablemente aumentada de las CD y de las células T CD8+, una mayor expresión de IFN-γ de las células T CD8+ y una reducción de la infiltración tumoral de las células T reguladoras, que en conjunto sirven para inhibir el crecimiento tumoral .
Orientación a NLRP3
Algunas pruebas emergentes sugirieron que NLRP3 también puede ser un objetivo potente en la terapia del cáncer PANoptótico. Se ha propuesto la posibilidad de atacar NLRP3 con nuevas moléculas pequeñas para lograr efectos terapéuticos. Se descubrió que la activación de NLRP3 en tumores ayudó a iniciar respuestas inmunes contra las células tumorales, lo que se cree que es un posible mecanismo eficaz para una inmunidad antitumoral sostenida . Otro estudio encontró que un agonista específico, la polifilina VI (PPVI), activa la vía de señalización ROS/NF-κB/NLRP3/GSDMD para inhibir el cáncer de pulmón de células no pequeñas (NSCLC). Exhibe importantes propiedades antitumorales al prevenir la proliferación de células cancerosas. Además, dada la baja sensibilidad de la quimioterapia en el NSCLC, este mecanismo también sugiere la promesa del PPVI como un nuevo fármaco terapéutico objetivo . Otro ejemplo es que el agente quimioterapéutico cisplatino (DDP) puede funcionar como agente antitumoral para el cáncer de mama triple negativo (TNBC), que induce la piroptosis para ejercer efectos antitumorales in vivo e vitro mediante la regulación positiva del gen expresado por la madre. 3 (MEG3) y la activación de la vía de señalización NLRP3/caspasa-1/GSDMD, mejorando así la tasa de remisión patológica completa en pacientes con TNBC y proporcionando nuevas perspectivas para el desarrollo de estrategias para intervenciones terapéuticas en TNBC.
Apuntando a RIPK1
La evidencia definitiva ha demostrado que la inducción de necroptosis mediada por RIPK1/RIPK3 tiene la capacidad de eliminar las células cancerosas que han adquirido resistencia a la apoptosis. De hecho, el propio RIPK1 regula el desarrollo de tumores y puede ser cancerígeno cuando se sobreexpresa. Wang y cols. Inicialmente descubrieron que RIPK1 estaba regulado positivamente en TAM de adenocarcinoma ductal pancreático (PDA). Para investigar más a fondo su papel en la progresión cancerígena, desarrollaron un inhibidor selectivo de molécula pequeña de RIPK1 y descubrieron que RIPK1 promueve la diferenciación de macrófagos tolerogénicos en el TME del cáncer de páncreas, lo que conduce a una activación inmune adaptativa y protección tumoral. Mientras tanto, la inhibición de RIPK1 también permitió que las inmunoterapias basadas en PD-1 mejoraran eficazmente el efecto del agonismo del ligando coestimulador (ICOS). Por lo tanto, RIPK1 se ha descrito como un punto de control quinasa que controla la inmunidad tumoral, y su inhibición puede considerarse como una posible terapia tumoral . También se ha demostrado que el tratamiento de ratones con el inhibidor de RIPK1 necrostatina-1 (Nec-1s) o la eliminación específica de células endoteliales de RIPK3 redujo la necroptosis endotelial inducida por células tumorales y la metástasis tumoral en modelos de ratón . Actualmente se están desarrollando algunos fármacos dirigidos a RIPK1, principalmente inhibidores de la quinasa RIPK1. Sin embargo, hasta ahora, los inhibidores de RIPK1 no han obtenido una eficacia definitiva en ensayos clínicos de tumores sólidos humanos .
Apuntando a RIPK3
Se ha demostrado que la activación de la necroptosis responde positivamente a muchos agentes quimioterapéuticos y contribuye a la muerte celular inducida por la quimioterapia. Dirigirse a RIPK3 puede ofrecer la ventaja de salvar células de un espectro más amplio de estímulos necroptóticos en comparación con la inhibición de RIPK1 . Los estudios han descubierto que la expresión de RIPK3 a menudo se silenciaba en las células cancerosas y sus defectos se seleccionaban activamente durante el crecimiento y desarrollo del tumor. Por ejemplo, en el 85% de los pacientes con cáncer de mama, la expresión de RIPK3 en el tumor se redujo en comparación con la de los tejidos normales, y la restauración de la expresión de RIPK3 con agentes de hipometilación podría promover la sensibilidad a los fármacos de quimioterapia de una manera dependiente de RIPK3 y mejorar el efecto de destrucción de tumores de algunos medicamentos de quimioterapia. Por lo tanto, es una mejor opción para los pacientes con cánceres con deficiencia de RIPK3 recibir agentes hipometilantes para inducir la expresión de RIPK3 antes de recibir quimioterapia convencional . Como punto especial, también se ha demostrado que el estado de expresión de RIPK3 en células de carcinoma cervical influye en la eficacia de la inmunoterapia inducida por PolyI:C , lo que facilita el desarrollo de una estrategia de inmunoterapia más racional basada en el nivel de RIPK3.
Otras rutas de tratamiento
La nanoterapia inmunogénica de reedición sonoinmune contra el cáncer iniciada por PANoptosis se ha convertido en una tecnología emergente llamativa al estimular la circulación inmune del cáncer. El estudio señaló que el mecanismo de resistencia innato o adquirido de los tumores refractarios a las inmunoterapias puede ser eficaz mediante una estrategia antitumoral de activación inmune basada en la ingeniería de vías de muerte celular PANoptotic facilitadas por vehículos eléctricos . Últimamente, se ha demostrado que algunas nanopartículas únicas pueden aumentar la inmunidad antitumoral mediante la inducción de piroptosis. Zhao y cols. diseñó una nanopartícula biomimética (BNP) cargada con verde de indocianina (ICG) y decitabina (DCT) para fotoactivar la piroptosis de las células cancerosas y secretar aún más contenidos intracelulares proinflamatorios, activando así una fuerte inmunidad antitumoral sistémica para suprimir los tumores sólidos y metastásicos para inmunoterapia para tumores primarios y a distancia . Otro estudio también ha demostrado que las de conversión ascendente (ZrNP) biodegradables K3ZrF7:Yb/Er, utilizadas como inductores de piroptosis para la inmunoterapia contra el cáncer, inhiben visiblemente el crecimiento tumoral y la metástasis pulmonar. In vivo, los experimentos confirmaron que la piroptosis inducida por ZrNP mostró una excelente actividad inmune antitumoral al mejorar la madurez de las CD y la frecuencia de las células T de memoria efectora .
Además, Lin et al. encontraron experimentos in vivo e in vitro que la ausencia de cisteína desulfurasa (NFS1) interactuaba sinérgicamente con el tratamiento con oxaliplatino podría aumentar el nivel de especies reactivas de oxígeno intracelular para desencadenar la PANoptosis, mejorando así significativamente la sensibilidad de las células CCR al oxaliplatino. Por el contrario, la prevención de la PANoptosis mediante la fosforilación de NFS1 bajo el tratamiento con oxaliplatino debilitó la sensibilidad de la quimioterapia del CCR al oxaliplatino, lo que mejoró la eficacia antitumoral de la quimioterapia basada en platino en el tratamiento del CCR . El sulconazol también tiene efectos inhibidores importantes sobre una variedad de células tumorales, especialmente al inhibir la proliferación y migración de células cancerosas de esófago. Mecánicamente, se ha descubierto que el sulconazol induce la PANoptosis desencadenando estrés oxidativo e inhibiendo la glucólisis para aumentar la radiosensibilidad en el cáncer de esófago . Por lo tanto, la regulación adecuada de la vía de la PANoptosis también es útil para mejorar la eficacia de la quimioterapia tumoral.
Direcciones futuras en el tratamiento del cáncer
A medida que la investigación sobre el intrincado mecanismo de la PANoptosis ha avanzado en los últimos años, la terapia dirigida a la PANoptosis ha surgido como un enfoque terapéutico con un potencial de desarrollo expansivo. Estudios anteriores han indicado que la manipulación de las tres vías de PCD (apoptosis, piroptosis y necroptosis) puede influir en la progresión del cáncer. Se han desarrollado varios fármacos dirigidos a vías individuales de PCD que han demostrado tener un papel importante en impedir el crecimiento tumoral. En consecuencia, la PANoptosis, que amalgama elementos de estas tres vías, representa un avance prometedor en la terapia contra el cáncer. Al dirigirse selectivamente y modular moléculas específicas dentro de la vía de señalización de la PANoptosis de las células tumorales, la terapia dirigida a la PANoptosis puede eliminar eficazmente las células cancerosas. Mall et al. identificaron y validaron biomarcadores inmunes innatos cruciales derivados de la PANoptosis a través de perfiles transcriptómicos pan-cáncer, que pueden servir como objetivos terapéuticos en oncología para mejorar el pronóstico de los pacientes con cáncer . Además, en comparación con la quimioterapia tradicional, la terapia dirigida a la PANoptosis reduce el daño a las células normales, disminuye las reacciones adversas relacionadas con el tratamiento y mejora la especificidad del tratamiento. La integración de la terapia dirigida a la PANoptosis con otras modalidades de tratamiento, como la radioterapia y la inmunoterapia, para establecer un modelo de tratamiento integral no solo demuestra una capacidad más amplia para inducir la muerte de las células cancerosas, sino que también supera la resistencia a los medicamentos y adapta mejor el tratamiento a cada paciente. Estas distintas ventajas de la terapia dirigida a la PANoptosis presentan oportunidades para impedir el crecimiento del tumor, aumentar la eficacia de las terapias actuales y mejorar los resultados de los pacientes. Con el progreso continuo de la tecnología y la acumulación de experiencia clínica, el desarrollo de fármacos dirigidos molecularmente en la vía de señalización PANoptotic está preparado para convertirse en un foco fundamental del desarrollo de nuevos fármacos en el futuro. Una intervención precisa dirigida a proteínas clave en la vía tiene el potencial de generar nuevos avances en el tratamiento del cáncer.
Conclusión
La PANoptosis representa una forma de PCD(muerte celular programada) caracterizada por la activación e interacción simultáneas de las vías de señalización de apoptosis, piroptosis y necroptosis. Se ha establecido que la PANoptosis juega un papel importante en el desarrollo y avance de diversas enfermedades, particularmente el cáncer. Dentro del TME, el impacto de la PANoptosis en la progresión del tumor puede variar, influenciado por el microambiente inmunológico y las funciones de los diferentes componentes de la vía. Por lo tanto, apuntar a elementos moleculares específicos dentro de las vías de la PANoptosis utilizando estrategias apropiadas es una promesa sustancial para la terapia del cáncer.
Esta revisión se centra en los hallazgos de investigaciones recientes sobre elementos clave de las vías de la PANoptosis. Los estudios indican que dirigir intervenciones hacia ZBP1, caspasas, NLRP3, RIPK1 y RIPK3 puede desencadenar una sólida respuesta inmune antitumoral, facilitando la erradicación eficiente de las células cancerosas. Además, metodologías novedosas que involucran nanopartículas y vesículas extracelulares diseñadas demuestran potencial para aprovechar la PANoptosis para mejorar la inmunidad antitumoral.
A pesar de las perspectivas prometedoras, la naturaleza dual de la PANoptosis al influir en el crecimiento y la progresión del tumor presenta desafíos en la terapia dirigida. Es esencial realizar más investigaciones y ensayos clínicos para validar la seguridad y eficacia de los tratamientos dirigidos a la PANoptosis. Es probable que la integración de la terapia dirigida a la PANoptosis con las modalidades existentes allane el camino para enfoques personalizados y adaptados al tratamiento del cáncer en el futuro.
FIGURA 1. Los factores proapoptóticos (p. ej., BAX, BAK, Bid) y antiapoptóticos (p. ej., BCL-2, BCL-XL, MCL-1) controlan la vía de apoptosis intrínseca. Cuando solo se activan las proteínas BH3 en los miembros proapoptóticos, BAX y BAK inducen MOMP, lo que lleva a la liberación de Cyc.C y la formación de un apoptosoma con Apaf-1, que a su vez activa la caspasa-9. La vía extrínseca, mediada principalmente por receptores de muerte y sus ligandos, da como resultado la formación del DISC, que activa la procaspasa-8. Una cascada de procesos apoptóticos se desencadena mediante la activación de las caspasas-3 y -7 posteriores por parte de las caspasas-8 y -9. En la vía clásica de la piroptosis, los sensores inflamatorios, como NLRP3, reclutan ASC ante diversos estímulos para promover la activación de la pro-caspasa-1, facilitando así aún más el ensamblaje del inflamasoma y la activación de la caspasa-1. La caspasa-1 activada escinde GSDMD y pro-caspasa-1, que forma el poro GSDMD y promueve la liberación de factores inflamatorios. La vía no clásica involucra LPS en el citoplasma, activando la caspasa-4/5/11 y escindiendo GSDMD para iniciar la piroptosis. La necroptosis suele implicar la vía de señalización del TNF. El complejo I, compuesto por TRADD, TRAF2, RIPK1, los inhibidores celulares de la apoptosis (cIAP) y el complejo de ensamblaje de cadena de ubiquitina lineal (LUBAC), puede promover la señalización de NF-кB. Después de eso, se reclutan FADD y TRADD para formar el complejo IIa con caspasa-8 y RIPK1. Cuando se inhibe la caspasa-8, RIPK1, RIPK3 y MLKL se fosforilan sucesivamente, lo que da como resultado la formación del necrosoma (complejo III). El poro MLKL se forma cuando MLKL se oligomeriza y pasa al plasma.
Figura 2
Diversos procesos reguladores en la PANoptosis se realizan principalmente a través del complejo multiproteico PANoptosoma. Bajo la regulación del PANoptosoma, se produce una gran cantidad de eventos de diafonía, y el núcleo de estos eventos incluye proteínas clave en la apoptosis, piroptosis y necroptosis, con la familia Caspasa y la familia RIPK desempeñando los papeles más destacados.
Figura 3
En el marco del TME, la PANoptosis promueve la regresión tumoral al inducir una potente inmunidad antitumoral. Numerosas células inmunitarias, incluidos macrófagos, células DC, células NK y linfocitos T, están íntimamente relacionadas con la destrucción de células tumorales. La activación de moléculas de señalización cruciales específicas, como GSDMD, GSDME, Caspasa-8, RIPK1 y RIPK3, promueve la activación de inmunoestimuladores, en particular las células T CD8+ y las células NK, que liberan citoquinas y citotoxinas para ejercer un potente efecto antitumoral citotóxico. inmunidad.
Figura 4
La PANoptosis puede ocurrir en respuesta al estrés celular o ciertas infecciones microbianas, como el IAV. Cuando se activan sensores específicos, como ZBP1, se inicia formalmente el ensamblaje del PANoptosoma. Esto, a su vez, promueve la activación de efectores, incluidos Gasderminas D y E, caspasa-3/7 y MLKL, y en última instancia conduce a la muerte celular inflamatoria, así como a la liberación de DAMP y PAMP. El proceso de PANoptosis es una forma intrincada de muerte celular cuyo mecanismo está regulado por varios componentes cruciales. Estas partes provienen de miembros importantes de las vías de señalización de apoptosis, piroptosis y necroptosis, incluidas ZBP1, la familia de caspasas, NLRP3, RIPK1 y RIPK3. Dirigirse a estas moléculas reguladoras en la vía de señalización de la PANoptosis es prometedor para el tratamiento de determinadas enfermedades, especialmente el cáncer. También se ha demostrado que otros métodos, como la utilización de nanopartículas para activar la PANoptosis, poseen