Ronald Palacios Castrillo
Resumen
El diagnóstico diferencial de la demencia sigue siendo un desafío en neurología debido a la superposición de síntomas entre etiologías, pero es crucial para formular estrategias de manejo tempranas y personalizadas. Xue,et.al.,[Nature Medicine(AI-based differential diagnosis of dementia etiologies on multimodal data. Nat Med (2024). https://doi.org/10.1038/s41591-024-03118-z).], presentan un modelo de inteligencia artificial (IA) que aprovecha una amplia gama de datos, incluidos datos demográficos, antecedentes médicos individuales y familiares, uso de medicamentos, evaluaciones neuropsicológicas, evaluaciones funcionales y neuroimagen multimodal, para identificar las etiologías que contribuyen a la demencia en los individuos.
El estudio, que contó con 51.269 participantes en 9 conjuntos de datos independientes y geográficamente diversos, facilitó la identificación de 10 etiologías distintas de demencia. Alinea los diagnósticos con estrategias de gestión similares, lo que garantiza predicciones sólidas incluso con datos incompletos.
El modelo logró un área micropromediada bajo la curva característica operativa del receptor (AUROC) de 0,94 al clasificar a individuos con cognición normal, deterioro cognitivo leve y demencia.
=> Recibir por Whatsapp las noticias destacadas
Además, el AUROC micropromedio fue de 0,96 para diferenciar las etiologías de la demencia. El modelo demostró competencia para abordar casos de demencia mixta, con un AUROC medio de 0,78 para dos patologías concurrentes.
En un subconjunto de 100 casos seleccionados al azar, el AUROC de las evaluaciones de los neurólogos aumentado por este modelo de IA superó las evaluaciones de los neurólogos únicamente en un 26,25 %.
Además, las predicciones del modelo se alinearon con la evidencia de biomarcadores y sus asociaciones con diferentes proteinopatías se corroboraron mediante hallazgos post mortem.
Este marco tiene el potencial de integrarse como una herramienta de detección de demencia en entornos clínicos y ensayos de medicamentos. Se necesitan más estudios prospectivos para confirmar su capacidad para mejorar la atención al paciente.
En Detalle
La demencia es uno de los desafíos de salud más apremiantes de nuestro tiempo. Con casi 10 millones de casos nuevos notificados anualmente, este síndrome, caracterizado por una disminución progresiva de la función cognitiva lo suficientemente grave como para impedir las actividades de la vida diaria, continúa presentando desafíos clínicos y socioeconómicos considerables.
En 2017, el plan de acción global de la Organización Mundial de la Salud destacó la necesidad de un diagnóstico rápido y preciso de la demencia como objetivo estratégico fundamental en respuesta al creciente número de casos de demencia en todo el mundo.
Como tal, la precisión diagnóstica en el variado panorama de la demencia sigue siendo una necesidad crítica, aún no cubierta, particularmente a medida que la población mundial envejece y aumenta la demanda de exámenes más precisos de los participantes en los ensayos de medicamentos.
Este desafío surge principalmente de la presentación clínica superpuesta de diferentes tipos de demencia, que se complica aún más por la heterogeneidad en los hallazgos de las imágenes por resonancia magnética (MRI).
La necesidad de mejoras en este campo se vuelve cada vez más apremiante considerando la escasez proyectada de especialistas, incluidos neurólogos, neuropsicólogos y proveedores de atención geriátrica, lo que enfatiza la urgencia de innovar y desarrollar nuevas herramientas de diagnóstico.
El diagnóstico diferencial preciso de la demencia es fundamental para prescribir intervenciones terapéuticas específicas, mejorar la eficacia del tratamiento y ralentizar la progresión de los síntomas.
Aunque la enfermedad de Alzheimer (EA) es una de las principales causas, otras formas como la demencia vascular (DV), la demencia con cuerpos de Lewy (LBD) y la demencia frontotemporal (DFT) también son prevalentes.
Estas etiologías a menudo pueden coexistir, marcadas por la superposición de síntomas y la intensidad variable de los síntomas, lo que complica aún más el proceso de diagnóstico.
Es importante destacar que los errores de diagnóstico prevalecen entre los adultos mayores, particularmente aquellos con condiciones comórbidas. Estos diagnósticos erróneos pueden traducirse en un uso inadecuado de medicamentos y resultados de salud adversos.
Por ejemplo, aunque los pacientes con EA en etapa temprana pueden ser candidatos para terapias antiamiloideas, la coexistencia de patología de otras etiologías, como la EV, puede aumentar el riesgo de anomalías en las imágenes relacionadas con el amiloide.
Este riesgo resalta la necesidad crítica de evaluar con precisión todo el espectro de factores etiológicos que contribuyen a la demencia para informar estrategias terapéuticas adecuadas y optimizar la atención al paciente.
La necesidad de disponer de herramientas de diagnóstico escalables en la EA y las demencias relacionadas es cada vez más urgente, dados los desafíos que supone acceder a pruebas estándar. Las recientes aprobaciones regulatorias han facilitado la transición de los biomarcadores del líquido cefalorraquídeo (LCR) y de la tomografía por emisión de positrones (PET) de entornos de investigación a entornos clínicos.
Aunque prometedora, la integración clínica de biomarcadores sanguíneos precisos sigue siendo un área de investigación activa.
A pesar de estos avances, la accesibilidad a estas herramientas de diagnóstico sigue siendo limitada, no solo en regiones remotas y económicamente en desarrollo sino también en los centros de salud urbanos, como lo demuestran los prolongados períodos de espera para las consultas de especialistas.
Este desafío se ve agravado por una escasez global de especialistas, como neurólogos conductuales y neuropsicólogos, lo que lleva a una dependencia excesiva de evaluaciones cognitivas que pueden no ser culturalmente apropiadas debido a la falta de programas formales de capacitación en neuropsicología en muchas partes del mundo.
Aunque los métodos convencionales como las evaluaciones clínicas, las pruebas neuropsicológicas y la resonancia magnética siguen siendo fundamentales para el diagnóstico diferencial antemortem de la demencia, su eficacia depende de un grupo cada vez menor de médicos especialistas.
Esta limitación subraya la necesidad urgente de que los sistemas de salud evolucionen y se adapten a la dinámica rápidamente cambiante del diagnóstico y tratamiento de la demencia.
El aprendizaje automático (ML) tiene el potencial de mejorar la precisión y eficiencia del diagnóstico de demencia. Los métodos de aprendizaje automático anteriores se han centrado en gran medida en aprovechar los datos de neuroimagen para distinguir a los individuos con cognición normal (NC) de aquellos con deterioro cognitivo leve (DCL) y demencia, siendo la EA la principal etiología dada su ubicuidad en el diagnóstico de demencia.
Algunos estudios han intentado discernir firmas de neuroimagen exclusivas de la EA comparándolas con otros tipos de demencia. Sin embargo, este énfasis principal en la EA puede tener implicaciones prácticas limitadas dada la prevalencia y coexistencia de otras etiologías.
Además, centrarse únicamente en los datos de imágenes puede resultar insuficiente para proporcionar una comprensión holística de la condición neurológica de un individuo. Recientemente, se propuso un enfoque computacional para estratificar a los individuos según su estado cognitivo y discernir posibles casos de EA de tipos de demencia sin EA mediante la incorporación de imágenes con datos no relacionados con las imágenes, como datos demográficos, historiales médicos y evaluaciones neuropsicológicas.
Estas investigaciones han comenzado a arrojar luz sobre la compleja matriz de factores que contribuyen a la demencia. Sin embargo, para que los modelos de ML se adopten en la práctica clínica, deben poder adaptarse a las complejidades de las etiologías mixtas, así como a la inclusión o exclusión de diferentes modalidades de datos que pueden estar disponibles o no.
Por lo tanto, el desarrollo de metodologías de IA capaces de aprovechar datos multimodales facilita la cuantificación precisa de diversas etiologías de demencia, independientemente de los recursos clínicos, alineando así las estrategias de tratamiento con los perfiles individuales de los pacientes.
En este estudio, Xue,et.al.,[Nature Medicine(AI-based differential diagnosis of dementia etiologies on multimodal data. Nat Med (2024). https://doi.org/10.1038/s41591-024-03118-z)] proponen un marco de aprendizaje automático multimodal que aprovecha una amplia gama de datos, incluidos datos demográficos, antecedentes médicos personales y familiares, uso de medicamentos, evaluaciones neuropsicológicas, evaluaciones funcionales y neuroimagen multimodal, para realizar un diagnóstico diferencial de demencia.
El modelo de Xue y colaboradores, diseñado para reflejar escenarios del mundo real, alinea los diagnósticos con estrategias de gestión similares y genera probabilidades para cada etiología. Este enfoque pretende imitar el razonamiento clínico y ayudar a los profesionales en la detección de la demencia y la planificación del tratamiento.
La solidez del modelo se demuestra mediante la validación de conjuntos de datos independientes y geográficamente diversos. En análisis comparativos, encontraron que las evaluaciones médicas mejoradas con IA lograron una precisión diagnóstica superior en comparación con las evaluaciones realizadas únicamente por médicos.
Al validar su modelo con biomarcadores estándar y datos post mortem para diferentes etiologías, enfatizan aún más la capacidad de su modelo para alinearse con la fisiopatología subyacente a la demencia. Este marco algorítmico tiene el potencial de mejorar la detección de la demencia, pero se necesitan más estudios para evaluar su impacto en los resultados de la atención médica.
Xue y colegas describen un modelo de IA diseñado para el diagnóstico diferencial de la demencia mediante el procesamiento de una variedad de datos multimodales. A diferencia de su trabajo anterior, el actual modelo aborda el desafío clínico de distinguir entre diversas etiologías de demencia, incluidas, entre otras, EA, VD y LBD. Esta diferenciación es crucial para la identificación precisa de la naturaleza multifactorial de la demencia, que está vinculada a la optimización de intervenciones terapéuticas personalizadas y estrategias de manejo de pacientes.
La solidez del modelo se estableció mediante su capacitación y validación en un conjunto diverso de cohortes independientes. Además, las predicciones del modelo sobre diversas etiologías fueron corroboradas por su validación en casos para los cuales se disponía de datos de biomarcadores y post mortem.
En un subconjunto de casos seleccionados al azar, las predicciones del modelo, cuando se combinaron con las evaluaciones de los neurólogos, superaron las evaluaciones realizadas por neurólogos solos. Estos resultados subrayan el potencial del modelo para mejorar la eficacia del diagnóstico de trastornos relacionados con la demencia.
El modelo de Xue y colaboradores está diseñado para abordar la naturaleza compleja de las demencias mixtas proporcionando puntuaciones de probabilidad para cada etiología contribuyente.
Este enfoque es importante ya que permite a los médicos priorizar sistemáticamente los posibles impulsores del deterioro cognitivo en función de los datos disponibles.
El modelo captura eficazmente las características multifactoriales y superpuestas de varios tipos de demencia, ofreciendo un marco claro para guiar la toma de decisiones clínicas. Por ejemplo, los diagnósticos erróneos en las etapas iniciales de la demencia son frecuentes, a menudo debido a una atribución errónea de los síntomas a trastornos psiquiátricos, situación que se complica aún más por la presencia de múltiples copatologías.
Aunque estos diagnósticos erróneos también podrían estar presentes en los datos de entrenamiento, el modelo validado puede actuar como una herramienta para ayudar a estandarizar la práctica, reduciendo potencialmente la variabilidad en las evaluaciones clínicas.
Específicamente, históricamente el LBD ha sido difícil de diagnosticar ya que los primeros síntomas a menudo se parecen a los de la EA y el PSY. La coexistencia de LBD y AD complica aún más el diagnóstico y tiende a pasarse por alto hasta la evaluación post mortem.
El modelo de Xue y colegas demostró un rendimiento notable, particularmente en la identificación de la combinación AD y LBD, destacando su capacidad para detectar demencias mixtas que comúnmente se reconocen solo mediante análisis postmortem. Esta capacidad es crucial, dado que una parte considerable de los casos de demencia están relacionados con factores de riesgo modificables.
Por lo tanto, los conocimientos proporcionados por este modelo podrían informar estrategias de intervención temprana, alterando potencialmente el curso de la enfermedad y mejorando los resultados de los pacientes.
En particular, el modelo representa un paso adelante en el campo al abordar la detección de demencias mixtas, ofreciendo así una herramienta valiosa para perfeccionar la precisión diagnóstica en la práctica clínica.
Impulsado por una arquitectura de transformador como columna vertebral, la utilidad del marco de modelado se basa en su procesamiento sólido de diversos tipos de entrada y su manejo experto de conjuntos de datos incompletos mediante enmascaramiento de características aleatorias.
Estas propiedades son esenciales para los médicos que requieren información de diagnóstico inmediata y precisa en entornos con disponibilidad de datos variable. Por ejemplo, cuando un médico general registra observaciones clínicas y resultados de pruebas cognitivas de una persona mayor con posible deterioro cognitivo, este modelo puede calcular una puntuación de probabilidad indicativa de deterioro cognitivo leve o demencia.
Esta función facilita la intervención médica temprana y decisiones más informadas con respecto a las derivaciones a especialistas. En una clínica especializada en memoria, la adición de datos extensos de neuroimagen y una batería neuropsicológica profunda al modelo puede aumentar la precisión del diagnóstico, lo que, a su vez, mejora la formulación de estrategias de manejo individuales con una puntuación de probabilidad revisada.
Tal capacidad para adaptar su producción al alcance de los datos de entrada ejemplifica el papel de nuestro marco de modelado en diferentes entornos de atención médica, incluidos aquellos donde el diagnóstico rápido y eficiente en recursos es primordial.
La generación de puntuaciones de probabilidad específicas y cuantificables por parte del modelo aumenta su utilidad, convirtiéndolo en un componente útil en el proceso de prestación de atención sanitaria. Al mostrar precisión diagnóstica utilizando datos de entrenamiento variados, que van desde información demográfica hasta signos clínicos, hallazgos de neuroimagen y resultados de pruebas neurológicas, la versatilidad del modelo facilita su adaptación a diversas operaciones clínicas sin necesidad de una revisión fundamental de los flujos de trabajo existentes.
Para aumentar aún más la solidez de los resultados y probar la eficacia de la herramienta para el cuidado de la demencia, son necesarios estudios prospectivos y ensayos clínicos.
Estos pasos ayudarán a validar el potencial del modelo y garantizar que satisfaga las necesidades de los médicos generales y especialistas en todos los entornos sanitarios.
En consecuencia, el modelo puede fomentar una transición fluida entre los diferentes niveles de atención de la demencia, permitiendo a los médicos generales realizar exámenes cognitivos preliminares y a los especialistas realizar exámenes exhaustivos.
Su funcionalidad inclusiva garantiza una herramienta accesible y completa que garantiza un funcionamiento a prueba de fallos en la detección temprana, la monitorización continua y el ajuste de los diagnósticos diferenciales, elevando así el estándar de la atención de la demencia.
Aunque este estudio tiene el potencial de avanzar en el campo del diagnóstico diferencial de la demencia, tiene algunas limitaciones.
El modelo de Xue y colegas fue desarrollado y validado en 9 cohortes distintas, pero aún no se ha determinado su total generalización en diversas poblaciones y entornos clínicos, ya que el conjunto de datos comprendía una población predominantemente blanca.
Aunque su modelo es experto en el manejo de datos faltantes, los resultados actuales sugieren que su desempeño puede variar cuando se aplica a cohortes más allá de NACC, como ADNI y FHS, lo que destaca la necesidad de realizar más investigaciones para mejorar su generalización en poblaciones diversas.
En el futuro, tiene potencial en la evaluación de la eficacia del modelo en todo el proceso de atención, que abarca centros de atención primaria, consultorios geriátricos y de neurología general, medicina familiar y clínicas especializadas en centros médicos terciarios.
Además, los modelos de IA como el actual poseen la capacidad de mejorar los procedimientos de selección de pacientes para el reclutamiento en ensayos clínicos.
Los conjuntos de datos del estudio de Xue y colegas consisten principalmente en casos de EA, y aunque la EA es el tipo más común de demencia, esto podría sesgar su modelo hacia un mejor reconocimiento de este subtipo específico, introduciendo un sesgo.
Aunque incorporaron varias etiologías de demencia, la representación desequilibrada podría afectar la generalización y la sensibilidad del modelo hacia tipos menos frecuentes.
Es importante señalar que, más allá del desequilibrio de los datos, ciertas condiciones fueron inherentemente más difíciles de evaluar dado el conjunto de características disponibles, como lo ejemplifica el menor desempeño de los neurólogos expertos en el diagnóstico de condiciones como SEF y TBI.
Este desafío se ve agravado por el hecho de que las anotaciones utilizadas para el entrenamiento del modelo pueden ser inciertas o inconsistentes, ya que las decisiones de diagnóstico pueden variar entre los médicos debido a las interpretaciones subjetivas de los síntomas y la variabilidad en la información disponible.
Los datos de entrenamiento podrían reflejar estas incertidumbres, lo que podría afectar la precisión del modelo. Sin embargo, el uso de modelos de IA en este contexto también presenta una oportunidad. Al analizar sistemáticamente grandes conjuntos de datos, la IA puede ayudar a identificar patrones que pueden ser menos evidentes en casos individuales, lo que puede reducir la variabilidad en las evaluaciones clínicas.
Los modelos entrenados con anotaciones inciertas también se pueden perfeccionar y mejorar con el tiempo a medida que se disponga de datos más precisos y completos. Este proceso de aprendizaje iterativo puede mejorar la confiabilidad y utilidad del modelo para diagnosticar condiciones complejas.
Además, Xue y colegas fusionaron los casos de demencia leve, moderada y grave en una sola categoría. Ellos reconocen que este método de categorización podría no reflejar completamente la estadificación individual matizada que se practica en entornos de atención médica específicos, donde los distintos grados de gravedad de la demencia conllevan distintas implicaciones para el tratamiento y las estrategias de manejo.
Este enfoque se centró principalmente en el diagnóstico diferencial más que en la estadificación de la enfermedad, lo que motivó esta decisión. Las mejoras futuras del modelo podrían incluir la estadificación de la enfermedad como una dimensión adicional, aumentando así su granularidad y relevancia.
Finalmente, este estudio no aborda completamente la considerable heterogeneidad inherente a la EA, que se caracteriza por diversas presentaciones clínicas y características patológicas.
Se necesitan estudios futuros para evaluar rigurosamente la heterogeneidad de la EA mediante la realización de análisis estratificados basados en subtipos clínicos y patológicos específicos para comprender cómo funciona el modelo en las diferentes variantes de la EA.
La evidencia recopilada en este estudio señala una convergencia entre los métodos computacionales avanzados y la tarea del diagnóstico diferencial de la demencia, crucial para escenarios con recursos escasos y el complejo desafío de la demencia mixta, una condición que se encuentra con frecuencia pero que es diagnósticamente compleja.
El modelo integra eficientemente datos multimodales, mostrando un sólido desempeño en diversos entornos. Las validaciones futuras, como estudios de cohortes prospectivos a gran escala y ensayos clínicos multicéntricos, que abarquen una extensión demográfica y geográfica más amplia, serán fundamentales para fundamentar la solidez del modelo y mejorar su utilidad diagnóstica en la atención de la demencia.
Además, los estudios longitudinales que rastrean los resultados de los pacientes y la investigación de efectividad comparativa con las prácticas estándar actuales son esenciales para confirmar la utilidad clínica de esta herramienta.
La investigación pragmática acentúa el potencial de las redes neuronales para refinar la granularidad de las evaluaciones diagnósticas en trastornos neurocognitivos.
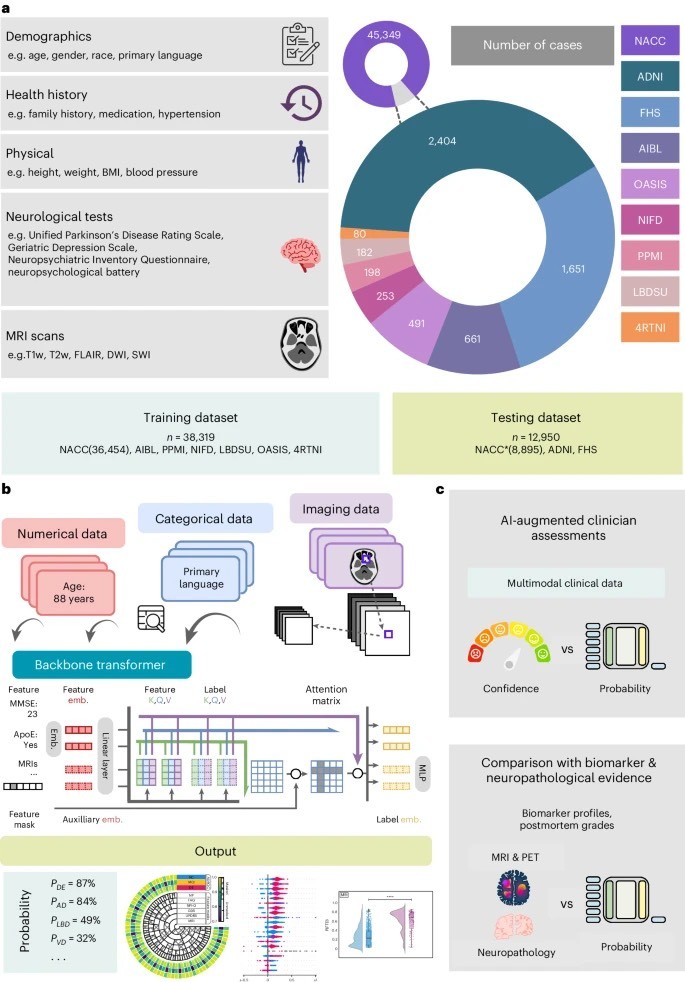
a, El modelo para el diagnóstico diferencial de la demencia se desarrolló utilizando diversas modalidades de datos, incluidos datos demográficos a nivel individual, antecedentes médicos, pruebas neurológicas, exámenes físicos/neurológicos y exploraciones por resonancia magnética multisecuencia.
Estas fuentes de datos, cuando estuvieron disponibles, se agregaron de nueve cohortes independientes: 4RTNI, ADNI, AIBL, FHS, LBDSU, NACC, NIFD, OASIS y PPMI.
Para el entrenamiento de modelos, fusionaron datos de NACC, AIBL, PPMI, NIFD, LBDSU, OASIS y 4RTNI. Utilizaron un subconjunto del conjunto de datos NACC para pruebas internas. Para la validación externa, utilizaron las cohortes ADNI y FHS.
b, Un transformador sirvió como andamio para el modelo. Cada característica se procesó en un vector de longitud fija utilizando una estrategia de incrustación (emb.) específica de la modalidad y se introdujo en el transformador como entrada. Se utilizó una capa lineal para conectar el transformador con la capa de predicción de salida.
c, Se eligió aleatoriamente un subconjunto del conjunto de datos de pruebas de NACC para realizar un análisis comparativo entre el desempeño de los neurólogos aumentado con el modelo de IA y su desempeño sin asistencia de IA.
De manera similar, llevaron a cabo evaluaciones comparativas con neurorradiólogos en ejercicio, a quienes se les proporcionó una muestra seleccionada al azar de casos confirmados de demencia de la cohorte de pruebas de NACC, para evaluar el impacto del aumento de la IA en su desempeño diagnóstico.
Para ambas evaluaciones, el modelo y los médicos tuvieron acceso al mismo conjunto de datos multimodales. Finalmente, evaluaron las predicciones del modelo comparándolas con perfiles de biomarcadores y grados de patología disponibles en las cohortes NACC, ADNI y FHS.