El síndrome antifosfolípido (SAF) se manifiesta mediante trombosis venosa o arterial, con o sin complicación del embarazo junto con la presencia continua de anticuerpos antifosfolípidos (aPL). La clasificación de SAF se basa en tres subtipos de aPL: anticardiolipina (aCL), anticuerpos anti-β2-glicoproteína I (anti-β2GPI) y anticuerpos anticoagulantes lúpicos (LA). Dado que la trombosis y los problemas del embarazo no son exclusivos del SAF, la identificación precisa y confiable de aPL constituye la base para el diagnóstico. Los ensayos semicuantitativos en fase sólida identifican dos anticuerpos, aCL y anti-β2GPI, mientras que la detección de LA se produce mediante varios ensayos de coagulación dependientes de fosfolípidos que se basan en el comportamiento de los anticuerpos.
El LA, específicamente, se asocia de manera concluyente con la trombosis, lo que genera debates sobre los criterios serológicos para el SAF. A pesar de los avances en la detección de LA, la estandarización de todos los ensayos de detección de aPL sigue siendo imperativa. La presencia combinada de aCL y anti-β2GPI con trombosis genera preocupación de manera inconsistente. Las presentaciones iniciales de los pacientes con SAF comúnmente presentan un mayor riesgo de accidente cerebrovascular, abortos espontáneos en las últimas etapas del embarazo, resultados positivos de las pruebas de LA y trombosis generalizada en múltiples órganos, lo que a menudo conduce a resultados adversos. Diagnosticar correctamente esta afección es fundamental para evitar una tromboprofilaxis secundaria innecesaria a largo plazo.
Introducción y antecedentes
El síndrome antifosfolípido (SAF) es una afección caracterizada por una respuesta autoinmune que conduce a un trastorno protrombótico. Este síndrome está estrechamente relacionado con la presencia de anticuerpos antifosfolípidos (aPL), que son proteínas inmunes que se dirigen por error a ciertos componentes de las membranas celulares. Inicialmente identificado y descrito por el médico Graham R. V. Hughes en 1993, el síndrome también se conoce comúnmente como síndrome de Hughes en reconocimiento a su contribución fundamental a su comprensión . El SAF se identifica por trombosis venosa, arterial o de pequeños vasos. Además, abarca la pérdida temprana recurrente del embarazo, la pérdida fetal o las complicaciones del embarazo en presencia de aPL persistentes documentados, como los anticoagulantes lúpicos (LA), los anticuerpos anti-β2-glicoproteína I (anti-β2GPI).
Los pacientes con SAF a menudo presentan un mayor riesgo de sufrir un accidente cerebrovascular, abortos espontáneos en las primeras etapas del embarazo, resultados positivos en las pruebas de LA y trombosis generalizada en múltiples órganos, lo que lleva a resultados desfavorables. Diagnosticar correctamente esta afección es fundamental para prevenir una tromboprofilaxis secundaria innecesaria a largo plazo.
=> Recibir por Whatsapp las noticias destacadas
Detección de APS
La detección temprana del SAF es crucial para prevenir la trombosis recurrente porque los pacientes enfrentan un riesgo significativo de recurrencia, con tasas del 52-69% en cinco a seis años, especialmente dentro de los primeros meses después de suspender la anticoagulación . Manejar los eventos trombóticos recurrentes puede ser un desafío y a menudo requiere terapia antitrombótica prolongada o de por vida. Hasta el 20% de los casos de trombosis venosa profunda (TVP), con o sin embolia pulmonar, pueden estar relacionados con aPL, lo que destaca la importancia de una terapia anticoagulante inmediata tras una detección temprana.
Confirmar APS requiere dos pruebas positivas de aPL con al menos seis semanas de diferencia para garantizar la persistencia de aPL y evaluar con precisión el riesgo trombótico. Mientras que los individuos asintomáticos con niveles de aPL elevados transitoriamente tienen un riesgo bajo de trombosis, aquellos con aPL persistentemente positivos tienen un riesgo mayor y pueden beneficiarse de la terapia profiláctica.
Prevalencia del SAF
En los EE.UU., el SAF tiene una incidencia anual de 2,1 por 100.000 y una prevalencia de 50 por 100.000 adultos, afectando predominantemente a la población blanca . En Argentina, la incidencia es de 2,6 por 100.000, con una prevalencia de 40,5 por 100.000 . Corea del Sur informa una incidencia más baja de 0,75 por 100.000 y una prevalencia de 6,19 por 100.000 . En Taiwán, la incidencia aumentó de 4,87 a 6,49 por 10.000 personas-año entre 2000 y 2013, y las mujeres mostraron una incidencia mayor que los hombres . En general, la prevalencia del SAF en la población general es de aproximadamente uno en 2.000, lo que la convierte en una enfermedad rara con una incidencia de aproximadamente cinco por 100.000 personas-año y una prevalencia de 40 a 50 por 100.000 personas-año . Esta rareza subraya la necesidad de más investigación y concientización.
En individuos sanos, los aPL pueden ocurrir incidentalmente: menos del 10% tiene títulos bajos de aCL y menos del 1% exhibe niveles moderados a altos de títulos de aCL y/o prueba de LA positiva. La prevalencia de pruebas positivas de aPL tiende a aumentar con la edad. El diagnóstico de SAF en pacientes mayores requiere especial cuidado debido al diagnóstico diferencial más amplio de la oclusión vascular en comparación con los adultos jóvenes . Aproximadamente, el 10% de los donantes de sangre sanos presentan positividad para los anticuerpos aCL y aproximadamente el 1% dan positivo para LA. Sin embargo, menos del 1% de estas muestras siguen siendo positivas después de un año.
Alrededor del 30% al 40% de las personas diagnosticadas con lupus eritematoso sistémico (LES) y aproximadamente el 20% de los pacientes con artritis reumatoide (AR) dan resultados positivos para aPL . Entre los pacientes con LES, alrededor del 20% al 30% presentan perfiles de aPL recurrentes, que están relacionados con un mayor riesgo de complicaciones clínicas.
Entre las personas sin enfermedad autoinmune, la prevalencia de positividad de aPL es aproximadamente del 17% en pacientes con accidente cerebrovascular menores de 50 años, del 11% en pacientes que sufrieron infarto de miocardio, del 10% en pacientes con trombosis venosa y del 6% en mujeres que experimentan complicaciones del embarazo. Sin embargo, es importante señalar que estas estimaciones de prevalencia provienen principalmente de estudios que involucraron pruebas de aPL realizadas una vez, incluyeron resultados casi positivos o ambos. Se necesitan estudios sólidos que empleen criterios estrictos para los aFL y definiciones claras de eventos clínicos.
Características clínicas del SAF
Las características clínicas del SAF varían ampliamente, desde afecciones leves como la positividad asintomática de aPL hasta casos graves como el SAF catastrófico. La trombosis venosa y arterial, junto con las complicaciones relacionadas con el embarazo, se consideran las características definitorias de la enfermedad . La presencia de aPL puede manifestarse en diversos escenarios clínicos, que van desde individuos asintomáticos identificados como “portadores de aPL” hasta aquellos con SAF clásico. El SAF clásico se caracteriza por eventos vasculares recurrentes como trombosis arterial o venosa. Además, el SAF puede afectar predominantemente al embarazo y provocar SAF obstétrico. Del mismo modo, existen pacientes que dan positivo para aPL pero presentan manifestaciones clínicas que no son de naturaleza trombótica u obstétrica. Un pequeño subconjunto de pacientes con SAF puede experimentar SAF catastrófico, una forma agresiva y potencialmente mortal caracterizada por la rápida aparición de múltiples eventos oclusivos que causan insuficiencia multiorgánica .
La clasificación de SAF “primario” es cuando ocurre sin ninguna asociación con otras enfermedades subyacentes, ya sea que se denomine “secundario” cuando está relacionado con afecciones, especialmente trastornos autoinmunes como el LES. Aunque se ha observado positividad de aPL en relación con neoplasias malignas, infecciones y medicamentos, en tales casos, los títulos de aPL suelen permanecer transitorios y bajos. En consecuencia, no elevan significativamente el riesgo de resultados adversos de embarazo o trombosis. Si bien las formas clínicas del SAF primario y secundario pueden tener similitudes, las características secundarias pueden complicarse aún más por la manifestación de la enfermedad subyacente.
Más allá de la trombosis y las complicaciones del embarazo, varias otras condiciones clínicas se han asociado tentativamente con aPL. Estos incluyen enfermedad de las válvulas cardíacas (a menudo oculta,conocida como endocarditis de Libman-Sacks), trombocitopenia, livedo reticularis/racemosis, corea y nefropatía. Sin embargo, al igual que los síntomas trombóticos y relacionados con el embarazo, ninguna de estas afecciones es específica del SAF. La mielopatía transversa, una afección que se observa en el LES, podría ocurrir con mayor frecuencia en personas con aPL. Ha habido afirmaciones sobre una asociación entre el SAF y la infertilidad, aunque dichas afirmaciones carecen de pruebas sustanciales . La relación entre el SAF y las migrañas sigue siendo controvertida; algunos estudios indican una conexión , mientras que otros no han encontrado tal asociación . Otra noción polémica es la semejanza del SAF con la esclerosis múltiple, como sugirió Hughes en 2003 de que MS podría responder a la terapia anticoagulante . Sin embargo, si bien los aPL pueden detectarse en ciertos casos de esclerosis múltiple típica , podría representar un epifenómeno en un trastorno impulsado principalmente por mecanismos inmunológicos.
Además, el término «SAF seronegativo» se introdujo para caracterizar a los pacientes que presentan manifestaciones clínicas de SAF pero que sistemáticamente dan resultados negativos para los aPL convencionales . En tales casos, los médicos deben considerar la posibilidad de un «SAF seronegativo» para garantizar una terapia adecuada y así mejorar el pronóstico. Sin embargo, el diagnóstico de «SAF seronegativo» podría plantear desafíos, ya que las manifestaciones primarias del SAF, como el fracaso del embarazo y la trombosis, son habituales y a menudo carecen de una base autoinmune, lo que podría ser un desafío.
Fisiopatología del SAF
Aunque no todos los individuos con aPL desarrollan SAF, existe una fuerte correlación entre la presencia de aPL y afecciones como la trombosis venosa, el accidente cerebrovascular isquémico y el infarto de miocardio. La probabilidad de desarrollar SAF clínico puede depender de varios factores, como el perfil de anticuerpos, que comprende el tipo, el título y las comorbilidades subyacentes. Por ejemplo, las personas que demuestran triple positividad con LA positivo, junto con anticuerpos anti-B2GPI y títulos de aCL altos enfrentan un mayor riesgo de aparición de APS. Por el contrario, la positividad esporádica o los títulos aislados o bajos de anticuerpos aCL y anti-B2GPI plantean un riesgo relativamente menor. Los pacientes con LES, factores de riesgo cardiovascular concurrentes, antecedentes de eventos trombóticos recurrentes a pesar de recibir terapia anticoagulante o antecedentes de trombosis arterial tienen un riesgo elevado de experimentar trombosis recurrente.
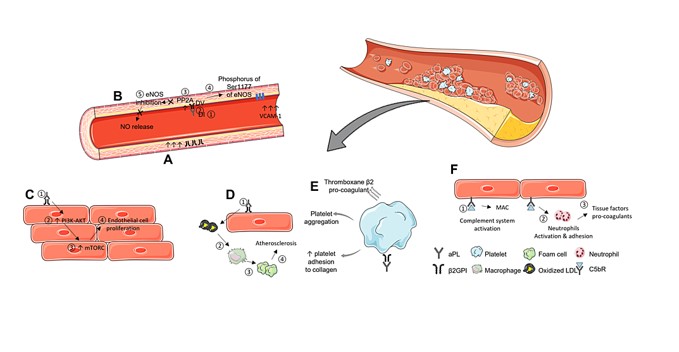
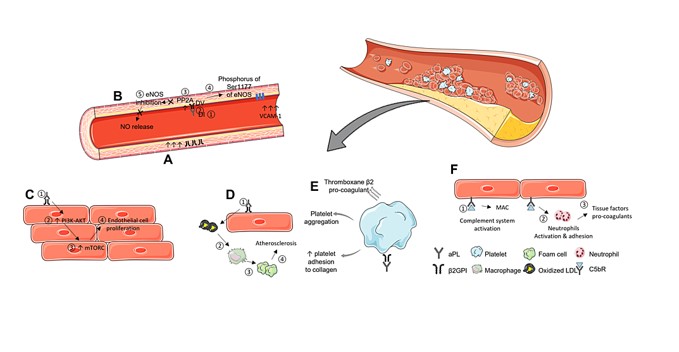
En modelos animales experimentales, se ha demostrado que los aPL de individuos con el síndrome contribuyen directamente al desarrollo de manifestaciones trombóticas . Se han propuesto algunas hipótesis para dilucidar la base molecular del estado protrombótico vinculado al estado de anticuerpos . Los informes indican que el aPL se une y desencadena la activación de las células endoteliales, impide las vías anticoagulantes naturales, interrumpe la unión de la anexina V a los fosfolípidos aniónicos e interfiere con la fibrinólisis . Sin embargo, la importancia clínica precisa de las vías individuales aún no está clara.
Reconocidos como entidades patógenas, los aPL desempeñan un papel crucial en la trombosis en lugar de simplemente servir como marcadores serológicos de los aPL. La teoría de los «dos impactos» sugiere que el desarrollo de APS implica un proceso de dos pasos. El primer paso (golpe inicial) se caracteriza por la activación de una respuesta protrombótica o inflamatoria desencadenada por aPL. Este golpe inicial prepara el escenario para una mayor vulnerabilidad a los eventos trombóticos. El segundo paso (segundo golpe) ocurre cuando el individuo se expone a un evento precipitante inmediato, que podría incluir someterse a una cirugía, estar expuesto a estrógenos exógenos, experimentar inmovilización o pasar por un embarazo. Curiosamente, en el contexto del embarazo, no se trata únicamente de un estado protrombótico precipitante; El examen de los productos de la concepción de mujeres aPL positivas y aPL negativas con abortos espontáneos tempranos recurrentes resalta una clara deficiencia en la invasión de los trofoblastos endovasculares deciduales en el SAF obstétrico (OAPS) e indica que el infarto placentario no es exclusivo del SAF.
La creciente evidencia experimental sugiere un papel no trombótico en la patogénesis del OAPS a través de la activación del complemento mediada por aPL, la inflamación y la alteración del desarrollo y la función de la placenta. Sin embargo, los datos clínicos del Registro Europeo del Síndrome Antifosfolípido Obstétrico (EUROAPS) que involucran a 247 pacientes con SAF indican una menor probabilidad de progresar a LES y trombosis en comparación con pacientes con SAF trombótico, lo que respalda la idea de que el SAF obstétrico representa un subconjunto distinto dentro del SAF.
Anticuerpo antifosfolípido y trombosis
Las venas profundas de las extremidades inferiores afectadas por la trombosis venosa representan la forma más frecuente de afectación venosa y potencialmente pueden progresar a una embolia pulmonar, provocando en consecuencia hipertensión pulmonar. Otros sitios susceptibles a la trombosis venosa abarcan las áreas renal, pélvica, hepática, mesentérica, axilar, portal, sagital, ocular y de la vena cava inferior. La trombosis arterial puede abarcar arterias de cualquier tamaño, desde la aorta hasta pequeños capilares. Los eventos isquémicos transitorios (TIA) o el accidente cerebrovascular isquémico son las manifestaciones arteriales del SAF observadas con mayor frecuencia, particularmente en pacientes jóvenes que carecen de otros factores de riesgo de aterosclerosis, lo que debería impulsar la consideración del SAF. Los sitios adicionales propensos a la trombosis arterial pueden incluir las arterias braquial, retiniana, periférica, mesentérica y coronaria. La presencia de trombosis arterial es indicativa de un mal pronóstico debido al mayor riesgo de recurrencia en estos casos.
La activación plaquetaria y la producción de procoagulantes, como el factor von Willebrand (vWF), son efectos bien conocidos de los aPL que contribuyen al desarrollo de la trombosis. A pesar de este conocimiento, el mecanismo preciso detrás de estos procesos sigue sin estar claro. Un estudio realizado por Levy et al. investigaron 88 pacientes hospitalizados con SAF, incluidos individuos con antecedentes de trombosis, aquellos sin aPL pero con antecedentes de trombosis y controles sanos . Los resultados revelaron que los pacientes con SAF con antecedentes de trombosis exhibieron una mayor adhesión y agregación plaquetaria en comparación con los pacientes sin antecedentes de trombosis y el grupo sano, quienes mostraron resultados normales (P <0,01). Un análisis más detallado mostró que la preincubación con el fragmento recombinante de vWF RG12986 inhibía la adhesión y agregación plaquetaria en un subgrupo específico de pacientes con SAF con eventos trombóticos, así como en controles. Sin embargo, no se estableció correlación entre el tipo de aPL y la aparición de trombosis en pacientes con SAF. El estudio sugiere que la activación plaquetaria en el SAF implica al menos dos mecanismos distintos. Un mecanismo está asociado con la activación plaquetaria inducida por aPL. Estos hallazgos contribuyen a una mejor comprensión de la compleja interacción entre aPL, activación plaquetaria y trombosis en pacientes con aPL.
Los modelos in vitro han demostrado predominantemente los mecanismos potencialmente patógenos que subyacen a la formación de trombos. Sin embargo, los conocimientos adquiridos a partir de modelos de trombosis in vivo, que implican la inducción de trombosis mediante traumatismo químico, mecánico o fotoquímico tanto en ratones como en hamsters, han arrojado luz sobre el papel de los aPL en la formación de trombos. Estos estudios han demostrado que los aPL pueden aumentar significativamente la formación de coágulos sanguíneos tanto en el sistema venoso como en el arterial. Además, los experimentos que involucran la infusión pasiva de inmunoglobulina G (IgG) aPL humana, combinada con una pequeña cantidad de lipopolisacárido (LPS), han llevado a eventos de coagulación observados en la microcirculación mesentérica de ratas. Además, dentro de las células endoteliales arteriales, se ha demostrado que la infusión de aPL induce alteraciones en los niveles de expresión de las moléculas de adhesión endotelial.
Además, se observa una regulación positiva en la expresión del factor tisular (TF) y del óxido nítrico (NO), lo que aclara aún más los intrincados mecanismos por los cuales el aPL contribuye a los eventos trombóticos. Estos efectos se observaron tanto con y sin β2GPI dimérico, lo que destaca el papel crucial de aPL en la instigación de anomalías vasculares. Las plaquetas estuvieron implicadas en la formación de trombos arteriales inducida por fotoquímicos, mientras que los monocitos de ratones inyectados pasivamente con aPL mostraron una mayor expresión de TF. Estos hallazgos subrayan las diversas formas en que los aPL contribuyen a la formación de trombos y a las anomalías vasculares, proporcionando información valiosa sobre la intrincada interacción de estos anticuerpos en los procesos trombóticos.
Las interacciones patogénicas de aPL con β2GPI humano y moléculas de ratones, ratas y hamsters se han confirmado mediante modelos in vivo. Los efectos trombóticos se indujeron in vivo utilizando IgG β2GPI purificada por afinidad y posteriormente se inhibieron mediante la absorción específica de la actividad β2GPI. Con base en estos hallazgos experimentales, la subpoblación de anticuerpos responsables de las manifestaciones trombóticas del SAF se identifica como aPL dependiente de anti-β2GPI. En particular, se informa que el LA dependiente de β2GPI exhibe una correlación más fuerte con la trombosis en comparación con el LA en general.
Los dos antígenos de aPL más estudiados son β2GPI y protrombina. Varias funciones fisiológicas propuestas de β2GPI incluyen la eliminación de células apoptóticas, la unión a lipoproteínas de baja densidad oxidadas y la interacción con el factor XI de coagulación. La protrombina, el precursor de la trombina, desempeña un papel crucial en la coagulación. La mayoría de los LA se dirigen a β2GPI o a la protrombina. Los anticuerpos anti-β2GPI se han incorporado a los criterios de clasificación de consenso para el SAF. Las investigaciones en curso investigan la utilidad clínica de los ensayos inmunoabsorbentes ligados a enzimas (ELISA) antiprotrombina.
En un estudio realizado por Forastiero et al., se examinó la participación de los anticuerpos anti-β2GPI y anti-PT en el riesgo trombótico en una cohorte de 194 pacientes consecutivos que presentaban LA y/o aCL persistentes . Los hallazgos indicaron que los pacientes con resultados positivos para anti-β2GPI exhibieron una tasa de trombosis más alta en comparación con los pacientes con SAF sin anti-β2GPI (8,0 % frente a 3,1 % por paciente-año). De manera similar, los individuos con anti-PT positivo demostraron una tasa de trombosis más alta en comparación con aquellos sin anti-PT (8,6 % frente a 3,5 % por paciente-año). La presencia de IgG anti-β2GPI y anti-PT en pacientes con LA y/o aCL, particularmente aquellos con LA, sirve como factor predictivo de un riesgo elevado de eventos tromboembólicos.
Los mecanismos procoagulantes iniciados por los aPL provienen de su capacidad para interactuar con proteínas de unión a fosfolípidos ubicadas en las membranas celulares de varios tipos de células. Según la hipótesis, cuando el anticuerpo se une a su antígeno correspondiente, forma un complejo que interfiere con la integridad de las membranas celulares. Posteriormente, esta alteración desencadena vías de señalización que se extienden hasta el núcleo celular (Figura 1). Las células perturbadas, dependiendo de sus funciones biológicas, podrían provocar diferentes respuestas, contribuyendo así a las diversas manifestaciones clínicas observadas en el SAF .
Se descubrió una anomalía hemostática en el 94% de los casos con abortos espontáneos recurrentes. Entre estos, aproximadamente el 67% fueron diagnosticados con SAF, comprendiendo el 81,2% con aCL y el 4% con LA, respectivamente. En aproximadamente el 55% de las pacientes que experimentaron abortos espontáneos recurrentes, se identificó un defecto procoagulante como un factor que contribuía a la oclusión vascular placentaria.
En los embarazos únicos con SAF primario, los anticuerpos aCL fueron los aPL predominantes identificados. Sin embargo, la existencia de anti-β2GPI se relacionó con la tasa más baja de nacidos vivos y la mayor aparición de afecciones como preeclampsia, restricción del crecimiento intrauterino y muerte fetal, en comparación con la presencia de anticuerpos aCL o LA solos.
Como reflejo de la naturaleza trombofílica de los aPL, la hipótesis inicial sugirió que la trombosis intraplacentaria, que causaba un deterioro del intercambio sanguíneo materno-fetal, constituía el principal mecanismo patogénico que conducía a la pérdida fetal. Los informes han documentado casos de trombosis e infarto placentario, lo que indica posibles complicaciones asociadas con el SAF durante el embarazo. Además, las investigaciones in vitro han proporcionado información sobre cómo los aPL pueden contribuir al desarrollo de un entorno procoagulante dentro de la placenta. Estos incluyen la capacidad de los anticuerpos aPL para alterar el escudo anticoagulante de anexina A5 en las monocapas de células endoteliales y trofoblastos. En consonancia con estas observaciones in vitro, la distribución de anexina A5 que cubre las superficies intervellosas fue notablemente menos extensa en las placentas de mujeres positivas para aPL en comparación con aquellas que carecían de estos autoanticuerpos.
Ratones preñados sin tratamiento previo sometidos a repetidas inyecciones intraperitoneales de cantidades sustanciales de IgG humana con actividad aPL exhibieron un daño inflamatorio pronunciado en la placenta, lo que resultó en reabsorción fetal y retraso del crecimiento. Este daño se caracterizó por el depósito de IgG humana y complemento de ratón, infiltración de neutrófilos y secreción localizada de factor de necrosis tumoral (TNF). La evidencia sugirió que la participación del complemento jugó un papel en la pérdida fetal mediada por aPL en este modelo de ratón, como lo indican los efectos protectores conferidos por la deficiencia en componentes específicos del complemento o la inhibición in vivo del complemento. En este modelo, el producto de escisión C5a del componente C5 del complemento se identificó como el efector clave, que actúa a través de la expresión regulada positivamente del factor tisular en la infiltración de neutrófilos placentarios. En particular, el efecto protector de la heparina en el modelo de ratón se asoció con su actividad anticomplemento más que con sus propiedades anticoagulantes.
Las vías del complemento y la coagulación muestran interconexiones intrincadas, y los datos emergentes proponen que los individuos con anticuerpos antifosfolípidos (aPL) pueden experimentar activación del complemento, actuando como cofactor en la patogénesis de eventos clínicos asociados a aPL. Durante la activación del complemento, se genera C5a, lo que desencadena una actividad procoagulante dependiente del factor tisular de los neutrófilos. Los estudios in vitro indican que β2GPI, el antígeno primario del aPL patógeno, posee efectos reguladores del complemento. Además, se observó evidencia de pérdida fetal inducida por aPL en ratones de tipo salvaje, pero no en ratones que carecían de componentes específicos del complemento (C3, C5). En la misma línea, aPL indujo trombosis en ratones de tipo salvaje, una respuesta que disminuyó en ratones deficientes en C3 o C5 o en presencia de un inhibidor de C5. A pesar de los niveles elevados de productos de activación del complemento en el suero de pacientes con aPL, su asociación con eventos clínicos sigue sin estar clara.
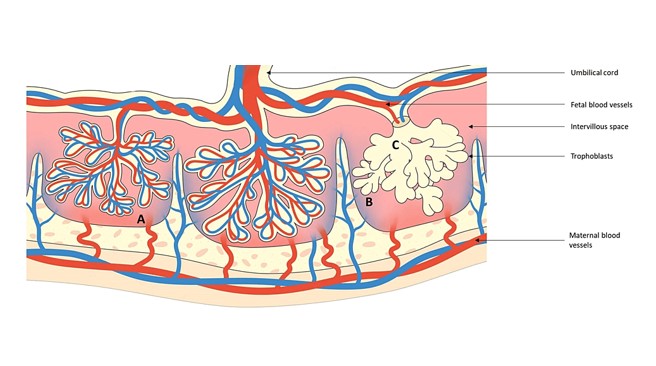
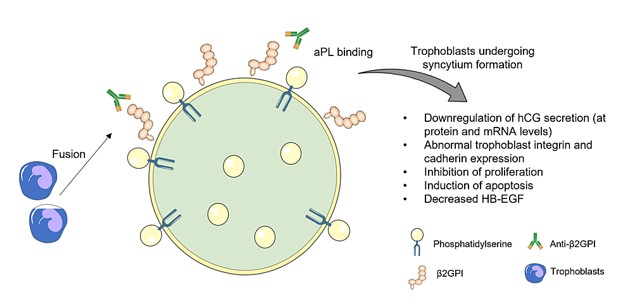
Además de la trombosis, existe evidencia convincente que sugiere que los aPL pueden alterar la placentación normal a través de mecanismos alternativos. Estos mecanismos implican el ataque directo tanto a la decidua materna como al trofoblasto invasor. Esto sugiere que los aPL pueden ejercer efectos perjudiciales sobre los resultados del embarazo no sólo a través de sus propiedades protrombóticas bien documentadas sino también a través de la interferencia directa con los intrincados procesos implicados en el establecimiento y mantenimiento de la placenta. Tales alteraciones en la placentación podrían tener profundas implicaciones para la salud general y la viabilidad del feto en desarrollo, contribuyendo a la complejidad del SAF en el contexto del embarazo (Figura 2). En el lado fetal, los aPL, específicamente los anticuerpos dependientes de β2GPI, se unen a los trofoblastos humanos, lo que afecta diversas funciones celulares in vitro (Figura 3). Estos efectos resultan en lesión celular y apoptosis, inhibición de la proliferación y formación de sincitios, reducción de la producción de gonadotropina coriónica humana, alteración de la secreción de factores de crecimiento y compromiso de la invasividad. Todos estos efectos mediados por aPL podrían contribuir potencialmente a una placentación defectuosa.
Hay evidencia que sugiere que los aPL pueden provocar anomalías en el aspecto materno de la placenta. Más precisamente, las observaciones extraídas de biopsias endometriales han revelado anomalías notables, incluida una diferenciación endometrial comprometida y una reducción en los niveles de expresión del factor acelerador de la descomposición del complemento, reconocido como CD55. Estas alteraciones previas a la concepción tienen el potencial de comprometer la implantación y pueden predisponer a las personas al fracaso del embarazo mediado por mecanismos relacionados con el complemento. Además, el aPL dependiente de β2GPI ha demostrado la capacidad de interactuar con células deciduales del estroma humano in vitro, provocando un fenotipo proinflamatorio.
Estos hallazgos sugieren que las complicaciones durante el embarazo relacionadas con el SAF pueden surgir de un espectro de eventos patogénicos. Es importante destacar que estos eventos no pueden atribuirse únicamente a los efectos procoagulantes o proinflamatorios típicamente asociados con los aPL. Esto implica que el impacto de los APS en los resultados del embarazo es multifacético e involucra mecanismos más allá de los tradicionalmente considerados. Comprender estas diversas vías patogénicas es crucial para abordar de manera integral las complejidades del SAF en el contexto del embarazo.
Diagnóstico del SAF
Los criterios de clasificación del SAF se formularon inicialmente en 1999 y se denominaron «criterios de Sapporo». Posteriormente, estos criterios fueron revisados durante el Congreso Internacional de Anticuerpos Antifosfolípidos de Sydney en 2006, pasando a ser conocidos como criterios actualizados de Sapporo o Sydney. Es importante reconocer que estos criterios se diseñaron principalmente como pautas de clasificación más que como herramientas de diagnóstico . Su objetivo principal era establecer un marco estandarizado para identificar a las personas con probabilidades de tener APS. Esta estandarización mejora la precisión y la coherencia del diagnóstico del SAF, facilitando así la inclusión de pacientes elegibles en ensayos clínicos prospectivos destinados a investigar el manejo y las estrategias de tratamiento del SAF. Es posible que los pacientes actualmente diagnosticados con SAF no cumplan necesariamente estos requisitos de clasificación.
Se adoptaron estándares de consenso para el diagnóstico de SAF con el objetivo de fomentar la coherencia y la estandarización en todos los esfuerzos de investigación. Estos estándares están resumidos en los «Criterios de clasificación revisados para APS».
Criterios clínicos
Los criterios clínicos en el diagnóstico del SAF se pueden dividir en trombosis vascular y morbilidad durante el embarazo.
Trombosis vascular: este criterio abarca la aparición de trombosis arterial, venosa o de pequeños vasos que afecta cualquier tejido u órgano del cuerpo. Es fundamental tener en cuenta que el diagnóstico de trombosis debe confirmarse mediante criterios objetivos y validados para garantizar la precisión y la fiabilidad. Morbilidad del embarazo: esta categoría incluye varias complicaciones relacionadas con el embarazo: (a) Muerte fetal inexplicable: se refiere a uno o más casos de muerte espontánea de un feto con características anatómicas normales, que ocurren después de la décima semana de gestación. La confirmación de la morfología fetal normal se puede establecer mediante examen ecográfico o inspección fetal directa. (b) Parto prematuro: Implica el parto de un bebé morfológicamente normal antes de completar la semana 34 de gestación. Esta afección surge debido a preeclampsia o eclampsia grave, o muestra signos identificables de insuficiencia placentaria, o (c) Los abortos espontáneos recurrentes se describen como la experiencia repetida de tres o más abortos espontáneos consecutivos inexplicables antes de llegar a la décima semana de gestación. Para cumplir con este criterio, es crucial investigar a fondo y descartar posibles anomalías anatómicas u hormonales maternas, así como causas cromosómicas paternas y maternas, para determinar con precisión las causas subyacentes de estos abortos espontáneos.
Selección de pacientes para la prueba LA
Sintomático: la evaluación de LA debe reservarse para pacientes que exhiben una probabilidad considerable de tener SAF o que presentan un tiempo de tromboplastina parcial activado (aPTT) prolongado e inexplicable durante la evaluación de laboratorio de rutina.
Asintomático: se desaconseja encarecidamente realizar búsquedas generalizadas utilizando muestras de sangre de personas asintomáticas o grupos de pacientes no mencionados específicamente en estas categorías. Esta precaución surge del riesgo de obtener resultados falsos positivos, una situación que es relativamente común debido a la escasa especificidad de los ensayos. Además, una vez que un paciente da positivo en la prueba de anticoagulante lúpico (LA), es crucial realizar pruebas en una segunda ocasión, asegurando un plazo de más de 12 semanas después de la prueba inicial. Es esencial recolectar muestras antes o sin la terapia anticoagulante, ya que esto podría interferir con la precisión de la prueba.
En ensayos donde el contenido de fosfolípidos es mínimo, el impacto de los anticoagulantes lúpicos se observa mediante la prolongación de los tiempos de recalcificación. A pesar de la disponibilidad de numerosos ensayos, todos funcionan según este principio fundamental. La confirmación de la presencia de anticoagulante lúpico puede implicar la aplicación de fosfolípidos exógenos para demostrar la normalización de los tiempos de recalcificación.
Criterios de laboratorio
Para establecer el diagnóstico de SAF es necesario confirmar la presencia de aPL persistente en dos ocasiones distintas, con un intervalo mínimo de 12 semanas entre pruebas. Es imperativo realizar las tres pruebas de aPL, que incluyen ensayos de LA, aCL y anti-β2GP1. Este enfoque integral es crucial porque el perfil específico de aPL afecta significativamente el riesgo de trombosis asociada con SAF. La presencia de triple positividad de aPL, definida como positividad simultánea para LA, inmunoglobulina G (IgG) y/o inmunoglobulina M (IgM) anti-β2GP1, e IgG y/o IgM aCL, se correlaciona con el mayor riesgo trombótico. Los aPL con títulos medios a altos tienen importancia clínica, particularmente en lo que respecta a eventos trombóticos, mientras que los títulos más bajos de IgG o IgM pueden seguir siendo relevantes, especialmente en el contexto de complicaciones del embarazo. El papel de IgM aCL y anti-β2GP1 sigue siendo incierto. Aunque un estudio multicéntrico no encontró ningún beneficio adicional en las pruebas de anticuerpos IgM en el SAF trombótico, la combinación de positividad para LA, IgG e IgM estuvo fuertemente relacionada tanto con la trombosis como con las complicaciones relacionadas con el embarazo. Esto indica la utilidad potencial de esta positividad combinada para estratificar el riesgo asociado con SAF.
La identificación de anticoagulantes lúpicos en pruebas de laboratorio se realiza utilizando diferentes principios. LA prolonga los tiempos de recalcificación en ensayos con pequeño contenido de fosfolípidos. Sin embargo, la confirmación de la existencia de AL se puede lograr mediante la aplicación de fosfolípidos exógenos, lo que da como resultado tiempos de recalcificación normalizados.
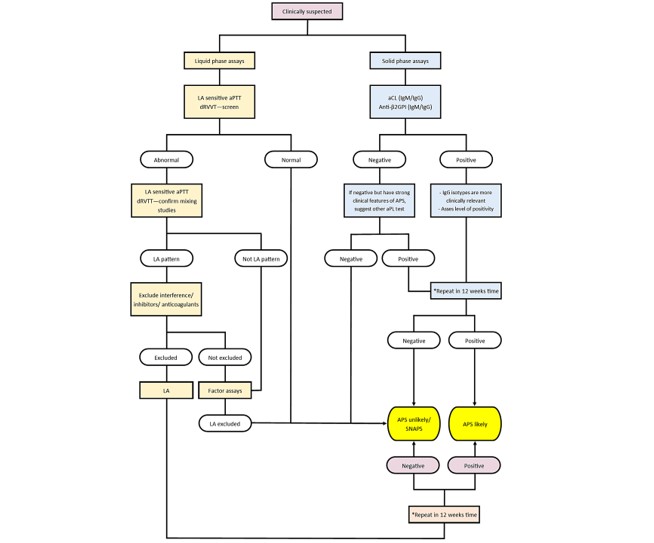
Para ilustrar la evaluación de laboratorio para posibles casos de APS, en la Figura 4 se muestra un algoritmo sugerido que incorpora ensayos en fase sólida y líquida. Los aspectos clave incluyen la necesidad de realizar pruebas en fase sólida y líquida, repetición de pruebas para confirmar la persistencia o excluir resultados transitorios y la realización de pruebas de aPL después de 12 semanas para eliminar resultados falsos negativos en el momento de la trombosis.
Perfil de aPL y riesgo trombótico
A diferencia de los criterios originales de Sapporo, los criterios de Sydney introdujeron un enfoque novedoso para categorizar a los pacientes con SAF. Esta reclasificación implicó dividir a los pacientes con SAF en dos grupos distintos: aquellos que dieron positivo para un único anticuerpo antifosfolípido (como LA, aCL o anti-β2GPI) y aquellos que mostraron positividad para más de un criterio de laboratorio, independientemente de la combinación. Esta diferenciación surgió del reconocimiento de que los individuos positivos para un solo anticuerpo antifosfolípido tienden a tener un menor riesgo de experimentar eventos trombóticos o complicaciones del embarazo en comparación con aquellos con positividad múltiple, particularmente triple. En consecuencia, evaluar a los pacientes basándose en su perfil general de anticuerpos LA, aCL o anti-β2GPI, en lugar de los resultados de las pruebas individuales, puede proporcionar información valiosa sobre su riesgo trombótico. Estas observaciones son consistentes con los objetivos antigénicos específicos de los anticuerpos antifosfolípidos patógenos, lo que arroja luz sobre la compleja interacción entre los perfiles de anticuerpos y los resultados clínicos en el SAF.
En 1990, se identificó un subgrupo fundamental de autoanticuerpos dirigidos a β2GPI en pacientes diagnosticados con SAF. Investigaciones posteriores iluminaron que los aCL relacionados con eventos trombóticos comprenden predominantemente autoanticuerpos anti-β2GPI que exhiben una fuerte afinidad por la cardiolipina. Esto llevó al reconocimiento de dos categorías distintas de aCL: los que dependen de la actividad anti-β2GPI, asociados con episodios trombóticos y complicaciones del embarazo, y los independientes de β2GPI, que a menudo se encuentran en el contexto de infecciones. La última categoría generalmente involucra anticuerpos transitorios y no conlleva un riesgo inherente de trombosis. En particular, numerosos kits de prueba de aCL incorporan una fuente de β2GPI para mejorar la sensibilidad.
Además, estudios posteriores revelaron que los autoanticuerpos dirigidos a β2GPI también pueden demostrar actividad LA. Aunque se ha establecido firmemente la unión del LA a β2GPI y su correlación con la trombosis, la disponibilidad de ensayos de LA que detectan la unión a la protrombina sigue limitada a los entornos de investigación. La diferenciación entre aCL dependientes de β2GPI e independientes de β2GPI, así como LA, tiene implicaciones clínicas importantes. Permite a los profesionales médicos distinguir entre anticuerpos patológicos asociados con eventos trombóticos y anticuerpos no patológicos.
El mecanismo de acción difiere entre los anticuerpos anti-β2GPI y anti-protrombina para causar AL. Los anticuerpos anti-β2GPI obstaculizan la activación del factor V por el factor Xa mediante interacción directa. Por el contrario, los anticuerpos antiprotrombina compiten con el factor Xa por los sitios de unión de fosfolípidos. Estos conocimientos proporcionan pistas para comprender la asociación paradójica entre la trombosis y el tiempo de coagulación prolongado.
Las pruebas de laboratorio que se centran en LA, aCL y anticuerpos anti-β2GPI a menudo identifican poblaciones de autoanticuerpos superpuestas pero diversas. Esta diversidad puede contribuir a las variadas manifestaciones clínicas observadas en el SAF. Los ensayos de LA parecen ser más eficaces para detectar aPL patológicos en comparación con los aCL o los ensayos anti-β2GPI. Además, más allá de la mera identificación de si los aPL se unen a β2GPI, se ha observado que diferentes subconjuntos de anticuerpos anti-β2GPI exhiben reconocimiento de distintos epítopos presentes en las moléculas de β2GPI. En particular, los anticuerpos que se unen al dominio I de β2GPI se asocian con complicaciones trombóticas y del embarazo en comparación con los que se unen a otros dominios. Los ensayos de laboratorio que detectan autoanticuerpos de unión al dominio I a menudo arrojan una positividad triple, lo que identifica a los pacientes con mayor riesgo de complicaciones trombóticas. Otras variables predictivas de trombosis incluyen aPL persistentes y títulos altos, lo que contribuyó a la inclusión de los criterios de Sydney.
Además de unirse a β2GPI, los aPL también pueden atacar otros fosfolípidos y/o cofactores proteicos. En pacientes con síndrome antifosfolípido secundario (SAF) asociado con LES, estos anticuerpos pueden estar dirigidos contra fosfatidilserina, protrombina (PT) y anexina V. Su presencia eleva el riesgo de complicaciones trombóticas, especialmente cuando se observan en frecuencias y concentraciones más altas .
Los autoanticuerpos que reconocen el complejo fosfatidilserina/protrombina (aPS/PT) se han sugerido como posibles biomarcadores del síndrome antifosfolípido (SAF). Los estudios han indicado una fuerte correlación entre los anticuerpos aPS/PT y las manifestaciones clínicas, así como la AL. En un estudio que involucró a 103 pacientes, la positividad persistente para anticuerpos IgG aPS/PT se correlacionó significativamente con la clasificación de APS, trombosis, positividad de anticuerpos antifosfolípidos triples (aPL), resultados positivos de LA y una puntuación global de APS (GAPSS) >9 puntos. Es probable que la persistencia de anticuerpos aPS/PT, en consonancia con los criterios de clasificación de laboratorio actuales, mejore el diagnóstico y la evaluación clínica de los pacientes con SAF.
La sólida correlación observada entre LA e IgG/IgM que reconocen el complejo fosfatidilserina/protrombina (aPS/PT) sugiere que este marcador podría ser valioso en la evaluación de APS. La inclusión de IgG/IgM aPS/PT en las evaluaciones diagnósticas puede mejorar el rendimiento general para el diagnóstico de APS, particularmente en situaciones donde las pruebas convencionales de aPL arrojan resultados negativos de manera consistente. Además, la IgG aPS/PT podría servir como un indicador útil para identificar pacientes con mayor riesgo de trombosis.
Riesgo de trombosis con pruebas positivas para un aPL
Una revisión sistemática no descubrió ninguna conexión discernible entre aCL y trombosis, un hallazgo confirmado posteriormente por estudios prospectivos. Incluso cuando se detectó en títulos moderados a altos (aCL >40 unidades de fosfolípidos IgG o IgM), la presencia de aCL por sí sola no mostró ninguna asociación con la trombosis, aunque no demostró un vínculo con la morbilidad del embarazo. De manera similar, las personas que dan positivo únicamente para anti-β2GPI tienden a no mostrar ninguna correlación con la trombosis o la pérdida del embarazo. Por el contrario, LA parece exhibir una correlación más fuerte con la trombosis y las complicaciones del embarazo. Sin embargo, evidencia contradictoria sugiere que la LA aislada no necesariamente eleva el riesgo trombótico . Las mujeres con LA persistente enfrentan un riesgo notablemente alto de sufrir complicaciones graves y potencialmente mortales durante el embarazo y resultados adversos.
Los ensayos ELISA para aCL y anti-β2GPI han encontrado problemas relacionados con una estandarización deficiente y resultados poco confiables. Por el contrario, los ensayos de LA demuestran una mejor estandarización y una fuerte asociación con las manifestaciones clínicas del SAF.
Riesgo de trombosis con pruebas positivas para dos o más aPL
El análisis de las muestras de pacientes recolectadas durante la inscripción del estudio Warfarina en el síndrome antifosfolípido (WAPS) reveló que los individuos que dieron positivo para LA y β2GPI exhibieron un mayor riesgo de trombosis general. Varias investigaciones retrospectivas y prospectivas han demostrado que los pacientes que presentan resultados positivos en tres pruebas de aPL se enfrentan a una mayor susceptibilidad a la trombosis o a complicaciones relacionadas con el embarazo. En un análisis retrospectivo que incluyó una cohorte de 160 pacientes con pruebas de aPL triple positivas, la aparición acumulada de trombosis aumentó al 12,2%, 26,1% y 44,2% después de 1, 5 y 10 años de seguimiento, respectivamente. Además, en un examen prospectivo que incluyó a 194 pacientes que presentaban LA persistente y/o aCL, los individuos con LA persistente que también dieron positivo para anticuerpos anti-β2GPI y anti-protrombina exhibieron la mayor incidencia de trombosis, estimada en 8,4% por paciente-año. Es imperativo realizar más investigaciones para determinar si los perfiles específicos de aPL pueden ejercer una influencia en la clasificación del síndrome antifosfolípido (SAF) y potencialmente afectar los procesos de toma de decisiones clínicas. La influencia de los perfiles de aPL sobre el riesgo trombótico requiere estudios adicionales.
El riesgo trombótico en los pacientes está influenciado por factores adicionales como la presencia de otros factores de riesgo trombótico (como la trombofilia hereditaria, el embarazo, la inmovilización y la cirugía) y la coexistencia de LES, junto con el perfil de aPL de los pacientes. Las personas con LES tienen un mayor riesgo de trombosis en comparación con la población general, y aquellos con aPL aislados pero persistentemente positivos tienden a enfrentar un riesgo aún mayor.
Manejo de SAF
Pacientes asintomáticos
En portadores asintomáticos de aPL, el riesgo de trombosis varía según el nivel, título, tipo y cantidad de anticuerpos aPL positivos. Un estudio prospectivo en el que participaron pacientes aPL positivos sin eventos trombóticos previos reveló un riesgo de trombosis comparable al de la población general si solo estaba presente un anticuerpo aPL (0,7% por año). Sin embargo, si el paciente daba positivo en tres anticuerpos, este riesgo se elevaba al 5,3% anual. Si bien no hay evidencia que respalde la tromboprofilaxis regular en portadores asintomáticos de aPL, se recomienda controlar activamente otros factores de riesgo vascular modificables, promover el abandono del hábito de fumar y evitar terapias que contengan estrógenos. En situaciones que implican un aumento transitorio del riesgo trombótico, como hospitalización o inmovilidad prolongada, se recomienda la profilaxis con heparina a corto plazo.
Para las mujeres que son portadoras asintomáticas de aFL y no tienen complicaciones previas relacionadas con el embarazo, existe evidencia limitada. Sin embargo, varios grupos de consenso recomiendan una estrecha vigilancia y el uso de aspirina en dosis bajas (80-100 mg) durante el embarazo. En mujeres con LES coexistente, la administración de aspirina en dosis bajas también ayuda a reducir el riesgo de preeclampsia durante el embarazo.
Trombosis vascular
Para las personas que presentan aPL positivos persistentes junto con antecedentes de tromboembolismo no provocado, se considera imperativa la administración de una terapia anticoagulante de por vida. Por lo general, el régimen anticoagulante comienza con heparina y avanza hasta mantenimiento con warfarina. Se han realizado extensas investigaciones para determinar la intensidad óptima de la anticoagulación. Actualmente, el protocolo establecido para el tratamiento a largo plazo de la trombosis venosa en el SAF requiere el mantenimiento de un índice internacionalmente normalizado (INR) dentro del rango de 2-3. Esta recomendación surge de los hallazgos de dos ensayos controlados aleatorios, que no revelaron ninguna ventaja sustancial en el uso de INR de alta intensidad (INR > 3) en comparación con warfarina de baja intensidad (INR 2-3) en la prevención de la trombosis recurrente. El tratamiento óptimo para la trombosis arterial en el SAF sigue siendo un tema de debate debido a la baja tasa de recurrencia y el número limitado de eventos arteriales observados en estos ensayos.
Existe divergencia de opiniones entre los expertos sobre el enfoque de tratamiento óptimo. Algunos proponen la combinación de warfarina con un INR entre 2 y 3 junto con dosis bajas de aspirina, mientras que otros argumentan a favor de la terapia con warfarina con un objetivo de INR más alto que oscila entre 3 y 4. Es crucial tener en cuenta que como dosis objetivo de los anticoagulantes aumenta, también aumenta el riesgo de hemorragia.
Los anticoagulantes orales directos (ACOD) se han creado como sustitutos de los antagonistas de la vitamina K (AVK) en diferentes indicaciones. El estudio Rivaroxaban in Antifosfolípidos (RAPS) demostró que rivaroxaban, un inhibidor del factor Xa, es una alternativa segura a la warfarina para la prevención secundaria en el SAF trombótico venoso. Sin embargo, en la actualidad no existe evidencia que respalde la utilización de ACOD en el tratamiento de la trombosis arterial en el SAF.
En casos de trombosis persistente mientras se toma warfarina, se pueden considerar varias opciones. Estas opciones abarcan ajustar el objetivo de INR a un rango de 3-4 en caso de recurrencia mientras se mantiene entre 2 y 3. Otras estrategias pueden implicar la incorporación de aspirina en dosis bajas (o clopidogrel) al régimen o la transición a heparina de bajo peso molecular(HBPM). Además, los agentes complementarios que podrían contemplarse incluyen hidroxicloroquina, que ha mostrado propiedades tanto antiinflamatorias como antitrombóticas en casos de LES; estatinas, reconocidas por sus efectos antiinflamatorios en pequeñas cohortes de pacientes con SAF y su capacidad para reducir la incidencia de tromboembolismo venoso en estudios de población más grandes; y sirolimus/rapamicina, un inhibidor de mTOR que ha demostrado eficacia para mitigar la vasculopatía renal después de una nefropatía asociada a APS. Varios informes de casos y series han sugerido posibles beneficios del rituximab en casos de SAF refractario. En un estudio piloto descriptivo de fase IIa (RITAPS) abierto, rituximab demostró éxito en el manejo de ciertas manifestaciones que no cumplen con los criterios.
El embarazo
Se recomienda a las pacientes embarazadas con antecedentes de OAPS y sin trombosis previa que consideren aspirina en dosis bajas y HBPM. El nivel de evidencia que respalda este enfoque de tratamiento varía con respecto a los diferentes síntomas obstétricos asociados con aPL. Si bien algunos estudios respaldan la aspirina como terapia independiente, las revisiones sistemáticas acumulativas y los artículos de consenso abogan por una combinación de HBPM y aspirina. Existen alternativas limitadas a la aspirina basadas en evidencia y la heparina no logra garantizar un embarazo saludable a término. En casos de LES/SAF, se debe considerar la medicación simultánea para controlar la actividad de la enfermedad en consonancia con el embarazo, incluidos corticosteroides e hidroxicloroquina.
La warfarina no se prescribe a pacientes con SAF trombótico debido a sus posibles efectos teratogénicos sobre el feto durante el embarazo. Tras la confirmación del embarazo, las pacientes deben pasar a la heparina terapéutica. Se recomienda asesoramiento previo al embarazo para informar a las pacientes sobre los riesgos potenciales del embarazo y las intervenciones terapéuticas necesarias.
APS catastrófico
Esta rara condición se maneja con base en el conocimiento colectivo recopilado del registro Internacional Catastrófico APS (CAPS). Este enfoque sugerido incluye inmunoglobulina intravenosa (IGIV), anticoagulación, recambio plasmático, glucocorticoides intravenosos en dosis altas y ciclofosfamida, particularmente en el SAF asociado con enfermedades reumáticas autoinmunes. En los casos en que los pacientes no respondan al tratamiento estándar, se podría considerar el rituximab. Además, los estudios de casos han demostrado los beneficios potenciales del inhibidor del complemento eculizumab.
En el tratamiento del SAF, el enfoque para los pacientes con SAF positivo y su régimen de tratamiento es el siguiente : (a) Para personas con antecedentes de TEV previo pero que no reciben terapia anticoagulante, las opciones incluyen warfarina con un INR objetivo de 2 -3 o DOAC. (b) Si ha habido un episodio previo de TEV mientras estaba tomando anticoagulación, el curso de acción recomendado es el tratamiento con warfarina con un INR objetivo de 3-4. (c) Para las personas con antecedentes de ATE previa y sin tratamiento anticoagulante, existe opinión de expertos contradictoria. Sin embargo, un enfoque es administrar warfarina con un INR objetivo de 2-3 junto con aspirina en dosis bajas. (d) En casos de tromboembolismo arterial recurrente durante el tratamiento anticoagulante, el tratamiento preferido es la warfarina con un INR objetivo de 3-4. (e) Para personas que experimentan eventos trombóticos recurrentes, se puede recomendar una combinación de aspirina o clopidogrel en dosis bajas junto con warfarina.
Con respecto al manejo del embarazo en mujeres con aPL positivo y recomendaciones asociadas : (a) Para personas sin antecedentes de trombosis pero con resultados positivos para aPL, se recomienda un enfoque cauteloso que incluya un seguimiento regular junto con la administración de aspirina en dosis bajas. (b) En los casos de LES combinado con SAF, el tratamiento generalmente implica aspirina en dosis bajas junto con terapia con HBPM, con la posible adición de hidroxicloroquina, (c) A las personas con antecedentes de trombosis previa a menudo se les prescribe un régimen que consiste en dosis bajas de aspirina junto con una dosis terapéutica de HBPM. (d) Para las personas que experimentan abortos espontáneos tempranos recurrentes, comúnmente se recomienda un régimen de tratamiento que incluya aspirina en dosis bajas junto con una dosis profiláctica de HBPM. (e) En casos de pérdida fetal tardía, preeclampsia grave o restricción del crecimiento intrauterino (RCIU) previa, un enfoque terapéutico puede implicar la administración de aspirina en dosis bajas junto con la terapia con HBPM.
Las posibles terapias complementarias : (a) Las estatinas se han mostrado prometedoras en el tratamiento del tromboembolismo recurrente incluso en casos en los que la terapia anticoagulante está en curso, lo que sugiere su utilidad potencial como tratamiento complementario. (b) El eculizumab, que funciona como inhibidor de C5, ha llamado la atención por su eficacia en la prevención de la microangiopatía trombótica asociada al SAF después de un trasplante renal y en el tratamiento del SAF recurrente, como lo indican los informes de casos. (c) Sirolimus/rapamicina actúa inhibiendo la activación de las células B y T mediante la inhibición de mTOR. En receptores de trasplante renal, la administración de sirolimus se ha asociado con la ausencia de recurrencia de la nefropatía del SAF y una reducción de la proliferación vascular. (d) El autotrasplante de células madre, si bien se muestra prometedor en el tratamiento temprano del LES y el SAF, va acompañado de tasas de eventos adversos que merecen consideración, según los estudios iniciales.
Pronóstico del SAF
Los resultados del seguimiento de 10 años del proyecto Eurofosfolípidos revelaron una tasa de retrombosis del 15,3% en pacientes que reciben tratamiento convencional para el SAF. Si bien la TVP se destacó como el evento trombótico inicial más frecuente, la aparición de eventos trombóticos arteriales aumentó a lo largo del curso de la enfermedad. La pérdida prematura del embarazo surgió como la complicación obstétrica predominante y afectó al 16,5% de las pacientes. Aunque el 72,9% de los embarazos concluyeron con el parto de uno o más recién nacidos vivos, persistió un grado notable de morbilidad fetal, ya que el 48,2% de los recién nacidos nacieron prematuros. Durante un período de 10 años, falleció un total del 9,3% de los pacientes, y la mayoría de las muertes se atribuyeron a incidentes trombóticos graves (36,5% infarto de miocardio, accidentes cerebrovasculares y EP, y 10,7% por hemorragias).
Para prevenir o reducir los resultados adversos del SAF, es esencial implementar estrategias específicas como el diagnóstico temprano, la terapia anticoagulante agresiva y el seguimiento regular de los pacientes. También son cruciales las medidas profilácticas durante períodos de alto riesgo, como el embarazo, y la educación del paciente sobre el cumplimiento de los protocolos de tratamiento.
El futuro de la investigación de SAF tiene como objetivo mejorar la comprensión de la fisiopatología de la enfermedad y mejorar los resultados de los pacientes. El conocimiento actual incluye la identificación de los aPL y su papel en la trombosis, pero se necesita más investigación para dilucidar los mecanismos detrás de la persistencia y variabilidad de los aPL en las manifestaciones clínicas. Para lograrlo, son necesarios esfuerzos colaborativos de investigación internacional, estudios longitudinales y análisis genómicos y proteómicos avanzados. Estos enfoques ayudarán a desarrollar tratamientos más eficaces y estrategias de manejo personalizadas para los pacientes con APS.
Conclusiones
El SAF representa una afección protrombótica caracterizada por diversos síntomas, principalmente venosos y arteriales (ATE), junto con pérdidas recurrentes del embarazo. La variedad de presentaciones clínicas y la variabilidad de los anticuerpos cruciales para el diagnóstico del SAF han planteado desafíos en el estudio de esta afección y han provocado debates sobre los tratamientos más efectivos. Los individuos con aPL consistentemente positivo, en particular aquellos que exhiben triple positividad, enfrentan un mayor riesgo de trombosis y aquellos que experimentan eventos trombóticos recurrentes a pesar de la terapia antitrombótica también tienen un riesgo elevado.
Este diagrama presenta un método que incorpora ensayos de fase sólida y líquida para la evaluación de posibles casos de APS. Enfatiza la necesidad de procedimientos de prueba integrales, repetición de las pruebas para confirmar resultados persistentes y la necesidad de descartar falsos positivos transitorios o relacionados con infecciones. Este enfoque garantiza una evaluación exhaustiva de la presencia de APS.