Ronald Palacios Castrillo
El síndrome de persona rígida ha llamado la atención e interés de las personas desde que la reconocida cantante Celine Dion fué diagnosticada con esta enfermedad. Aquí comentamos sobre un novedoso tratamiento para esta enfermedad,que aunque carísimo,ha sido exitoso parcialmente en un paciente refractario a todo tipo de tratamiento.
Resumen
El tratamiento con células T autólogas del receptor de antígeno quimérico (CAR-T) se ha convertido en un enfoque muy eficaz en trastornos neuroinmunológicos como la miastenia gravis. Presentamos un caso de uso exitoso de células CAR-T anti-CD19 en el síndrome de persona rígida (SPS) refractario al tratamiento.
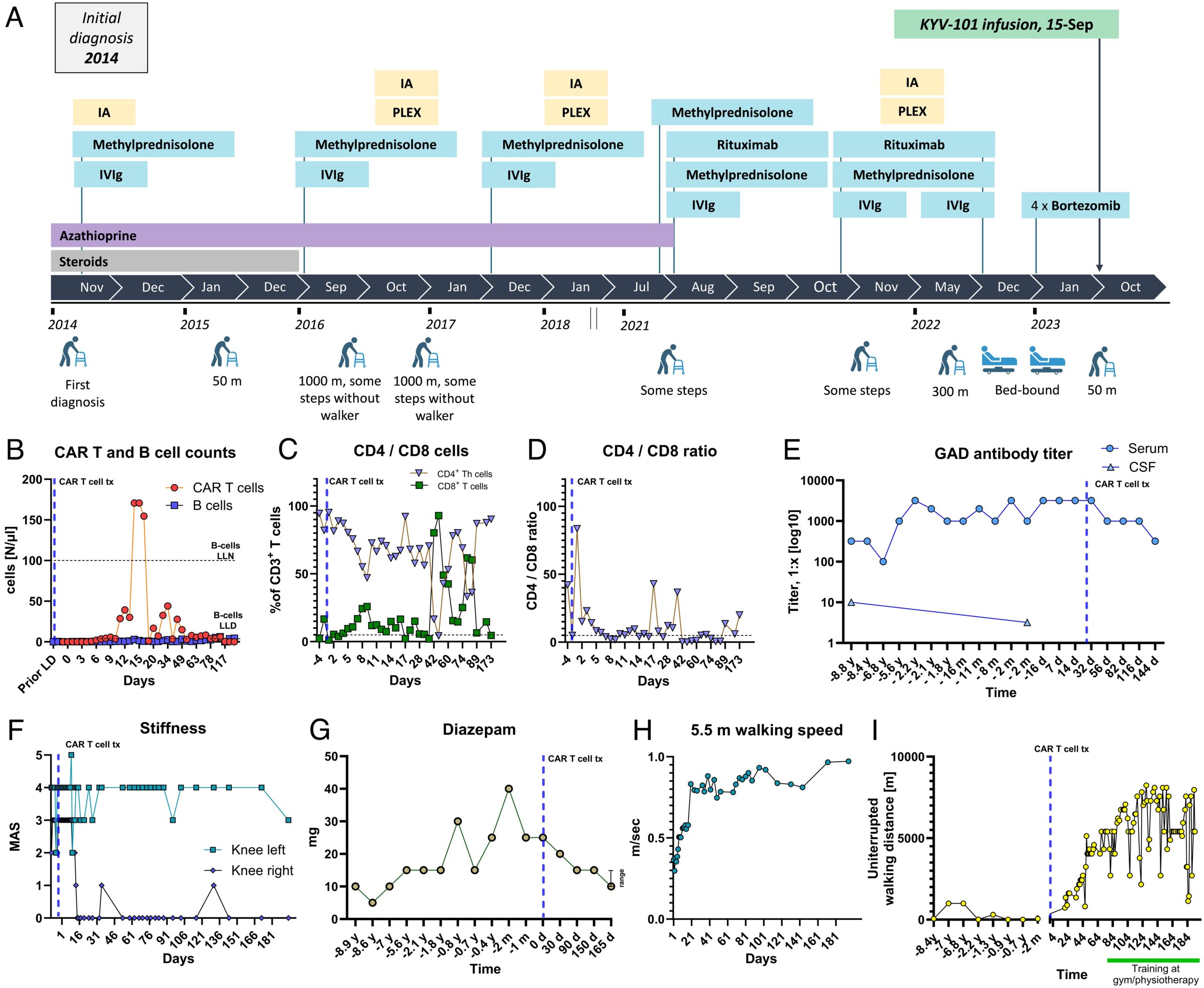
Para investigar los efectos clínicos e inmunológicos del uso de células CAR-T anti-CD19 en SPS refractario al tratamiento, Faisner,et.,al.,(PNAS.https://doi.org/10.1073/pnas.2403227121) trataron una mujer de 69 años con antecedentes de 9 años de SPS refractario al tratamiento con episodios de rigidez en deterioro quién recibió una infusión de Células CAR-T anti- CD19 (KYV-101) autólogas y se monitoreó clínica e inmunológicamente durante más de 6 meses.
=> Recibir por Whatsapp las noticias destacadas
La infusión de células CAR-T dio como resultado una reducción de la rigidez de las piernas, una mejora drástica en la marcha, un aumento de la velocidad de marcha de más del 100 % y una mejora de la distancia de caminata diaria de menos de 50 m a más de 6 km en 3 meses.
La medicación GABAérgica (benzodiazepinas) se redujo en un 40%. Las células CAR-T KYV-101 fueron bien toleradas con efecto secundario síndrome de liberación de citoquinas de bajo grado. Este informe sobre el uso exitoso de células CAR-T anti-CD19 en SPS refractario al tratamiento respalda la exploración continua de este enfoque en SPS y otros trastornos autoinmunes relacionados con células B.
En Detalle
El síndrome de la persona rígida (SPS) se caracteriza por rigidez progresiva y espasmos musculares, que suelen afectar a los músculos axiales y de las extremidades.
El SPS se puede clasificar en SPS clásico o variantes como SPS focal o segmentario, entre otros . En la mayoría de los pacientes, se pueden detectar anticuerpos contra la amphyphysin o la descarboxilasa del ácido glutámico (GAD).
Se cree que la inmunopatología antineuronal, incluidos los autoanticuerpos y los mecanismos celulares que se dirigen específicamente
a las vías inhibidoras GABAérgicas y a la maquinaria de señalización sináptica, contribuye a la patogénesis. El SPS asociado con anticuerpos contra la Amphyphysina también suele ir acompañado de la aparición de enfermedades neoplásicas.
Los enfoques de tratamiento dirigidos a mecanismos patogénicos impulsados por células B, como el recambio plasmático, la inmunoglobulina intravenosa, los enfoques dirigidos contra CD20 o los inmunosupresores, han tenido un éxito variable.
Las células T con receptor de antígeno quimérico (CAR-T) anti-CD19 se desarrollaron originalmente para el tratamiento de neoplasias malignas hematológicas de células B y recientemente han surgido como un enfoque prometedor para los trastornos autoinmunes.
Este informe se suma a la experiencia clínica emergente sobre el uso de células T CAR-T anti-CD19 en trastornos neuroinmunológicos que afectan el sistema nervioso central (SNC) .
Faisner,et.,al.,(PNAS.https://doi.org/10.1073/pnas.2403227121) ,describen un caso de uso exitoso de células CAR-T anti-CD19 en SPS refractario al tratamiento.
La terapia dirigida a células B con células CAR-T anti-CD19 ha surgido recientemente como un enfoque prometedor para el tratamiento de una variedad de trastornos autoinmunes. La eficacia se demostró por primera vez en cinco pacientes con lupus eritematoso sistémico con remisión continua sin fármacos después de una mediana de seguimiento de 8 meses. Además, en pacientes con síndrome antisintetasa, esclerosis sistémica (Esclerodermia) y miastenia gravis (MG) , se observó una eficacia sólida.
Estos hallazgos se suman al informe reciente sobre los efectos positivos de los enfoques de células con CAR-T en un estudio de fase 1b/2a no aleatorizado en MG que evalúa el impacto de las células T transducidas con RNA (rCAR-T) dirigidas al antígeno de maduración de células B (BCMA).
Si bien se reconoce que la cuantificación de los anticuerpos anti-receptor de acetilcolina y los anticuerpos anti-GAD65 utiliza metodologías diferentes, los títulos anti-GAD65 disminuyeron en 56 días de 1:3200 a 1:1000, y a 1:320 después de 5 meses, con una dinámica similar a la reportado en MG para anticuerpos anti-receptor de acetilcolina.
La evaluación de los cambios de los anticuerpos anti-GAD65 en el LCR podría haber sido más informativa y debería considerarse en ensayos clínicos.
Estos hallazgos demuestran que los plasmablastos que expresan CD19 y las células plasmáticas de vida corta son susceptibles al agotamiento por las células CAR-T anti-CD19.
La reducción de los títulos anti-GAD65 puede haber contribuido a la mejoría clínica observada, aunque todavía se debate el papel patogénico directo de estos autoanticuerpos en el SPS.
La presencia recientemente informada de células con CAR-T anti-CD19 KYV-101 en el LCR de pacientes con esclerosis múltiple y el impacto asociado en las bandas oligoclonales puede haber contribuido a la mejora de la enfermedad SPS dado el papel demostrado de las células B clonales específicas anti-GAD activadas en el SNC y la consiguiente síntesis intratecal de autoanticuerpos anti-GAD.
Esto también puede haber contribuido a una reducción de células T, potencialmente implicado en la autoinmunidad dirigida hacia GAD65.
Hasta ahora, no está claro cómo el tratamiento con células CAR-T anti-CD9podría afectar la repoblación de células B o el nicho de células plasmáticas de larga vida CD19neg.
La hipótesis es que el agotamiento profundo de las células B podría favorecer la repoblación de un fenotipo de células B nuevas/vírgenes, lo que debería investigarse en estudios adicionales.
El paciente aquí reportado mostró sólo una modesta mejoría de la rigidez, probablemente debido al curso prolongado de la enfermedad.
La autopsia de un paciente con SPS anti-GAD65 grave con un curso de la enfermedad de >18 meses, que no responde a múltiples inmunoterapias, documentó degeneración espinal debido a la pérdida neuronal asociada con la microgliosis, lo que puede explicar la rigidez residual en este caso.
Además, la rigidez se evaluó mediante la MAS para documentar cambios potencialmente sutiles. Dada su validación y su uso precedente en ensayos clínicos, futuros ensayos clínicos deberían considerar el uso del índice de rigidez.
Para abordar esta posible limitación, en los ensayos clínicos, la evaluación clínica de los pacientes podría complementarse con la adición de una evaluación electrofisiológica del grado de inhibición recíproca .
Es importante destacar que, de acuerdo con la experiencia emergente sobre el uso de células CAR-T anti-CD19 para el tratamiento de enfermedades autoinmunes, incluida la MG, no hay señales de seguridad graves como CRS grado ≥ 3 o síndrome de neurotoxicidad asociado a células efectoras inmunes.
La tolerabilidad aceptable de KYV-101 puede estar relacionada con el nivel más bajo de citocinas que se producen en respuesta a la activación del CAR-T totalmente de origen humano, lo que se tradujo en una reducción de 10 veces de los eventos neurotóxicos graves en pacientes con linfoma de células B.
El seguimiento de 6 meses del paciente aquí presentado aún es limitado. Un seguimiento adicional, como se informó recientemente para una serie de 15 pacientes de reumatología autoinmune tratados con células CAR-T anti-CD19 , ayudará a evaluar el potencial en enfermedades neuroinmunológicas.
Estos resultados proporcionan evidencia adicional que respalda la evaluación adicional a través de ensayos clínicos controlados del uso de células CAR-T anti-CD19 como un enfoque terapéutico potencialmente eficaz en los trastornos neuroinmunológicos refractarios a tratamientos convencionales relacionados con las células B .