Aspectos destacados
Un ensayo aleatorizado de fase III de Vacunas BCG para la COVID-19 y la protección contra infecciones
Ensayo realizado en Estados Unidos en la última fase de la pandemia en diabéticos tipo 1 vulnerables a infecciones
=> Recibir por Whatsapp las noticias destacadas
Las vacunas BCG brindan protección contra enfermedades infecciosas, incluida la COVID-19
Las vacunas de mRNA comerciales en diabéticos tipo 1 no protegen contra COVID-19
Resumen
La vacuna de Bacillus Calmette-Guérin tiene muchos beneficios además de la protección contra la tuberculosis miliar , incluida la protección contra diversas enfermedades infecciosas. A medida que el SARS-CoV-2 evolucionó, la enfermedad por COVID-19 se volvió más transmisible y menos letal. En este ensayo de fase III, doble ciego y controlado con placebo, realizado en la última fase de la pandemia, Kühtreiber,et.al. [https://doi.org/10.1016/ j.isci.2024.109881 ] evaluaron si la BCG multidosis protegía contra la COVID-19 y otras enfermedades infecciosas, resultados coprincipales. Desde abril de 2021 hasta noviembre de 2022, las vacunas BCG de la cepa Tokio brindaron una protección significativa contra la enfermedad COVID-19 (p = 0,023) y una fuerte protección de la plataforma contra todas las enfermedades infecciosas (p < 0,0001). A lo largo del estudio, se lanzaron vacunas comerciales contra la COVID-19, la mayoría de las cuales estaban basadas en mRNA. A diferencia de la protección brindada por la BCG, tal como informaron otros previamente, la vacuna de mRNA contra la COVID-19 por sí sola no brindó protección contra la enfermedad COVID-19 (p = 0,43). La eficacia de la vacunación con BCG no se vio afectada por las vacunaciones concurrentes contra la COVID-19; las vacunas contra la COVID-19 no ayudaron ni obstaculizaron la protección con BCG.
En Detalle
Los ensayos clínicos y las investigaciones epidemiológicas realizadas durante la última década han demostrado que la vacuna contra el bacilo de Calmette-Guérin (BCG), desarrollada originalmente para la protección contra la tuberculosis, parece tener amplios beneficios fuera del objetivo en forma de protección contra enfermedades infecciosas de plataforma.
La vacuna BCG, una versión viva atenuada de la micobacteria que causa la tuberculosis en el ganado (Mycobacterium bovis), confiere protección duradera. Cuando se administra a neonatos, puede proteger contra la tuberculosis sobre todo la forma miliar, durante más de 40 años y puede beneficiar el metabolismo de la glucosa durante más de 70 años.
Aclamada como la vacuna más segura en uso continuo a nivel mundial, la vacuna BCG está designada como medicamento esencial por la Organización Mundial de la Salud.
Las vacunas de mRNA desarrolladas para la COVID-19 tienen limitaciones debido a su limitada eficacia contra variantes virales específicas, así como a la poca o ninguna protección contra la infección.
A medida que se desarrollaba la pandemia del SARS-CoV-2, una profusión de investigaciones internacionales buscaron probar si la BCG podía proteger contra el desarrollo de la COVID-19. Cinco ensayos aleatorios mostraron eficaci mientras que siete ensayos aleatorios no mostraron eficacia.
Además, al observar el punto final de la muerte después de las infecciones por COVID-19, un análisis post-hoc de ocho de los ensayos clínicos recientes encontró que los grupos de BCG tuvieron una mortalidad estadísticamente significativamente menor que los controles que recibieron placebo.
Es importante señalar las diferencias en los diseños de estos ensayos.
Todos los ensayos clínicos que no mostraron ningún beneficio tenían una o más características que podrían haber disminuido la probabilidad de encontrar un efecto de la BCG: el ensayo inscribió a sujetos que habían recibido previamente la vacuna BCG neonatal o exposición previa a la tuberculosis (TB), todo lo cual confiere protección a largo plazo; los ensayos utilizaron cepas menos potentes de BCG; los ensayos utilizaron una dosis única de BCG, en lugar de los beneficios de múltiples dosis; o el ensayo tuvo un tiempo de seguimiento insuficiente desde la fecha de
vacunación hasta los datos de exposición a la infección y, por lo tanto, no pudo capturar la eficacia de la BCG (es decir, el ensayo duró semanas o meses en lugar de los dos o más años necesarios para muchos efectos no deseados). Cuando la vacuna BCG se utilizó con éxito contra enfermedades autoinmunes en adultos (sin BCG previa) en Europa y los EE. UU., la eficacia total no se alcanzó hasta al menos dos años. El desfase temporal puede deberse al posible mecanismo de acción de la BCG, que implica el restablecimiento epigenético lento de varios años de genes críticos en el sistema inmunológico innato y adaptativo humano adulto, al menos en adultos.
Recientemente, Kühtreiber,et.al.[ https://doi.org/10.1016/ j.isci.2024.109881] informan sobre el segundo de dos ensayos de protección con dosis múltiples de BCG contra la COVID-19 en una población estadounidense de diabéticos tipo 1 vulnerables a la infección. El ensayo de fase II anterior se realizó al principio de la pandemia estadounidense.
Estudiar una población estadounidense tiene múltiples ventajas: no ha sido vacunada con BCG neonatal; tiene bajas tasas de tuberculosis endémica; y es altamente vulnerable a las enfermedades infecciosas en general y a la COVID-19 en particular.
En su estudio anterior sobre BCG, un ensayo de fase II de RCT, excluyeron a los pacientes con antecedentes de exposición a la tuberculosis y con antecedentes de vacunación neonatal con BCG.
Las mismas exclusiones se aplican al ensayo de fase III actual realizado al final de la pandemia estadounidense, también una evaluación aleatorizada, doble ciego y controlada con placebo. Si bien la población de pacientes y las medidas de resultados son similares en los dos ensayos, hay tres diferencias clave: períodos de estudio consecutivos y no superpuestos con diferentes variantes circulantes del SARS-CoV-2 (pandemia temprana versus tardía); diferentes diagnósticos (perfiles de anticuerpos versus diagnósticos estándar de atención); y diferente
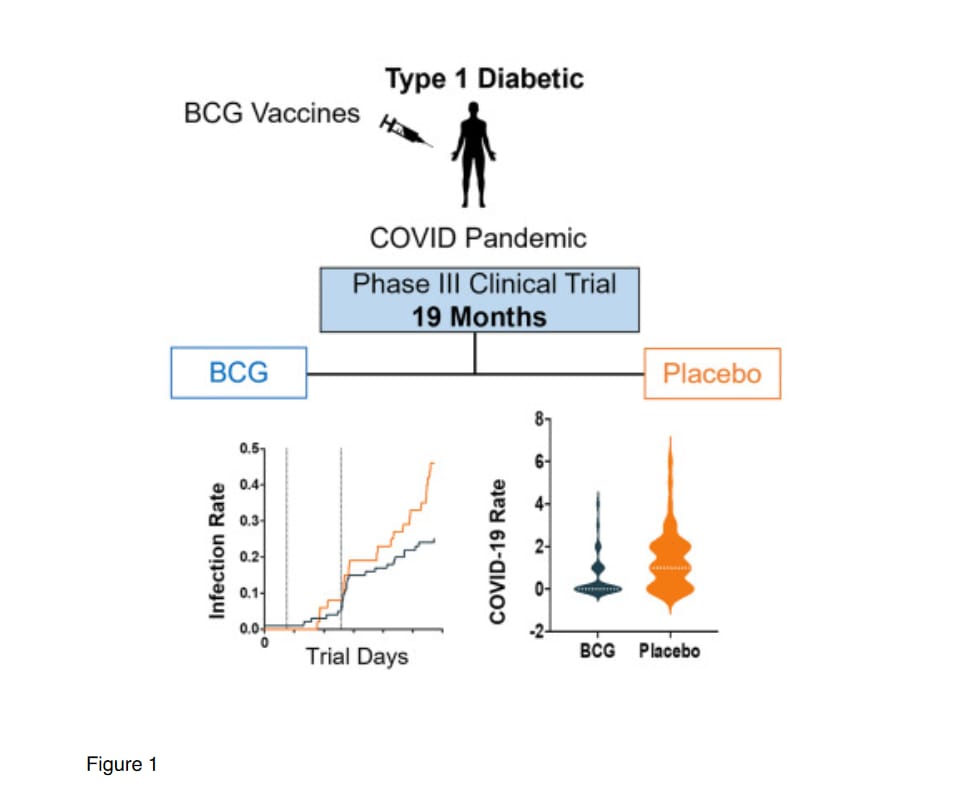
disponibilidad de vacunas comerciales contra la COVID-19 en los EE. UU. (ninguna versus múltiples vacunas .(Figuras 1).
El ensayo clínico de fase III actual comenzó el 1 de abril de 2021 y continuó durante 19 meses hasta casi el final de la emergencia de salud pública por COVID-19 en los Estados Unidos el 11 de mayo de 2023, según lo definido por los Centros para el Control y la Prevención de Enfermedades de EE. UU. Los resultados coprincipales fueron la protección de la vacuna BCG contra la enfermedad por COVID-19 y otras enfermedades infecciosas.
Se llevó a cabo un ensayo de fase III aleatorizado, doble ciego y controlado con placebo en los Estados Unidos durante un período de 19 meses para probar si la BCG intradérmica de dosis múltiples ofrecía protección contra la enfermedad por COVID-19 y protección contra la enfermedad infecciosa en general, los resultados coprincipales (Figura 1). La aleatorización fue de 2:1 y dos sujetos recibieron BCG por cada sujeto placebo inscrito (Figura 1). El ensayo de fase III se llevó a cabo a fines de la pandemia de COVID-19 durante el predominio secuencial de las
variantes Beta, Gamma, Delta y Omicron. En comparación con la cepa original del SARS-CoV-2, estas variantes posteriores son más transmisibles y, en algunos casos, menos virulentas.
Durante este ensayo, la distribución en EE. UU. de las vacunas comerciales contra la COVID-19 se desarrolló de manera gradual y consistió principalmente en vacunas de mRNA. Por lo tanto, evaluaron la eficacia de las vacunas contra la COVID-19 con y sin vacunación concurrente con BCG como un estudio observacional.
Resultados
Las características basales de los sujetos diabéticos tipo 1 fueron similares en los grupos de BCG (n = 93) y placebo (n = 48) . Los participantes eran hombres y mujeres adultos con distribuciones de sexo similares en el grupo de BCG (43 % mujeres y 57,0 % hombres) y el grupo de placebo (39,6 % mujeres y 60,4 % hombres). To dos los participantes eran ciudadanos estadounidenses y, en el momento de la inscripción original, dieron negativo para vacunas BCG anteriores y dieron negativo para tuberculosis, como se confirmó con una prueba de tuberculosis QuantiFERON Gold negativa.
La tasa de retención fue excelente, ya que el 100 % de los sujetos (n = 141) completaron el ensayo de fase III de 19 meses de duración. Al inicio de este ensayo clínico de fase III, todos los sujetos habían sido aleatorizados y vacunados con 6 vacunas BCG o placebo (70 % de los sujetos) o vacunados con 5 vacunas BCG o placebo (30 %) (Figura 1). El número promedio de días hasta la sexta y última vacuna fue de 124 ± 16 días. El ensayo utilizó la cepa Tokyo-174 de BCG. La mediana de edad al inicio de la diabetes para todos los sujetos fue de 26,2 ± 1 año, y la duración promedio de la diabetes tipo 1 fue de 17,9 años .
BCG protege contra la enfermedad COVID-19, un resultado coprimario.
Se identificaron sujetos con enfermedad COVID-19 confirmada durante los 19 meses de observaciones. Se determinó que los sujetos tenían un caso confirmado de enfermedad por COVID-19 cuando se cumplían todas las siguientes condiciones: informar al menos un síntoma de COVID-19 (según lo definido en el documento de Pautas para la industria de la FDA); al menos un día de enfermedad; y dar positivo en una prueba en el punto de atención para la infección por COVID-19 utilizando ensayos comerciales (PCR o prueba rápida de antígenos).
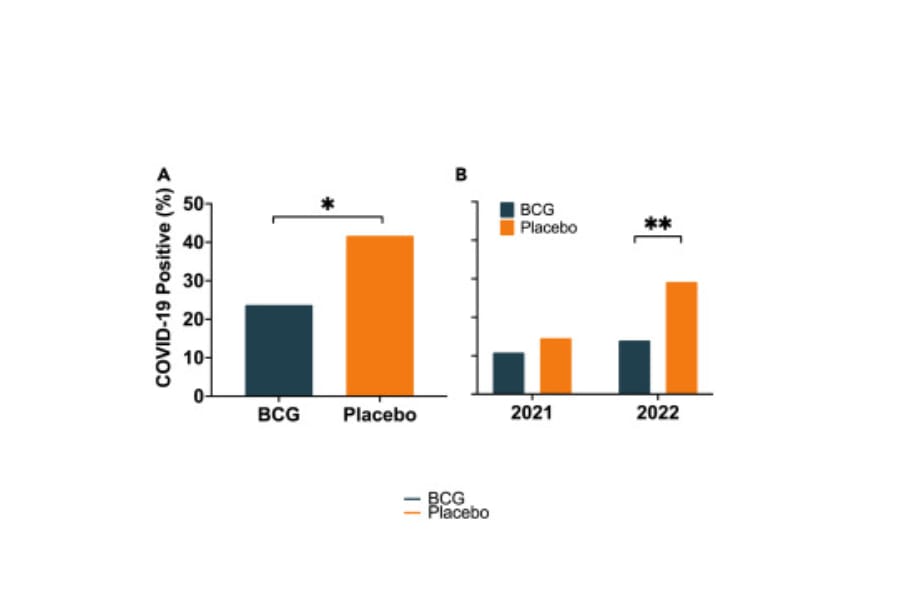
Durante los 19 meses de este ensayo clínico, la enfermedad por COVID-19 se presentó en 22 de los 93 participantes del grupo BCG (23,7 %) y en 20 de los 48 participantes del grupo placebo (41,7 %) (Figura 2). Una prueba exacta de Fisher de una cola fue significativa en p = 0,023, lo que demuestra que múltiples vacunas BCG protegieron a los sujetos diabéticos tipo 1. La eficacia de la vacuna BCG frente al placebo, según la fórmula de la sección Métodos STAR, fue del 43,2 %.
También estratificamos la protección de la BCG contra la enfermedad COVID-19 según el año calendario (2021 y 2022) ( Figura -B). Para 2021, hubo 10 de 93 sujetos únicos confirmados como positivos para COVID-19 en el grupo BCG (10,8%) y 7 de 48 (14,6%) en el grupo placebo. La eficacia de la vacuna BCG fue del 26,3%, pero la diferencia entre los grupos no fue significativa (prueba exacta de Fisher de una cola p = 0,342). Para 2022, hubo 13 de 93 sujetos confirmados como positivos para COVID-19 en el grupo BCG (14,0%) y 14 de 48 (29,2%) en el grupo placebo. La eficacia de la vacuna BCG fue del 52,1% y la diferencia fue significativa (prueba exacta de Fisher de una cola p = 0,015). Por lo tanto, durante el predominio de Ómicron, la variante más transmisible del SARS-CoV-2, las vacunas BCG brindaron más protección que el placebo.
Este es el segundo ensayo en EE. UU. sobre la eficacia de la BCG en la población diabética tipo 1 en relación con la protección contra enfermedades infecciosas y la protección contra la COVID-19. Aunque se trataron de dos ensayos separados con protocolos de ensayo clínico separados, consentimientos separados, datos separados y comité de monitoreo de seguridad (DSMB), períodos de tiempo separados con diferentes exposiciones a variantes genéticas de la COVID-19 y con diferentes resultados primarios, ambos ensayos utilizaron los mismos sujetos diabéticos tipo 1 aleatorizados que residían en los Estados Unidos. En laFigura 3 se presenta una cronología acumulada de eventos de COVID-19 en los dos ensayos. El ensayo de fase II (de enero de 2020 a abril de 2021) abarcó 15 meses, con una eficacia de la BCG del 92 % (p = 0,004) (Figura 3 A). El ensayo de fase III actual (abril de 2021 – noviembre de 2022) muestra una eficacia de BCG del 43,2 % (p = 0,023) (Figura 3B). En esta fase, el grupo placebo acumuló más eventos de COVID-19 y a un ritmo más rápido durante la última parte del ensayo (Figura 3B). Hubo un claro aumento de eventos acumulados durante el predominio de ómicron, presumiblemente correspondiente a su mayor transmisibilidad en comparación con las variantes anteriores.La diferencia estadística entre los grupos BCG y placebo persistió (p = 0,023) (Figura 3B). Durante los 34 meses completos de la pandemia de COVID-19 en EE. UU., BCG muestra una eficacia del 54,3 % (p = 0,0007) (Figura 3C).
La BCG protege contra enfermedades infecciosas, el resultado coprincipal.
Analizamos todos los eventos de enfermedades infecciosas recopilados como eventos adversos según la codificación de clasificación MedDRA . Para este ensayo clínico, las enfermedades infecciosas observadas incluyeron eventos virales, bacterianos y fúngicos, así como la propia enfermedad COVID-19. La BCG proporciona una amplia protección contra las enfermedades infecciosas según la literatura mundial, y los autores demostraron previamente que este es el caso de los sujetos diabéticos tipo 1 durante el ensayo de fase II.
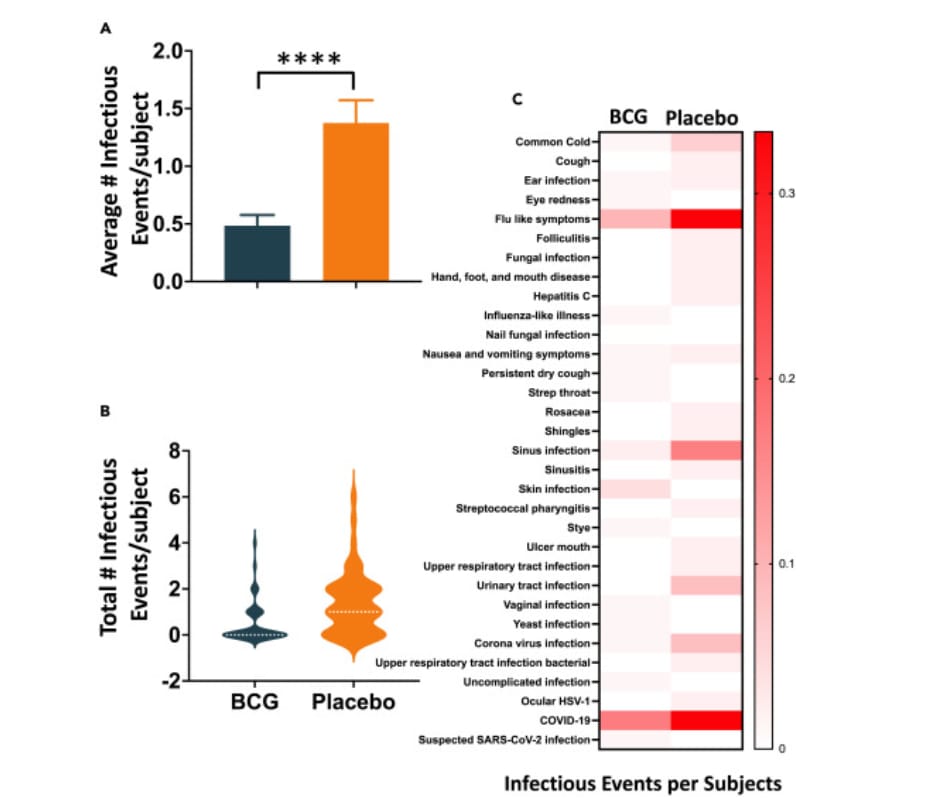
Por lo tanto, estudiaron si las vacunas BCG en este período de ensayo de fase III de 19 meses continuaron mostrando una amplia protección después de la introducción de las vacunas comerciales COVID-19 a fines de la pandemia en EE. UU. En el grupo BCG hubo 44 eventos infecciosos, mientras que hubo 66 en el grupo placebo. El número promedio de infecciones por sujeto fue menor en el grupo BCG que en el grupo placebo, y las estadísticas de Poisson indicaron una diferencia significativa en p
< 0,0001. Un gráfico de violín muestra que más sujetos del grupo placebo tuvieron muchos más eventos infecciosos en comparación con los sujetos del grupo BCG (Figura 4B). Teniendo en cuenta la diferencia en el número de sujetos en los grupos BCG (n = 93) y placebo (n = 48) con la aleatorización 2:1, el mapa de calor muestra un desglose de los diversos eventos infecciosos por sujeto (Figura 4C). Los tonos más oscuros de rojo para muchas de las infecciones indican una tasa de infección más alta en el grupo placebo que en el grupo BCG. En conjunto, estos resultados indican que los sujetos tratados con BCG tienen menos eventos infecciosos en comparación con los sujetos tratados con placebo.
También ,analizaron la acumulación de eventos infecciosos a lo largo del tiempo durante los 34 meses completos de los ensayos clínicos aleatorizados doble ciego de fase II y fase III, un período que abarca casi toda la pandemia de COVID-19 en los Estados Unidos. El diagrama de consorcios coloca el ensayo de fase II
anterior y el ensayo de fase III actual en una línea de tiempo de variantes dominantes del SARS-CoV-2 (Figura 5A). Para tener en cuenta los diferentes tamaños de los grupos de BCG y placebo (BCG n = 93; Placebo n = 48), estudiaron la tasa acumulada de eventos infecciosos por sujeto. Para el ensayo clínico de fase III actual, los datos demuestran que los sujetos del grupo placebo acumulan enfermedades infecciosas a un ritmo más rápido en comparación con el grupo de BCG (Figura 5B). Los eventos de enfermedades infecciosas totales combinados en los ensayos clínicos de fase II y fase III (34 meses) muestran claramente que los sujetos tratados con BCG tienen una tasa de infección más baja durante todo el período en comparación con los sujetos tratados con placebo (Figura 5C; estadística de Poisson p < 0,0001).
Según la fecha de inicio de cada evento, se calculó el número de días desde el inicio del ensayo de Fase II o del ensayo de Fase III actual para cada Evento Infeccioso en los grupos BCG vs. placebo por separado. El número de sujetos en el grupo BCG y el grupo placebo fue diferente (Fase II, BCG n = 96 y Placebo n = 48; Fase III, BCG n = 93; Placebo n = 48). Por lo tanto, los datos se normalizaron en relación con el tamaño del grupo expresando el número acumulado de eventos infecciosos como una tasa por sujeto. Luego, la Tasa de Eventos Acumulativos por Sujeto se representó en un gráfico de pasos contra el tiempo transcurrido en días. Para obtener una lista de los tipos de Eventos Infecciosos observados y el número total de infecciones por sujeto, consulte la Figura 4B.
. Tenga en cuenta que esto incluye, entre otros, los eventos de COVID-19. (A) El diagrama de consorcio muestra la cronología de los ensayos de fase II y fase III de BCG en sujetos diabéticos tipo 1, en relación con la variante dominante del SARS-CoV-2.
- Tasa acumulada de eventos infecciosos por sujeto durante el ensayo de fase III (del 1 de abril de 2021 al 3 de noviembre de 2022). El grupo placebo experimentó una tasa mucho mayor de eventos infecciosos por sujeto en comparación con el grupo de BCG. Las líneas verticales de puntos delinean los períodos aproximados de predominio de las variantes del SARS-CoV-2 en los Estados Unidos. (Estadísticas de Poisson p < 0,0001).
- Períodos de ensayo de fase II y fase III combinados. Las variantes dominantes están delineadas por líneas verticales de (Estadísticas de Poisson p < 0,0001). También realizaron una estadística de riesgos proporcionales de Andersen-Gill Cox sobre estos datos para ver el impacto positivo o negativo de las vacunas contra la COVID-19 en los efectos protectores de BCG. Con los días calendario de vacunación contra la COVID-19 como variable, demostraron que no hubo beneficios ni daños significativos de las vacunas contra la COVID-19 en la prevención general de enfermedades infecciosas con BCG (p = 0,253).
(C) Períodos de ensayo de fase II y fase III combinados. Las variantes dominantes están delineadas por líneas verticales de puntos. (Estadísticas de Poisson p < 0,0001). Las estadísticas de riesgo proporcional de Andersen-Gill Cox con los días calendario de vacunación contra la COVID-19 como variable tampoco fueron significativas (p = 0,154).
También realizaron las estadísticas de riesgo proporcional de Andersen-Gill Cox para evaluar si el tiempo que los sujetos fueron vacunados con las vacunas contra la COVID-19 tuvo un efecto (beneficioso o perjudicial) en las tasas generales de enfermedades infecciosas. Esto se hizo incluyendo el número de días calendario de vacunación contra la COVID-19 como parámetro. Utilizando datos de enfermedades infecciosas tanto para los ensayos clínicos de fase II como de fase III, el valor p resultante no fue significativo (p = 0,154). El índice de riesgo fue de 0,998 (IC del 95 %: 0,995-1,001). Concluyen que el tiempo que un sujeto recibe tratamiento con vacunas contra la COVID-19 no desempeña un papel beneficioso ni perjudicial en la prevención de infecciones que ofrece la BCG.
Las vacunas mRNA contra la COVID-19 no ofrecen protección a los diabéticos tipo 1 contra la enfermedad de la COVID-19
Aunque no es un resultado primario de este ensayo clínico de fase III, era importante evaluar el impacto de las vacunas comerciales contra la COVID-19 para los diabéticos tipo 1 en ausencia o presencia de la vacuna BCG. Durante este ensayo, se produjo la implementación de las vacunas comerciales, predominantemente de mRNA. Primero, cuantificaron la eficacia de las vacunas comerciales contra la COVID-19 en ausencia de la vacuna BCG como un resultado observacional (Figura 6). Los receptores de placebo (no vacunados con BCG) se dividieron en cohortes vacunadas contra la COVID-19 y nunca vacunadas contra la COVID-19. Se tabuló el número de sujetos en cada grupo con enfermedad de la COVID-19. Al igual que en el estudio general, se consideró que un sujeto tenía la enfermedad de COVID-19 cuando presentaba uno o más síntomas de COVID-19 según la definición de la FDA,con una duración de la enfermedad de al menos un día, así como una prueba positiva de COVID-19 en el punto de atención mediante PCR o prueba rápida de antígenos.
De un total de 48 sujetos placebo, 39 recibieron vacunas comerciales contra la COVID-19 y 9 nunca recibieron vacunas contra la COVID-19. En la cohorte tratada con la vacuna contra la COVID-19, 17 (43,6 %) tenían COVID-19, mientras que en la cohorte nunca vacunada contra la COVID-19, 3 (33,3 %) tenían COVID-19 (Figura 6A). Si bien el porcentaje de positivos para COVID-19 en el grupo nunca vacunado tendió a ser menor, la diferencia no fue estadísticamente significativa (prueba exacta de Fisher unilateral p = 0,43).
Dado que diferentes variantes del SARS-CoV-2 fueron dominantes durante 2021 (Beta, Gamma y Delta) en comparación con 2022 (principalmente Ómicron) y las vacunas comerciales contra la COVID-19 tienen una duración de eficacia corta y una eficacia diferente según la variante, también analizamos el período de tiempo aproximado de dos años como años separados Figura 6B). No se alcanzó significación estadística en ninguno de los años. En 2021, el 12,8% de los sujetos vacunados contra la COVID-19 dieron positivo a la COVID-19 frente al 22,2% de los sujetos que nunca se habían vacunado contra la COVID-19. La prueba exacta de Fisher de una cola no mostró ninguna diferencia significativa, p = 0,39. En 2022, el 30,8% de los sujetos vacunados contra la COVID-19 dieron positivo a la COVID-19 frente al 22,2% de los sujetos que nunca se habían vacunado contra la COVID-19. La prueba exacta de Fisher de una cola tampoco fue significativa, p = 0,47. Estos resultados observacionales indican que las vacunas contra la COVID-19 disponibles comercialmente, no parecen proteger a la diabetes tipo 1 contra la enfermedad de la COVID-19, al menos durante el período de tiempo en estudio.
La BCG ofrece una amplia protección a los sujetos diabéticos tipo 1 contra las enfermedades infecciosas independientemente de la vacuna contra la COVID-19
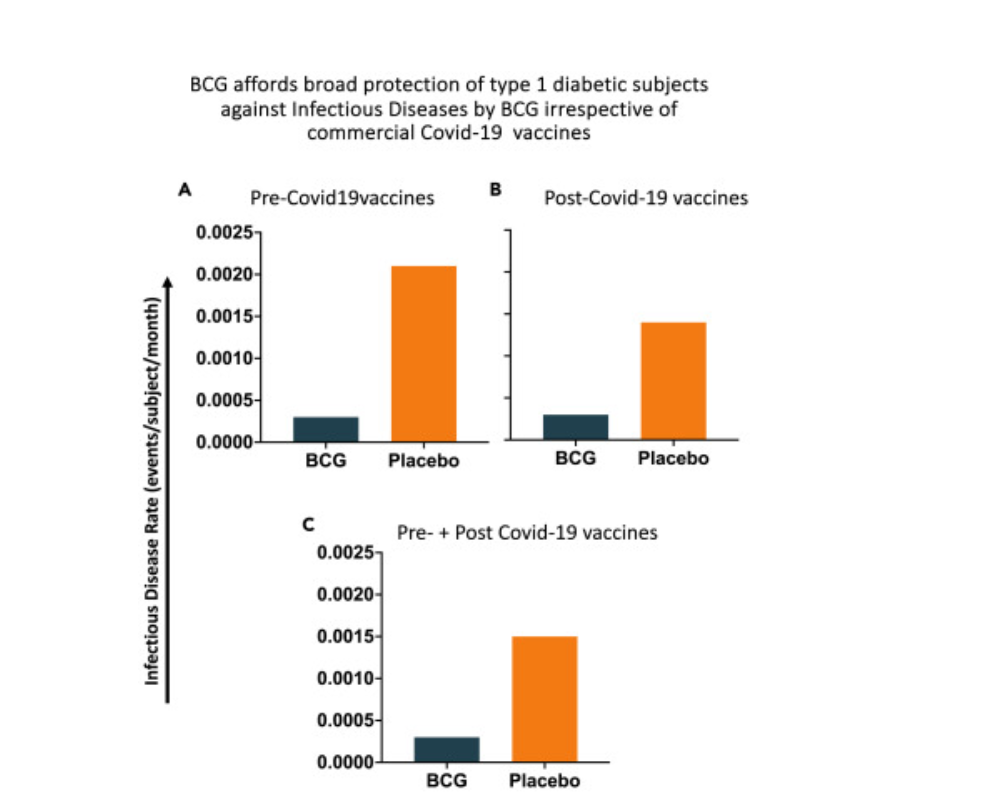
Otra forma de estudiar el impacto de las vacunas comerciales contra la COVID-19 es analizar los resultados de las enfermedades infecciosas (que incluyen la COVID-19). Este análisis se realiza por grupo de tratamiento (BCG frente a placebo) y por períodos de tiempo dentro de este ensayo de fase III: vacunas previas a la COVID-19, vacunas posteriores a la COVID-19 y vacunas previas y posteriores a la COVID-19
(Figura 7). Dado que las vacunas comerciales contra la COVID-19 se recibieron de forma aleatoria o en momentos individualizados, calcularon el número de meses que cada sujeto estuvo vacunado antes de la COVID-19 (es decir, el tiempo antes de recibir la vacuna contra la COVID) y después de recibir la vacuna contra la COVID-19 (es decir, el tiempo después de recibir la vacuna) y luego expresaron los datos como la tasa de eventos infecciosos por sujeto y por mes. Realizamos estadísticas de Poisson para Figura 7C (vacunas previas y posteriores a la COVID; distribución de Poisson) ya que esto abarcó un período de tiempo constante para cada sujeto (581 días). En los tres períodos de tiempo de análisis por sujeto, la tasa de enfermedad por COVID-19 en el grupo BCG fue siempre baja y siempre fue menor que la del grupo placebo, independientemente de si los sujetos habían recibido una vacuna contra la COVID-19 (p < 0,001). Este análisis es consistente con el anterior (Figura 6) de que las vacunas comerciales contra la COVID-19 no protegieron a los diabéticos tipo 1 de la COVID-19.
Este ensayo de fase III aleatorizado, doble ciego y controlado con placebo realizado a fines de la pandemia en los EE. UU. muestra que las vacunas BCG multidosis en una población vulnerable con diabetes tipo 1 protegen contra la enfermedad COVID-19 y las enfermedades infecciosas. Esta fue una época de predominio secuencial de las variantes Beta, Gamma, Delta y Ómicron del SARS-CoV-2, todas más transmisibles y algunas menos virulentas que las cepas anteriores.
Con base en datos observacionales, tampoco encontramos eficacia de las vacunas de mRNA comerciales para esta población de diabéticos tipo 1 vulnerable a las enfermedades infecciosas. Finalmente, la recepción de la vacuna COVID-19 no tuvo relación con la eficacia de la vacunación concurrente con BCG.
Esta es la segunda prueba exitosa de la vacuna BCG en los Estados Unidos. Los dos ensayos consecutivos, un ensayo de fase II y un ensayo de fase III, comparten algunas similitudes y algunas diferencias . Ambos utilizaron la cepa de BCG Tokyo 174 administrada como un régimen intradérmico de dosis múltiples, y ambos excluyeron antecedentes de BCG neonatal y tuberculosis previa. El ensayo de fase II se realizó al comienzo de la pandemia cuando los diagnósticos aprobados aún no estaban ampliamente disponibles. La enfermedad COVID-19 se confirmó a través del perfil de anticuerpos de COVID-19.
El ensayo clínico de fase III actual utilizó diagnósticos de COVID-19 en el punto de atención para detectar y confirmar COVID-19. El ensayo de fase II mostró una protección casi total del grupo BCG contra la enfermedad COVID-19 (92% frente a placebo; p = 0,0036) con las variantes del SARS-CoV-2 menos transmisibles pero altamente virulentas al principio de la pandemia (la variante original y la variante Alfa). El ensayo de fase III reveló una protección algo menor de las vacunas BCG contra la enfermedad COVID-19 al final de la pandemia con las variantes del SARS-CoV-2 más transmisibles (43% frente a placebo; p = 0,023), pero aún con significación estadística continua. En conjunto, los dos ensayos muestran que las vacunas BCG brindaron protección continua a los sujetos diabéticos tipo 1 durante casi toda la pandemia de COVID-19 en los Estados Unidos. La protección con BCG es independiente de las variantes genéticas de COVID-19 e incluso protegió a los sujetos vacunados de Omicron, la variante más transmisible.
Tanto los ensayos de ECA de fase II como de fase III también encontraron protección de plataforma de las vacunas BCG (en comparación con placebo) contra otras enfermedades infecciosas (p < 0,01, p < 0,0001, respectivamente). Todos los participantes de los ensayos clínicos recibieron múltiples dosis de BCG y en ambos ensayos los participantes habían recibido >3 vacunas BCG durante un período de 2 años antes del inicio del monitoreo del riesgo de enfermedades infecciosas en el ensayo clínico aleatorizado doble ciego de fase II o de fase III.
Se aprecia que en poblaciones adultas sin tratamiento previo, la vacuna BCG administrada como vacuna intradérmica tarda al menos dos años en lograr una protección completa para otras infecciones.
El ensayo clínico de fase II hizo un seguimiento de los sujetos durante 15 meses, mientras que el segundo ensayo clínico hizo un seguimiento de los sujetos durante los siguientes 18 meses. El ensayo de fase III coincidió con el lanzamiento en EE. UU. de vacunas comerciales contra la COVID-19 predominantemente del tipo mRNA. Permitió la evaluación observacional de la eficacia del mRNA, así como el impacto en la vacuna BCG concurrente. El análisis no encontró ni beneficios ni daños de la tecnología de la vacuna específica para el antígeno en sujetos diabéticos tipo 1 (p= 0,43), como también informaron otros previamente.
Atribuimos el éxito de nuestros ensayos de fase II y III a varias características metodológicas. En primer lugar, el tiempo de seguimiento superó los dos años. Las vacunas BCG en adultos estadounidenses tardan dos años en generar protección contra enfermedades infecciosas u otros beneficios no deseados, como protección contra la autoinmunidad en adultos no vacunados previamente que no habían recibido la vacuna.
Poco después de la vacunación y en cuestión de semanas, la BCG estimula la inmunidad innata que ciertamente está relacionada con la introducción de productos bacterianos extraños.
En cuanto a los efectos sobre otras infecciones y patologías en adultos, la BCG provoca cambios en la metilación del DNA de los genes del sistema inmunológico innato y adaptativo y de las vías metabólicas, y las vías de señalización se reconfiguran en un período de tiempo que se correlaciona con las mejoras clínicas lentas pero duraderas.
En segundo lugar, excluyeron0 a los individuos con antecedentes de exposición a la BCG o a la tuberculosis. La protección de la exposición anterior de este tipo probablemente dure décadas y, por lo tanto, tendería a ocultar el hallazgo de un beneficio de una vacuna BCG reciente. En tercer lugar, utilizaron una cepa potente de BCG (Tokyo 174). Al igual que el uso de BCG para el cáncer de vejiga, las distintas cepas de BCG tienen una eficacia muy diferente, y la cepa Tokio 174 sigue mostrando fuertes efectos.
En cuarto lugar, utilizaron múltiples dosis de BCG. Los estudios en animales y humanos muestran que la multidosis es mejor para los cambios metabólicos y los cambios de las células T a través de la reprogramación epigenética tanto en el sistema inmunológico adaptativo como en el innato.
En quinto lugar, estudiaron una población vulnerable a las enfermedades infecciosas de diabéticos tipo 1, lo que facilitó la búsqueda de un efecto. De manera similar, otros ensayos positivos de BCG para COVID-19 se realizaron en poblaciones de alto riesgo.
En contraste, tres ensayos negativos estudiaron a trabajadores de la salud, población sana a menudo resistente a las infecciones y sin compromiso inmunológico.
Los investigadores no som los primeros en informar que los sujetos diabéticos, incluidos los sujetos diabéticos tipo 1, no están adecuadamente protegidos contra la COVID-19 por las vacunas de mRNA.
Estos estudios muestran que los sujetos diabéticos, como grupo, corren el riesgo de contraer una infección por COVID-19 después de la vacunación mRNA contra la COVID-19. Los sujetos diabéticos tipo 1, más específicamente, probablemente tengan un riesgo aún peor de contraer una infección, una inferencia basada en la investigación que muestra que los diabéticos tipo 1 frente a los diabéticos tipo 2 tienen al menos el doble de probabilidades de morir por COVID-19.
Dada la falta de eficacia de la vacunación con mRNA para los diabéticos tipo 1, todavía existe una necesidad insatisfecha para esta población de pacientes, especialmente en lo que se refiere a las variantes nuevas y emergentes del SARS CoV-2. Dada la alta tasa de enfermedades infecciosas en la población vulnerable de diabéticos tipo 1, todavía existe una necesidad insatisfecha para esta población de pacientes de una plataforma de protección contra enfermedades infecciosas.
La falta de eficacia de las vacunas de mRNA descritas aquí se ve reforzada por investigaciones que muestran que las vacunas de mRNA en sujetos diabéticos tipo 1 no provocan ninguna respuesta de células T.
El hallazgo coincide con otros datos que indican que los sujetos diabéticos tipo 1 no tienen la capacidad de generar una respuesta inmunitaria adecuada utilizando células T de la respuesta inmunitaria adaptativa. Los datos mecanicistas de su laboratorio muestran que el beneficio de BCG para COVID-19 y enfermedades infecciosas puede deberse a que fortalece la respuesta de las células T a través de la desmetilación de muchos de los genes clave del receptor de células T (TCR).
Los datos muestran que los sujetos diabéticos tipo 1 normalmente tienen una baja expresión del complejo TCR resultante de la sobremetilación de los genes TCR, así como de la proteína CD3 asociada de los complejos TCR. BCG corrige este defecto en un período de tres años.
En el campo de las enfermedades infecciosas, existe una necesidad apremiante de nuevos antibióticos o vacunas para satisfacer el ritmo de las enfermedades infecciosas emergentes. Si bien las vacunas de mRNA representan un gran avance para la mayoría de las personas debido a la rapidez de la producción de vacunas y la respuesta biológica, la protección es a corto plazo (una cuestión de meses) frente a la deriva genética viral.
Las vacunas BCG parecen ofrecer una oportunidad de plataforma, pero con la salvedad de que los beneficios pueden no manifestarse durante un mínimo de 2 años. No obstante, la BCG ofrece la posibilidad de una protección casi de por vida.
Limitaciones del estudio
Este ensayo se realizó en una población vulnerable a enfermedades infecciosas, sujetos con diabetes tipo 1, y por lo tanto, los hallazgos pueden no aplicarse a poblaciones de pacientes no diabéticos o poblaciones sanas. Este ensayo clínico fue de pequeño tamaño, pero no tuvo abandonos. Además, este ensayo largo en un formato de ensayo clínico aleatorizado doble ciego permitió la exposición de los sujetos a muchas variantes del SARS-CoV-2 y exposiciones a enfermedades infecciosas. Este formato de ensayo clínico más prolongado es un diseño de ensayo alternativo en comparación con los ensayos de vacunas de mRNA que inscriben a un gran número de pacientes pero con un seguimiento más corto de meses en lugar de años para capturar la variante viral específica para la que se diseñó la vacuna de mRNA.
Otra limitación de este estudio es la dependencia de datos observacionales sobre la eficacia de las vacunas de mRNA, ya sea solas o con la vacunación concurrente con BCG. Los datos observacionales no se pueden utilizar para inferir causa y efecto. Además, no sabemos si la falta de eficacia de la vacuna de mRNA contra la COVID-19 que se informa aquí se debe a la enfermedad subyacente (es decir, diabetes tipo 1) o a la exposición a nuevas variantes virales que surgieron durante el transcurso del estudio. Al di de hoy, está bien documentado que las inyecciones ModRNA NO previenen la infección ni la diseminaciòn del virus SARSCoV-2.
Otra limitación es que no secuenciaron genéticamente las variantes de la COVID-19 de las cohortes infectadas, sino que utilizaron el marco temporal epidemiológico basado en EE. UU. para documentar la exposición. Por último, este fue un ensayo basado en EE. UU., por lo que los hallazgos pueden no ser necesariamente aplicables a otros países.
Figure 1
Figura 7. La BCG ofrece una amplia protección a los sujetos con diabetes tipo 1 contra las enfermedades infecciosas independientemente de las vacunas contra la COVID-19 Dado que los sujetos con diabetes tipo 1 fueron vacunados con vacunas comerciales contra la COVID-19 en diferentes momentos durante este ensayo clínico de fase III actual, se calculó el número de meses previos y posteriores a la vacuna contra la
COVID-19 para los grupos de BCG (n = 93) y placebo (n = 48) por separado. Luego se determinó el número acumulado de eventos infecciosos en los grupos de BCG frente a placebo antes y después de la vacuna contra la COVID-19 y se calculó la tasa de eventos infecciosos por sujeto y por mes. Los sujetos que nunca se vacunaron contra la COVID-19 se consideraron como sujetos previos a la vacuna contra la COVID-19 durante toda la duración del ensayo clínico de fase III. Las diferencias entre los grupos de BCG y placebo se determinaron utilizando estadísticas de Poisson.
- La tasa de eventos infecciosos por sujeto por mes antes del tratamiento con vacunas comerciales contra la COVID-19 es mucho mayor en el grupo placebo (sin BCG) en comparación con el grupo
- La tasa de eventos infecciosos por sujeto por mes después del tratamiento con vacunas comerciales contra la COVID-19 también es mucho mayor en el grupo placebo (sin BCG) en comparación con el grupo
- La tasa de eventos infecciosos por sujeto por mes durante todo el transcurso del ensayo de fase III, es decir, tanto antes como después de las vacunas contra la COVID, muestra el mismo patrón. Las estadísticas de riesgo proporcional de Andersen-Gill Cox mostraron que no hubo un efecto significativo de las vacunas contra la COVID-19 en el tiempo en la prevención o aceleración de las enfermedades infecciosas en general (p = 0,253). En general, estos resultados indican que la BCG protege ampliamente a la diabetes tipo 1 contra las enfermedades infecciosas, independientemente de la presencia o ausencia de vacunas comerciales contra la COVID-19. Además, las vacunas comerciales contra la COVID-19 no interfirieron en la protección de la vacuna BCG de la plataforma contra la COVID-19 y la enfermedad infecciosa en general.
Figura 2. Las vacunas BCG protegen a los diabéticos tipo 1 de la enfermedad COVID-19
- Durante el ensayo de 19 meses, las vacunas BCG multidosis protegieron a los diabéticos tipo 1 contra la enfermedad COVID-19. Durante el período del ensayo de fase III (del 1 de abril de 2021 al 3 de noviembre de 2022), 22 de 93 sujetos (23,7 %) del grupo BCG contrajeron la enfermedad COVID-19 (es decir, dieron positivo para COVID-19), mientras que 20 de 48 sujetos (41,7 %) del grupo placebo dieron positivo para COVID-19. La prueba exacta de Fisher de una cola muestra que esta diferencia es significativa (p = 0,023). La eficacia de la vacuna BCG fue del 43,2 %, con una eficacia definida por (p1 – p2)/p1 x 100, donde p1 es el % de positivos para COVID en el grupo placebo y p2 es el % de positivos para COVID en el grupo BCG.
- Porcentaje de pacientes diabéticos tipo 1 que dieron positivo a COVID-19, según año. En 2021, 10 de 93 sujetos (10,8 %) del grupo BCG dieron positivo a COVID-19, mientras que en el grupo placebo, lo hicieron 7 de 48 (14,6 %). En 2022, 13 (14,0 %) del grupo BCG dieron positivo a COVID-19 y 14 (29,2 %) del grupo placebo. Una prueba exacta de Fisher unilateral para los datos de 2021 no fue significativa (p = 0,342), pero para 2022 la diferencia entre los grupos fue significativa (p = 0,015).
Figura 4. Las vacunas BCG protegen a los sujetos diabéticos tipo 1 contra las enfermedades infecciosas
- El gráfico de barras muestra la tasa promedio y el error estándar de la media de todos los eventos de enfermedades infecciosas en los sujetos BCG (azul) frente a los sujetos placebo (naranja). Se calcularon los promedios y luego se expresaron como una tasa (eventos promedio/sujeto) para tener en cuenta los diferentes números de participantes en cada grupo. Número de pacientes por grupo: BCG (n = 93) frente a placebo (n = 48). El número total de eventos infecciosos en el grupo BCG es 44 frente a 66 en el grupo placebo. Tasa promedio/sujeto: BCG, 0,47; Placebo, 1,38. Las estadísticas de Poisson indican que la diferencia entre los grupos BCG y placebo es significativa a p < 0,0001. Los datos se representan como media ± error estándar de la media.
- El gráfico de violín muestra la densidad del número de eventos infecciosos por sujeto durante todo el período de prueba de 19 meses. La distribución en el gráfico naranja (placebo) muestra un número mayor en comparación con el gráfico azul (BCG). Esto también es evidente a partir de la mediana más alta en el gráfico naranja (las líneas punteadas blancas indican la mediana).
- El mapa de calor de los grupos BCG versus placebo muestra el número de varios tipos de eventos infecciosos por paciente durante todo el ensayo de fase Los colores rojos más oscuros en el grupo placebo indican que este grupo tendió a tener un mayor número de eventos infecciosos en comparación con el grupo BCG. Una lista detallada de los datos en este mapa de calor se muestra en la Figura S3 . ∗∗∗∗p < 0,0001.
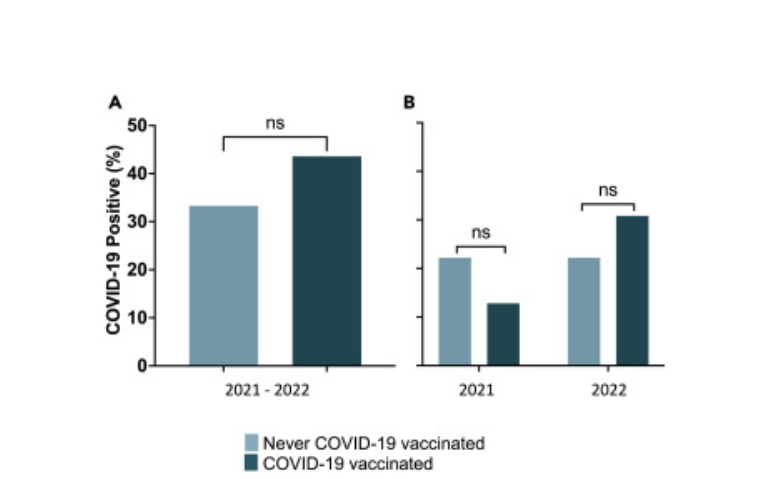
Figura 6. Las vacunas contra la COVID-19 (Pfizer, Moderna, J&J) no protegen a los sujetos con diabetes tipo 1 de la enfermedad por COVID-19
- Para evaluar la eficacia de las vacunas contra la COVID-19 por sí solas en nuestros sujetos con diabetes tipo 1, excluimos la BCG como un posible factor de confusión y analizamos solo la cohorte de placebo (sin BCG). Los sujetos con diabetes tipo 1 que recibieron placebo se dividieron en grupos vacunados contra la COVID-19 y nunca vacunados contra la COVID-19. De un total de 48 sujetos en el grupo de placebo (sin BCG), 39 estaban vacunados contra la COVID y 9 nunca habían recibido la vacuna. Luego contamos el número de sujetos a los que se les diagnosticó la enfermedad por COVID-19. En la cohorte tratada con la vacuna contra la COVID, 17 de 39 sujetos (43,6
%) dieron positivo en la prueba de COVID-19, mientras que en la cohorte nunca vacunada, 3 de 9 (33,3 %) dieron positivo. Si bien el porcentaje de positividad en el grupo que nunca se vacunó mostró una tendencia a la baja, la diferencia no fue estadísticamente significativa (prueba exacta de Fisher de una cola, p = 0,43).
- Comparación de la efectividad de las vacunas contra la COVID-19 en 2021 frente a Cuantificamos el porcentaje de sujetos con enfermedad por COVID-19. Este análisis observacional solo incluyó sujetos placebo a los que no se les administró la vacuna BCG. No se alcanzó significancia estadística en ninguno de los años (prueba exacta de Fisher de una cola: 2021, p = 0,39; 2022, p = 0,47), lo que confirma que las vacunas contra la COVID-19 disponibles comercialmente protegieron a los sujetos diabéticos tipo 1 de la COVID-19.