Aspectos destacados
- La dapagliflozina mitiga la fibrosis renal y mejora la función renal en la nefropatía hiperuricémica
- La dapagliflozina activa ERRα para regular los transportadores de AU, mejorando la excreción de AU
- La dapagliflozina alivia la lesión tubular y la TIF al restaurar la función mitocondrial
- El eje ERRα-OAT1 es vital en la patogénesis de la nefropatía hiperuricémica y es un objetivo terapéutico potencial
Resumen
La nefropatía hiperuricémica (NH) es un trastorno metabólico global caracterizado por una disfunción del metabolismo del ácido úrico (AU), que resulta en hiperuricemia (HUA) y fibrosis tubulointersticial (TIF). El inhibidor del transportador de glucosa dependiente de sodio 2, dapagliflozina, ha demostrado potencial para reducir los niveles séricos de AU en pacientes con enfermedad renal crónica (ERC), aunque sus efectos protectores contra la nefropatía hiperuricémica siguen siendo inciertos.
Este estudio investiga los cambios funcionales, patológicos y moleculares en HN a través de análisis histológicos, bioquímicos y transcriptómicos en pacientes, ratones HN y células HK-2 estimuladas con AU. Los hallazgos indican que la dapagliflozina mitiga significativamente la disfunción tubular y activación fibrótica inducidas por AU.
=> Recibir por Whatsapp las noticias destacadas
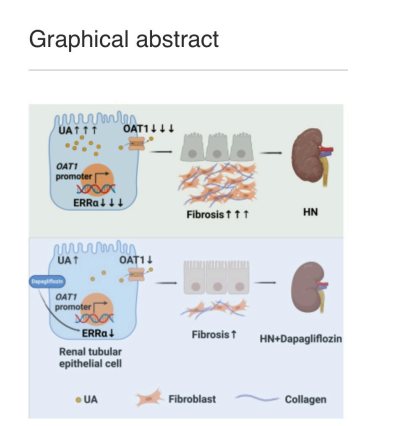
El análisis transcriptómico identifica el receptor α relacionado con estrógenos (ERRα), un factor de transcripción regulado a la baja en HN. Los ratones knockin de ERRα y las células HK-2 con sobreexpresión de ERRα demuestran resistencia al AU, mientras que la inhibición de ERRα exacerba los efectos del AU. La dapagliflozina se dirige a ERRα, activando el eje ERRα-transportador de aniones orgánicos 1 (OAT1) para mejorar la excreción de AU y reducir el TIF. Además, la dapagliflozina mejora la fibrosis renal en modelos de ERC sin HN, lo que subraya la importancia terapéutica del eje ERRα-OAT1 en HN y ERC.
En Detalle
El ácido úrico (AU) se sintetiza principalmente en el hígado como subproducto del metabolismo de las purinas y los nucleótidos. En el riñón, aproximadamente dos tercios del AU producido se filtra en el glomérulo y aproximadamente el 95 % se reabsorbe posteriormente en los túbulos proximales, y el 50 % se vuelve a secretar en el lumen tubular. El funcionamiento de este proceso depende de varias proteínas transportadoras de AU, entre ellas el transportador de aniones orgánicos 1 (OAT1), el transportador de ácido úrico 1 (URAT1), el transportador de glucosa 9 (GLUT9) y el miembro 2 de la superfamilia G del casete de unión al trifosfato de adenosina (ATP) (ABCG2). Se ha identificado al OAT1 como un actor crucial en la excreción de AU, y los fármacos que se dirigen al OAT1 han demostrado un valor terapéutico potencial.
La expresión desregulada de las proteínas transportadoras conduce inevitablemente a niveles elevados de AU, que superan el rango fisiológico, lo que a su vez desencadena la apoptosis, la inflamación y el estrés oxidativoen células en el túbulo proximal, lo que perjudica su función. Además, las células tubulares proximales dañadas contribuyen al desarrollo de la fibrosis tubulointersticial (TIF) al activar las vías autocrinas y paracrinas. Varios estudios han identificado a la TIF como un factor clave en la progresión de la hiperuricemia (HUA) a la nefropatía hiperuricémica (HN).
La prevalencia global tanto de HUA como de HN ha experimentado un rápido aumento en las últimas décadas, lo que ha supuesto una carga sustancial para la salud pública y la economía. Por lo tanto, es imperativo desarrollar estrategias eficaces para prevenir la progresión de la HN y mejorar la función renal a fin de aliviar esta carga. Actualmente, el tratamiento de la HN implica principalmente el manejo de los síntomas, lo que destaca la necesidad de explorar nuevas opciones farmacológicas para mejorar la HN.
La dapagliflozina, un inhibidor del cotransportador de sodio-glucosa 2 (SGLT2), ha demostrado una eficacia clínica significativa en pacientes con diabetes y enfermedad renal diabética, lo que lleva a una reducción notable del riesgo de deterioro renal y complicaciones cardiovasculares. Mecanísticamente, la dapagliflozina reduce la reabsorción de glucosa, mitiga la inflamación y atenúa el TIF en ratones con nefropatía diabética al inhibir selectivamente la expresión de SGLT2 en los túbulos proximales.
Estudios recientes también han indicado que la dapagliflozina puede tener un papel en las enfermedades renales no diabéticas, incluida la nefropatía isquémica o hipertensiva y la glomerulonefritis como la nefropatía por IgA, la glomeruloesclerosis focal y segmentaria y la nefropatía membranosa. Además, se ha demostrado que la dapagliflozina disminuye los niveles de AU en ratones modelo diabéticos, y estudios recientes han corroborado también su capacidad para reducir los niveles de AU en pacientes con insuficiencia cardíaca, ejerciendo un efecto protector.
A pesar de estos hallazgos, el efecto protector de la dapagliflozina frente a la HN y su mecanismo específico no han sido dilucidados. Por lo tanto, el objetivo de este estudio fue explorar el efecto protector de la dapagliflozina frente a la HN e investigar sus posibles mecanismos.
En este estudio Hu,et.al., [Cell Reports Medicine.Volume 5, Issue 8101690August 20, 2024], observaron que la dapagliflozina mejoraba la TIF tanto en pacientes con HN como en modelos de ratón con HN a través de la activación del eje ERRα-OAT1. Desde el punto de vista mecanístico, descubrieron que el TF ERRα desempeñaba un papel crucial en la regulación de la excreción de AU al controlar la expresión de la proteína transportadora de AU OAT1 en los túbulos renales proximales.
En particular, la expresión de ERRα se reguló a la baja en HN, mientras que el tratamiento con dapagliflozina provocó una regulación positiva de la expresión de ERRα y un aumento de OAT1, mejorando así la excreción de AU y atenuando la TIF. En general, este estudio proporciona una perspectiva del posible mecanismo subyacente a los efectos terapéuticos de la dapagliflozina en HN. Además, ofrece evidencia convincente del posible uso de la dapagliflozina en el tratamiento de enfermedades renales no diabéticas.
Los niveles elevados de AU durante un período prolongado pueden afectar negativamente la función de las células tubulares renales, lo que lleva a la contracción celular y promueve la apoptosis o la transdiferenciación. Estas células tubulares renales deterioradas posteriormente contribuyen a la fibrosis renal a través de la secreción autocrina o paracrina, lo que exacerba la progresión de HUA a HN.29
En última instancia, la manifestación patológica distintiva de HN es la fibrosis renal, caracterizada por la regulación positiva de los productos de las células mesenquimales, como αSMA y FN1. En su estudio Hu,et.al., [Cell Reports Medicine.Volume 5, Issue 8101690August 20, 2024], examinaron modelos de ratón HN inducidos por adenina y oxonato de potasio, que exhibieron niveles elevados de AU sérico, función renal deteriorada, inflamación renal pronunciada y fibrosis, lo que confirma la confiabilidad de este enfoque de modelado.
Además, observaron una mejora significativa en TIF en ratones HN tratados con dapagliflozina, lo que corrobora aún más el efecto protector de la dapagliflozina contra el desarrollo de HN. Los túbulos renales proximales son ampliamente reconocidos por su participación crucial en la reabsorción de iones, siendo las proteínas transportadoras en la membrana celular de estos túbulos las principales responsables del transporte de AU dentro del riñón. Cualquier cambio en estas proteínas transportadoras puede afectar significativamente la reabsorción y secreción de AU, resultando en consecuencia en mayores niveles de AU.
OAT1, clasificada como una proteína transportadora de aniones orgánicos, facilita principalmente la secreción de AU en el lumen del túbulo renal durante el metabolismo de AU. El estudio de Schneider ha demostrado que la regulación positiva de OAT1 puede proteger contra la lesión renal después de una lesión renal aguda isquémica. Además, OAT1 ha sido reconocido como un objetivo vital para el transporte renal de fármacos, transporte de lípidos, y la regulación de los microbios intestinales.
Dado su papel sustancial en el metabolismo de AU y las enfermedades renales, se investigó las alteraciones en la expresión de OAT1 tanto en pacientes con HN como en modelos de ratón HN. Los hallazgos de Hu,et.al., [Cell Reports Medicine.Volume 5, Issue 8101690August 20, 2024] revelaron una regulación negativa de la expresión de OAT1 tanto en pacientes con HN como en modelos de ratón HN. En particular, la expresión de OAT1 mostró una correlación con los indicadores clínicos de pacientes con HN, lo que destaca a OAT1 como un importante objetivo terapéutico potencial para la HN.
OAT1, también conocida como SLC22A6, pertenece a la familia de proteínas transportadoras de solutos, un grupo regulado por TF, como Sirt6, HIF-1α, y Nrf2, en condiciones fisiológicas. Estudios anteriores han destacado la regulación transcripcional de OAT1 por varios TF nucleares. El análisis de secuenciación de la región promotora de OAT1 identificó sitios de unión para TF como PAX1, PBX, WT1 y HNF1.
Se ha demostrado que ERα activado por ligando activa el TF de unión a CCAAT-box y la ribonucleoproteína nuclear heterogénea K, ambos capaces de unirse al promotor de OAT1 y mejorar su transcripción. En el presente estudio, utilizando ensayos de ChIP-seq y luciferasa dual, hicieron el descubrimiento de que los TF nucleares, específicamente ERRα, podrían unirse a OAT1 y estimular su transcripción. ERRα, clasificado como un TF nuclear, desempeña papeles vitales en el mantenimiento de la función mitocondrial y la oxidación de ácidos grasos y se regula a la baja significativamente en trastornos metabólicos.
Dentro del riñón, ERRα se expresa predominantemente en los túbulos renales proximales y se ha demostrado que se regula a la baja en varias condiciones, incluyendo fibrosis renal, envejecimiento, lesión renal aguda, y modelos de ratón con dieta alta en sal. La desregulación del metabolismo de AU es ampliamente reconocida como un factor significativo en el desarrollo y progresión de HN, posicionando a HN como el cuarto trastorno metabólico más prevalente después de la hipertensión, hiperlipidemia e hiperglucemia.
Además, nuestro estudio descubrió la regulación a la baja de la expresión de ERRα tanto en pacientes con HN como en modelos de ratón HN, lo que indica inhibición de la vía transcripcional involucrada en la regulación de OAT1. Esta interrupción influyó en el metabolismo de AU y contribuyó a la progresión de HN, subrayando aún más la importancia de ERRα en el mantenimiento del metabolismo de AU dentro del contexto de HN como un trastorno metabólico.
En los últimos años, el inhibidor de SGLT2 dapagliflozina ha demostrado importantes beneficios clínicos en la prevención y el tratamiento de la diabetes mellitus y la enfermedad renal crónica. Esto se logra al dirigirse e inhibir la expresión de SGLT2 en el túbulo proximal, lo que a su vez reduce la reabsorción de sodio y glucosa. Como resultado, esto mejora una amplia gama de lesiones celulares y mitiga los síntomas de la diabetes mellitus y la enfermedad renal crónica.
Además, el papel potencial de la dapagliflozina en el tratamiento de enfermedades no diabéticas está ganando atención. En particular, los estudios han indicado su impacto positivo en enfermedades renales como la nefropatía hipertensiva y la glomerulonefritis, incluida la nefropatía por IgA, la glomeruloesclerosis focal y segmentaria y la nefropatía membranosa.
Se ha demostrado que retrasa el aumento de los niveles de creatinina en sangre en pacientes y mejora el pronóstico. Aunque estudios clínicos recientes han sugerido el efecto protector de la dapagliflozina contra la HUA, el mecanismo exacto y sus beneficios protectores no se han explorado ampliamente. Hu,et.al., [Cell Reports Medicine.Volume 5, Issue 8101690August 20, 2024] , investigó el efecto de la dapagliflozina en HN tanto en pacientes humanos como en modelos de ratón. En este estudio, descubrieron que la dapagliflozina mejoró significativamente el TIF en pacientes con HN y ratones HN.
A través de experimentos de acoplamiento molecular, CETSA y DARTS, identificaron que la dapagliflozina se dirige y activa el ERRα para ejercer sus efectos protectores. En particular, la expresión de ERRα se restableció después del tratamiento con dapagliflozina tanto en pacientes con HN como en modelos de ratón HN, lo que proporciona evidencia de su posible aplicación terapéutica en enfermedades renales no diabéticas. Además, la dapagliflozina restauró eficazmente el OAT1 regulado a la baja en HN, promoviendo la secreción de UA en los túbulos renales.
En consecuencia, esto condujo a una reducción en los niveles de AU en sangre, lo que contribuyó aún más a los efectos protectores de la dapagliflozina. Además, dado que la fibrosis renal es una característica común de la ERC, también se descubrió que la dapagliflozina mejoró el TIF a través de la activación del eje ERRα-OAT1 en tres modelos animales de ERC no HN (ratones HFD, UUO y db/db). En conclusión, los hallazgos respaldan la hipótesis de que la dapagliflozina ejerce sus efectos protectores tanto en la ERC HN como en la no HN a través de la regulación positiva del eje ERRα-OAT1.
Limitaciones del estudio
Deben considerarse varias limitaciones del presente estudio. En primer lugar, la sobreexpresión de OAT1 se llevó a cabo en un experimento in vitro, que promovió la excreción de ácido úrico y atenuó la fibrosis renal. Los estudios futuros que sobreexpresen OAT1 in vivo ayudarán a dilucidar aún más el papel de OAT1 en la HN.
En segundo lugar, dado el papel de ERRα en la atenuación de la fibrosis renal, los agonistas específicos de ERRα podrían identificarse en el futuro, atenuando así los efectos secundarios de la dapagliflozina. Además, la dapagliflozina aún puede aliviar la fibrosis renal a través de otros mecanismos, como la inhibición de la síntesis de ácido úrico o mecanismos antiinflamatorios, y estudios adicionales proporcionarán una comprensión más profunda del mecanismo de acción de la dapagliflozina.
Conclusión
Este estudio ha identificado un mecanismo a través del cual la dapagliflozina facilita la excreción de AU en el lumen tubular de los túbulos renales. Este efecto se logra al actuar sobre el eje ERRα-OAT1, lo que posteriormente produce una reducción de los niveles séricos de AU. Cabe destacar que esta reducción de los niveles de AU desempeña un papel fundamental en el alivio de la TIF en la enfermedad renal crónica con y sin HN. Los hallazgos de este estudio aportan información sobre el posible tratamiento de las enfermedades renales no diabéticas con dapagliflozina.
Ronald Palacios Castrillo, M.D.,PhD.