Ronald Palacios Castrillo
Resumen
La enfermedad de Alzheimer se ha asociado con alteraciones metabólicas cerebrales. Minhas et al. [Science.2024.DOI:10.1126/science.abm61319107] estudiaron el papel de las alteraciones del metabolismo de la glucosa en la progresión de la enfermedad utilizando una combinación de células madre pluripotentes inducidas humanas y modelos de ratón .Los autores demostraron que la activación de la indolamina-2,3-dioxigenasa 1 (IDO1) por parte de los oligómeros de amiloide β o tau, dos proteínas patológicas importantes en la enfermedad de Alzheimer, promueve la conversión de triptófano en quinurenina, que luego suprime la glucólisis astrocítica, reduciendo así una de las principales fuentes de energía para las neuronas. La inhibición de IDO1 rescató la plasticidad sináptica in vitro y mejoró la cognición en múltiples modelos de roedores. El tratamiento de las disfunciones metabólicas es prometedor para los trastornos neurodegenerativos.
En Detalle
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo asociado con la edad que se caracteriza por una pérdida progresiva e irreversible de sinapsis y circuitos neuronales. Los principales procesos fisiopatológicos que contribuyen a la pérdida sináptica, incluida la proteostasis alterada, la acumulación de amiloide y tau mal plegados y la disfunción microglial, se están investigando enérgicamente con el objetivo de identificar terapias modificadoras de la enfermedad. Sin embargo, estas patologías específicas se acompañan de una disminución sostenida del metabolismo cerebral de la glucosa, y estudios proteómicos recientes han revelado una marcada alteración del metabolismo astrocítico y microglial en sujetos con EA.
=> Recibir por Whatsapp las noticias destacadas
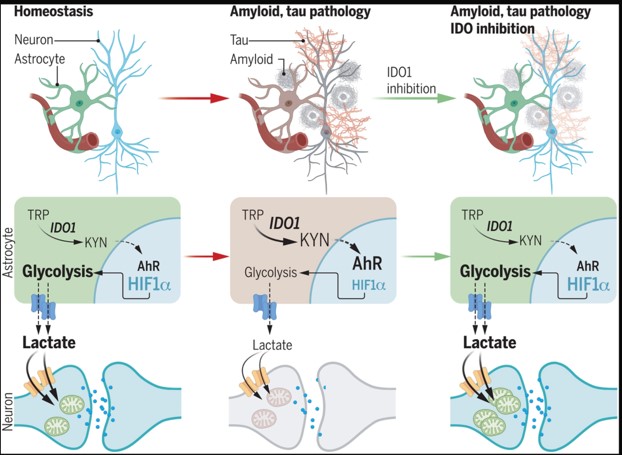
Los astrocitos generan lactato que se exporta a las neuronas para alimentar la respiración mitocondrial y apoyar la actividad sináptica. Estudios recientes han sugerido un papel de la indol-2,3-dioxigenasa 1 (IDO1), una enzima expresada en los astrocitos, en múltiples trastornos neurodegenerativos, incluida la EA. La IDO1 es la enzima limitante de la velocidad de conversión de triptófano (TRP) a quinurenina (KYN), un metabolito que provoca supresión inmunitaria en contextos inflamatorios y neoplásicos a través de la interacción con el receptor de aril-hidrocarburos (AhR). La actividad de IDO1 aumenta significativamente mediante una variedad de estímulos inmunogénicos y, en el cerebro, IDO1 se expresa en astrocitos y microglia pero no en neuronas, donde los niveles pueden aumentar en respuesta a estímulos inflamatorios.
Minhas et.al. [Science .2024.DOI: 10.1126/science.abm61319107] Informan que la inhibición de IDO1 y la producción de KYN rescatan la plasticidad sináptica hipocampal y la función de la memoria en modelos preclínicos de patología amiloide y tau al restaurar el soporte metabólico astrocítico de las neuronas. La activación de IDO1 en astrocitos por oligómeros de β amiloide y tau, dos de los principales efectores patológicos en la EA, aumenta KYN y suprime la glucólisis de una manera dependiente de AhR. Por el contrario, la inhibición farmacológica de IDO1 restaura la glucólisis astrocítica y la producción de lactato.
En ratones APPSwe-PS1∆E9 y 5XFAD productores de amiloide y en ratones P301S productores de tau, la inhibición de IDO1 mejora el metabolismo de la glucosa en el hipocampo, como lo demuestran los análisis metabolómicos y MALDI-MS (espectrometría de masas por desorción láser asistida por matriz), y restaura la memoria espacial. El bloqueo de IDO1 también rescata la potenciación a largo plazo del hipocampo de una manera dependiente del transportador de monocarboxilato, lo que sugiere que la actividad de IDO1 altera el soporte metabólico astrocítico de las neuronas.
De hecho, el marcaje masivo in vitro de astrocitos humanos demostró que IDO1 regula la generación de lactato por parte de los astrocitos, que luego es absorbido por las neuronas humanas. En cocultivos de astrocitos y neuronas derivadas de sujetos con EA, la producción deficiente de lactato por parte de los astrocitos y su transferencia a las neuronas se corrigió mediante la inhibición de IDO1, lo que resultó en un mejor metabolismo neuronal de la glucosa.
Conclusión
Además de descubrir un papel previamente no caracterizado de IDO1 en el metabolismo de la glucosa cerebral, este estudio destaca el potencial de los inhibidores de IDO1 que penetran en el cerebro, desarrollados como una terapia complementaria para el cáncer, para ser reutilizados para el tratamiento de enfermedades neurodegenerativas como la EA. Este estudio también revela un mecanismo general que contribuye a la disfunción neuronal que afecta a distintas patologías.
Además de la enfermedad de Alzheimer, la manipulación de IDO1 puede ser relevante para la demencia asociada a la enfermedad de Parkinson, que se caracteriza por la acumulación de amiloide además de α-sinucleína, así como para el amplio espectro de tauopatías. Existe la posibilidad de que el metabolismo deficiente de la glucosa por los astrocitos también pueda ser la base de otras enfermedades neurodegenerativas caracterizadas por la acumulación de otras proteínas mal plegadas en las que se han observado aumentos de los metabolitos de la vía de la quinurenina.
Mecanismo de acción de la actividad de IDO1 astrocítica en las patologías de la enfermedad de Alzheimer.
(Izquierda) Los astrocitos (en verde) generan lactato, y la expresión del gen glucolítico está regulada en parte por el factor inducible por hipoxia 1-α (HIF1α). Se transfiere suficiente lactato del astrocito a la neurona (en azul) para alimentar la respiración mitocondrial neuronal y la actividad sináptica. (Medio) La generación de KYN por IDO1 astrocítica aumenta, alterando el equilibrio entre la señalización nuclear de AhR y HIF1α y reduciendo la glucólisis astrocítica, la producción de lactato y el apoyo metabólico de la actividad neuronal. (Derecha) La disminución de KYN astrocítico restablece la glucólisis y el apoyo metabólico de las neuronas y reduce la gravedad de las patologías de amiloide y tau. [Figura creada con BioRender.com]