Ronald Palacios Castrillo
Favor leer mi nota al final del artículo
Desde los años noventa, la incidencia de cánceres esporádicos de aparición temprana (EA) ha aumentado en todo el mundo. Las razones subyacentes aún se desconocen. Sin embargo, identificarlas es vital para avanzar tanto en la prevención como en la intervención. En este artículo, Mauri,et.al.,[Cell Reports Medicine.DOI: 10.1016/j.xcrm.2024.101737] aprovecharon el conocimiento disponible derivado de las observaciones clínicas para formular hipótesis comprobables destinadas a definir los factores causales de esta epidemia y analizaron cómo probarlas experimentalmente. Exploraron el impacto potencial de los cambios en el exposoma desde los millennials hasta las generaciones jóvenes contemporáneas, considerando tanto las exposiciones ambientales como las susceptibilidades mejoradas al desarrollo de cáncer EO. Destacan cómo establecer el tiempo requerido para que se desarrolle un cáncer EO es relevante para definir futuras estrategias de detección. Finalmente, analizan la importancia de integrar datos multidimensionales de colaboraciones internacionales para generar conocimiento integral y traducir estos hallazgos nuevamente a la práctica clínica.
Durante las últimas tres décadas, la epidemiología del cáncer ha estado cambiando notablemente debido a la creciente incidencia de cánceres esporádicos de aparición temprana (EA). Tradicionalmente observados en adultos mayores de 65 años, estos tumores principalmente sólidos ahora se diagnostican cada vez más en individuos más jóvenes menores de 50 años. En consecuencia, el término cánceres EA hoy en día identifica aquellos tumores sólidos que generalmente se presentan en personas de 60 a 70 años diagnosticados en individuos menores de 50. Sin embargo, esta definición es meramente arbitraria, basada en la practicidad más que en una lógica biológica. La incidencia del cáncer EA está aumentando particularmente entre adolescentes y adultos jóvenes de 15 a 39 años. Este cambio epidemiológico fue informado inicialmente en los EE. UU. durante los años ochenta y luego confirmado en todo el mundo desde principios de los años noventa, emergiendo progresivamente como un importante problema de salud pública debido a sus consecuencias físicas, sociales, económicas y psicológicas. Por lo tanto, comprender por qué está sucediendo esto, al mismo tiempo que se define cómo tratar a los adultos jóvenes diagnosticados con cánceres, es una prioridad para la investigación oncológica.
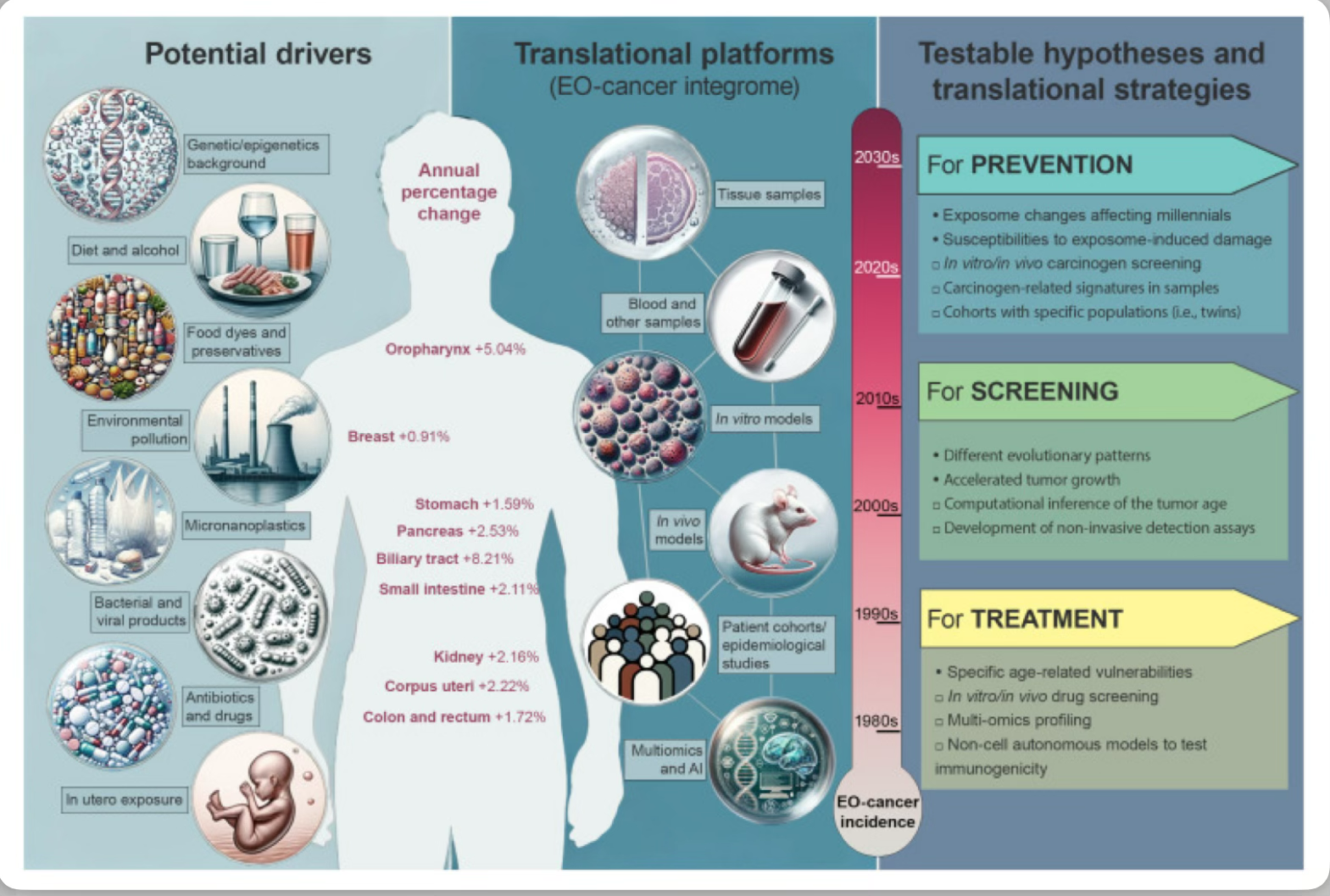
Aquí, Mauri,et.al.,[Cell Reports Medicine.DOI: 10.1016/j.xcrm.2024.101737] formularon hipótesis comprobables y sugieren un enfoque integral traslacional para abordar esta epidemia. A partir de la revisión de las posibles causas del aumento de cánceres asociados a EA, proponen cómo probar varias hipótesis a través de plataformas translacionales, integrando datos de modelos tanto autónomos como no autónomos en una evaluación integral basada en multiómica de cánceres asociados a EA (el integroma de cánceres asociados a EA). Comprender la biología de los cánceres asociados a EA, las causas subyacentes y las peculiaridades clínicas de los individuos afectados es fundamental para identificar estrategias preventivas y de diagnóstico temprano, así como oportunidades terapéuticas personalizadas (Figura 1).
=> Recibir por Whatsapp las noticias destacadas
De la observación clínica a las hipótesis comprobables
La relevancia clínica del aumento del cáncer de EA se destaca por su aparición como la principal causa de mortalidad en adolescentes y adultos jóvenes (15 a 49 años) en regiones del mundo con un índice sociodemográfico medio a alto, superando a las enfermedades cardiovasculares que predominaron en la década de 1990. La incidencia mundial del cáncer de EA aumentó casi un 80% entre 1990 y 2019, y el número de muertes por cáncer de EA también aumentó alrededor del 30%. De hecho, aunque con diferentes tendencias probablemente debido al entorno local, el estilo de vida y el nivel de tratamientos médicos disponibles, este fenómeno está afectando a todo el mundo, no se limita a Europa y América del Norte, sino que también afecta a Oriente Medio, Australia y África. Las proyecciones para los próximos 15 años sugieren que los cánceres más comunes en adultos de 20 a 49 años serán el de mama (aumento anual +0,91%), el gastrointestinal y, en particular, el colorrectal (+1,72%) y el de riñón. (+2,16%). En particular, varios otros tipos de tumores EO también están aumentando, algunos con tasas aún más rápidas, incluyendo el cáncer de apéndice (+15,61%) y del tracto biliar (+8,12%).
Ya se ha refutado que los estudios de diagnóstico mejorados y las campañas de detección son los únicos responsables del aumento de los diagnósticos de cáncer EA. Los cánceres EA de mama, digestivo y respiratorio son particularmente letales en la población de adultos jóvenes. Entre todos, el cáncer colorrectal EA (EA-CCR) es el ejemplo más paradigmático de este fenómeno, con una incidencia y mortalidad en aumento, particularmente entre individuos menores de 40 años. Como consecuencia, el EA-CCR se ha convertido recientemente en la primera causa de muerte relacionada con el cáncer entre los hombres de 20 a 49 años en los EE. UU., y las estimaciones actuales indican que para 2030 un tercio de todos los CCR se diagnosticarán en individuos menores de 50 años. Por el contrario, la mortalidad por cáncer de mama EA (EA-BC) y la mayoría de los otros tipos de cáncer está disminuyendo a pesar del aumento en la incidencia. Esta disparidad probablemente se deba a variaciones en múltiples niveles que abarcan desde la disponibilidad de pruebas de detección hasta la agresividad biológica intrínseca de la enfermedad. Una disección clinicopatológica extensa de los cánceres EA está más allá del alcance de nuestra perspectiva, ya que ya se ha abordado ampliamente en otros lugares. Brevemente, los cánceres EA pueden presentarse con características clinicopatológicas peculiares, como la lateralidad izquierda en EA-CRC (particularmente impulsada por diagnósticos de cáncer rectal, aunque con diferencias regionales de Europa a América del Norte), características de anillo de sello en EA-CRC y cánceres gástricos, o subtipos no luminales agresivos en EA-BC. No obstante, hasta la fecha no se han identificado de manera concluyente diferencias genómicas ni transcripcionales significativas, más allá de una mayor prevalencia de alteraciones genéticas que impulsan síndromes de cáncer hereditario. Como ya se discutió en revisiones anteriores sobre este tema, las únicas diferencias genéticas y transcriptómicas entre EA-CRC y su contraparte más antigua fueron una mayor prevalencia de inestabilidad de microsatélites y características del subtipo molecular de consenso (CMS) 1, y una menor prevalencia de mutaciones BRAF, probablemente relacionada con la mayor prevalencia de CCR relacionado con el síndrome de Lynch entre pacientes menores de 50 años. Varios estudios retrospectivos que incluyeron grandes cohortes de pacientes con CCR-EA no encontraron diferencias significativas en la prevalencia de mutaciones accionables o troncales como RAS, APC y TP53. Además, a pesar de que generalmente se someten a procedimientos médicos y quirúrgicos más intensivos tanto en el entorno adyuvante como metastásico, los pacientes con cáncer-EA generalmente no logran beneficios de supervivencia significativos mientras que potencialmente sufren más eventos adversos relacionados con el tratamiento. Finalmente, si bien se ha sugerido anticipar el inicio del cribado para aquellas enfermedades en las que esto es factible, esta estrategia aún representa un enfoque empírico agnóstico de la biología y, en cualquier caso, estaría limitada a tipos de cáncer específicos (CCR-EA, CM y cáncer de cuello uterino). En este sentido, incluso en tipos de cáncer en los que la anticipación del cribado podría ser teóricamente factible, la sostenibilidad socioeconómica de tales medidas sigue siendo cuestionable.
La identificación de las características biológicas del cáncer de EA es fundamental para determinar medidas de prevención y opciones de tratamiento eficaces para esta enfermedad. El aumento de los casos de cáncer de EA ha impulsado la investigación de los mecanismos fundamentales del aumento del cáncer de EA, centrándose principalmente en el «exposoma». Cabe destacar que los factores ambientales, incluidos, entre otros, la dieta y los estilos de vida sedentarios, han cambiado en todo el mundo en el último siglo, aunque con variaciones geográficas sustanciales. La interacción de múltiples factores, en lugar de un único agente causal, debe tenerse en cuenta al investigar los impulsores etiológicos de los cánceres de EA. Dadas las complejidades involucradas en la identificación de las causas dentro de este contexto, los esfuerzos para desentrañar estas complejidades requieren un enfoque de reducción de escala metodológica. A continuación, enumeran la evidencia y las hipótesis comprobables relacionadas con respecto al aumento inesperado de los cánceres de EA, y específicamente el CCR de EA, en todo el mundo. En primer lugar, ¿qué sustancias ambientales, a las que estuvieron expuestos los millennials y las generaciones posteriores (es decir, la generación Z), han cambiado en las últimas cinco décadas aproximadamente, lo que podría haber aumentado la incidencia de cáncer de colon observado desde los años 1990? ¿Existen nuevas susceptibilidades epigenéticas o del sistema inmunológico definidas en individuos jóvenes a medida que avanzan hacia la edad adulta? En segundo lugar, dado que se han identificado cánceres de colon en individuos de tan solo 20 años, se vuelve imperativo preguntarse cómo entender su patogénesis. ¿El cáncer colorrectal de colon se desvía de la vía ampliamente aceptada de tumorigénesis colorrectal, como la cascada adenoma-carcinoma descrita por Fearon y Vogelstein? De hecho, es difícil imaginar (pero posible) que un tumor colónico en un individuo sano de 20 años haya estado progresando desde la primera infancia. Esta observación conduce a una hipótesis crítica: ¿estos tumores evolucionan a través de la misma vía pero más rápidamente que en individuos mayores debido a un tejido sano ya «preparado para el desarrollo del tumor»? ¿O siguen un patrón evolutivo distintivo y biológicamente diferente? Abordar estas preguntas tendrá profundas implicaciones, en particular para las estrategias de prevención secundaria. En tercer lugar, si estos tumores o su microambiente son diferentes, ¿podría la respuesta y la resistencia del cáncer de EA a los agentes anticancerígenos ya disponibles ser diferentes de las de los cánceres que afectan a pacientes mayores? Aún más importante, en ausencia de una disección biológica integral de los cánceres de EA, podrían pasarse por alto vulnerabilidades terapéuticas nuevas y potencialmente específicas. Responder a estas preguntas sobre los cánceres de EA permitiría opciones de tratamiento más efectivas y personalizadas desde la prevención hasta el manejo de la enfermedad en etapa avanzada. De hecho, confiar en algoritmos de tratamiento derivados de estudios clínicos que incluyeron solo un número limitado de individuos con cáncer de EA podría conducir a un enfoque de “talla única”, que puede no ser adecuado para este subconjunto peculiar de pacientes. Por ejemplo, se sabe que las mujeres premenopáusicas diagnosticadas con cáncer de mama con hormonas positivas antes de los 40 años tienen un peor pronóstico y son tratadas en consecuencia con tratamientos más intensivos que generalmente incluyen regímenes citotóxicos. De manera similar, incluso si el pronóstico del cáncer colorrectal en pacientes más jóvenes aún se debate, los médicos tienden a tratarlos más intensivamente de acuerdo con un sesgo relacionado con la edad sin evidencia de que este enfoque realmente se traduzca en un beneficio de supervivencia.
El impacto de los cambios del exposoma de los millennials a los individuos más jóvenes
La mayoría de los casos de cáncer EA solían atribuirse a alteraciones genéticas hereditarias, y la prevalencia de estos casos hereditarios se ha mantenido estable a lo largo del tiempo. Sin embargo, solo entre el 20% y el 30% de los cánceres EA-CCR y EA-páncreas son hereditarios, mientras que el resto son esporádicos. De hecho, el aumento de los cánceres EA se atribuye a casos esporádicos, cuya etiología sigue siendo esquiva. Las causas subyacentes se asocian, por lo tanto, muy probablemente con el llamado «exposoma» (Figura 1). Durante el último siglo, debido a una expansión industrial sin precedentes que condujo a mejoras significativas tanto del bienestar como de la esperanza de vida, se ha producido un aumento exponencial del número y la abundancia de sustancias que interactúan con los animales y los seres humanos desde su vida prenatal en adelante. Como resultado, también ha aumentado el número de carcinógenos potenciales. De hecho, el potencial carcinógeno de la mayoría de las sustancias disponibles comercialmente es en gran medida desconocido, incluidas aquellas que se utilizan habitualmente en la preparación de alimentos y bebidas. No solo la mutagénesis sino también la inflamación metabólica subclínica crónica (metainflamación) inducida por el estilo de vida occidental pueden haber contribuido a la anticipación del desarrollo del cáncer en los jóvenes al promover su desarrollo a través de la modulación de la desdiferenciación, la proliferación y la regulación negativa inmunológica.
Hasta ahora han surgido varios culpables putativos. A partir de estudios epidemiológicos, aprendimos que la occidentalización de la dieta ha llevado a una mayor exposición a carcinógenos bien conocidos como 2-amino-1-metil-6-fenilimidazo[4,5-b] piridina (PhIP), compuestos N-nitroso cancerígenos e hidrocarburos aromáticos policíclicos, que están muy extendidos particularmente en comidas rápidas, comidas congeladas y carnes curadas, particularmente en áreas metropolitanas. Estudios recientes de hecho mostraron una prevalencia potencialmente diferente de cánceres de EA entre áreas metropolitanas y rurales, desenmascarando así una posible distribución geográfica heterogénea de los factores de riesgo de cáncer de EA. Estas moléculas, junto con un déficit La presencia de nutrientes protectores como las vitaminas que favorecen la reparación del ADN y la desintoxicación de especies radicales de oxígeno, puede haber contribuido al aumento de los cánceres de EA a través de la inducción de aductos de ADN y la promoción del estrés oxidativo. Dado que estos compuestos tendrían un tiempo limitado para inducir la acumulación de mutaciones del ADN en sujetos jóvenes, su posible efecto cancerígeno plantea preguntas sobre los mecanismos implicados. Una hipótesis a explorar es si los compuestos podrían afectar directamente la configuración epigenética de las células cancerosas de EA de origen, lo que llevaría a una aceleración de la transformación neoplásica. En este contexto, las alteraciones del microbioma y la disbiosis también podrían desempeñar un papel en el desarrollo de tumores del tracto gastrointestinal y otros cánceres. Además, los bajos niveles de actividad física, la obesidad, el síndrome metabólico, el nivel más bajo de vitaminas específicas como la vitamina D, la diabetes tipo 2 y las condiciones socioeconómicas menos favorables que a menudo se asocian con un mayor consumo de alimentos procesados y de baja calidad se han correlacionado con un mayor riesgo de desarrollar cánceres de EA.
Además, se sugirió un vínculo entre los hábitos alimentarios y la microbiota, relacionado con el metabolismo microbiano particular de los compuestos de azufre de la dieta que son carcinógenos gastrointestinales. En contraste, los datos sobre el papel del alcohol y sus metabolitos como culpables de los cánceres de EA son contradictorios ya que, particularmente en los países de altos ingresos, se describió una tendencia hacia un menor consumo de alcohol entre adolescentes y adultos jóvenes. Se informaron tendencias opuestas sobre la ingesta de azúcares libres y jarabe de maíz con alto contenido de fructosa (JMAF) de bebidas endulzadas y alimentos procesados, que se han relacionado con la patogénesis de varios tipos de cáncer debido a su papel en la desregulación metabólica y también efectos oncogénicos directos. Por ejemplo, se ha demostrado un papel causal del JMAF en la promoción del desarrollo de CCR en modelos preclínicos. Asimismo, el uso de colorantes, conservantes y aditivos de color se ha extendido gradualmente, particularmente en caramelos y bocadillos endulzados que consumen niños y adolescentes. En este sentido, están surgiendo datos iniciales sobre la potencial carcinogenicidad de colorantes como el Rojo 40, un colorante elaborado a partir de petróleo. Sin embargo, la evaluación de la carcinogenicidad de dichos agentes se ve obstaculizada por su heterogeneidad y dispersión en varios tipos de alimentos, por lo que se requieren plataformas experimentales para probar cientos de ellos (y sus combinaciones) en modelos preclínicos seleccionados. En general, escasos estudios, en su mayoría de casos y controles y solo unos pocos prospectivos, investigaron epidemiológicamente el impacto de los factores de riesgo dietéticos en los cánceres de EA. Para mejorar este conocimiento, el estudio internacional DEMETRA (NCT05732623) está actualmente en curso con el objetivo de comparar las asociaciones de factores dietéticos y de estilo de vida específicos en pacientes con EA-CRC en comparación con controles sanos de la misma edad y sexo en países con una incidencia de EA-CRC en aumento versus estable o decreciente, adoptando un cuestionario de frecuencia alimentaria semicuantitativo. Por último, el uso extensivo de fertilizantes, pesticidas, antibióticos y hormonas tanto en la agricultura como en la ganadería, que en última instancia contaminan tanto las verduras como la carne, también podría estar relacionado con el aumento del cáncer de EA.
Cabe destacar que los cambios del exposoma no se limitan a los hábitos de dieta y ejercicio. El uso indiscriminado de medicamentos comunes como los antibióticos también podría estar relacionado con los cánceres EA por al menos dos razones: su impacto en la microbiota intestinal y la genotoxicidad de algunos de ellos en las células humanas. Además, las prescripciones excesivas y/o inadecuadas de antibióticos también en recién nacidos, niños y adolescentes han aumentado exponencialmente la exposición general de los individuos a estos medicamentos desde su edad más temprana. De manera similar, otros medicamentos surgieron como potencialmente asociados con EA-CRC, como los betabloqueantes y Valeriana officinalis. Paralelamente a las preocupaciones farmacológicas, la exposición a bacterias o virus específicos podría tener un impacto cancerígeno en las células humanas. Curiosamente, el papel de la colibactina, una genotoxina relacionada con las bacterias, está bajo investigación como una posible causa de EA-CRC y por su impacto en la respuesta al tratamiento de las células de CRC a los agentes quimioterapéuticos estándar.
Recientemente se ha demostrado que la contaminación del aire por PM2 impulsa el desarrollo de Cáncer de pulmón de células no pequeñas (CPCNP) mutante del EGFR al inducir estrés oxidativo y regular a la baja la vigilancia del sistema inmunológico sobre células pulmonares no tumorales mutantes del EGFR preexistentes. Teniendo en cuenta que la mayoría de los CPCNP esporádicos en adultos jóvenes son adictos a los oncogenes (principalmente a través de genes RET, ALK o ROS1 reordenados), se debe investigar más a fondo si PM2.5 también podría fomentar el desarrollo del cáncer en individuos más jóvenes que albergan eventos iniciadores como translocaciones oncogénicas en su epitelio pulmonar. Además, dichos efectos promotores de tumores no podrían limitarse al CPCNP y también extenderse más allá de la contaminación del aire. De hecho, la contaminación ubicua del medio ambiente por microfibras y nanofibras de plástico es otra amenaza emergente para la salud pública. Se ha sugerido que los micro y nanoplásticos pueden acumularse en diferentes órganos, lo que lleva a disfunción neuroendocrina, eventos cardiovasculares, inflamación y cánceres. Estas partículas pueden actuar como vectores para otros carcinógenos, pero también inducir inflamación, Mientras que el impacto de la autonomía celular impulsada por el plástico aún está por demostrarse. De hecho, los estudios in vitro e in vivo solo informan del efecto de la exposición aguda a micro y nanoplásticos en líneas celulares que ya son cancerosas, lo que limita la posibilidad de extraer conclusiones definitivas. Se justifican demostraciones formales sobre la exposición crónica in vivo e in vitro tanto en modelos autónomos de células como en modelos no autónomos de células. Además, los micro y nanoplásticos se obtienen mediante la manipulación de compuestos químicos, como el bisfenol A, que también podrían tener una acción iniciadora y/o promotora del cáncer.
Todas las hipótesis de exposición mencionadas anteriormente podrían afectar el desarrollo embrionario en el útero. En relación con esto, el conocimiento sobre la capacidad de las sustancias ambientales y dietéticas para eludir la barrera hematoplacentaria es críticamente insuficiente. También sería importante investigar las exposiciones maternas a las sustancias mencionadas anteriormente. Curiosamente, la incidencia de cáncer colorrectal de origen primitivo comenzó a aumentar a principios de los años 90, décadas después del aumento del cáncer colorrectal de aparición tardía. Este desfase temporal sugiere la presencia de un denominado «efecto de cohorte de nacimiento» (es decir, la exposición única de un grupo a medida que avanza en el tiempo), lo que subraya aún más la importancia de los factores de riesgo en la vida temprana para el aumento observado en la incidencia de cánceres de origen primitivo. Por ejemplo, se ha sugerido que la creciente adopción de procedimientos médicos como las cesáreas, que se prevé que se realicen en casi un tercio de todos los nacimientos en 2030, está relacionada con mayores probabilidades de CCR-EA en mujeres en comparación con individuos nacidos por parto vaginal, lo que destaca un papel potencial de la disbiosis intestinal temprana en esta población. Finalmente, también se deben investigar las mayores tasas de apendicectomías y amigdalectomías durante los años noventa, así como la difusión de la alimentación con biberón y el mayor uso de antibióticos en los días perinatales, ya que podrían alterar la constitución inicial de la microbiota de los niños y la competencia del sistema inmunológico.
El espectro de mayor susceptibilidad al desarrollo de cáncer-EA
Más allá de la exposición a carcinógenos, otra capa de complejidad involucra la interacción entre estos compuestos y predisposiciones genéticas, poligénicas o epigenéticas. De hecho, si bien los síndromes de predisposición al cáncer hereditario están bien caracterizados, Aunque se reconocen clínicamente y se han mantenido epidemiológicamente estables, el papel de las predisposiciones poligénicas no mendelianas, incluidos los polimorfismos de un solo nucleótido y las modificaciones epigenéticas, está menos explorado. En este contexto, es poco probable que los estudios epidemiológicos adoptados hasta ahora proporcionen conocimientos exhaustivos sobre la complejidad del fenómeno. Lo más importante es que vale la pena investigar el impacto de los modificadores de la susceptibilidad en la transformación inicial de células sanas en cancerosas, o en la promoción del crecimiento y la agresividad de las células cancerosas existentes, o incluso en la evasión inmunológica y la inflamación.
La competencia del sistema inmunológico es fundamental para restringir el desarrollo del cáncer. En consecuencia, su deficiencia puede acelerar la aparición de cánceres EA y facilitar su propagación. Más allá de los síndromes de inmunodeficiencia mayores que permiten el desarrollo del cáncer, en realidad no sabemos cómo medir la competencia anticancerígena relacionada con el sistema inmunitario en recién nacidos y adultos jóvenes. De hecho, la complejidad del sistema inmunitario y su interacción con las células cancerosas y el exposoma es tal que actualmente carecemos de métricas clínicas sólidas para estimar, a nivel individual, la competencia anticancerígena del sistema inmunitario más allá de la de los síndromes inmunodepresivos peculiares.
Se ha informado cada vez más que los millennials y las generaciones posteriores de la generación Z sufren cada vez más problemas de salud mental y angustia emocional como síndromes de agotamiento, depresión grave y trastornos del sueño. Se desconoce en qué medida estas afecciones afectan la competencia anticancerígena inmunitaria. Cabe destacar que un estudio reciente informó que la angustia emocional podría conducir a una peor respuesta a los inhibidores de puntos de control inmunitarios cuando se trata el melanoma en el entorno neoadyuvante. Este resultado sugiere que la susceptibilidad individual al desarrollo, progresión y respuesta al tratamiento del cáncer de EA podría extenderse mucho más allá de los factores genómicos y epigenéticos, abarcando aspectos como la salud mental y los ritmos circadianos que anteriormente se subestimaban. Por lo tanto, se justifica la investigación sistemática de estos factores, que podrían estar implicados en impulsar la respuesta a la exposición al exposoma, para comprender la biología del cáncer de EA y su aumento en poblaciones jóvenes.
Patrones peculiares de evolución y crecimiento de los cánceres de EA: implicaciones para el diagnóstico temprano
La patogenia de los cánceres de EA, en particular el CCR de EA, presenta un área convincente de investigación translacional. Según el modelo de Fearon y Vogelstein, el CCR generalmente se desarrolla durante un período de 5 a 10 años siguiendo vías moleculares bien definidas. Este modelo está respaldado por evidencia clínica y principalmente por la eficacia de las campañas de detección basadas en colonoscopia actuales para reducir la incidencia de CCR en individuos con pólipos. Es fundamental evaluar si la progresión tradicional del «Vogelgrama» puede ocurrir más rápido, por ejemplo en solo uno a tres años, en individuos menores de 40 años donde el CCR de EA está aumentando más. Destacamos esta posibilidad ya que consideramos cuestionable que un tumor colónico pueda comenzar a crecer en individuos de 10 a 15 años en ausencia de una predisposición de la línea germinal. Por lo tanto, una posibilidad es que el impacto del exposoma actual en un patrón aún desconocido de factores de riesgo individuales en etapas tempranas de la vida podría inducir un evento desregulatorio masivo que puede afectar la cromatina y áreas específicas del ADN, como potenciadores y promotores de genes, lo que en última instancia conduce a un desarrollo más rápido del cáncer en adolescentes.
La posibilidad de un desarrollo acelerado del CCR-EA plantea consideraciones clínicas pragmáticas. De hecho, la anticipación de los protocolos de detección actuales, como las pruebas de sangre oculta en heces y la colonoscopia, solo puede ser eficaz para la detección temprana si el CCR-EA se desarrolla de acuerdo con las líneas de tiempo «clásicas» del modelo de Vogelstein. Esto es particularmente relevante en el CCR-EA ya que, en comparación con otros cánceres de EA, su mortalidad está aumentando y los procedimientos de detección más ampliamente aplicados son invasivos.
En consecuencia, el desarrollo de pruebas de detección no invasivas, como pruebas basadas en sangre que consideren las líneas de tiempo de la patogénesis del CCR-EA en individuos más jóvenes, teniendo en cuenta la edad de aparición, la velocidad de desarrollo del tumor y la biología del cáncer de EA, podría ser más relevante. La detección de ADN tumoral circulante (ctDNA) y los ensayos basados en proteómica plasmática podrían ser ventajosos en este entorno, lo que permite realizar pruebas más frecuentes dada la invasividad limitada, con la posibilidad de realizar una colonoscopia como procedimiento de seguimiento, en contraste con los cánceres en otros sitios (es decir, pulmón, páncreas) donde las investigaciones de seguimiento después de un resultado positivo La prueba de ctDNA puede ser más invasiva o menos definitiva. En este sentido, la monitorización de ctDNA puede ser eficaz para la detección temprana del CCR de inicio estándar. Sin embargo, su adopción como procedimiento de detección todavía se ve obstaculizada significativamente por varios factores, como la utilidad clínica desconocida (no hay pruebas definitivas de mortalidad relacionada con el cáncer, a pesar de que se sugiere un mayor cumplimiento), la baja sensibilidad para las lesiones premalignas, los altos costos analíticos sin análisis de costo-efectividad, las grandes cantidades de sangre requeridas (alrededor de 60 ml) y, finalmente, la especificidad limitada.
Una definición de cáncer de EA: ¿tumores sólidos esporádicos que surgen antes de los 40 años?
Establecer una definición operativa del umbral de edad del cáncer de EA es fundamental. La gran mayoría de los estudios actuales han adoptado un límite de edad preespecificado de menos de 50 años basado en la edad de entrada de las recomendaciones de detección que, sin embargo, carece de una justificación biológica. Dado que la incidencia de cáncer de EA está aumentando más entre los pacientes menores de 40 años, es más probable que centrarse en estos pacientes permita identificar las peculiaridades biológicas reales de los cánceres de EA. Hacerlo podría representar una estrategia ganadora pragmática. Dado que hasta la fecha estos pacientes representan aproximadamente un tercio de todos los casos de cáncer de EA, la creación de redes internacionales multiinstitucionales será crucial para obtener la cantidad necesaria de muestras para explotar experimentalmente y extraer conclusiones notables. Si bien confiar en la edad de 40 años como un límite pragmático para identificar a los pacientes con cáncer de EA para el muestreo y el perfil translacional puede ser práctico, esto aún podría representar una limitación en estudios de cohorte grandes centrados, por ejemplo, en los resultados del tratamiento entre los pacientes con cáncer de EA. Esto se debe a que, hasta la fecha, ningún límite de edad preespecificado se basa en una lógica biológica. En un contexto de investigación clínica, siempre que sea estadísticamente aplicable en cohortes de gran tamaño de muestra, la edad podría considerarse una variable continua (es decir, en el contexto de los biobancos traslacionales), evitando así el sesgo de un límite de corte preestablecido que no esté determinado biológicamente. De hecho, sugerimos que los límites de corte de edad se consideren instrumentales para el propósito de un estudio en lugar de un dogma al que adherirse siempre que se trate el tema de los cánceres de EA.
Hacia una mejora en el tratamiento clínico de los cánceres de EA
El hecho de que los cánceres de EA sean entidades biológicamente distintas con trayectorias evolutivas divergentes en comparación con sus contrapartes de aparición más tardía también puede tener implicaciones para la eficacia de las modalidades de tratamiento médico y quirúrgico. Los médicos son propensos a tratar en exceso a los pacientes con cáncer de EA con abordajes quirúrgicos y médicos más intensivos, a pesar del hecho de que este abordaje carece de evidencia de beneficios mejorados de supervivencia en comparación con la población de mayor edad, al tiempo que expone a los individuos jóvenes a más efectos secundarios que afectan su calidad de vida. Los autores y otros han planteado previamente la hipótesis de que un subconjunto de cánceres de EA puede responder de manera diferente a terapias que son típicamente efectivas en cánceres de inicio estándar, como la quimioterapia citotóxica y/o la inmunoterapia. No solo la presencia de firmas genéticas y epigenéticas específicas en los cánceres de EA puede hacerlos más resistentes a medicamentos que de otra manera son efectivos en pacientes mayores, sino que también el microambiente tumoral y la microbiota distintivos pueden influir en la eficacia de los medicamentos y los mecanismos de resistencia.
El desarrollo de estrategias de tratamiento personalizadas requerirá un perfil multiómico integral de los cánceres de EA para identificar (si existen) características moleculares subyacentes a las alteraciones que se pueden tratar con medicamentos. La evaluación del papel potencial de la colibactina podría ser fundamental para este fin. Además, la exploración de nuevos regímenes terapéuticos podría incluir combinaciones de terapias dirigidas nuevas o ya existentes, inmunoterapias y quimioterapias tradicionales para refinar de manera translacional la forma en que tratamos a los pacientes con cánceres EA. En general, estos esfuerzos de investigación no solo deben apuntar a mejorar la eficacia del tratamiento, sino también a minimizar los efectos adversos, mejorando así la calidad de vida general de los pacientes con cáncer más jóvenes tanto a corto como a largo plazo, en particular para aquellos que serán sobrevivientes de cáncer a largo plazo.
El integroma EA-cáncer
Desentrañar los efectos e interacciones de las exposiciones concomitantes y las predisposiciones subyacentes, junto con la tumorigénesis subyacente y las trayectorias evolutivas de los cánceres EA será un desafío. La integración efectiva de estudios epidemiológicos y de cohorte, análisis de exposición y datos clinicopatológicos, biobancos de muestras dedicados al cáncer EA y plataformas de modelos preclínicos derivados de pacientes será fundamental para el éxito (Figura 1). De hecho, la disponibilidad de muestras y modelos de cánceres de EA sigue siendo muy limitada, lo que obstaculiza el ritmo de investigación en este campo de manera similar a lo que sucedió en el pasado con neoplasias malignas raras, que se beneficiaron enormemente de la creación de redes internacionales. Se deben explotar diferentes tipos de modelos preclínicos en el campo de los cánceres de EA según el objetivo de cada pregunta de investigación específica: los tumores derivados del paciente o los xenoinjertos representan los mejores modelos para identificar opciones terapéuticas específicas , mientras que los organoides de la mucosa sana y los modelos de ratones in vivo podrían ser, en cambio, los más apropiados para comprender el papel potencial de la carcinogénesis y la promoción. Los modelos de cocultivo en lugar de los modelos de ratones in vivo podrían explotarse para investigar el papel del sistema inmunológico en los cánceres de EA .Una vez analizados, estos biorepositorios podrían brindar información crítica sobre el impacto de variables individuales y combinadas, impulsando nuevos conocimientos biológicos y oportunidades de tratamiento. En este contexto, será obligatorio un análisis integrado que incluya información clínica anamnésica, datos de exposomas, perfiles tumorales y de células normales emparejadas de alto nivel (es decir, genética, epigenética, transcriptómica, proteómica) y resultados generados experimentalmente en modelos preclínicos. Este enfoque, en última instancia, conserva el potencial de sustentar los efectos interactivos y proporcionar una comprensión más integral de la naturaleza multifactorial de la etiología y patogénesis del cáncer de ovario. Creemos que este enfoque es lo que finalmente conducirá al desarrollo del «integroma del cáncer de ovario». Ya se han dado los primeros pasos en esta dirección y se ha informado que es factible, como ya lo atestiguan las publicaciones recientes en el campo del cáncer colorrectal de ovario.
La integración de diferentes fuentes de datos es clave para abordar el desafío de los EA-cáncer, y la creciente disponibilidad de herramientas basadas en inteligencia artificial será fundamental para integrar diferentes ómicas, con datos clínicos y epidemiológicos. Esto implica diferentes diseños y plataformas de estudio, cada uno con su conjunto único de ventajas y desventajas.
Los modelos preclínicos también serán fundamentales para probar de manera mecánica y funcional las hipótesis que se han planteado en los párrafos anteriores. Tanto los modelos tumorales como los epiteliales sanos deben aprovecharse de manera efectiva para realizar experimentos de carcinogénesis y pruebas de detección de fármacos. La inmunoterapia ha demostrado inequívocamente que muchos tipos de tumores se desarrollan y se vuelven clínicamente evidentes en adultos debido a la supresión de la respuesta inmunitaria por parte del microambiente tumoral. Los linfocitos T aislados de muestras de tejido tumoral y células mononucleares de sangre periférica (PBMC) recolectadas de pacientes con cáncer de EA podrían cocultivarse in vitro con tumoroides derivados de tejidos tumorales para evaluar los fenómenos de edición inmunitaria del cáncer y determinar si las respuestas inmunitarias anticancerígenas provocadas en cánceres de EA son diferentes de los tumores de aparición tardía, y si existe una firma en las células T intratumorales y periféricas potencialmente asociada con fallas de la respuesta inmunitaria específicas para los tumores de EA. Más allá de estos sistemas de cocultivo, la explotación de modelos in vivo, principalmente murinos, podría ser fundamental para diseccionar el efecto de carcinógenos potenciales en un sistema que imite la exposición en humanos. Sin embargo, es importante reconocer las limitaciones in vivo debido a las diferencias entre los sistemas inmunitarios humanos y murinos, como el antígeno leucocitario humano (HLA) versus el complejo mayor de histocompatibilidad (MHC) de ratón en el reconocimiento de epítopos. Por lo tanto, los resultados de los estudios murinos deben interpretarse con cautela. Para mitigar estas limitaciones, se podría explorar el uso de modelos de ratón humanizados que imiten mejor la biología humana, como los modelos de ratón HLA transgénicos o mediante el injerto de células madre hematopoyéticas CD34+ humanas.
Por último, la computación avanzada y el modelado de datos serán fundamentales para extraer información significativa del vasto volumen de datos experimentales generados in silico y por vía húmeda. Por ejemplo, se han informado firmas específicas asociadas con la exposición a carcinógenos para una amplia gama de posibles exposiciones y podrían utilizarse de manera efectiva en este contexto.
Una limitación aún en debate: definir la lectura experimental
Una limitación de las plataformas experimentales mencionadas anteriormente sigue siendo la identificación de una lectura inequívoca. En este sentido, la identificación de características biológicas, genómicas y transcriptómicas distintivas del cáncer de EA (si existen) es clave para seguir avanzando. Por ejemplo, eventos disruptivos como la desmetilación del elemento nuclear 1 intercalado largo (LINE-1) o la cromotripsis podrían impulsar el desarrollo del cáncer EA y su ocurrencia podría usarse como un indicador en experimentos de carcinogénesis. Como se discutió previamente, la identificación de firmas genómicas relacionadas con la exposición a carcinógenos podría arrojar más luz sobre el daño del ADN inducido en cánceres EA incluso si la carcinogenicidad solo puede postularse tras la exposición. Es relevante que actualmente se desconoce si el aumento de diferentes tipos de cánceres EA, como EA-BC y EA-CRC, está impulsado por las mismas causas o por diferentes. Por supuesto, esto también podría tener un impacto significativo en el tipo de lectura compartida o diferente que se adopte en el entorno experimental traslacional.
Conclusiones
Identificar las causas de los cánceres EA es obligatorio para proteger a las próximas generaciones de esta epidemia sin precedentes. En este contexto, hemos destacado cómo los hallazgos clínicos, epidemiológicos y experimentales traslacionales deben integrarse para reunir un conocimiento integral de la biología de los cánceres EA.
Mi punto de vista:
El aumento en la frecuencia de cáncer EA está sobre todo determinada en EEUU. Mucho menos en Europa, Asia y África. Las causas del aumento en cáncer EA y no EA en EEUU, seguramente están relacionadas con el consumo obsesivo de alimentos procesados/ultra procesados y el consumo de bebidas no naturales plagadas de aditivos cómo preservantes y otros químicos. Esto ocurre desde la niñez y adolescencia, y ha dado lugar a un incremento fenomenal en la población obesa(desde la niñez en adelante) , diabetes mellitus, síndrome metabólico, toda esta patología se asocia a un proceso inflamatorio crónico; es el conjunto de estos eventos que está aumentando/acelerando la edad temprana en la que se detectan cánceres sobre todo en, colón/recto, mamá, riñones, gástricos y linfomas. Todos los países del mundo deberían aprender en cabeza ajena de lo que sucede hoy en EEUU y tomar las medidas obvias muy a la vista para evitar estos problemas de salud. Hoy es sexy y está de moda en la actividad científica usar los “omas”[exomas, genomas, microbiomas, etc), su verdadera valía y significado en la biología y en la medicina se verificará con el tiempo.