Aspectos destacados
- Los pacientes con tumores resistentes a la terapia anti-PD-1 presentan niveles elevados de sTim-3 en suero
- sTim-3 promueve la progresión tumoral y confiere resistencia anti-PD-1 en modelos tumorales
- sTim-3 promueve el agotamiento de las células T CD8+ y la resistencia al bloqueo de PD-1 a través de CEACAM-1
- El inhibidor de ADAM10 suprime la progresión tumoral y revierte la resistencia anti-PD-1
Resumen
La resistencia al bloqueo de PD-1 en oncoinmunoterapia limita en gran medida su aplicación clínica. La inmunoglobulina de células T y el dominio de mucina que contiene-3 (Tim-3), un objetivo de punto de control inmunológico prometedor, se escinde por ADAM10/17 para producir su forma soluble (sTim-3) en humanos, lo que potencialmente se involucra en la resistencia anti-PD-1. En este estudio, se observó una regulación positiva de sTim-3 en suero en el cáncer de pulmón de células no pequeñas (CPCNP) y varios tumores digestivos. Cabe destacar que la sTim-3 sérica se regula al alza en pacientes que no responden a la terapia anti-PD-1 para el CPCNP y en pacientes con colangiocarcinoma resistente a anti-PD-1.
Además, la sobreexpresión de sTim-3 facilita la progresión tumoral y confiere resistencia a anti-PD-1 en modelos murinos con tumores múltiples. Mecanísticamente, sTim-3 induce el agotamiento de las células T terminales y atenúa la respuesta de las células T CD8+ al bloqueo de PD-1 a través de la molécula de adhesión celular relacionada con el antígeno carcinoembrionario 1 (CEACAM-1). Además, el inhibidor de ADAM10 GI254023X, que bloquea la producción de sTim-3, reduce la progresión tumoral en ratones humanizados con Tim-3 y revierte la resistencia a anti-PD-1 en linfocitos infiltrantes de tumores (TIL) humanos. En general, sTim-3 humano tiene un gran potencial predictivo y terapéutico en oncoinmunoterapia.
=> Recibir por Whatsapp las noticias destacadas
En Detalle
Los tumores malignos, una de las principales causas de mortalidad y morbilidad a nivel mundial, plantean un riesgo sustancial para la salud humana. El agotamiento de las células inmunitarias, especialmente de las células T, es un mecanismo significativo que contribuye a la progresión tumoral que ocurre comúnmente dentro del microambiente tumoral (TME).
Las células T agotadas se caracterizan por una alta expresión de múltiples receptores inhibidores (como la proteína de muerte celular programada 1 [PD-1] y el antígeno asociado a los linfocitos T citotóxicos 4 [CTLA-4]), pérdida progresiva de funciones efectoras y disminución de la citotoxicidad para las células tumorales. En particular, la oncoinmunoterapia que utiliza el bloqueo de los puntos de control inmunitario (ICB), principalmente a través de anticuerpos anti-PD-L1/PD-1, rejuvenece las células T agotadas, lo que mejora la erradicación del tumor.
Además, los anticuerpos dirigidos contra PD-1/PD-L1 han demostrado resultados clínicos notables en el tratamiento de diversas neoplasias malignas, como el cáncer de pulmón de células no pequeñas (CPCNP), el melanoma y el carcinoma hepatocelular (CHC), lo que anuncia una nueva era de oncoinmunoterapia. Sin embargo, las terapias anti-PD-1 solo benefician a unos pocos pacientes con cáncer, y la mayoría desarrolla resistencia durante el tratamiento. En otras palabras, la aparición de resistencia a la inmunoterapia anti-PD-1 obstaculiza en gran medida su utilidad clínica. Por lo tanto, es imperativo identificar biomarcadores predictivos y dilucidar a fondo los mecanismos subyacentes a la resistencia anti-PD-1 en pacientes con cáncer.
La evidencia acumulada sugiere que las formas solubles de moléculas de puntos de control en sueros podrían servir como biomarcadores predictivos. Por ejemplo, se observaron niveles elevados de CTLA-4 soluble en pacientes con cáncer de mama y mesotelioma, un fenómeno que se correlacionó con la progresión del cáncer. Además, se informaron altas concentraciones séricas de sPD-1 y sPD-L1 en pacientes con linfoma de Hodgkin, melanoma y carcinoma hepatocelular, entre otras neoplasias malignas.
Las formas solubles de las moléculas de punto de control también realizan diversas funciones inmunomoduladoras. Por ejemplo, la expresión forzada de sPD-1 reprimió la progresión tumoral y prolongó la supervivencia de los ratones con carcinoma hepatocelular. Por el contrario, se informó que las variantes de empalme de PD-L1 secretada median la resistencia a la terapia anti-PD-1/PD-L1. Además, recientemente se informó que la combinación de sPD-L1 y sCTLA-4 discrimina la respuesta a la terapia de bloqueo de PD-1/PD-L1 en pacientes con CPNM de manera eficiente. En este sentido, una mayor exploración de factores inmunes solubles adicionales podría generar nuevos conocimientos, mejorando el desarrollo de estrategias predictivas para la terapia con ICB.
Se ha establecido que la inmunoglobulina de células T y el dominio de mucina que contiene-3 (Tim-3), una glicoproteína transmembrana tipo I descubierta por primera vez en 2002, se expresa en gran medida en células T agotadas durante la infección viral crónica y la progresión tumoral. Además, descubrimos anteriormente que Tim-3 regula las células inmunes y tumorales, agravando potencialmente la progresión tumoral.
La regulación positiva de Tim-3 también se ha identificado como un biomarcador potencial para la resistencia adaptativa al bloqueo de PD-1, con anticuerpos anti-Tim-3 que previenen la resistencia anti-PD-1. Además, la orientación simultánea de Tim-3 y PD-1 mejoró sinérgicamente la actividad antitumoral de las células T y suprimió el crecimiento tumoral. Estos hallazgos sugieren colectivamente que Tim-3 es un objetivo de inmunoterapia ICB altamente prometedor.
Se ha confirmado que existe en humanos una forma soluble de Tim-3 (sTim-3), generada a través de empalme alternativo a nivel de mRNA en ratones o desprendimiento de la molécula de superficie a través de las metaloproteinasas de matriz (MMP) ADAM10 y ADAM17 a nivel de proteína. Además, las investigaciones clínicas correlacionaron sTim-3 con la progresión de múltiples enfermedades, incluyendo sepsis, lupus eritematoso sistémico (LES), enfermedad de injerto contra huésped (EICH) e infección por HIV.
Sin embargo, hay una investigación biofuncional limitada sobre sTim-3, y los pocos estudios existentes han arrojado resultados contradictorios. En concreto, se ha demostrado que el segmento extracelular de Tim-3 murino, que es estructuralmente idéntico al sTim-3 escindido, mejora la proliferación de células T y la secreción de citocinas. Por el contrario, se ha informado de que la variante empalmada del sTim-3 de ratón obstaculiza la respuesta antitumoral mediada por células T. En este sentido, el papel preciso del sTim-3 humano en la progresión tumoral, así como el mecanismo de su interacción con la terapia anti-PD-1, sigue sin estar claro.
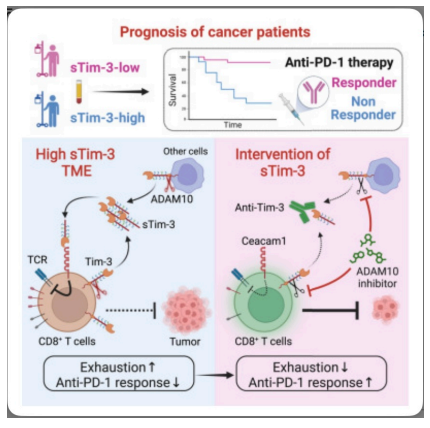
En este estudio Chen,et.al. [Cell Reports Medicine.Volume 5, Issue 8101686.August 20, 2024], descubrieron una importante regulación positiva del sTim-3 tanto en pacientes no respondedores sometidos a tratamiento anti-PD-1 para CPNM como en pacientes con colangiocarcinoma resistente a anti-PD-1. Además, el sTim-3 promueve la progresión tumoral y confiere resistencia a la terapia anti-PD-1 en modelos murinos de cáncer de hígado primario espontáneo. Además, sTim-3 incrementa el estado de agotamiento de las células T y suprime la respuesta de las células T CD8+ al bloqueo de PD-1 de una manera dependiente de la molécula de adhesión celular relacionada con el antígeno carcinoembrionario 1 (CEACAM-1).
Además, la administración del inhibidor de ADAM10, que bloquea eficazmente la producción de sTim-3, retarda la progresión del cáncer de hígado y revierte la resistencia anti-PD-1 en los linfocitos infiltrantes de tumores (TIL) aislados de pacientes con CHC. Con base en estos hallazgos, es plausible que sTim-3 pueda servir como un biomarcador para la progresión tumoral y la resistencia al tratamiento con bloqueo de PD-1. En general, la focalización de sTim-3 tiene un gran potencial en el tratamiento del cáncer.
En este estudio, Chen,et.al. [Cell Reports Medicine.Volume 5, Issue 8101686.August 20, 2024] exploramos el papel inhibidor de sTim-3 en la respuesta antitumoral y la terapia anti-PD-1 con varios tipos de modelos tumorales de ratón y TIL humanos. Además de arrojar luz sobre la evasión inmunitaria tumoral y la resistencia anti-PD-1, este estudio destacó a sTim-3 como un posible biomarcador y un objetivo terapéutico prometedor para la oncoinmunoterapia.
Se observó que sTim-3 estaba regulado positivamente en el CPCNP y en varios tumores digestivos. Además, los niveles elevados de sTim-3 en suero se correlacionaron con una supervivencia más corta, estadios tumorales más avanzados y una mayor carga tumoral en pacientes con CPCNP, lo que destaca a sTim-3 como un posible biomarcador de la progresión tumoral. Además, sTim-3 mostró una tendencia gradualmente creciente en la progresión del CHC relacionado con el HBV y se correlacionó positivamente con las concentraciones de ALT y AST.
Estos hallazgos fueron consistentes con los de un estudio reciente, que informó una mayor expresión de sTim-3 en pacientes con cirrosis por HBV en comparación con los portadores de HBV, lo que subraya aún más los roles potenciales de sTim-3 como un marcador de inflamación crónica. Cabe destacar que los pacientes con CPNM que no respondieron a la terapia anti-PD-1 también mostraron niveles más altos de sTim-3 que los respondedores.
De manera similar, los pacientes con colangiocarcinoma, que se ha informado que responde mal a la terapia anti-PD-1, mostraron niveles séricos más altos de sTim-3 que los pacientes con CHC. Estos hallazgos respaldan firmemente la utilidad clínica de sTim-3 como un biomarcador fácilmente detectable para el pronóstico tumoral y la respuesta a la terapia anti-PD-1. Además, la combinación de sTim-3 con otros biomarcadores potenciales, como sPD-L1, podría mostrar una mayor precisión para predecir la respuesta al bloqueo anti-PD-1 en pacientes con tumores, lo que justifica un estudio adicional.
Después de excluir el efecto directo de sTim-3 sobre la proliferación de células tumorales in vitro, descubrimos que sTim-3 promovía el crecimiento tumoral tanto en modelos de tumores de xenoinjerto subcutáneo como en modelos de cáncer de hígado espontáneo a través de la regulación de TME. Cabe destacar que sTim-3 es más que un simple biomarcador de resistencia a anti-PD-1, ya que podría inhibir directamente la respuesta al bloqueo de PD-1 en modelos tumorales de HCC y ICC ortotópicos.
Las investigaciones funcionales que involucraron CTL CD8+ de ratones y TIL humanos revelaron que sTim-3 altera la función efectora de las células T al tiempo que promueve el agotamiento de las células T y la resistencia al bloqueo de PD-1. Sin embargo, varios estudios han demostrado que el ectodominio de Tim-3 murino fusionado con IgG humana, con una estructura similar a la forma escindida, promueve la proliferación de células T y la producción de citocinas in vitro y suprime la inducción de tolerancia para acelerar la diabetes in vivo.
Las discrepancias se pueden atribuir al hecho de que la etiqueta Fc en la proteína recombinante podría alterar la función de sTim-3 o que sTim-3 podría desempeñar diferentes papeles en varias enfermedades. En consecuencia, se requiere investigación adicional para dilucidar aún más el papel de sTim-3 en diferentes enfermedades.
Dado que el papel promotor de tumores de sTim-3 no depende de Tim-3 de membrana, especulamos que sTim-3 podría funcionar como un ligando de ciertos receptores en las células T en lugar de como un competidor de Tim-3. Hasta ahora, se han identificado varios socios de unión de Tim-3, incluyendo Galectin-9, HMGB1, PS y CEACAM-1. Las investigaciones revelaron que sTim-3 no podía inhibir la producción de citocinas por las células T periféricas humanas. Además, se detectó la expresión de CEACAM-1 en células T infiltradas en tumores pero no en células T periféricas en humanos, lo que explica sus diferentes respuestas a sTim-3. Este hallazgo demostró que sTim-3 inhibe la función de las células T y la respuesta al bloqueo de PD-1 a través de CEACAM-1.
Según la investigación, ADAM10/17 desprendió el ectodominio, generando sTim-3 humano. Nuestros hallazgos revelaron que los tejidos tumorales exhibieron una mayor expresión de ADAM10/17 que los tejidos paratumorales. Dado que Tim-3 se expresa en gran medida en las células T que se infiltran en el tumor, es plausible que la alta expresión de ADAM10/17 en el TME medie la eliminación de Tim-3 de las células T. Además, el inhibidor de ADAM10 que bloquea en gran medida la generación de sTim-3 podría suprimir la progresión del CHC in vivo y revertir la resistencia anti-PD-1 en los TIL de pacientes con CHC.
Este fenómeno respalda el uso combinado de inhibidores de ADAM10 y anticuerpos PD-1 en oncoinmunoterapia. Además, se ha demostrado que algunos inhibidores de ADAM10/17 colaboran con varias terapias tumorales existentes para inhibir el crecimiento tumoral. Por ejemplo, se administró clínicamente un inhibidor dual de ADAM10/17 (INCB7839) junto con trastuzumab para tratar a pacientes con cáncer de mama metastásico HER2-positivo. Esta terapia combinada demostró seguridad y fue bien tolerada. En este sentido, se propone una nueva aplicación de los inhibidores de ADAM10/17 junto con las estrategias de oncoinmunoterapia existentes en el tratamiento del cáncer, un enfoque terapéutico que podría beneficiar a los pacientes tumorales con resistencia a anti-PD-1.
Utilizando ratones Tim-3 KO, que carecen tanto de Tim-3 unido a la membrana como soluble del huésped, verificaron la eficacia preliminar de los anticuerpos Tim-3 en la neutralización de sTim-3 en el modelo de CHC. Sin embargo, observaron niveles elevados de sTim-3 después del tratamiento anti-PD-1 en pacientes con CPNM, lo que planteó serias preocupaciones con respecto a la dosificación de los anticuerpos Tim-3 y su eficacia terapéutica para una posible aplicación clínica. En este sentido, se deduce que el hecho de que se haya demostrado que el tratamiento anti-PD-1 estimula las células T y que Tim-3 se regule positivamente durante la activación de las células T podría explicar la inducción de sTim-3 mediada por anti-PD-1.
Los avances recientes en la tecnología multiómica han mejorado enormemente nuestra comprensión de la heterogeneidad de las células T. Los estudios han demostrado que después del tratamiento anti-PD-1, varios subconjuntos de células T exhiben alteraciones únicas en sus capacidades proliferativas, funciones efectoras, actividades de anidación y expresión de marcadores de agotamiento. Se plantea la hipótesis de que la producción de sTim-3 inducida por el tratamiento anti-PD-1 podría atribuirse a cierto(s) subconjunto(s) de células T, que median la resistencia al tratamiento anti-PD-1.
Además, Tim-3 también es expresado por otras células inmunes y células tumorales, que también son fuentes potenciales de sTim-3. El uso de tecnologías multiómicas para identificar las células T asociadas a sTim-3 u otros subconjuntos de células representa una vía prometedora para futuras investigaciones. Además, ADAM10/17, altamente expresado en el TME, podría desprenderse continuamente de la membrana Tim-3. Por lo tanto, antes de emplear el anticuerpo Tim-3 como una intervención terapéutica, es imperativo realizar evaluaciones farmacocinéticas exhaustivas tanto en modelos preclínicos como en ensayos clínicos. Además, es esencial monitorear de cerca los niveles plasmáticos de sTim-3 en pacientes sometidos a terapia para identificar la ventana de tratamiento óptima.
En resumen, los hallazgos resaltan la importancia de sTim-3 en la mediación del escape inmunológico tumoral y la resistencia al bloqueo de PD-1. Como resultado, se propone sTim-3 humano como un biomarcador candidato para la progresión de varios tumores y la respuesta a la terapia anti-PD-1 con tremendas implicaciones terapéuticas. Además, los hallazgos respaldan firmemente la aplicación clínica de los anticuerpos Tim-3 para inhibir tanto la supresión inmunológica mediada por Tim-3 de membrana como soluble en oncoinmunoterapia. En general, apuntar al eje ADAM10-sTim-3-CEACAM-1 podría beneficiar a los pacientes con tumores resistentes a los anti-PD-1.
Ronald Palacios Castrillo