Ronald Palacios Castrillo
Resumen
El síndrome del intestino irritable (SII) es uno de los trastornos gastrointestinales más frecuentes, caracterizado por dolor abdominal recurrente y un patrón de defecación alterado.
El dolor abdominal crónico representa el síntoma distintivo del SII y se informa que tiene el impacto más molesto en la calidad de vida del paciente. Lamentablemente, no existen estrategias terapéuticas efectivas para reducir el dolor abdominal, debido principalmente a una comprensión limitada de los mecanismos que lo provocan.
En los últimos años, nuevos e interesantes conocimientos han señalado que la comunicación alterada entre las células inmunitarias intestinales y los nervios sensibles al dolor actúa como un factor distintivo del dolor abdominal relacionado con el SII. En esta revisión, Van Remoortel ,et.al., [Cell Reports Medicine, volumen 5, número 10,2024] resume su conocimiento actual sobre la comunicación neuroinmune alterada como el principal factor impulsor de la señalización alterada del dolor, con un enfoque específico en el funcionamiento alterado de los mastocitos, y destacar la relevancia de apuntar a los mecanismos mediados por los mastocitos como una nueva estrategia terapéutica para el dolor abdominal crónico en pacientes con SII.
=> Recibir por Whatsapp las noticias destacadas
Introducción
El síndrome del intestino irritable (SII) se presenta como un trastorno gastrointestinal (GI) crónico caracterizado por dolor abdominal asociado con hábitos intestinales alterados en ausencia de una causa orgánica. Por lo general, las pruebas de laboratorio, las investigaciones radiológicas y/o endoscópicas no logran identificar una causa subyacente de estos síntomas, y el diagnóstico del SII depende en gran medida del cumplimiento de los criterios diagnósticos de Roma IV (Figura 1A). Con base en el patrón de deposiciones predominante, los pacientes con SII se clasifican en cuatro subgrupos: SII con diarrea (SII-D), SII con estreñimiento (SII-E), SII con patrón de deposiciones mixto (SII-M) y SII no clasificado (SII-U).
La prevalencia del SII se estima en el 5%–20% de la población general, aunque esto depende de los criterios de diagnóstico utilizados. El SII no solo tiene un impacto social negativo considerable para los pacientes, sino que también reduce la productividad laboral y causa un uso desproporcionado de los recursos de atención médica.
Según la Fundación Internacional para Trastornos Funcionales del Sistema Gastrointestinal, la carga económica del SII en Estados Unidos (EE. UU.) se estima en 21 mil millones de dólares estadounidenses por año, mientras que en Europa el costo anual total estimado asciende a hasta 3000 euros/año por paciente. La etiopatogenia del SII es compleja e incluye alteraciones del eje microbiota-intestino-cerebro, reactividad postinfecciosa, sensibilidad a los alimentos y malabsorción. Actualmente, el tratamiento del SII se limita principalmente a los esfuerzos por corregir los patrones de defecación alterados mediante el uso de medicamentos antidiarreicos o laxantes.
Sin embargo, este enfoque produce resultados decepcionantes y a menudo deja a los pacientes desesperados, ya que su síntoma más debilitante, el dolor abdominal, permanece sin tratamiento. La angustia de los pacientes con SII a menudo se enfrenta a la incomprensión, incluso de los médicos, y ha alimentado la falsa creencia de que «su problema probablemente radica en la mente», como suelen citar los pacientes. Esto destaca una necesidad médica obvia de mejorar el tratamiento clínico del SII, que sigue sin satisfacerse debido a la falta de conocimiento de los mecanismos fisiopatológicos subyacentes del SII y, en particular, del dolor abdominal.
En los últimos 50 años, se ha producido una importante evolución en el enfoque de la investigación sobre la fisiopatología del SII. Inicialmente, se consideraba que el SII era un trastorno psicosomático sin ningún indicador macroscópico de enfermedad en el tracto gastrointestinal.
Con el desarrollo de nuevas herramientas para estudiar la función del tracto gastrointestinal en los años 70 y 80, la investigación sobre la fisiopatología del SII se desplazó hacia el estudio de los cambios en la motilidad gastrointestinal. Lamentablemente, la conexión entre los síntomas y la motilidad alterada sigue siendo limitada y no se ha traducido en opciones de tratamiento eficaces para el dolor abdominal.
En las últimas dos décadas, la hipersensibilidad visceral, en lugar de la dismotilidad, se ha convertido en el principal foco de investigación que vincula la fisiopatología del SII con el dolor abdominal.
La hipersensibilidad visceral es un término utilizado para describir la señalización anormal del dolor que se origina en las vísceras y que se manifiesta como una respuesta dolorosa a los estímulos normales (alodinia) o una respuesta dolorosa exagerada a los estímulos dolorosos (hiperalgesia) (Figura 1B).
Hasta la fecha, la hipersensibilidad visceral se considera un mecanismo patológico central subyacente al dolor abdominal, y ha quedado claro que obtener una mejor comprensión de los mecanismos que impulsan la hipersensibilidad visceral ofrece la promesa de nuevas opciones de tratamiento para esta población de pacientes.
En esta revisión, Van Remoortel ,et.al., [Cell Reports Medicine, volumen 5, número 10,2024] describiren cómo un enfoque translacional único que comienza desde el paciente hasta el laboratorio ha demostrado que los mastocitos y su mayor liberación de mediadores desempeñan un papel distintivo en el impulso del dolor abdominal en el intestino afectado por el SII. Analizan cómo se desencadena su actividad alterada, cómo esto contribuye a una mayor activación y sensibilización del eje de señalización del dolor intestinal y destacan la relevancia clínica de dirigirse a los mastocitos y sus mediadores como una nueva opción de tratamiento para el manejo del dolor abdominal en pacientes con SII.
De la cabecera del paciente al laboratorio: perspectivas mecanicistas del dolor abdominal en pacientes con SII
Hasta la fecha, se acepta ampliamente que la señalización anormal del dolor representa uno de los principales mecanismos involucrados en la patogenia del SII. A principios de la década de 1970, Ritchie informó un aumento de las respuestas al dolor en pacientes con SII en estudios con barostato rectal.
Los experimentos con barostato evalúan las respuestas al dolor al inflado gradual de un globo colocado en el recto de un paciente. Cabe destacar que los pacientes con SII experimentaron puntuaciones de dolor más altas en comparación con los controles sanos, lo que introdujo la idea de que la hipersensibilidad visceral podría ser un biomarcador importante para el SII. Es importante destacar que este hallazgo se ha confirmado repetidamente en más del 60% de los pacientes con SII y está fuertemente asociado con la gravedad de los síntomas gastrointestinales de los pacientes con SII.
Como era de esperar, se ha dedicado mucha investigación a comprender los mecanismos que contribuyen a esta señalización alterada del dolor. En esta sección, los autores se centran en los mecanismos involucrados en la señalización del dolor intestinal y describe cómo el uso de un enfoque translacional a partir del material del paciente ha permitido aclarar los mecanismos subyacentes a la hipersensibilidad visceral en pacientes con SII.
Un primer vistazo a la señalización del dolor intestinal
El intestino está inervado por dos intrincadas redes neuronales: una inervación intrínseca, llamada sistema nervioso entérico (SNE) o el “segundo cerebro”, y una inervación extrínseca, a menudo denominada “eje intestino-cerebro”.
Mientras que el SNE intrínseco representa un circuito neuronal local dentro de la pared intestinal que es capaz de mantener funciones gastrointestinales básicas como la secreción, la absorción y la motilidad, el eje intestino-cerebro permite la transmisión de sensaciones viscerales, incluido el dolor, desde el intestino hasta el sistema nervioso central (SNC). Dentro de este eje intestino-cerebro, la percepción del dolor está mediada por neuronas especializadas “detectoras del dolor”, también conocidas como nociceptores intestinales (Figura 2).
Las terminales nerviosas de los nociceptores intestinales residen en la pared intestinal y envían información a través de sus cuerpos celulares ubicados en los ganglios de la raíz dorsal (GRD) a la médula espinal y al sistema nervioso central (Figura 2). Como tales, los nociceptores intestinales son una clase de neuronas sensoriales especializadas en detectar y responder a estímulos reales o potencialmente dañinos, como estímulos térmicos, mecánicos o químicos.
Para permitir la detección de tales estímulos, las terminales nerviosas periféricas de los nociceptores intestinales están equipadas con una plétora de receptores y canales iónicos que se clasifican como pronociceptivos (o excitatorios) o antinociceptivos (o inhibidores). Los ejemplos típicos de receptores pronociceptivos/canales iónicos incluyen canales de potencial receptor transitorio (TRP) (TRPV1, TRPA1 y TRPV4), canales iónicos sensibles al ácido, receptores purinérgicos e histaminérgicos (H1-4R) y receptores activados por proteasa (PAR1-2), mientras que los receptores opioides y cannabinoides son ejemplos típicos de receptores antinociceptivos.
El equilibrio entre las señales de entrada pro y antinociceptivas que los nociceptores intestinales reciben en sus terminaciones periféricas determinará si transmitirán señales de dolor a la médula espinal y al cerebro. Esto implica que la señalización del dolor anormalmente aumentada observada en pacientes con SII puede ser resultado tanto de mayores entradas excitatorias como de entradas antinociceptivas reducidas a los nociceptores intestinales.
Mediadores y mecanismos implicados en la hipersensibilidad visceral
Un importante aporte a nuestra comprensión de los mediadores y mecanismos implicados en la hipersensibilidad visceral ha sido el uso del sobrenadante de biopsia de la mucosa derivada del paciente. Para generar el sobrenadante de la biopsia, pequeñas biopsias de la mucosa, obtenidas del paciente mediante colonoscopia, se incuban en una solución o medio fisiológico, lo que permite que los mediadores locales presentes en el tejido se difundan desde la biopsia al medio.
Los estudios han demostrado que el sobrenadante de la biopsia del SII contiene más histamina, proteasas y serotonina en comparación con el sobrenadante sano. La histamina es una amina biógena conocida principalmente por su papel en la causa de reacciones alérgicas y es producida principalmente por células inmunes innatas, específicamente mastocitos.
Se ha observado de manera constante un aumento de las proteasas, especialmente las serina proteasas, como la triptasa, producida por los mastocitos, y la tripsina-3, producida por las células epiteliales, en el intestino de los pacientes con SII. También se observaron niveles elevados de serotonina en biopsias colónicas de pacientes con SII-D, lo que probablemente se deba a un mayor número de células enteroendocrinas, aunque una mayor activación de los mastocitos también podría contribuir a una mayor producción de serotonina.
Es importante destacar que se sabe que todos estos mediadores activan los nociceptores, lo que favorece los efectos pronociceptivos sostenidos sobre los nociceptores intestinales debido a su mayor presencia en el entorno.
De hecho, la aplicación de sobrenadante de IBS a nociceptores intestinales murinos in vitro o in vivo induce una activación neuronal más pronunciada en comparación con el sobrenadante de biopsia sana, un efecto que se revierte al bloquear la señalización de histamina o proteasa.
De manera similar, el sobrenadante de IBS induce una mayor activación de las neuronas submucosas humanas en comparación con el sobrenadante sano, un efecto mediado por histamina, serotonina y proteasas, lo que indica además que una mayor presencia de estos mediadores en el microambiente de IBS juega un papel directo en la actividad neuronal alterada.
El aumento de la activación de los nociceptores intestinales también se ha relacionado con la regulación positiva de la expresión del receptor pronociceptivo y del canal iónico en la membrana plasmática de la neurona. Con respecto al IBS, varios estudios han sugerido una expresión y actividad alteradas de los canales TRP pronociceptivos como un mecanismo subyacente a la hipersensibilidad visceral.
Los canales TRP son una familia de canales iónicos controlados por ligando que normalmente se expresan en neuronas sensoriales nociceptivas.
Los canales TRP están altamente conservados en las distintas especies y su activación es un componente central de la nocicepción. Los informes indican una expresión elevada de TRPV1 en biopsias de pacientes con SII, que se correlaciona con la intensidad del dolor abdominal. Mediadores como la histamina y la serotonina, pero también el factor de crecimiento nervioso (NGF), pueden aumentar la expresión del canal TRP e inducir el transporte de canales TRP a la membrana celular de los nociceptores intestinales.
Mecanísticamente, dicha expresión aumentada de canales TRP pronociceptivos impulsa una mayor señalización nociceptiva tras la estimulación nociva.
Además de la mayor expresión del canal TRP pronociceptivo, la sensibilización de estos canales TRP también desempeña un papel central en la fisiopatología de la hipersensibilidad visceral en pacientes con SII. Dicha sensibilización se define como un funcionamiento aumentado del canal TRP, típicamente inducido por la fosforilación de residuos intracelulares, lo que resulta en un umbral de activación reducido y flujos de iones aumentados tras estimulación nociva.
En particular, la sensibilización de los canales TRP TRPV1, TRPV4 y TRPA1 se ha vinculado repetidamente con la fisiopatología del SII. Los pacientes con SII con hipersensibilidad visceral confirmada por estudios de barostato rectal informan una mayor percepción del dolor con la aplicación rectal del agonista TRPV1 capsaicina en comparación con los pacientes sin hipersensibilidad visceral.
Sorprendentemente, aunque estos pacientes informaron más dolor con la capsaicina rectal, la expresión de ARNm y proteína TRPV1 rectal fue similar entre los pacientes con SII y los individuos sanos, lo que indica que TRPV1 parece estar sensibilizado en lugar de expresarse en niveles más altos en esta cohorte de pacientes.
Esto se confirmó aún más mediante estudios in vitro, donde las neuronas DRG murinas expuestas a sobrenadantes de biopsia de pacientes con SII mostraron una mayor respuesta a la capsaicina en comparación con las neuronas expuestas al sobrenadante de sujetos sanos, lo que indica sensibilización a TRPV1.
En la misma línea, las respuestas de TRPV1 a la capsaicina se potenciaron en las neuronas submucosas rectales de pacientes con SII pero no en sujetos sanos. También se han observado hallazgos similares para otros Canales TRP como TRPV4 y TRPA1. En conjunto, ha quedado claro que hay mediadores bioactivos presentes en el microambiente de la mucosa del SII que causan una expresión y sensibilización alteradas del canal TRP, contribuyendo así a la señalización alterada del dolor en el SII (Figura 3).
Entre estos mediadores bioactivos, la histamina representa uno de los principales candidatos involucrados en la sensibilización del canal TRP en el SII. Como se describió anteriormente, se han reportado repetidamente niveles elevados de histamina en biopsias de mucosa de pacientes con SII.
En los nociceptores intestinales, la histamina típicamente envía señales a través del receptor de histamina 1 (H1R), iniciando cascadas de señalización intracelular mediadas por proteína G que impulsan la fosforilación y sensibilización del canal TRP corriente abajo. De hecho, la exposición de neuronas DRG murinas a la histamina sensibiliza directamente los canales TRPV1, TRPV4 y TRPA1, un efecto revertido por el antagonismo del receptor de histamina 1 o la inactivación del receptor.
De manera similar, los efectos sensibilizadores del sobrenadante del SII en TRPV1, TRPV4 y TRPA1 son revertidos directamente por el antagonismo de H1R, lo que indica además un papel directo de la histamina en la sensibilización del canal TRP.
Las proteasas también han estado implicadas en la sensibilización del dolor en el SII. Entre las diferentes clases de proteasas, se ha descubierto que las serina proteasas como la tripsina-3 y la triptasa aumentan en el microambiente del SII.
Estas proteasas pueden enviar señales a través de la activación de su receptor activado por proteasa cognado (PAR2) expresado en todo el cuerpo, incluso por inervación nociceptiva intestinal. PAR2 se activa por la escisión mediada por proteasa del extremo N extracelular del receptor, que a su vez actúa como un ligando que induce la señalización mediada por proteína G intracelular y la sensibilización descendente de los canales iónicos, como los canales TRP.
La evidencia de estudios preclínicos ha indicado que las proteasas pueden promover la hiperexcitabilidad de las neuronas DRG in vitro y la hipersensibilidad visceral in vivo, probablemente a través de la sensibilización de los canales TRP mediada por PAR2.
Más recientemente, se descubrió que los miembros de los receptores acoplados a proteína G relacionados con Mas (Mrgprs), Mrgpra3 y Mrgprc11, desempeñan un papel en la sensibilización de las aferencias intestinales en ratones a través de TRPA1, aunque sus supuestos ligandos y su papel exacto en la fisiopatología del SII aún deben estudiarse.
Finalmente, se sabe que los mediadores como el NGF y el factor neurotrófico derivado del cerebro aumentan la expresión y sensibilización del canal TRP, pero, aunque se han encontrado mayores niveles de estos factores de crecimiento en pacientes con SII, su papel exacto en la hipersensibilidad visceral sigue siendo difícil de determinar.
En conclusión, la mayor presencia de mediadores pronociceptivos en el SII El microambiente, junto con sus efectos posteriores sobre el funcionamiento del canal TRP en los nociceptores intestinales, desempeña un papel crucial en el aumento anormal de la señalización del dolor en pacientes con SII.
Curiosamente, todavía queda por desentrañar cómo se relaciona este aumento de la señalización del dolor con los hábitos intestinales alterados que se observan en el SII.
Por supuesto, los mediadores pronociceptivos que aumentan en el microambiente del SII, como la histamina y la serotonina que se encuentran en el sobrenadante del SII, no solo aumentan la excitabilidad de los nociceptores, sino que también afectan la actividad de las neuronas entéricas humanas que controlan la absorción/secreción y la motilidad. Alternativamente, la evidencia preclínica más reciente sugiere que el aumento de la actividad de los nociceptores intestinales también podría afectar la motilidad intestinal a través de una vía refleja espinal directa que afecta la actividad de las neuronas entéricas.
Los mastocitos atacan un nervio: el papel de la comunicación neuroinmune alterada en el síndrome del intestino irritable
Una pregunta importante que surge es de dónde provienen los mediadores que causan la señalización anormal del dolor. La respuesta a esta pregunta se encuentra en el sistema inmunológico del intestino. Aunque no se observa una inflamación macroscópica o microscópica obvia en los pacientes con síndrome del intestino irritable, la evidencia acumulada de las últimas décadas sugiere un papel importante de la activación inmunológica de las mucosas en los pacientes con síndrome del intestino irritable.
Ya a principios de la década de 2000, se observó un aumento duradero en el número de células T y células mononucleares en la mucosa de pacientes que habían desarrollado SII después de un episodio de gastroenteritis infecciosa aguda, un hallazgo que fue confirmado recientemente por un metanálisis.
Los datos que comparan la expresión génica de citocinas o la liberación de citocinas por biopsias de la mucosa entre SII e individuos sanos son bastante inconsistentes, al igual que los datos sobre los niveles séricos de citocinas en pacientes con SII, a menudo debido a pequeñas poblaciones de pacientes. Sin embargo, estudios más recientes que comprenden grupos de estudio más grandes han proporcionado evidencia de mayores niveles séricos y expresión génica de la mucosa de marcadores inflamatorios en subgrupos de pacientes con SII.
Asimismo, un enfoque de matriz de expresión génica imparcial reveló un subconjunto de pacientes (33%) que mostraron una regulación positiva de la interleucina-1β (3 veces), la prostaglandina sintasa PTGS2 (2,1 veces) y el receptor X2 acoplado a proteína G relacionada con Mas específico de los mastocitos. (MRGPRX2) (10,7 veces), pero estos cambios de expresión no estaban relacionados con los síntomas clínicos del SII. No obstante, los hallazgos de las investigaciones de las últimas dos décadas destacan claramente que la activación inmunitaria podría desempeñar un papel importante en la fisiopatología del SII.
Hasta la fecha, el vínculo entre la activación inmunitaria y el dolor abdominal en el SII reside en la activación de los mastocitos. Los mastocitos son miembros del sistema inmunitario innato, que se encuentran típicamente en las superficies mucosas, donde ejercen numerosas funciones fisiológicas, como la regulación del flujo sanguíneo, la coagulación y la cicatrización de heridas, la homeostasis tisular, la defensa antimicrobiana y la modulación del dolor.
Los mastocitos se activan clásicamente a través de la reticulación de los receptores de inmunoglobulina E (IgE) de alta afinidad (FcεRI) que se encuentran en su superficie por complejos antígeno-IgE.
Cada vez hay más pruebas que destacan el papel de los mecanismos independientes de la IgE, como la vía MRGPRX2, en la activación de los mastocitos. El intestino humano alberga distintos subtipos de mastocitos identificados en función de su expresión de proteasas. La mayoría de los mastocitos (98 %) de la mucosa contienen altos niveles de triptasa, pero poca o ninguna quimasa. Este subconjunto de mastocitos se suele denominar mastocitos mucosos (MMC).
En la submucosa, una capa más profunda de tejido conectivo que alberga una red de neuronas entéricas, vasos sanguíneos y tejido conectivo, solo una minoría de los mastocitos tienen un fenotipo MMC, mientras que hasta el 77% de los mastocitos contienen triptasa, quimasa y carboxipeptidasa.
Esto recuerda a los mastocitos del tejido conectivo (CTMC) que también se encuentran en la piel. Los mastocitos producen y liberan una gran cantidad de mediadores bioactivos, como histamina, proteasas, serotonina, citocinas y quimiocinas, lo que les otorga un papel importante en la fisiología tisular. Como se describió anteriormente, la inervación nociceptiva intestinal está equipada con receptores para estos mediadores; por lo tanto, los mastocitos son candidatos probables para transmitir información de daño o peligro potencial.
El vínculo entre los mastocitos y la fisiopatología del SII fue introducido por primera vez por Weston et al., quienes publicaron un artículo histórico que informaba un aumento en el número de MMC en el íleon terminal de pacientes con SII. En la misma línea, Barbara et al. ha informado de un aumento del número de mastocitos en las biopsias rectales de pacientes con SII. Sin embargo, observar el número de mastocitos como tal ha demostrado ser un biomarcador poco fiable, ya que algunos grupos no detectaron ninguna diferencia en el número de mastocitos entre pacientes sanos y con SII o incluso informaron de recuentos de mastocitos más bajos en las biopsias de pacientes con SII.
Es importante destacar que, en lugar de aumentos en el número absoluto de mastocitos, ha quedado claro que los cambios en el funcionamiento de los mastocitos son un sello distintivo de la fisiopatología del SII, que se caracteriza por una mayor actividad y liberación de mediadores. De hecho, se ha encontrado repetidamente que los niveles aumentados de mediadores de mastocitos, como la histamina y las proteasas, aumentan en la mucosa de los pacientes con SII.
Además, los mastocitos degranulados se encuentran muy cerca de los nervios de la mucosa en pacientes con SII, un hallazgo que se correlaciona con la frecuencia y la gravedad del dolor abdominal informado por estos pacientes. Más La evidencia directa que respalda un papel importante para el funcionamiento sobreexpresado de los mastocitos proviene de estudios funcionales que utilizan sobrenadante de biopsia de SII.
Como se describió anteriormente, la exposición in vitro de nociceptores intestinales murinos o neuronas submucosas humanas al sobrenadante de SII induce hiperexcitabilidad neuronal y sensibilización del canal TRP, efectos que pueden bloquearse al dirigirse a los mediadores de los mastocitos utilizando antagonistas de la histamina o inhibidores de la proteasa. In vivo, los estabilizadores de los mastocitos, los antagonistas de la histamina o los inhibidores de la proteasa reducen eficazmente la hipersensibilidad visceral en modelos murinos, lo que confirma directamente el papel causal de los mastocitos en la inducción y el mantenimiento de la hipersensibilidad visceral.
Estos hallazgos preclínicos resaltan el papel crucial de los mediadores derivados de los mastocitos como un impulsor central de la sensibilización neuronal, que en última instancia conduce al desarrollo de hipersensibilidad visceral y dolor abdominal crónico en pacientes con SII.
Nuevos conocimientos sobre los desencadenantes del dolor abdominal en el síndrome del intestino irritable
Faltan terapias eficaces para el dolor abdominal en pacientes con síndrome del intestino irritable, debido principalmente a una mala comprensión de los factores patobiológicos subyacentes a este trastorno. Como se ha comentado en las secciones anteriores, el aumento de la actividad de los mastocitos y la liberación de mediadores contribuyen a la sensibilización de los nociceptores y al dolor abdominal, pero los mecanismos que inician esta vía siguen siendo objeto de debate.
Aunque se han propuesto varios desencadenantes, como los alimentos, el estrés, la microbiota intestinal y la permeabilidad intestinal alterada o el llamado «intestino permeable», su vínculo con el dolor abdominal sigue siendo asociativo y a menudo carece de pruebas experimentales convincentes. Es interesante destacar que nuevos estudios translacionales centrados en el paciente han destacado el papel de los alimentos como un desencadenante importante de la activación de los mastocitos.
Eres lo que comes: La comida como desencadenante del dolor abdominal
La comida es un desencadenante importante de los síntomas en los pacientes con SII. La mayoría de los pacientes informan de un inicio rápido o una exacerbación de sus síntomas gastrointestinales tras el consumo de determinados alimentos, normalmente en las 3 h posteriores al consumo.
Curiosamente, hasta el 50% de los pacientes informan de un inicio de los síntomas en la hora siguiente al consumo y muestran un síndrome posprandial superpuesto (p. ej., dispepsia funcional). Estas observaciones implican que no solo el intestino grueso sino también el intestino delgado podrían estar implicados en la generación temprana de síntomas relacionados con los alimentos.
Entre estos alimentos, el trigo, el gluten, la leche y los productos lácteos, la cafeína, los alimentos grasos o picantes, los oligosacáridos/disacáridos/monosacáridos y polioles fermentables (FODMAP) o los alimentos ricos en aminas biógenas (alimentos fermentados) son los desencadenantes más frecuentes de sus síntomas. El papel de los FODMAP en la generación de síntomas está particularmente bien establecido en los pacientes con SII.
Los FODMAP son carbohidratos de cadena corta que se absorben mal en el intestino delgado y que causan distensión luminal, un desencadenante importante del dolor visceral en un intestino sensibilizado, como resultado de sus efectos osmóticos y su fermentación por las bacterias colónicas en el colon.
Estudios recientes han proporcionado evidencia emocionante de que ciertos alimentos también pueden desencadenar reacciones inmunomediadas en el tracto gastrointestinal de pacientes con SII. Bischoff y colegas inyectaron extractos de alimentos en la mucosa cecal de pacientes con síntomas abdominales crónicos y sospecha de alergia alimentaria.
Hasta el 77% de los pacientes, pero ninguno de los controles sanos, mostraron una reacción a al menos una inyección, caracterizada por una reacción local de roncha y erupciones.
Sorprendentemente, los antígenos inyectados que provocaron una reacción mucosa coincidieron con los alimentos que indujeron molestias en los pacientes. Además, las reacciones mucosas a los antígenos inyectados se asociaron con la activación de los mastocitos en el sitio de la inyección, pero no con mayores concentraciones de IgE total o específica del antígeno en el suero o reacciones cutáneas a los antígenos evaluados, excluyendo la alergia alimentaria.
El concepto de que los alimentos podrían desencadenar respuestas inmunes locales en la pared intestinal de los pacientes con SII se exploró más a fondo mediante estudios que utilizaron endoscopia láser confocal, una tecnología avanzada de imágenes endoscópicas que, junto con colorantes fluorescentes tópicos o intravenosos, permite una «biopsia óptica» para el diagnóstico en tiempo real. La aplicación de extractos de alimentos (trigo, levadura, gluten, leche de vaca) a la mucosa duodenal provocó una reacción positiva, con aumentos en los linfocitos intraepiteliales, formación de espacios interepiteliales y desprendimiento de células, en dos tercios de los pacientes en dos cohortes de pacientes con SII sin ninguna indicación clara de alergia alimentaria.
De interés, aunque el número total de mastocitos y eosinófilos fue similar entre los pacientes con SII y los controles, una reacción positiva a los antígenos alimentarios se asoció con la liberación de proteína catiónica de eosinófilos, lo que sugiere una mayor activación de los eosinófilos en la mucosa del SII, pero esto requiere más estudios.
En la misma línea, nuestro grupo demostró recientemente que la inyección de antígenos alimentarios en la mucosa del colon rectosigmoide de 12 pacientes con SII y 8 controles sanos provocó una reacción mucosa en los pacientes con SII pero no en los controles sanos.
Curiosamente, en la mayoría de los pacientes con SII, los antígenos alimentarios que causaban respuestas mucosas tras la inyección también fueron informados por el paciente como desencadenantes síntomas inducidos por los alimentos. En general, estos hallazgos recientes han proporcionado evidencia experimental importante de que los alimentos desencadenan una reacción mucosa local en pacientes con SII.
Relación de los alimentos con la alteración de la función de los mastocitos
La observación de que los pacientes con SII presentan respuestas mucosas a los antígenos alimentarios sugiere una ruptura de la tolerancia oral a los alimentos.
En estado estable, el sistema inmunitario de las mucosas está preparado para tolerar antígenos inocuos, como los relacionados con los alimentos, un concepto denominado tolerancia oral. La falta de inducción de la tolerancia oral o su pérdida provocará una respuesta inmunitaria tras la exposición al antígeno, que es responsable de enfermedades como la alergia alimentaria y la enfermedad celíaca.
En la alergia alimentaria, la pérdida de la tolerancia oral da lugar a la producción de anticuerpos IgE específicos del antígeno alimentario, lo que conduce a la activación de los mastocitos dependiente de IgE y a la desgranulación de los mastocitos tras la ingestión posterior del antígeno alimentario sensibilizante.
Los anticuerpos IgE específicos del antígeno alimentario se encuentran sistémicamente en pacientes alérgicos a los alimentos y pueden detectarse en el suero o mediante pruebas cutáneas. Sorprendentemente, a pesar de mostrar respuestas mucosas a los antígenos alimentarios, los pacientes con SII no responden a los antígenos alimentarios mediante pruebas cutáneas y no muestran mayores títulos de anticuerpos IgE específicos de los alimentos en suero.
Recientemente, ha surgido evidencia convincente que propone un papel para una respuesta local de IgE hacia los antígenos alimentarios en la activación de los mastocitos y el desencadenamiento del dolor abdominal en pacientes con SII. Uno de los principales factores de riesgo clínicos para el desarrollo del SII es la gastroenteritis infecciosa, un evento que planteamos como hipótesis podría alterar la tolerancia oral a los antígenos alimentarios, como se informó de manera similar en la enfermedad celíaca.
Se alimentó a ratones con el antígeno dietético ovoalbúmina (OVA) durante una enteritis infecciosa causada por Citrobacter rodentium.
Después de la eliminación de la infección, los ratones fueron expuestos nuevamente a OVA. Esto resultó en la activación de mastocitos dependiente de IgE y la sensibilización de los nociceptores intestinales por TRPV1 mediada por histamina, lo que llevó al desarrollo de hipersensibilidad visceral en estos ratones.
El tratamiento con anticuerpos bloqueadores de IgE o el uso de ratones deficientes en IgE impidió el desarrollo de hipersensibilidad visceral después de la reexposición a OVA. Sorprendentemente, al contrario de lo que se indica en los modelos de alergia alimentaria, los anticuerpos IgE específicos de OVA solo fueron detectables en el tejido colónico y no se encontraron en el suero.
Estas observaciones sugieren que, mientras que la alergia alimentaria resulta de una pérdida sistémica de la tolerancia oral a los antígenos alimentarios, el dolor abdominal inducido por alimentos en el SII resulta más bien de una pérdida local de la tolerancia a los antígenos alimentarios.
Cabe destacar que la mucosa de los pacientes con SII exhibió un mayor número de mastocitos sensibilizados por IgE ubicados en las proximidades de las terminaciones nerviosas, una observación que se correlacionó con la gravedad del dolor abdominal en estos pacientes.
En conjunto, estos hallazgos proporcionan un cambio de paradigma en la fisiopatología del SII y respaldan una base inmunológica del desarrollo del dolor abdominal en el SII, con un papel particular para los mastocitos.
Más allá de la activación mediada por IgE, los mecanismos independientes de IgE también pueden activar los mastocitos, lo que aumenta la posibilidad de que contribuyan al funcionamiento aberrante de los mastocitos en el SII. Las sustancias catiónicas llamadas secretagogos básicos, como la sustancia neuropeptídica P, pueden activar los mastocitos de una manera independiente de la IgE.
El receptor involucrado en estas respuestas, el receptor X2 acoplado a proteína G relacionada con Mas (MRGPRX2), fue descubierto recientemente. Cabe destacar que la activación de los mastocitos mediada por MRGPRX2 da como resultado una liberación de mediadores espaciotemporalmente distinta en comparación con la activación mediada por IgE.
La activación de MRGPRX2 da como resultado preferentemente la liberación de triptasa y serotonina en lugar de histamina, y se ha descubierto que la activación de su contraparte de ratón Mrgprb2 desencadena hipersensibilidad al dolor y picazón en la piel.
Como se mencionó anteriormente, encontramos una regulación positiva de 10,7 veces del ARNm que codifica MRGPRX2 en biopsias de la mucosa colónica de un subconjunto de pacientes con SII, lo que sugiere que la activación de los mastocitos mediada por MRGPRX2 en estos pacientes podría contribuir al desarrollo de la dolor, pero esto sigue siendo un tema de estudios futuros.
Del laboratorio a la cama del paciente: la focalización de los mastocitos como una nueva opción de tratamiento para el síndrome del intestino irritable
La estrategia actual de tratamiento clínico para los pacientes con síndrome del intestino irritable se centra principalmente en la corrección de los patrones de defecación alterados mediante medicación antidiarreica para los pacientes con síndrome del intestino irritable con diarrea o laxantes para los pacientes con síndrome del intestino irritable con eczema.
Lamentablemente, las terapias eficaces dirigidas al dolor abdominal siguen siendo muy limitadas. Sin embargo, el papel emergente de los mastocitos en la fisiopatología del síndrome del intestino irritable ha allanado el camino para nuevos estudios que prueben terapias dirigidas a los mastocitos como una nueva estrategia de tratamiento para el dolor abdominal en pacientes con síndrome del intestino irritable (Figura 4).
Tratamiento de la desgranulación de los mastocitos
Una posible terapia dirigida a los mastocitos es el uso de fármacos estabilizadores de los mastocitos. Los estabilizadores de los mastocitos, como el cromoglicato sódico y el ketotifeno, impiden la entrada de iones de calcio en los mastocitos activados, inhibiendo así la desgranulación de los mastocitos inducida por el calcio y la liberación de mediadores, lo que los convierte en una estrategia interesante para tratar a los pacientes con SII.
El estabilizador de mastocitos cromoglicato sódico se utiliza de manera eficaz para reducir los síntomas y la gravedad de los trastornos alérgicos de las vías respiratorias, como el asma y la rinitis alérgica, así como para reducir la diarrea y el dolor abdominal en pacientes con mastocitosis.
En un pequeño estudio piloto realizado con pacientes con SII-D, los pacientes tratados con cromoglicato sódico informaron una reducción significativa del dolor abdominal y una mejor consistencia de las heces, un efecto que se asoció con una reducción de los signos de activación de los mastocitos.
Asimismo, demostramos anteriormente que el tratamiento con ketotifeno, otro fármaco estabilizador de mastocitos, disminuyó la hipersensibilidad visceral y mejoró los síntomas, lo que confirma aún más el potencial terapéutico de los estabilizadores de mastocitos en el SII. Una alternativa a la estabilización general de los mastocitos podría ser dirigirse específicamente a los mecanismos de activación de los mastocitos, como el papel recientemente descubierto de la activación local de los mastocitos mediada por IgE en el dolor abdominal inducido por los alimentos.
En este contexto, el omalizumab es un anticuerpo anti-IgE monoclonal humanizado aprobado para el tratamiento del asma alérgica grave y recientemente también para la anafilaxia alimentaria. Este fármaco inhibe las respuestas alérgicas al unirse a los anticuerpos IgE séricos, evitando así la interacción con los receptores celulares de IgE expresados en los mastocitos. Curiosamente, informes de casos recientes describen una mejoría clínica de los síntomas del SII en pacientes con asma grave que recibieron omalizumab, lo que sugiere que también podría usarse como terapia para interferir localmente con la activación de los mastocitos mediada por IgE en pacientes con SII.
Además, la señalización independiente de IgE de MRGPRX2 ha avanzado significativamente como una nueva estrategia de tratamiento en afecciones cutáneas inflamatorias de tipo 2, como la dermatitis atópica. Aunque la señalización mediada por MRGPRX2 en el SII necesita más estudios, también podría ofrecer una nueva estrategia de tratamiento para subconjuntos de pacientes con SII.
Alternativamente, la señalización dirigida a los receptores de membrana que inhiben directamente la activación de los mastocitos también podría ofrecer nuevas posibilidades terapéuticas. Entre estos, la lectina similar a inmunoglobulina que se une al ácido siálico (Siglec)-8 (Siglec-8) es un receptor inhibidor expresado en los mastocitos que, al ser atacado por un anticuerpo monoclonal, ha demostrado inhibir directamente la activación de los mastocitos mediada por IgE y la inflamación alérgica no mediada por IgE, lo que lo convierte en un posible objetivo terapéutico para la actividad aberrante de los mastocitos en pacientes con SII.
Ataque a los mediadores de los mastocitos y su señalización
Dado que la activación y/o sensibilización de los nociceptores intestinales por mediadores derivados de los mastocitos desempeña un papel importante en la hipersensibilidad visceral, una estrategia alternativa para tratar el dolor abdominal es bloquear los efectos nociceptivos de estos mediadores.
El bloqueo de la señalización de la serotonina, un importante mediador de los mastocitos que se sabe que activa y sensibiliza a los nociceptores intestinales, se ha utilizado para tratar el dolor abdominal en pacientes con SII.
Hace veinte años se obtuvieron resultados alentadores con el antagonista del receptor 5-HT3 alosetrón, que mostró un alivio adecuado del dolor, una disminución de la urgencia y la frecuencia de las deposiciones y un aumento de la firmeza de las heces. Sin embargo, debido a efectos secundarios como la colitis isquémica, el uso de este compuesto está restringido actualmente en los EE. UU. mientras que no está disponible en Europa.
Estudios más recientes en Japón muestran resultados prometedores con ramosetrón, otro antagonista del receptor 5-HT3, en pacientes con SII-D con una mejoría global significativamente mayor, un aumento de la consistencia de las heces y una reducción del dolor y el malestar abdominal, lo que confirma aún más el potencial terapéutico del antagonismo del receptor 5-HT3. El uso de inhibidores de proteasas dirigidos a la actividad de las proteasas ha demostrado su eficacia como tratamiento para la hipersensibilidad visceral en modelos preclínicos, pero actualmente faltan estudios clínicos.
Recientemente, el uso de fármacos antihistamínicos dirigidos a la histamina y su vía de señalización en los nociceptores ha ganado interés como una posible opción de tratamiento para los pacientes con SII-D. Los fármacos antihistaminérgicos de segunda generación, como la ebastina, previenen la señalización mediada por histamina al bloquear selectivamente el receptor de histamina H1 y son la opción de tratamiento de primera línea para los trastornos de los mastocitos mediados por IgE, como la rinitis alérgica y la urticaria crónica.
Con base en las observaciones de que el bloqueo del receptor de histamina H1 previno la excitación neuronal por el sobrenadante de las biopsias del SII y redujo eficazmente la hipersensibilidad visceral en modelos preclínicos, se diseñó un estudio piloto que evaluaba el efecto del antagonista H1R ebastina en pacientes con SII.
Después de un período de tratamiento de 12 semanas, hasta el 46% de los pacientes que recibieron ebastina informaron un alivio de los síntomas significativamente mejorado y una reducción del dolor abdominal, en comparación con el 13% en el grupo tratado con placebo.
En consonancia con estos datos clínicos, los estudios con barostato rectal confirmaron una reducción significativa de los síntomas de hipersensibilidad visceral en pacientes con SII tratados con ebastina. Recientemente, un estudio de fase 2 aleatorizado, doble ciego y controlado con placebo confirmó aún más el potencial de la ebastina para mejorar el alivio global de los síntomas y la intensidad del dolor abdominal en pacientes con SII-D.
Observaciones finales
En los últimos años, ha quedado claro que una alteración de la comunicación neuroinmune subyace a la señalización aberrante del dolor en pacientes con SII.
En concreto, los mediadores de los mastocitos generan un microambiente pronociceptivo que impulsa el aumento de la señalización del dolor y la hipersensibilidad visceral.
El descubrimiento de que una infección gastrointestinal puede romper la tolerancia oral, lo que lleva a la producción local de anticuerpos IgE específicos de antígenos alimentarios y la activación de los mastocitos, es sin duda un gran avance en nuestra comprensión del SII, aunque los mecanismos inmunológicos previos que conducen a tales respuestas alérgicas locales en pacientes con SII siguen siendo desconocidos.
Sin duda, muchos otros factores, como el estrés, la microbiota y la permeabilidad intestinal alterada, pueden conducir potencialmente a la activación inmunitaria y la hipersensibilidad visceral y siguen siendo áreas interesantes de investigación futura.
En este sentido, la aparición de la ómica unicelular podría ofrecer una visión imparcial de los distintos estados transcripcionales o funcionales de las células inmunitarias en la pared intestinal de los pacientes con SII, así como de sus interacciones con otros tipos de células, lo que contribuirá aún más a nuestra comprensión mecanicista del dolor abdominal y la hipersensibilidad visceral en el SII.
Es importante destacar que los hallazgos de nuestra investigación básica se han traducido de manera eficaz en opciones de tratamiento novedosas y eficaces para los pacientes con SII. El uso de fármacos antihistaminérgicos existentes para prevenir las acciones pronociceptivas de los mediadores de los mastocitos sobre los nociceptores intestinales ha demostrado ser eficaz y tiene un gran valor terapéutico. En este sentido, un importante desafío futuro será aclarar los mecanismos que impulsan el dolor abdominal en los pacientes con SII que no responden al antagonismo del receptor H1.
En conclusión, un enfoque traslacional de laboratorio a la cabecera del paciente ha ofrecido nuevos conocimientos sobre los mecanismos subyacentes a la señalización aberrante del dolor en los pacientes con SII, y los esfuerzos continuos son prometedores hacia el descubrimiento de nuevas opciones de tratamiento eficaces para esta población de pacientes.
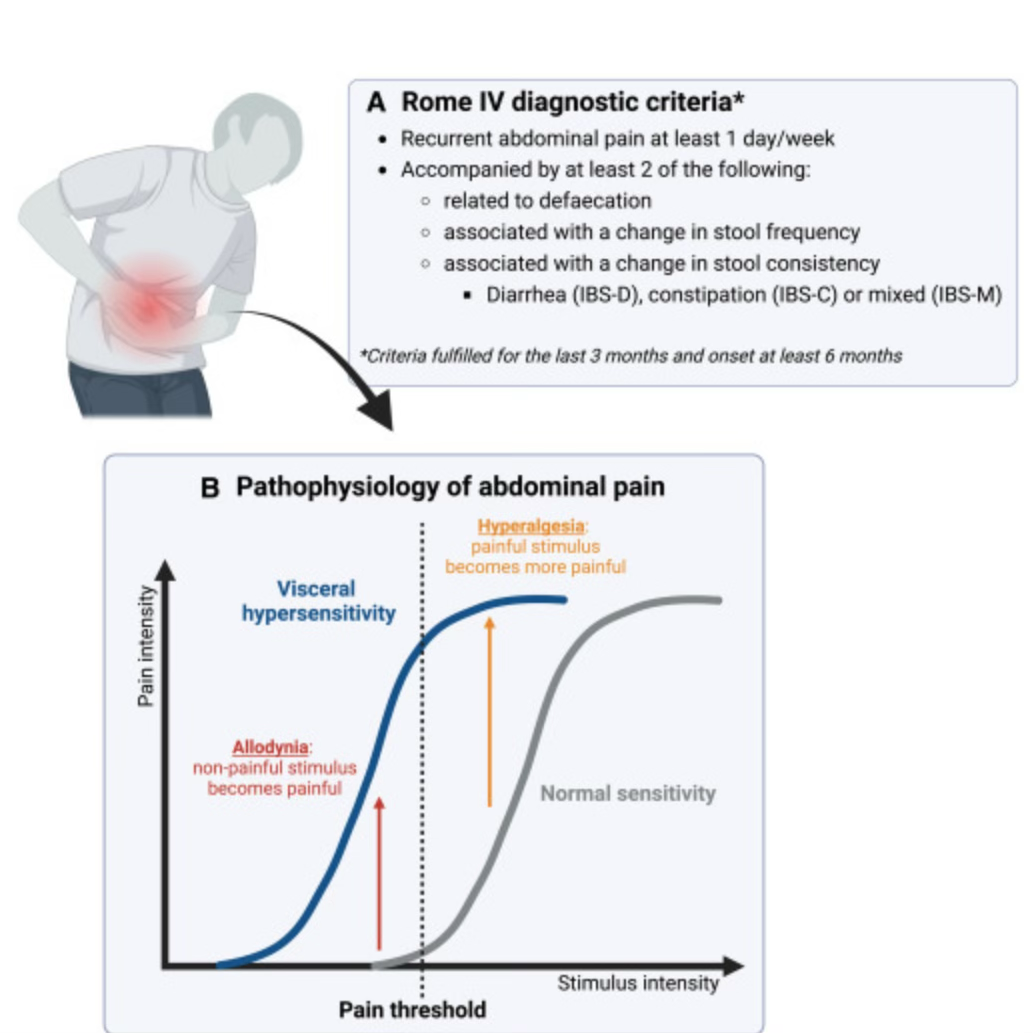
(A) Criterios de Roma IV para el diagnóstico clínico del SII.
(B) La hipersensibilidad visceral es la principal causa del dolor abdominal que experimentan los pacientes con SII y se presenta como una sensibilidad al dolor anormalmente aumentada en el intestino, caracterizada principalmente por alodinia (rojo) e hiperalgesia (naranja).
La alodinia se refiere al proceso en el que los estímulos que normalmente se perciben como no dolorosos se perciben como dolorosos. La hiperalgesia se refiere al proceso en el que los estímulos que normalmente se perciben como dolorosos se perciben como aún más dolorosos.
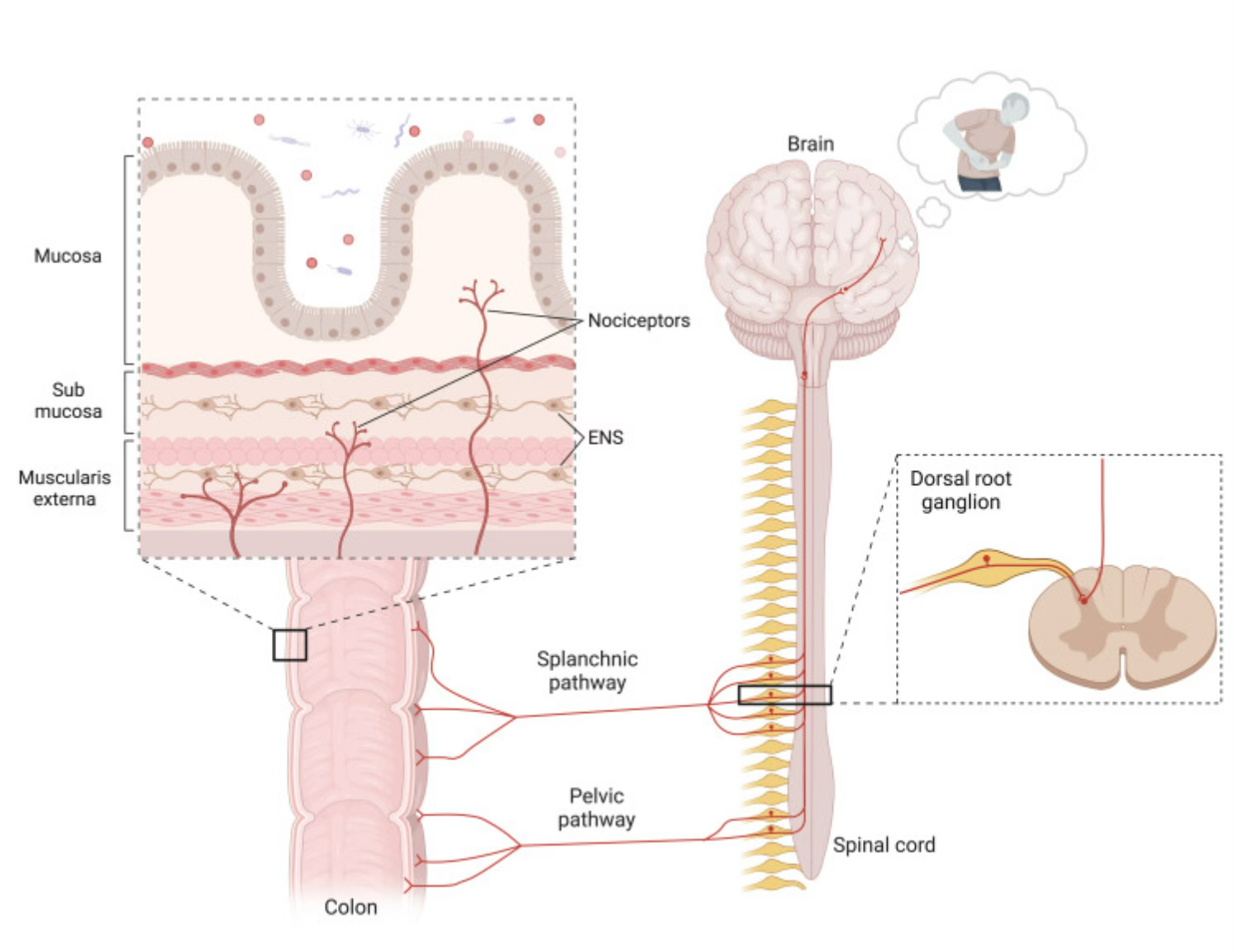
La sensación de dolor colónico está mediada por nervios aferentes especializados, los nervios esplácnico y pélvico, cuyos cuerpos neuronales pseudounipolares se encuentran en los ganglios de la raíz dorsal (GRD) ubicados cerca de la médula espinal. Las terminaciones nerviosas periféricas de estos nervios aferentes residen en las diferentes capas de la pared intestinal (mucosa, submucosa y muscularis externa), donde actúan como centinelas que detectan peligros potenciales.
A diferencia del sistema nervioso entérico (SNE), que comprende un circuito de señalización neuronal local e intrínseco, los nociceptores intestinales son parte de un eje de señalización extrínseco del intestino al cerebro que transmite sus señales de dolor a través de los nervios esplácnico y pélvico al GRD y la médula espinal. En el asta dorsal de la médula espinal, esta entrada nociceptiva es integrada por neuronas de la médula espinal y luego transmitida hacia el cerebro, lo que da como resultado la percepción del dolor. ENS, sistema nervioso entérico.
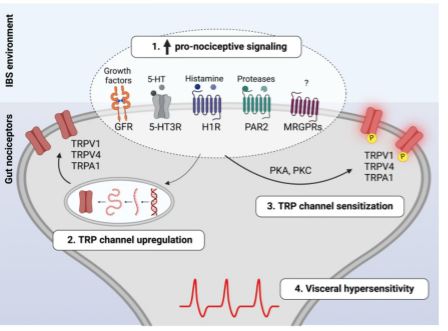
Figura 3 Mecanismos moleculares implicados en la señalización anormal del dolor en pacientes con SII
El microambiente del SII se caracteriza por mayores niveles de mediadores pronociceptivos como serotonina, histamina, proteasas, factores de crecimiento, etc. A través de la activación de sus receptores afines en las terminaciones nerviosas nociceptivas intestinales, estos mediadores pueden activar y modular directamente el funcionamiento de los nociceptores intestinales (1).
El aumento de la señalización por mediadores pronociceptivos induce una mayor expresión y regulación positiva de los canales iónicos pronociceptivos, principalmente canales TRP (2). Además, los mediadores pronociceptivos desencadenan cascadas de señalización intracelular que activan las proteínas quinasas posteriores, lo que da como resultado la fosforilación y sensibilización del canal TRP (3).
En conjunto, estos mediadores pronociceptivos y sus efectos sobre el funcionamiento del canal TRP son el mecanismo distintivo que subyace a la excitabilidad aberrante de los nociceptores en pacientes con SII. GFR, receptor del factor de crecimiento; 5-HT, serotonina; 5-HT3R, receptor de serotonina 3; H1R, receptor de histamina 1; PAR2, receptor 2 activado por proteasa; MRGPRs, receptores acoplados a proteína G relacionados con Mas; TRP, potencial transitorio del receptor; PKA, proteína quinasa A; PKC, proteína quinasa C.
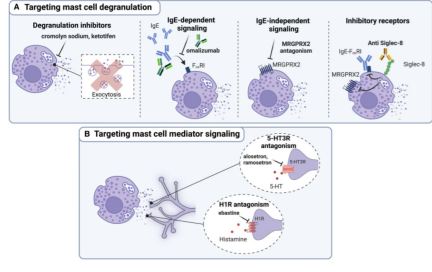
Figura 4 Terapias dirigidas a los mastocitos como nueva estrategia de tratamiento para el síndrome del intestino irritable
(A) Una estrategia terapéutica eficaz consiste en dirigirse a la desgranulación aumentada de los mastocitos intestinales. Esto se puede lograr utilizando fármacos estabilizadores de los mastocitos (cromoglicato sódico, ketotifeno), que bloquean la exocitosis y, por lo tanto, evitan la liberación de mediadores por los mastocitos activados.
Un enfoque alternativo consiste en evitar la activación dependiente o independiente de IgE de los mastocitos. Para la señalización dependiente de IgE, esto se puede lograr mediante anticuerpos anti-IgE monoclonales (omalizumab) que se dirigen a los anticuerpos IgE y, por lo tanto, evitan la unión de los anticuerpos IgE a los receptores FcεRI en los mastocitos intestinales.
Para la señalización independiente de IgE, esto se podría lograr mediante antagonistas del receptor MRGPRX2. Alternativamente, Siglec-8 es un receptor inhibidor expresado en los mastocitos que, tras la activación por anticuerpos monoclonales anti-Siglec-8, inicia cascadas de señalización intracelular que previenen la activación mediada y no mediada por IgE, lo que resulta en la desgranulación de los mastocitos.
(B) Dirigirse a la señalización de los mediadores de los mastocitos representa una estrategia terapéutica muy prometedora en el SII.
Este enfoque terapéutico se basa en bloquear los receptores de mediadores pronociceptivos de los mastocitos, como la serotonina (alosetrón, ramosetrón) o la histamina (ebastina), previniendo así eficazmente la señalización pronociceptiva en la inervación del dolor intestinal. IgE, inmunoglobulina E; FceR1, receptor de inmunoglobulina E; 5-HT, serotonina; 5-HT3R, receptor de serotonina 3; H1R, receptor de histamina 1.