Ronald Palacios Castrillo
Candida auris se identificó por primera vez en 2009, en un aislamiento del canal auditivo de un paciente en Japón (“auris” es la palabra latina para “oreja”), y ha surgido rápidamente como una amenaza grave para la salud pública mundial.
La especie, que se ha extendido por más de 45 países en seis continentes, se subdivide en cinco clados (I a V) con distribuciones geográficas distintas (vea el gráfico interactivo, disponible con el texto completo de este artículo en NEJM.org).
C auris es de particular preocupación debido a su capacidad de adherirse a la piel humana y a objetos inanimados y de persistir, causando con frecuencia brotes difíciles de controlar en los centros de atención médica.
La identificación errónea de C. auris como otra especie de cándida, una comprensión incompleta de sus reservorios ambientales, la alta morbilidad y mortalidad asociadas con infecciones invasivas y la resistencia de C. auris a varias clases de agentes antimicóticos representan desafíos adicionales para brindar una atención eficaz al paciente.
=> Recibir por Whatsapp las noticias destacadas
Los graves riesgos que plantea C. auris llevaron a los Centros para el Control y la Prevención de Enfermedades (CDC) a clasificarlo como una amenaza urgente en el informe Amenazas de resistencia a los antibióticos de 2019. De manera similar, la Organización Mundial de la Salud (OMS) colocó recientemente a C. auris en el grupo «crítico» de patógenos fúngicos humanos, lo que indica una necesidad urgente de priorizar la investigación para mejorar el diagnóstico, el tratamiento y los resultados en pacientes afectados por este hongo oportunista.
Características micológicas
- auris es una levadura en ciernes estrechamente relacionada con C. haemulonii y C. duobushaemulonii que, a diferencia de C. albicans, rara vez forma pseudohifas o hifas. A diferencia de otras especies de Candida, C. auris prospera en condiciones de alta salinidad y alta temperatura (como se analiza a continuación). Esta adaptabilidad puede explicar su persistencia en entornos hostiles y se ha postulado que es una adaptación ambiental al cambio climático. El cambio climático también puede explicar la aparición simultánea de C. auris en diversas regiones geográficas en todo el mundo. Por lo tanto, el calentamiento global puede haber permitido a C. auris atravesar la «barrera endotérmica» humana, que es un factor importante en la resistencia humana a la infección por hongos ambientales. Sobre la base de esta hipótesis, C. auris puede ser el primer hongo patógeno que haya surgido en humanos debido al cambio climático, aunque otros factores también pueden haber contribuido a su aparición global. La secuenciación del genoma completo de cepas clínicas de C. auris ha identificado cinco clados geográficamente distintos que tienen diferentes propiedades de virulencia, características clínicas y perfiles de resistencia a fármacos (que se analizan a continuación): el clado del sur de Asia (I), el clado del este de Asia (II), el clado africano (III), el clado sudamericano (IV) y un clado iraní informado más recientemente (V) (Figura 1).
PUNTOS CLAVE
INFECCIONES POR CANDIDA AURIS
Desde 2009, cuando se identificó por primera vez, Candida El C. auris se ha propagado rápidamente por más de 45 países en seis continentes; se ha subdividido en cinco clados con distribuciones geográficas distintas.
- auris puede identificarse erróneamente como otras especies de Candida en ciertas pruebas microbiológicas.
- auris persiste durante largos períodos en la piel humana y en objetos inanimados, lo que con frecuencia causa brotes difíciles de controlar en los centros de atención médica.
- La colonización de la piel por C. auris es un factor de riesgo para la candidemia posterior, que puede desarrollarse en hasta el 25% de los pacientes gravemente enfermos que están colonizados por el hongo.
- La mayoría de las cepas de C. auris son resistentes al fluconazol, y algunas cepas son resistentes a todas las clases disponibles de medicamentos antimicóticos.
- Las equinocandinas son el tratamiento de elección para los pacientes con infección invasiva por C. auris, pero el riesgo de fracaso del tratamiento y de recaída de la infección después de la terapia antimicótica es mayor con C. auris que con otras especies de Candida.
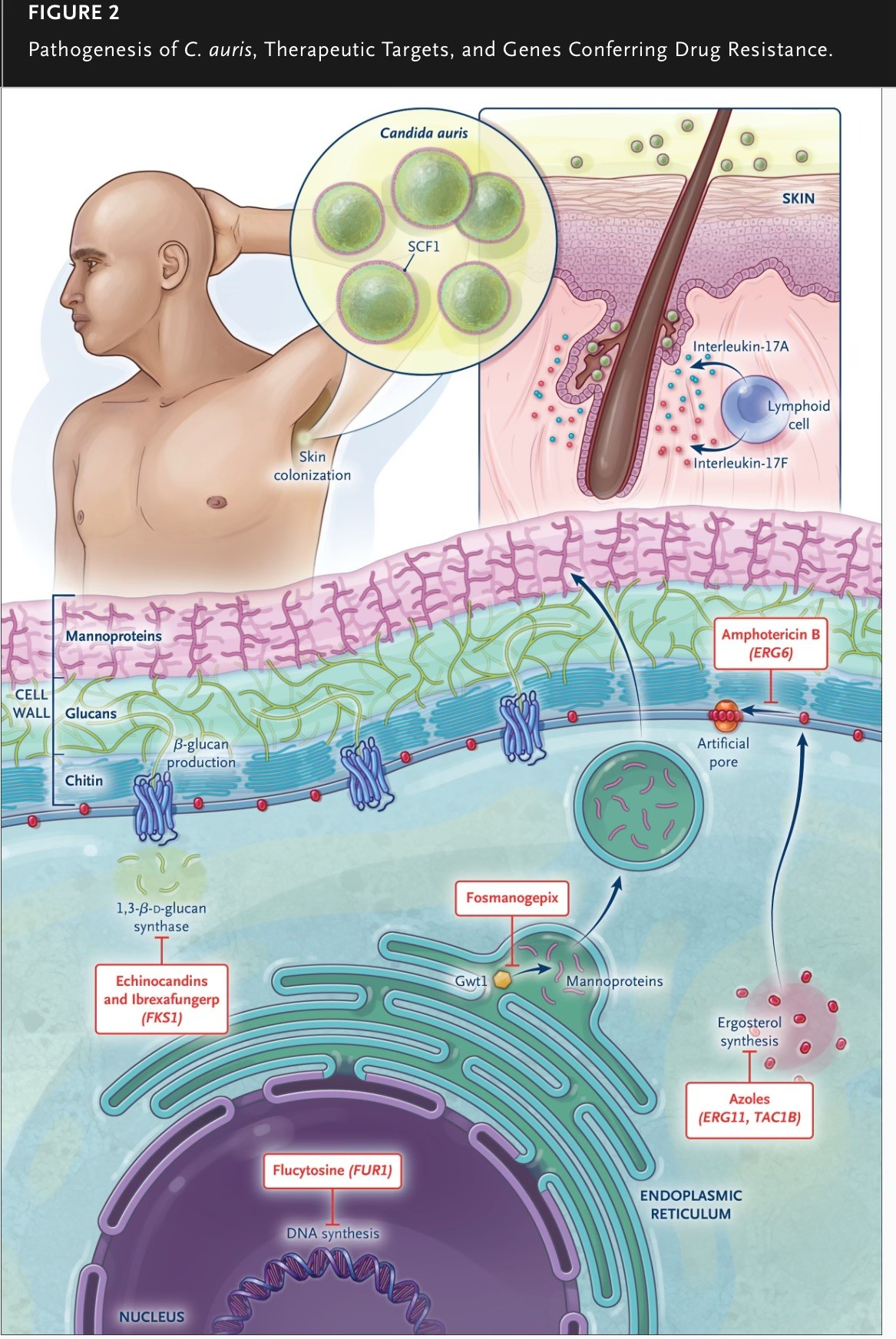
- auris es particularmente hábil para colonizar la piel humana y las superficies abióticas, incluidos los dispositivos médicos. Los modelos de piel ex vivo de cerdos y humanos y los modelos de colonización de la piel en ratones han demostrado la capacidad de C. auris para mantener la colonización y han resaltado la capacidad del organismo para formar biopelículas multicapa cuando se expone al sudor humano y para residir dentro de los folículos pilosos y penetrar las capas profundas de la piel, evadiendo la detección clínica. El reciente descubrimiento del factor de colonización de la superficie de adhesina específico de C. auris (Scf1) ha subrayado la participación crucial de esta adhesina en la formación de biopelículas, la colonización de la piel y los dispositivos médicos y la virulencia durante las infecciones invasivas (Figura 2), descubriendo un objetivo prometedor para la intervención terapéutica.
FIGURA 2
Patogénesis de C. auris, objetivos terapéuticos y genes que confieren resistencia a los fármacos.
Respuesta inmunitaria
La producción de interleucina-17A e interleucina-17F por parte de las células linfoides innatas y adaptativas es fundamental para disminuir la colonización y la invasión de la piel por C. auris, lo que es coherente con el papel fundamental de la señalización de la interleucina-17 en la lucha contra la cándida en las barreras mucocutáneas (Figura 2).
Por lo tanto, los agentes biológicos que se dirigen a la vía de la interleucina-17, que se utilizan a menudo para tratar la psoriasis, pueden aumentar el riesgo de colonización de la piel por C. auris.
Aunque los linfocitos son cruciales para controlar la colonización de la piel por C. auris, la eliminación de la sangre y los órganos profundos depende de los fagocitos, principalmente monocitos, macrófagos y neutrófilos. C. auris evade eficazmente la fagocitosis y la eliminación por los neutrófilos, una característica que se atribuye a su estructura de manano, que difiere significativamente de la de C. albicans.
Una estrategia de vacuna que aprovecha la secuencia similar a la aglutinina de la adhesina fúngica 3, que anteriormente se encontró que era eficaz para reducir los episodios de vaginitis en mujeres con candidiasis vulvovaginal recurrente, impulsó la eliminación de hongos dependiente de macrófagos y disminuyó la mortalidad y el crecimiento de hongos entre ratones con infección sistémica por C. auris, revelando una estrategia preventiva prometedora para pacientes vulnerables.
Características epidemiológicas
- auris se propagó rápidamente por todo el mundo en el plazo de una década tras el informe inicial en Japón en 2009. Se han notificado importantes brotes de infecciones del torrente sanguíneo por C. auris en centros sanitarios de todo el mundo, en particular en India, Pakistán, Sudáfrica, Kenia, Reino Unido, España, Singapur, Venezuela, Colombia, Brasil y Estados Unidos . En Sudáfrica y la India, C. auris ha sido responsable de hasta el 25% y el 40% de los casos de candidemia, respectivamente, en ciertos entornos de atención médica .
La secuenciación del genoma completo de los aislamientos de C. auris ha demostrado la aparición simultánea de clados genéticamente no relacionados en seis continentes.
Tres de estos clados (I, III y IV) divergieron de un ancestro común en los últimos 30 años, mientras que el clado más antiguo (II) divergió hace aproximadamente 400 años.
Cada clado tiene muy pocos polimorfismos de un solo nucleótido distintos, lo que sugiere que se ha producido una expansión clonal dentro de la región.
Las investigaciones epidemiológicas moleculares de los brotes de C. auris suelen mostrar agrupaciones de aislamientos estrechamente relacionados, lo que respalda la transmisión local y continua.
Además, la detección de aislamientos de diferentes clados en cada uno de los cuatro países (Alemania, Reino Unido, Singapur y Estados Unidos) sugiere que hubo múltiples introducciones en estos países, seguidas de transmisión local.
En los Estados Unidos, C. auris se notificó por primera vez en 2016, y el número de casos notificados cada año a partir de entonces ha aumentado, con aumentos del 95% y el 200% en los casos clínicos y de vigilancia, respectivamente, que se produjeron en 2021.
Aunque los casos iniciales de infección por C. auris en los Estados Unidos fueron principalmente importados, la transmisión local en entornos de atención médica ha sido responsable del aumento significativo de los casos notificados en los últimos años.
En los Estados Unidos, la colonización en pacientes y la transmisión en curso se informan principalmente en centros de atención a largo plazo, en particular en hospitales de cuidados agudos a largo plazo y centros de enfermería especializada equipados con respiradores.
La piel de los residentes de hogares de ancianos puede estar colonizada crónicamente con C. auris y sirve como un reservorio importante para su propagación. C. auris contamina ávidamente pisos de hospitales, barandillas de camas, equipo médico, carritos, teléfonos celulares, bandejas de camas, alas de aire acondicionado y superficies de lavabos, lo que contribuye a la transmisión continua dentro de los centros de atención médica. Además, se ha sugerido un posible papel de la transmisión nosocomial a través de la dispersión aérea.
Más allá de los entornos de atención médica, C. auris ha sido aislado de humedales costeros en las Islas Andamán y Colombia, de manzanas almacenadas, de aguas residuales durante la vigilancia después de un brote en Nevada, y de la boca, orejas y piel de perros en India y Estados Unidos. La rápida propagación de C. auris y su presencia en el medio ambiente y en los animales resaltan la importancia para la salud pública de monitorear de cerca este patógeno fúngico.
Factores de riesgo
Los factores de riesgo de colonización e infecciones invasivas por C. auris son similares a los de otras especies de Candida y a los de muchos otros microorganismos resistentes a múltiples fármacos, como las bacterias entéricas productoras de carbapenemasas.
Estos factores incluyen edad avanzada; presencia de dispositivos médicos permanentes, como catéteres venosos centrales o urinarios; ciertas afecciones coexistentes, como diabetes mellitus y enfermedad renal neoplásica o crónica; nutrición parenteral total; ventilación mecánica; hemodiálisis; estados inmunocomprometidos, como neutropenia, uso de glucocorticoides o recepción de un trasplante de órgano; cirugía reciente; enfermedad grave por coronavirus 2019 (Covid-19); y tratamiento reciente con antibióticos o antimicóticos de amplio espectro, que pueden enriquecer las condiciones para el desarrollo de comunidades microbianas cutáneas permisivas a C. auris.
Los pacientes afectados suelen tener estancias prolongadas en un hospital o unidad de cuidados intensivos, a menudo más largas que las de los pacientes con candidemia causada por otras especies de Candida, un hallazgo consistente con la naturaleza adquirida en el hospital de las infecciones invasivas por C. auris.
Además, la colonización cutánea previa por C. auris es un factor de riesgo para infecciones invasivas posteriores, y la candidemia se desarrolla en hasta el 25% de las personas gravemente enfermas que son colonizadas.
Manifestaciones clínicas
Los pacientes pueden ser colonizados con C. auris sin tener signos o síntomas clínicos. El sitio más común de colonización es la piel, principalmente en las fosas nasales, las axilas y las ingles.
La colonización del tracto gastrointestinal o urogenital ocurre con menos frecuencia. Este patrón de colonización difiere del observado con otras especies de Candida, como C. albicans y C. glabrata, que colonizan predominantemente el tracto gastrointestinal humano.
Las infecciones de las mucosas, incluidas la candidiasis oral, la candidiasis esofágica y la candidiasis vulvovaginal, son poco frecuentes con C. auris. Al igual que con otras especies de Candida, las infecciones invasivas por C. auris se manifiestan principalmente como candidemia, con o sin sepsis asociada, pero C. auris puede propagarse hematógenamente a sitios anatómicos distales.
C. auris se ha aislado de los líquidos cefalorraquídeo, pleural, pericárdico, biliar y peritoneal y se ha informado que causa miocarditis, pericarditis, meningitis, infección hepatoesplénica, osteomielitis, infecciones del tracto urinario, endoftalmitis, infecciones de oído e infecciones de heridas, así como enfermedad derivada del donante después del trasplante de pulmón.
La candidemia asociada a C. auris y la candidiasis invasiva pueden poner en peligro la vida, con tasas de letalidad bruta informadas que oscilan entre el 30 y el 60%.2,3 Sin embargo, la mortalidad atribuible es difícil de cuantificar con precisión debido a las condiciones agudas y crónicas concurrentes.
Diagnóstico
El análisis de muestras obtenidas con fines clínicos o de detección es la piedra angular del diagnóstico de laboratorio de la infección por C. auris.
El aislamiento de C. auris en el cultivo es importante para informar los patrones de susceptibilidad a los antimicóticos. C. auris se puede cultivar fácilmente a partir de sangre, orina, esputo, otros fluidos corporales y tejido en medios micológicos y de laboratorio de rutina, como el agar dextrosa
Sabouraud. Morfológicamente, C. auris no se puede distinguir de otras especies de Candida. Sin embargo, a diferencia de la mayoría de las otras especies de Candida, C. auris crece bien a una temperatura de 40 a 42 °C. En los medios cromogénicos tradicionales, las colonias de C. auris suelen aparecer blancas o rosadas. Un nuevo agar cromogénico, CHROMagar Candida Plus, permite la identificación rápida de C. auris y la diferenciación de otras especies de Candida.
- auris aparece como colonias de color crema pálido con un halo azul visible dentro de las 48 horas en el medio CHROMagar Candida Plus. C. diddensiae y C. vulturna pueden mostrar una coloración similar, aunque estas especies son clínicamente raras. Sin embargo, un estudio reciente que evaluó el uso de CHROMagar Candida Plus en una gran cantidad de aislamientos fúngicos no informó resultados falsos positivos con estas especies raras. Además, otro medio cromogénico, HardyCHROM Candida+, que se utiliza para detectar C. auris sobre la base de las características morfológicas de la colonia, el color y la fluorescencia ultravioleta, está disponible para una fácil diferenciación de C. auris de otras especies de cándida. Cuando se utiliza este medio, C. auris produce colonias blancas con centros de «ojo de buey» de color verde azulado o verde azulado que son positivas para la fluorescencia ultravioleta. Actualmente, los CDC recomiendan el uso de un medio de enriquecimiento con alto contenido de sal y alta temperatura (caldo Sabouraud Dulcitol con 10 % de sal) para el aislamiento confiable de C. auris a partir de hisopos cutáneos clínicos y muestras de vigilancia ambiental. Los sistemas convencionales de identificación fenotípica de levaduras, como VITEK-2 YST, API 20C, BD Phoenix y MicroScan, pueden identificar erróneamente los aislamientos de C. auris como C. haemulonii, C. sake, Rhodotorula glutinis u otras especies de Candida. Sin embargo, varios de estos sistemas se han actualizado recientemente para incluir C. auris. Aunque se utilizan ampliamente en laboratorios con recursos limitados en todo el mundo, los sistemas actualizados aún tienen una capacidad limitada para identificar correctamente C. auris de los clados africanos y del este de Asia.
La identificación precisa de C. auris se logra con espectrometría de masas de ionización por desorción láser asistida por matriz-tiempo de vuelo (MALDI-TOF).
Los dos sistemas MALDI-TOF más comunes, el Bruker Biotyper y el VITEK MS, incluyen C. auris en sus bases de datos solo para uso en investigación y en ciertas versiones de sus bases de datos de sistemas aprobados por la Administración de Alimentos y Medicamentos (FDA).
Además, una base de datos curada por los CDC, MicrobeNet, incluye espectros de C. auris y está disponible gratuitamente como complemento de la base de datos de Bruker.
Los laboratorios también pueden identificar de manera confiable a C. auris mediante la secuenciación de la región D1-D2 del ADN ribosómico 28S (ADNr) o las regiones espaciadoras transcritas internas del ADNr.
Los ensayos de reacción en cadena de la polimerasa (PCR) en tiempo real son métodos sensibles y específicos para identificar directamente los ácidos nucleicos de C. auris en muestras clínicas, con un umbral de detección tan bajo como 1 a 10 unidades formadoras de colonias.
La PCR cuantitativa TaqMan (qPCR), la qPCR SYBR Green y el ensayo de resonancia magnética T2 son herramientas prometedoras para la detección de pacientes colonizados con C. auris, con resultados disponibles en cuestión de horas.
Estos ensayos tienen mayor sensibilidad y especificidad que los métodos basados en cultivos y brindan resultados el mismo día.
El panel de patógenos fúngicos de identificación de hemocultivos (BCID) GenMark ePlex y el BioFire FilmArray BCID2 son pruebas moleculares aprobadas por la FDA para la identificación de C. auris en hemocultivos positivos. Sin embargo, actualmente no hay pruebas aprobadas por la FDA disponibles para hisopos de colonización.
Resistencia a los antimicóticos
La resistencia de C. auris a los agentes antimicóticos es específica de cada clado, y los clados I, III y IV son responsables de infecciones invasivas resistentes a múltiples fármacos en todo el mundo.Por el contrario, el clado II (el clado del este de Asia) causa predominantemente infecciones de oído y es uniformemente susceptible a los fármacos antimicóticos.
La resistencia de C. auris al fluconazol parece ser adquirida, y aproximadamente el 90 % de las cepas de todos los clados, excepto el clado II, son resistentes al fluconazol.
El mecanismo más común de resistencia a los azoles en C. auris implica mutaciones en ERG11, que codifica la enzima diana del fármaco, lanosterol 14α-desmetilasa (Figura 2).
Las mutaciones de ERG11 más frecuentemente reportadas resultan en las sustituciones de aminoácidos F126L, Y132F y K143R, que son específicas del clado.
Además, las mutaciones en genes que codifican factores de transcripción del grupo de zinc pueden promover la resistencia al fluconazol. Un ejemplo es una mutación en TAC1B que aumenta la expresión de bombas de eflujo como Cdr1p.65
Las equinocandinas actúan inhibiendo la síntesis de un componente principal de la pared celular fúngica, el 1,3-β-glucano.
En general, la resistencia a las equinocandinas es poco común, y se ha informado que aproximadamente el 5 % de los aislamientos de C. auris son resistentes a las equinocandinas.
Sin embargo, la resistencia puede desarrollarse durante la terapia con equinocandinas y es causada por mutaciones en el aminoácido S639 (S639Y, S639F o S639P) en el punto caliente 1 de la diana del fármaco 1,3-β-d-glucano sintasa, que está codificada por FKS1 (Figura 2).
Además, se ha observado una mutación recién descubierta fuera de la región del punto caliente 1 que confiere resistencia a las equinocandinas en aislamientos clínicos de C. auris.
Estas mutaciones reducen sustancialmente la sensibilidad de la glucano sintasa a la inhibición por las equinocandinas. De manera alarmante, los CDC informaron que las tasas de resistencia a las equinocandinas se triplicaron en 2021 en relación con los 2 años anteriores.
La resistencia clínica a la anfotericina B es poco común entre los hongos. Sin embargo, se ha informado de resistencia a la anfotericina B en aproximadamente el 30% de los aislamientos de C. auris, principalmente de los clados I y IV, sobre la base de un punto de corte de susceptibilidad tentativo de 2 μg por mililitro para la anfotericina B contra C. auris.
Un informe de un solo caso mostró que una mutación en ERG6 dentro de la vía biosintética del ergosterol se asoció con resistencia a la anfotericina B en un aislamiento clínico de C. auris (Figura 2). Los aislamientos de C. auris resistentes a la anfotericina B tienen una permeabilidad reducida de los lípidos de membrana, lo que también puede contribuir a la resistencia.
El problema más preocupante con respecto a las infecciones por C. auris es la transmisión, en los Estados Unidos, de algunos aislamientos que son resistentes a las equinocandinas y otros que son resistentes a todas las clases disponibles de fármacos antimicóticos, lo que sugiere que los clones resistentes a los fármacos se están propagando en los entornos de atención sanitaria.
Tratamiento
Faltan ensayos clínicos aleatorizados que evalúen el tratamiento de las infecciones por C. auris y la eficacia de terapias antimicóticas específicas.
Las recomendaciones actuales de los CDC desaconsejan el tratamiento antimicótico en pacientes con colonización por C. auris si no hay evidencia de infección clínica[en mi opiniòn absurda].
Sin embargo, para los pacientes con candidemia por C. auris o candidiasis invasiva, se requiere el inicio rápido del tratamiento antimicótico y se recomienda la consulta con un especialista en enfermedades infecciosas, porque esta estrategia se asocia con mejores resultados para los pacientes con infecciones invasivas por otras especies de cándida.
Para la infección por C. auris en adultos y en niños de 2 meses de edad o más, los CDC recomiendan el uso de equinocandinas como terapia empírica o inicial en espera de los resultados de las pruebas de susceptibilidad, dada la potente actividad in vitro de estos agentes y las tasas relativamente bajas de resistencia primaria a las equinocandinas (Figura 2).
Las equinocandinas preferidas para niños de 2 meses de edad o más son caspofungina y micafungina debido a los datos farmacocinéticos y farmacodinámicos limitados sobre anidulafungina en este grupo de edad. En el caso de los neonatos y los lactantes menores de 2 meses de edad, el tratamiento recomendado es el desoxicolato de anfotericina B, con un cambio a una formulación lipídica de anfotericina B si no hay respuesta clínica (Figura 2).
Esta recomendación se deriva de la propensión de la candidiasis invasiva a causar enfermedad diseminada, incluida la meningoencefalitis, en este grupo de edad y de la penetración limitada de las equinocandinas en el líquido cefalorraquídeo.
Los pacientes deben ser monitoreados de cerca para asegurar que se resuelva una infección invasiva, porque puede ocurrir resistencia primaria a las equinocandinas, aunque con poca frecuencia, y porque se ha documentado la aparición de resistencia secundaria en cepas seriadas de C. auris después del tratamiento con equinocandinas.
Se debe realizar un hemocultivo de seguimiento para establecer la eliminación de la candidemia, y cualquier cepa fúngica posterior debe someterse a pruebas de sensibilidad repetidas. Se recomiendan dos semanas de terapia antimicótica después de la eliminación de los hemocultivos para los pacientes que no tienen focos metastásicos.
Se puede considerar el cambio a una formulación lipídica de anfotericina B si un paciente tiene hemocultivos positivos persistentes durante 5 días o más sin respuesta clínica al tratamiento con equinocandinas.
El desoxicolato de anfotericina B es el tratamiento preferido en países con escasez de recursos donde no se dispone de equinocandinas ni de pruebas de sensibilidad in vitro. Debido a que C. auris suele ser resistente a los agentes antimicóticos azólicos (Figura 2), las opciones de tratamiento oral son limitadas para los pacientes con infección por C. auris.
Los azoles, como fluconazol, voriconazol o posaconazol, deben considerarse solo como tratamiento de reducción gradual después de una terapia inicial exitosa con una equinocandina en pacientes seleccionados que están infectados con cepas susceptibles.
Los enfoques adicionales para el manejo de la infección por C. auris son los mismos que los de las infecciones con otras especies de Candida, como se describe en las pautas de práctica clínica de la Sociedad de Enfermedades Infecciosas de Estados Unidos de América de 2016.
Estos enfoques incluyen la extracción rápida de los catéteres venosos centrales, cuando sea posible, y el examen oftalmológico para descartar la afectación intraocular, dada la escasa penetración de las equinocandinas en este sitio anatómico. Sobre la base de una revisión sistemática de la literatura que muestra una baja frecuencia de endoftalmitis concordante entre los pacientes con candidemia, la Academia Estadounidense de Oftalmología recomienda el examen de fondo de ojo solo en pacientes con signos o síntomas sugestivos de infección ocular.
Se necesitan protocolos rentables y basados en la evidencia, avalados tanto por las sociedades de enfermedades infecciosas como por las sociedades profesionales de oftalmología, para identificar a los pacientes con candidemia y compromiso ocular.
Los pacientes con candidemia causada por C. auris tienen un mayor riesgo de fracaso del tratamiento y recurrencia microbiológica después de completar la terapia antimicótica que los pacientes con candidemia causada por otras especies de Candida.
Prevención
En los centros de atención de salud, la transmisión de C. auris entre pacientes puede ocurrir dentro de las 3 a 4 horas posteriores a la contaminación del ambiente o el equipo. Por lo tanto, se justifica la rápida identificación de la presencia de C. auris y la adopción oportuna de medidas de control de la infección para prevenir brotes nosocomiales.
Aunque el cribado en el momento del ingreso es una herramienta valiosa para identificar y controlar la introducción de C. auris en los centros de atención de salud, este enfoque no evalúa la propagación entre las personas dentro de un centro.
Por lo tanto, el cribado en el momento del ingreso debe ir acompañado de encuestas periódicas de prevalencia puntual para controlar la propagación de C. auris.
Se recomiendan precauciones de contacto o barreras reforzadas, incluido el uso universal de batas y guantes durante el contacto con los pacientes o su entorno, la ubicación de pacientes individuales en habitaciones individuales o agrupaciones de pacientes con colonización o infección por C. auris y el aislamiento preventivo de pacientes que hayan estado en contacto con pacientes portadores de C. auris.
Se puede implementar equipo médico exclusivo y cambiar a alternativas de uso único o para un solo paciente (p. ej., manguitos de presión arterial) y asignar personal de enfermería para cuidar a los pacientes en la misma área designada, siempre que sea posible.
El equipo que debe compartirse debe limpiarse completamente entre usos. Durante el aislamiento, se requiere la desinfección y limpieza diaria del piso y las superficies cercanas a los pacientes. Los desinfectantes que se usan rutinariamente en entornos de atención médica, como los compuestos de amonio cuaternario, no son efectivos contra C. auris.
Por lo tanto, los CDC recomiendan el uso de un desinfectante de grado hospitalario registrado en la Agencia de Protección Ambiental (EPA) (bajo la Lista P de la EPA) contra C. auris, que también es eficaz contra las esporas de Clostridioides difficile.
Conclusiones y perspectivas futuras
La rápida aparición y propagación mundial de C. auris resistente a múltiples fármacos subraya la necesidad urgente de intensificar las medidas de control contra este patógeno fúngico oportunista.
Una comprensión más profunda de los rasgos de virulencia de C. auris y los factores moleculares que promueven la inmunidad podría conducir al descubrimiento de nuevos objetivos farmacológicos antimicóticos, terapias inmunológicas complementarias o vacunas.
La mejora de las pruebas de diagnóstico no basadas en cultivos, como la qPCR, podría facilitar la identificación oportuna y precisa de la colonización e infección por C. auris.
El uso de medidas eficaces de control de infecciones puede ayudar a reducir o erradicar la colonización y la transmisión, mejorar la desinfección ambiental y reducir el riesgo de brotes nosocomiales de infección por C. auris.
La delimitación precisa de los reservorios ambientales es otro paso importante para mejorar las estrategias de prevención y control de infecciones en pacientes vulnerables.
Las equinocandinas son el tratamiento preferido para las infecciones por C. auris. Las funciones de la rezafungina, una equinocandina de acción prolongada recientemente aprobada, y del ibrexafungerp, un compuesto triterpenoide oral recientemente aprobado que también inhibe la síntesis de glucanos fúngicos, justifican una mayor investigación (Figura 2).
En el caso de los pacientes infectados con cepas resistentes a las equinocandinas o resistentes a múltiples fármacos, es fundamental determinar el régimen farmacológico antimicótico que se debe utilizar.
El fosmanogepix, que inhibe la enzima fúngica Gwt1 y altera la síntesis de manoproteínas de la pared celular (Figura 2), ha demostrado ser prometedor en estudios iniciales y se está evaluando en ensayos clínicos de fase 3.
Se necesita más trabajo para caracterizar mejor los mecanismos moleculares que subyacen a la resistencia intrínseca y adquirida a los fármacos antimicóticos de cepas de diferentes clados y para comprender mejor las diferencias de cepas específicas de clados en cuanto a la resistencia y virulencia a los antimicóticos.
Definir las estrategias más efectivas para el diagnóstico, la prevención y el tratamiento de las infecciones por C. auris puede frenar su propagación y mejorar los resultados clínicos.
Patogenia de C. auris, dianas terapéuticas y genes que confieren resistencia a fármacos.
La parte superior de la ilustración muestra levaduras C. auris que colonizan la piel, incluidos los folículos pilosos, un proceso que es promovido por el factor de colonización superficial de adhesina fúngica (Scf1).
La colonización de C. auris es contrarrestada por la interleucina-17 producida por las células linfoides. La parte inferior muestra dianas terapéuticas de fármacos antimicóticos contra C. auris.
Las equinocandinas y la ibrexafungerp inhiben la producción de β-glucanos en la pared celular fúngica. Los azoles y la anfotericina B se dirigen al ergosterol en la membrana celular fúngica.
El fosmanogepix se dirige al transporte de manoproteínas fúngicas y la flucitosina inhibe la síntesis de ADN. Los genes implicados en la resistencia de C. auris a los fármacos antimicóticos correspondientes se muestran entre paréntesis.
- Afortunadamente el Laboratorio PLEXUS en Santa Cruz realiza una prueba de agar cromogènico que detecta C.Auris(solicite: cultivo para cándida identificar Cándida Auris).