Ronald Palacios Castrillo
Groarke et al.[1] informan los resultados de un ensayo clínico de fase 2 de la terapia con ponsegromab (100, 200 o 400 mg cada 4 semanas) para la caquexia por cáncer en pacientes con niveles humorales elevados del factor de diferenciación del crecimiento 15 (GDF-15).
La proteína GDF-15 es una citocina de la familia del factor de crecimiento transformante β; ponsegromab, un anticuerpo monoclonal humanizado , la inhibe. Se demostró seguridad y eficacia en pacientes con cáncer de pulmón, páncreas o colorrectal que recibieron 400 mg de ponsegromab cada 4 semanas.
Al final del período de tratamiento de 12 semanas, los participantes del grupo de 400 mg habían ganado una media de 2,81 kg más de peso que los del grupo placebo, y el aumento del índice de músculo esquelético lumbar fue mayor en 2,04 cm2 por metro cuadrado que en el grupo placebo. Los efectos adversos relacionados con el tratamiento fueron mínimos.
¿Qué es la caquexia por cáncer?
=> Recibir por Whatsapp las noticias destacadas
La caquexia por cáncer es un síndrome definido por una pérdida de peso progresiva en presencia de una enfermedad maligna subyacente, que puede culminar en un agotamiento extremo del tejido muscular y adiposo y, en última instancia, la muerte[3]. Su prevalencia y gravedad varían según los diferentes tipos de cáncer y entre personas con el mismo tipo de cáncer.
La caquexia es desencadenada por el cáncer, pero la activación inmunitaria inducida por el tumor y los efectos no deseados de las terapias contra el cáncer también son factores de riesgo (Figura 1).
Los pacientes con caquexia tienen un bienestar psicológico, emocional y social reducido relacionado con su ingesta inadecuada de alimentos, la imagen corporal alterada y la función física reducida. Además, la afección genera mayores costos de atención médica y predispone a complicaciones relacionadas con el tratamiento del cáncer y a la muerte. A pesar del renovado interés en la terapéutica de la caquexia, las opciones de tratamiento son limitadas.4.FIGURA 1.
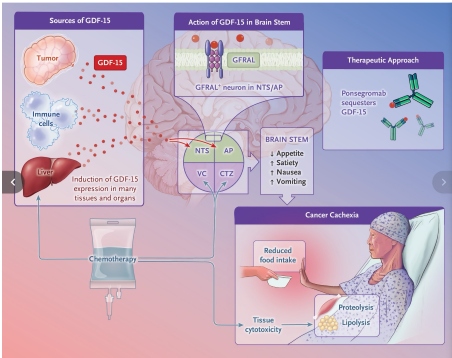
Ponsegromab, GDF-15 y caquexia por cáncer.
El manejo clínico de la caquexia se define por sus dos componentes etiológicos principales, la ingesta dietética reducida y el metabolismo o catabolismo anormal[3]. Aunque el déficit nutricional no es el único culpable, la deficiencia grave de nutrientes es común[5].
Aproximadamente una cuarta parte de los pacientes con cáncer avanzado consumen menos de 13 kcal por kilogramo de peso corporal por día (equivalente a dietas hipocalóricas prescritas para la pérdida intencional de aproximadamente 2,5 kg durante un período de 30 días en pacientes con obesidad)[5].
En comparación con un gasto energético total medio (±DE) de 29,7 ± 6,3 kcal por kilogramo por día,6 la ingesta inadecuada de alimentos es una causa incuestionable de balance energético negativo. El consejo a los pacientes para que consuman alimentos más densos en energía no puede revertir por completo la caquexia si los síntomas como la falta de apetito y las náuseas siguen siendo impedimentos constantes para comer.
El tronco encefálico, la anorexia, la saciedad, las náuseas y los vómitos
Varios mecanismos que limitan la ingesta de alimentos residen en el tronco encefálico. Su relevancia fisiológica es evitar la sobrealimentación (a través de la respuesta a la sobredistensión del intestino y la sobrecarga osmolar, por ejemplo), detener la ingesta de compuestos tóxicos y expulsarlos (vómitos) y condicionar la aversión.
A diferencia de la interacción matizada de los neurocircuitos orexigénicos y anorexigénicos en el hipotálamo, que adaptan la afluencia de nutrientes durante las comidas equilibrando el apetito y la saciedad, las funciones atribuidas al tronco encefálico se consideran respuestas de alarma que detienen rápidamente la ingesta de alimentos.
Al unirse a su receptor, que se expresa en las neuronas del área postrema y del núcleo del tracto solitario del tronco encefálico, el GDF-15 induce respuestas anorexigénicas y aversivas y náuseas[7]. El GDF-15 se expresa en exceso en muchos tumores.
También se induce en tejidos no tumorales mediante terapias contra el cáncer, en particular el cisplatino, lo que supone un doble revés. A través de sus efectos sobre el intestino y la zona desencadenante de los quimiorreceptores del tronco encefálico, el cisplatino es ematógeno.
Su inducción de la síntesis de GDF-15 aumenta los niveles de GDF-15 sistémico y, por lo tanto, añade más impulso a las náuseas y los vómitos. Los pacientes más vulnerables pueden ser aquellos con la desafortunada combinación de niveles elevados de GDF-15 circulante y quimioterapia ematógena concurrente.
Resultados adicionales implican al tronco encefálico y las náuseas en la caquexia. Por ejemplo, en un ensayo de fase 3, el tratamiento con olanzapina (que suprime las náuseas) resultó en un aumento de peso medio de 2,7 kg en pacientes con cánceres avanzados de pulmón y gastrointestinales y caquexia[8].
Aún falta una comprensión integral de cómo el cáncer afecta al tronco encefálico. De hecho, el descubrimiento de vías de saciedad y aversión en el tronco encefálico continúa a buen ritmo[9]. Por ejemplo, un estudio reciente respalda una acción anorexígena de la interleucina-6 en el área postrema[10].
¿Qué sigue?
Hace tiempo que se debería haber reconocido que la ingesta deficiente de alimentos es un factor clave de la caquexia. Más allá de los resultados del ensayo de Groarke et al., necesitamos saber la durabilidad de los efectos del ponsegromab más allá de las 12 semanas y el momento más efectivo del tratamiento y su eficacia.
La falta de datos sobre la historia natural y la epidemiología de la caquexia y sobre los niveles de GDF-15 en pacientes con caquexia por cáncer limita la capacidad de dirigir el ponsegromab a los pacientes con más probabilidades de tener una respuesta.
Otras moléculas que suprimen la alimentación (por ejemplo, la interleucina-1β) pueden estar presentes simultáneamente con el GDF-15 o provocar anorexia en poblaciones específicas de pacientes.
La riqueza de conceptos y métodos maduros desarrollados por investigadores que estudian la neurociencia de la obesidad constituyen un conjunto de herramientas valioso para los investigadores de la caquexia.
El sistema neurológico que regula el peso corporal consta de una red compleja e interconectada que incluye el hipotálamo, los sitios corticales, los centros de recompensa y el tronco encefálico. Distintas poblaciones neuronales interconectan regiones cerebrales mediante hormonas circulantes, nutrientes, metabolitos y señales postprandiales.
El hipotálamo regula el apetito, la saciedad, el metabolismo, la sed, los ritmos circadianos y múltiples ejes endocrinos de forma directa e indirecta: la perturbación del hipotálamo asociada al cáncer puede tener consecuencias generalizadas. Se ha postulado que un mecanismo hipotalámico para el exceso de saciedad en la caquexia por cáncer implica la activación del receptor anorexigénico de melanocortina 4 (MC4R)[11].
Ahora es posible dirigir la terapia a este mecanismo con la aparición de antagonistas de receptores de moléculas pequeñas que pueden atravesar la barrera hematoencefálica, y actualmente se está probando un compuesto pionero en su clase (TCMCB07) en un estudio de fase 1 (número de ClinicalTrials.gov, NCT05529849).
Otras vías de regulación neural de la alimentación siguen sin explorarse en la caquexia por cáncer. El sistema de recompensa se ha estudiado ampliamente en la obesidad y, dado que su función fisiológica es motivar la ingestión de alimentos densos en calorías y agradables al paladar, tal vez se pueda aprovechar para ayudar a restablecer el equilibrio energético en pacientes con cáncer.tambièn, puede ser muy efectivo contra la caquexia el uso combinado de ponsegromab y Olanzapina! Por fin hay progreso real en el manejo de este problemo serio de la caquexia en los pacientes con cáncer, la anorexia y el sida avanzado.
Referencias Bibliográficas
1.Groarke JD, Crawford J, Collins SM, et al. Ponsegromab for the treatment of cancer cachexia. N Engl J Med 2024;391:2291-2303.
Go to Citation
2.Laird BJA, Skipworth RJE. Ponsegromab for cancer cachexia — a new dawn for an old condition? N Engl J Med 2024;391:2371-2373.
Go to Citation
3.Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12:489-495.
4.Roeland EJ, Bohlke K, Baracos VE, et al. Management of cancer cachexia: ASCO guideline. J Clin Oncol2020;38:2438-2453.
Go to Citation
5.Martin L, Muscaritoli M, Bourdel-Marchasson I, et al. Diagnostic criteria for cancer cachexia: reduced food intake and inflammation predict weight loss and survival in an international, multi-cohort analysis. J Cachexia Sarcopenia Muscle 2021;12:1189-1202.
6.Purcell SA, Elliott SA, Walter PJ, et al. Total energy expenditure in patients with colorectal cancer: associations with body composition, physical activity, and energy recommendations. Am J Clin Nutr2019;110:367-376.
Go to Citation
7.Li J, Hu X, Xie Z, Li J, Huang C, Huang Y. Overview of growth differentiation factor 15 (GDF15) in metabolic diseases. Biomed Pharmacother 2024;176:116809-116809.
Go to Citation
8.Roeland EJ, Bohlke K, Baracos VE, Smith TJ, Loprinzi CL. Cancer cachexia: ASCO guideline rapid recommendation update. J Clin Oncol 2023;41:4178-4179.
Go to Citation
9.Huang K-P, Acosta AA, Ghidewon MY, et al. Dissociable hindbrain GLP1R circuits for satiety and aversion. Nature 2024;632:585-593.
Go to Citation
10.Sun Q, van de Lisdonk D, Ferrer M, et al. Area postrema neurons mediate interleukin-6 function in cancer cachexia. Nat Commun 2024;15:4682-4682.
Go to Citation
11.Zhu X, Callahan MF, Gruber KA, Szumowski M, Marks DL. Melanocortin-4 receptor antagonist TCMCB07 ameliorates cancer- and chronic kidney disease-associated cachexia. J Clin Invest2020;130:4921-4934.
Ponsegromab, GDF-15 y caquexia por cáncer.
La caquexia se inicia por una mezcla compleja de factores derivados del tumor y moléculas proinflamatorias generadas por la comunicación cruzada entre las células tumorales y las células inmunitarias asociadas. Estos factores pueden provocar el catabolismo directamente en los órganos terminales de la caquexia (músculo esquelético, tejido adiposo y corazón) o hacerlo a través del sistema nervioso central.
La quimioterapia estimula la caquexia mediante la inducción de náuseas y vómitos y a través de acciones tóxicas sobre las células musculares y grasas. Múltiples fuentes contribuyen al aumento de los niveles humorales del factor de diferenciación del crecimiento 15 (GDF-15), que se expresa en las células tumorales, las células inmunitarias y los órganos y tejidos (hígado, riñón y tejido muscular y adiposo) en respuesta a la quimioterapia.
Las regiones cerebrales clave que regulan el equilibrio energético incluyen el tronco encefálico, el hipotálamo y el sistema de recompensa. Las regiones interconectadas del tronco encefálico incluyen el área postrema (AP), el núcleo del tracto solitario (NTS), la zona gatillo de los quimiorreceptores (CTZ) y el centro del vómito (VC).
El GDF-15 ejerce su acción a través de un receptor específico (glial cell–derived neurotrophic factor family receptor α-like [GFRAL]) expresado por neuronas del AP y del NTS, que se cruza con las náuseas inducidas por quimioterapia (señaladas directamente en la CTZ así como desde el tracto gastrointestinal a través del nervio vago; este último no se muestra).