Ronald Palacios Castrillo, M.D.,PhD.
Resumen
Desde el inicio de la pandemia de COVID-19 hace 4 años, la secuenciación viral continúa documentando numerosas mutaciones individuales en la proteína de espiga viral en muchas variantes.
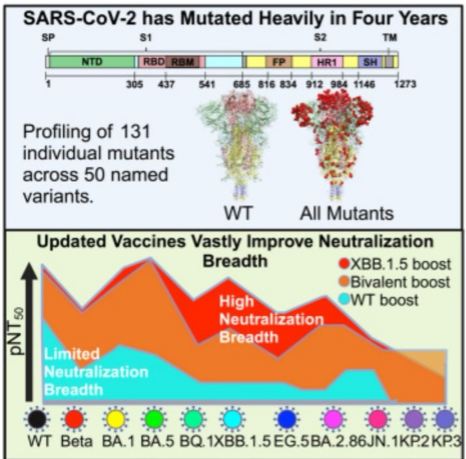
Para determinar la capacidad de la inmunidad humoral mediada por la vacunas ModRNA para combatir la evolución continua del SARS-CoV-2, Roederer,et.al.,[Cell Reports Medicine, DOI: 10.1016/j.xcrm.2024.101850A, publicado Dic 9,2024] construyeron un panel integral de pseudovirus que albergan cada mutación individual que abarca 4 años de la pandemia para comprender el costo de adaptación y los beneficios de resistencia de cada uno.
Estos esfuerzos identifican numerosas mutaciones que escapan a la inmunidad humoral inducida por las vacunas ModRNA. A lo largo de 50 variantes y 131 mutantes que construyeron, observaron una pérdida progresiva de neutralización en todas las variantes, independientemente de las dosis de boosters de ModRNA administrados, así como un aumento de la infectividad y la unión de ACE2.
=> Recibir por Whatsapp las noticias destacadas
Es importante destacar que la reciente dosis de refuerzo XBB.1.5 aumenta significativamente los títulos contra la mayoría de las variantes, pero no contra JN.1, KP.2 o KP.3. Estos hallazgos demuestran que las variantes siguen evadiendo las vacunas ModRNA actualizadas, lo que pone de relieve la necesidad de adoptar diferentes enfoques para controlar la transmisión del SARS-CoV-2.
Ha llegado el momento de dejar de administrar estas injecciones ModRNA de pfizer/moderna a niños y adultos para disminuir ( si es aùn posible) el nùmero creciente de personas en el mundo que sufren de efectos secundarios, algunos graves y mortales, secundarios a estas injecciones.
En Detalle
Desde su descripción a finales de 2019, el SARS-CoV-2 ha experimentado una evolución continua. El virus se originó en Wuhan, China, y fue declarado pandemia mundial el 11 de marzo de 2020 por la Organización Mundial de la Salud (OMS). Desde entonces, ha infectado a más de 700 millones de personas y ha causado casi 7 millones de muertes.
La primera mutación que se fijó en la población, D614G, surgió en febrero de 2020 y demostró ser más infecciosa y estable que la secuencia original. Sin embargo, la primera variante en ser nombrada, B.1.1.7 o Alpha, albergaba múltiples mutaciones y se convirtió en la cepa dominante en el Reino Unido, exhibiendo una infectividad un 50% mayor que el tipo salvaje (WT).
A medida que la pandemia entró en su segundo año, surgieron variantes adicionales que portaban mutaciones en el dominio de unión al receptor (RBD) que mejoraron la transmisibilidad a través de una mejor unión de ACE2 y exhibieron un escape viral de los sueros convalecientes. Numerosos estudios en los primeros dos años de la pandemia informaron mutaciones que incluyen L452R, K417N/T, E484K, N501Y, Q677H, y P618H/R, que exhibieron evasión inmunológica, unión ACE2 más fuerte o mayor fusogenicidad e infectividad.
En los dos años siguientes, el número de variantes que se han documentado ha aumentado significativamente, con mutaciones (predominantemente en el RBD) que permiten escapar de los anticuerpos neutralizantes inducidos por la vacuna y mejoran la transmisibilidad.
Un esfuerzo sin precedentes para desarrollar contramedidas efectivas dio como resultado que la Administración de Alimentos y Medicamentos (FDA) aprobara múltiples vacunas en los Estados Unidos, todas las cuales se basaban en la proteína de espiga del SARS-CoV-2 WT que contenía mutaciones estabilizadoras que se habían identificado previamente para el virus respiratorio sincitial (VSR) y el síndrome respiratorio de Oriente Medio (MERS).
Se emplearon numerosas tecnologías de vacunas, incluidas las nanopartículas lipídicas que contienen modRNA ( pfizer/moderna), las proteínas recombinantes o las vacunas vectorizadas por adenovirus; sin embargo, las vacunas de ModRNA fueron las más ampliamente enforzadas en los Estados Unidos.
Sin embargo, la aparición de la variante Ómicron y la disminución de los títulos de anticuerpos con el tiempo llevaron a la recomendación de una tercera dosis de refuerzo de las vacuna ModRNA por parte de la FDA, produciendo anticuerpos neutralizantes y reactivos cruzados contra Ómicron.
La aparición de variantes como BA.5 en 2022 requirió la reformulación de las vacunas, lo que estimuló la transición de vacunas monovalentes a bivalentes que incorporan tanto picos WT como BA. A pesar de la eficacia de las vacunas originales, su efectividad disminuyó contra variantes muy mutadas y altamente transmisibles como BQ.1.1, XBB, BA.2. y sus subvariantes.
Estas cepas altamente evolucionadas portaban entre 34 y 58 mutaciones en total dentro de la proteína de espiga, con 28 de estas mutaciones en el RBD en la variante más reciente JN.1. Numerosos estudios han destacado la evasión de la vacuna por mutaciones de la espiga individuales encontradas en estas cepas, a saber, V445P, N460K, y F486 P/S, entre otras.
En el otoño de 2023, un comité asesor de la FDA recomendó el despliegue de una vacuna ModRNA monovalente actualizada que codifica la espícula XBB.1.5. Sin embargo, JN.1 y sus derivados KP.2 y KP.3 representan más del 90% de las secuencias de COVID que se envían a GISAID. Roederer,et.al.,[Cell Reports Medicine, DOI: 10.1016/j.xcrm.2024.101850A, publicado Dic 9,2024] descubrieron que el último refuerzo XBB.1.5 mejora la actividad neutralizante contra muchas variantes que escaparon a los sueros reforzados de forma bivalente; sin embargo, la última variante JN.1 sigue siendo significativamente resistente a la neutralización en todas las vacunaciones.
Para comprender el impacto de las mutaciones que han surgido en el cambiante panorama de la vacunación, Roeder y colegas construyeron una biblioteca de transgenes de la proteína espiga individuales que albergan cada mutación individual encontrada en las variantes de preocupación o interés.
Utilizando este recurso, realizaron un análisis exhaustivo del escape por mutaciones individuales que surgieron durante la pandemia. Utilizando un ensayo de alto rendimiento previamente validado, midieron la neutralización de los pseudovirus que representan cada mutación individual en una cohorte de participantes del estudio que habían recibido la serie primaria de vacunas ModRNA (dos dosis) o la serie de refuerzo (tres dosis) y no habían estado expuestos a la COVID.
Además, evaluaron la actividad de neutralización de los sueros de individuos reforzados contra todas las mutaciones individuales, así como las cepas que albergan combinaciones de mutaciones a través de JN.1, lo que suma un total de 220 pseudovirus diferentes.
Además, perfilaron la unión de ACE2 recombinante de las 220 construcciones de expresión de la proteína espiga para evaluar las diferencias entre mutantes y variantes individuales. Curiosamente, encontraron que un puñado de mutaciones individuales que surgen permiten un escape significativo del suero reforzado, pero también han reducido la unión de ACE2.
Cabe destacar que las variantes más recientes, incluidas BQ.1.1, XBB y XBB.1.5, muestran una capacidad de escape de los sueros reforzados comparable a la del SARS-CoV-1 y la cepa preemergente relacionada WIV1. Sin embargo, los sueros de individuos que recibieron refuerzos bivalentes y XBB.1.5 mostraron una actividad neutralizante significativa contra todas las variantes.
A pesar de esto, variantes como EG.5, HK.3 y JN.1 muestran una capacidad de escape sustancial de los sueros reforzados bivalentes, mientras que KP.2 y KP.3 escapan significativamente de los sueros reforzados con XBB.1.5, lo que sugiere que el SARS-CoV-2 sigue estando a la vanguardia de los esfuerzos por actualizar las vacunas.
Las variantes no solo aumentaron la capacidad de escape con el tiempo, sino que también aumentaron drásticamente su infectividad y su capacidad de unión a la ACE2. En conjunto, los resultados demuestran la necesidad de desarrollar enfoques diferentes a los boosters con injecciones ModRNA capaces de inducir una inmunidad humoral ampliamente neutralizante para contrarrestar la evolución continua del SARS-CoV-2.
Aunque la OMS puso fin a la declaración de pandemia de COVID-19 en mayo de 2023, el SARS-CoV-2 sigue transmitiéndose a nivel mundial en forma de variantes altamente mutadas. Buscamos comprender cómo la constelación de mutaciones que han aparecido desde el comienzo de la pandemia se vio afectada por el panorama cambiante de la inmunidad humoral impulsado por los refuerzos con ModRNA actualizadas.
Sorprendentemente, los investigadores encontraron que los sueros de donantes sin antecedentes de COVID que recibieron una serie de vacunas primarias fueron especialmente vulnerables a mutaciones individuales en múltiples regiones de la proteína de la espiga, incluyendo NTD, RBD, la región C-terminal de S1 y el extremo C de S2. Numerosas mutaciones individuales dentro del RBD resultaron en un escape significativo de la vacunación primaria, muchas de las cuales han sido reportadas previamente.
Una mayoría de los mutantes individuales a través de la variante Delta (82%) probados también exhibieron una unión de ACE2 más baja.
Esto podría atribuirse a la expresión en la superficie de las células; sin embargo, la mayoría de los mutantes se expresaron a un nivel similar al virus WT. De acuerdo con otros, encontraron que D614G y H655Y confirieron el mayor aumento en la unión de ACE2 en relación con la espiga WT. Los mutantes D215G y ΔH69V70 también aumentaron la unión de ACE2. En contraste con la literatura, observaron que N501Y tenía una unión a ACE2 significativamente menor en relación con el WT.
Esta diferencia podría atribuirse a una expresión ligeramente menor del mutante N501Y; sin embargo, la mayoría de los experimentos han realizado la unión con RBD expresado de forma recombinante, mientras que el de los autores se realiza en toda la espiga en la superficie de la célula, lo que puede explicar esta diferencia.
En general, sus datos de unión a ACE2 coinciden predominantemente con lo que se ha publicado. En particular, varios mutantes, incluidos Q52R, L452R, S477N, T572I, D614G, H655Y y H1101D, produjeron tanto una mayor unión a ACE2 como una menor neutralización.
Específicamente, tres mutaciones RBD de la variante Beta (K417N, E484K y N501Y) y dos mutaciones de la variante Delta (L452R y P681R) redujeron sustancialmente la actividad de neutralización de sueros de donantes primarios, en línea con lo que otros han observado.
La diferencia entre los mutantes dobles y triples RBD y las variantes parentales probablemente se deba a la mutación crítica D614G observada en todas las variantes, así como P681R para Delta. Además, las combinaciones de mutaciones tuvieron efectos sorprendentes en la unión de ACE2, con el RBD triple mutante Beta aumentando significativamente la unión de ACE2 de acuerdo con otros mientras que el RBD doble mutante Delta disminuyó significativamente la unión de ACE2.
En particular, la cepa Delta completa tuvo una unión de ACE2 significativamente mayor, lo que sugiere que otras mutaciones dentro de Delta pueden haber contribuido a esta diferencia y que las mutaciones dependen del contexto en su influencia en la unión de ACE2. La inclusión de los mutantes D614G y P681R junto con los mutantes RBD probablemente contribuiría al aumento de la unión de ACE2 de la variante Delta.
Una tercera dosis de refuerzo de ModRNA mostró una neutralización significativamente mejorada en muchos, pero no todos, los mutantes individuales que probamos. Menos mutaciones individuales de Delta o variantes anteriores pudieron escapar significativamente del suero reforzado, aunque todavía hubo un escape significativo por parte de los mutantes D253G, L452R, S477N, Q677P y P681R, que se han caracterizado previamente.
Los mutantes P26S, Y453F, V1176F y M1229I también escaparon significativamente del suero del donante reforzado. Además, el refuerzo aumentó desproporcionadamente los títulos contra mutaciones de escape clave específicas en toda la espiga, incluidas D80A, K417N, T572I y Q677H. Publicaciones recientes han sugerido que los anticuerpos existentes influyen en el resultado de la vacunación al reducir el umbral de activación de las células B para permitir que participen clones de menor afinidad, así como el enmascaramiento de epítopos para permitir respuestas a objetivos previamente ignorados.
Aunque el refuerzo resultó en una amplitud sustancialmente mayor de neutralización contra cepas más recientes, los autores observaron una clara pérdida de actividad para los sueros reforzados a partir de la aparición de la variante BQ.1.1.
Curiosamente, esto pareció estar impulsado en gran medida por las mutaciones RBD y NTD en las posiciones 213, 445, 460 y 486, que se han conservado en todas las variantes desde XBB. Interesantemente, estas cuatro mutaciones lograron resistencia a la neutralización sin la pérdida de la unión de ACE2 en su ensayo.
Además, las mutaciones que aparecen después de la variante Delta redujeron principalmente la unión de ACE2 aparte de la N460K informada anteriormente.40 De acuerdo con otros, cuando midieron la unión de la variante a ACE2, todas las variantes habían aumentado la unión en relación con el WT.
Significativamente, este hallazgo indica que las mutaciones se coordinan entre sí en el contexto de la estructura principal de cada variante, lo que podría explicar por qué la mayoría de los mutantes individuales disminuyeron la unión de ACE2 en sus ensayos.
En respuesta a la rápida aparición de variantes del SARS-CoV-2, la formulación de la vacuna ModRNA se actualizó dos veces, primero para administrar un inmunógeno bivalente que contenía proteínas de espiga de las cepas WT y BA.4/BA.591,92 y luego nuevamente para administrar una secuencia de pico monovalente XBB.1.5. Roeder y colegas Descubrieron que el refuerzo bivalente da como resultado una actividad neutralizante comparable a la WT para las variantes BA.5 y anteriores, al mismo tiempo que mejora la actividad contra BQ.1.1 y variantes posteriores.
Sin embargo, estas variantes posteriores aún escaparon significativamente a la vacunación de refuerzo bivalente y aumentaron la unión de ACE2. Por el contrario, descubrieron que el refuerzo XBB.1.5 produce una potencia de neutralización sustancial contra variantes posteriores y solo se observó un escape significativo contra Beta y la variante más reciente JN.1.
Además de mediar el escape de los sueros de la vacuna, descubrieron que las mutaciones de la proteína espiga también contribuyen significativamente a la capacidad del pseudovirus de infectar células y unirse a ACE2, lo que sugiere que la evolución viral está optimizando el escape de anticuerpos, la unión al receptor y la entrada viral simultáneamente.
Descubrieron que las proteínas espigas de las variantes posteriores a BA.1 produjeron pseudovirus que eran hasta 30 veces mejores en la transducción de células diana que las WT, lo que sugiere que la proteína espiga WT del SARS-CoV-2 no estaba configurada de manera óptima para la entrada viral dependiente de ACE2.
Además, Roeder y colegas descubrieron que las variantes exhibieron una unión a ACE2 hasta 5 veces mejor por las proteínas espículas expresadas en la superficie de las células, aunque la unión a ACE2 y la infectividad no se correlacionaron significativamente a pesar de que existe una tendencia general hacia una mejor unión al receptor y la entrada del pseudovirus.
Este estudio exhaustivo demuestra que las personas que reciben el régimen completo de vacunación con ModRNA, incluida la dosis de refuerzo XBB.1.5, tienen una actividad neutralizante máximamente eficaz contra las cepas recientes del SARS-CoV-2.
Sin embargo, a pesar de las mejoras mediadas por las dosis de refuerzo XBB.1.5 contra las cepas emergentes más recientes, todavía hay escape, en particular por parte de los últimos descendientes de JN.1, KP.2 y KP.3. Sorprendentemente, la variante beta también pudo escapar significativamente de los donantes bivalentes y de las dosis de refuerzo XBB.1.5.
En particular, las mutaciones de la variante beta que no se observaron en las variantes posteriores que escaparon significativamente incluyen L18F, D80A, D215G, del242-244 y A701V. Estos resultados indican que todavía existe un riesgo de que reaparezca una variante anterior, aunque probablemente con una aptitud menor que las variantes actuales.
Estos resultados resaltan el desafío continuo que presenta la evolución continua del SARS-CoV-2, que ha superado los intentos de actualizar las vacunas ModRNA. Los hallazgos respaldan el desarrollo de otro tipo de vacunas y modalidades de prevención capaces de generar una amplia protección contra futuras variantes/brotes. Cabe destacar que se han descrito varios anticuerpos monoclonales que se dirigen a epítopos altamente conservados, como la hélice del tallo o el péptido de fusión, que son capaces de neutralizar a toda la familia Coronaviridae.
Asi pues, otro tipo de medidas de prevenciòn ,incluyendo tratamientos efectivos, seguros y accesible que ahora están al alcance de todos (i.e Latripleta constituida por la combinaciòn de nitazoxanida, Hidroxicloroquina y Zinc)y el desarrollo de vacunas de próxima generación( idealmente con otras plataformas diferentes a la ModRNA que está causando una frecuencia creciente de efectos secundarios, algunos graves inclusi la muerte, en las personadas que recibieron este tipo de vacunas y sus refuerzos) que aprovechen estos y otros sitios de vulnerabilidad en todos los coronavirus probablemente serán necesarias para combatir la evolución en curso del SARS-CoV-2 y pueden ayudar a prevenir futuras pandemias.
Queda absolutamente claro con el excelente trabajo de Roeder y colegas que las vacunas ModRNA de pfizer/moderna y cuánto refuerzos se deseen administrar, han fallado dramáticamente en el control de la evoluciòn del virus SarsCov-2 y sus variantes que son resistentes a los anticuerpos neutralizantes inducidos , además de adquirir una eficiencia mucho mayor de u iòn a su receptor en las cèlulas humanas y consecuentemente, de infectar al ser humano.