Resumen
El dolor crónico afecta a uno de cada cinco adultos. No solo es una de las principales causas de discapacidad para los pacientes individuales, sino también un factor de costos para los sistemas de atención médica en su totalidad. El tratamiento del dolor sigue siendo un desafío y el uso de opioides ha provocado además una epidemia de opioides concurrente. En esta revisión, Wang,et.al., [Cell Reports Medicine, volumen 5, número 10,2024] analizan las opciones de tratamiento estándar actuales para el dolor crónico, incluidos los tratamientos farmacológicos, conductuales e intervencionistas. Además, revisan las investigaciones en curso en diferentes áreas que potencialmente abrirán el camino a nuevas terapias.
Introducción
En los Estados Unidos, el dolor crónico, definido como el dolor que dura más de 3 meses, es un problema de salud pública devastador que afecta aproximadamente al 20 % de los adultos y cuesta aproximadamente 600 mil millones de dólares al año, más que cualquier otra afección médica. De los más de 50 millones de adultos con dolor crónico, se estima que entre el 8 % y el 10 % tienen dolor crónico de alto impacto, definido como dolor que limita el trabajo o las actividades de la vida. En esta revisión, Wang,et.al., [Cell Reports Medicine, volumen 5, número 10,2024] brindan una descripción general de los enfoques de tratamiento actuales para el dolor crónico y analizan innovaciones recientes seleccionadas en la investigación clínica del dolor.
Enfoques de tratamiento actuales
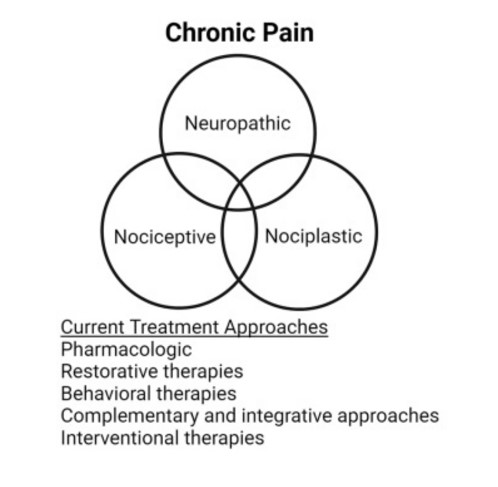
La Asociación Internacional para el Estudio del Dolor (IASP) define el dolor como una “experiencia sensorial y emocional desagradable asociada con, o similar a la asociada con, daño tisular real o potencial”. El dolor crónico tradicionalmente ha sido categorizado ampliamente por la fisiopatología como dolor nociceptivo y neuropático . El dolor nociceptivo resulta de la activación de receptores nociceptivos y canales iónicos en los nervios periféricos y se cree que es la consecuencia de agresiones traumáticas al tejido periférico. Por el contrario, la IASP define el dolor neuropático como el dolor “causado por una lesión o enfermedad del sistema nervioso somatosensorial”.
Si bien esta categorización amplia es útil para orientar terapias específicas, como se analiza más adelante, debe tenerse en cuenta que muchos síndromes de dolor tienen componentes neuropáticos y nociceptivos superpuestos, como el dolor lumbar que contiene síntomas tanto miofasciales como radiculares, y muchas formas de dolor por cáncer. Recientemente, se ha reconocido que ciertas afecciones dolorosas también pueden ocurrir debido a alteraciones en el procesamiento del dolor en ausencia de evidencia clara de daño tisular o nervioso real o potencial, y este tipo de dolor se ha denominado recientemente dolor nociplásico(central).Un ejemplo destacado de dolor nociplásico es la fibromialgia. El dolor nociplásico también puede ocurrir en el contexto del dolor nociceptivo y/o neuropático, como se ve en muchos síndromes de dolor generalizado.
=> Recibir por Whatsapp las noticias destacadas
La 11.ª versión de la Clasificación Internacional de Enfermedades incluye una clasificación sistemática del dolor crónico en siete categorías: dolor primario crónico, dolor crónico relacionado con el cáncer, dolor posquirúrgico o postraumático crónico, dolor neuropático crónico, dolor orofacial o secundario crónico, dolor visceral secundario crónico y dolor musculoesquelético secundario crónico.
El dolor primario crónico es el dolor como enfermedad o condición de salud por sí mismo, y el dolor nociplásico puede ser la base de algunas de las fisiopatologías similares. Las otras categorías de dolor se consideran síndromes de dolor secundario, en los que el dolor es el resultado de una enfermedad subyacente.
El dolor crónico relacionado con el cáncer se debe al dolor del propio cáncer o del tratamiento del cáncer. Este dolor puede incluir componentes neuropáticos y nociceptivos.
El dolor posquirúrgico crónico o el dolor postraumático a menudo incluyen componentes neuropáticos.
El dolor neuropático crónico se puede subdividir en dolor neuropático periférico o central.
El dolor orofacial o secundario crónico se debe a una enfermedad subyacente, como un traumatismo o lesión, una enfermedad dental o trastornos temporomandibulares.
El dolor visceral secundario crónico surge de los órganos internos, incluidos el abdomen y la pelvis.
El dolor musculoesquelético secundario crónico surge de los huesos, las articulaciones, los músculos o los tejidos blandos y, a menudo, es de naturaleza nociceptiva.
Independientemente de las categorías de dolor, el paradigma clínico actual ha sido adoptar un enfoque de tratamiento multimodal para el manejo del dolor crónico. Este enfoque multimodal incluye medicamentos, terapias restaurativas, terapias intervencionistas, terapias conductuales y enfoques de salud complementarios e integradores . Cabe señalar que los enfoques y las pautas actuales generalmente se centran en la condición o los síntomas del dolor, y la medicina personalizada o de precisión para el dolor crónico sigue siendo un desafío.
Farmacoterapias
Agentes establecidos para el manejo del dolor nociceptivo
Los tratamientos para el dolor nociceptivo crónico no oncológico están mejor estudiados y respaldados por mejor evidencia disponible que para otras afecciones de dolor crónico. Las opciones farmacológicas incluyen medicamentos antiinflamatorios no esteroides (AINE), paracetamol, antidepresivos y opioides. En 2016, una revisión sistemática y un metanálisis de ensayos controlados aleatorios (ECA) evaluaron los AINE para el tratamiento del dolor lumbar crónico no específico.
Seis estudios con 1354 participantes compararon los AINE con placebo con una mediana de seguimiento de 56 días (RIC 13 a 91 días). La diferencia media agrupada en la puntuación del dolor en una escala analógica visual de 100 mm desde el inicio fue de -6,97 (intervalo de confianza [IC] del 95 % -10,74 a -3,19), a favor de los AINE. Seis estudios adicionales con 1.161 participantes compararon los AINE con placebo, con discapacidad como resultado primario, medido con el Cuestionario de Discapacidad de Roland Morris, con una mediana de seguimiento de 84 días (RIC 42 a 105 días).
La diferencia media agrupada en la discapacidad desde el inicio fue de -0,85 (IC del 95%: -1,30 a -0,40), lo que indica eficacia para los AINE. Mientras tanto, dos ECA más pequeños compararon dos tipos de AINE no selectivos entre sí y no encontraron diferencias significativas. Si bien la mayoría de los AINE se toman en preparaciones orales, también existen formulaciones tópicas para evitar los efectos secundarios sistémicos, en particular en pacientes con alergias a medicamentos específicos, enfermedad por reflujo gastroesofágico y enfermedad cardíaca. En 2016, una revisión sistemática y un metanálisis de RCTs evaluaron los AINE tópicos para el dolor musculoesquelético crónico.
Este análisis identificó seis estudios con 2353 participantes que compararon el diclofenaco tópico con placebo para el dolor de la osteoartritis. El riesgo relativo de al menos un 50% de alivio del dolor después de 6 a 12 semanas de tratamiento fue de 1,2 (IC del 95%: 1,1-1,3) para el tratamiento en comparación con placebo; el número necesario a tratar (NNT) fue de 9,8 (IC del 95%: 7,1-16). Cuatro estudios con 2573 participantes examinaron la eficacia analgésica del ketoprofeno tópico.
El riesgo relativo de al menos un 50% de alivio del dolor después de 6 a 12 semanas de tratamiento fue de 1,1 (IC del 95%: 1,01-1,2) para el tratamiento en comparación con placebo, con un NNT de 6,9 (IC del 95%: 5,4-9,3). Estos estudios indican que tanto los AINE sistémicos como los tópicos son eficaces para el dolor nociceptivo, ya sea agudo o crónico.
El paracetamol es otro agente que se recomienda a menudo para el dolor nociceptivo, principalmente debido a su amplia disponibilidad y perfil de efectos secundarios favorables en dosis bajas a moderadas (<2 g diarios). Sin embargo, una revisión sistemática y un metanálisis de 2015 de ECA de paracetamol frente a placebo para el dolor espinal no específico de cualquier duración no encontraron ningún beneficio del paracetamol sobre el placebo para el dolor espinal.
Por el contrario, en siete estudios de osteoartritis de cadera o rodilla con 3153 participantes, la diferencia media agrupada para la intensidad del dolor en una escala de 0 a 100 fue de -3,7 (IC del 95 %: -5,5 a -1,9) a favor del paracetamol hasta por 3 meses de tratamiento. La evidencia de osteoartritis de cadera o rodilla se consideró de alta calidad utilizando el sistema GRADE (clasificación de recomendaciones, evaluación y desarrollo) pero con un efecto pequeño.
Los antidepresivos, como los inhibidores de la recaptación de serotonina y noradrenalina (SSRIN) y los antidepresivos tricíclicos (ATC), son agentes de primera línea para el dolor neuropático (ver más adelante), pero también se han estudiado para afecciones dolorosas que generalmente se consideran de naturaleza nociceptiva. En 2022, una revisión sistemática y un metanálisis examinaron los ECA de antidepresivos para el dolor de osteoartritis de cadera y rodilla.
En 9 ECA con 2038 participantes, la diferencia media agrupada para la intensidad del dolor en una escala de 10 puntos fue de -0,59 (IC del 95 %: -0,88 a -0,31) durante 8 a 16 semanas a favor de los antidepresivos, aunque los resultados no fueron necesariamente clínicamente significativos debido a la pequeña mejora terapéutica general en las puntuaciones de dolor. Sin embargo, en un análisis independiente que examinó seis ensayos clínicos con 1.904 participantes que utilizaron un análisis de respuesta, definido como al menos un 50% de alivio del dolor, el 45,2% (IC del 95%: 37,5%–54,9%) que recibieron antidepresivos y el 28,6% que recibieron placebo lograron alivio del dolor, se encontró que el NNT con antidepresivos era 6 (IC del 95%: 4–11). Por lo tanto, es probable que los antidepresivos sean útiles en al menos un subconjunto de pacientes con osteoartritis de cadera y rodilla.
Los opioides han sido un pilar para el manejo del dolor crónico durante las últimas décadas. La epidemia de opioides surgió en parte de las preocupaciones de que el dolor estaba siendo tratado de manera insuficiente, y la prescripción de opioides aumentó a medida que esos medicamentos alguna vez se comercializaron como analgésicos con la falsa afirmación de un bajo potencial adictivo. Estudios recientes han comenzado a examinar cuidadosamente el papel de los opioides en el manejo del dolor crónico.
En 2018, una revisión sistemática y un metanálisis examinaron los RCT de opioides frente a cualquier no opioide para el dolor crónico no oncológico con al menos un mes de seguimiento. En 42 estudios de 16.617 participantes con seguimiento durante 3 meses o más, la diferencia media agrupada para la reducción del dolor en una escala de 10 puntos fue de -0,69 (IC del 95%: -0,82 a -0,56) a favor de los opioides sobre el placebo, con una diferencia de riesgo modelada para lograr una diferencia clínicamente importante del 11,9% (IC del 95%: 9,7%–14,1%).
Mientras tanto, cincuenta y un RCT con 15.754 participantes mostraron un pequeño beneficio de los opioides sobre el placebo para la función física, pero el cambio no cumplió los criterios para la diferencia mínimamente importante desde el punto de vista clínico. Además, nueve RCTs de 1.431 participantes no mostraron diferencias significativas entre los opioides y los AINE para aliviar el dolor. Tres RCTs de 246 participantes no mostraron diferencias significativas entre los opioides y la nortriptilina para aliviar el dolor. Cabe destacar que estos ensayos excluyeron a pacientes con trastornos por consumo de sustancias u otros trastornos de salud mental.
En general, los resultados de estos estudios plantean la cuestión de la eficacia analgésica superior de los medicamentos opioides para el dolor nociceptivo crónico. A pesar de esto, aproximadamente el 22% de los adultos con dolor crónico en los Estados Unidos usaron opioides recetados en los últimos 3 meses, según datos de la Encuesta Nacional de Entrevistas de Salud de 2019. Se han publicado pautas para la prescripción de opioides, en particular de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos en 2016 y actualizadas en 2022.
Después de la publicación de las pautas de 2016, hubo preocupaciones por la mala aplicación de las pautas y las consecuencias no deseadas, como el uso de límites de dosis estrictos o una reducción abrupta de los opioides. Por ejemplo, la reducción de la dosis después de una terapia con opioides a largo plazo se asoció con el riesgo de sobredosis, crisis de salud mental y menos visitas de atención primaria. Las pautas actualizadas de 2022 recomiendan un enfoque individualizado y centrado en el paciente.
Tratamiento farmacológico del dolor neuropático
A diferencia de nuestro conocimiento de los mecanismos moleculares y los circuitos neuronales del dolor nociceptivo, nuestra comprensión de la fisiopatología básica del dolor neuropático crónico sigue siendo inadecuada, lo que conduce a menos opciones de tratamiento. En 2015, el Grupo de Interés Especial sobre Dolor Neuropático de la IASP realizó una revisión sistemática y un metanálisis de estudios aleatorizados, doble ciego, de terapias farmacológicas orales y tópicas para el dolor neuropático, incluida la neuralgia posherpética, la polineuropatía, el dolor posamputación, el dolor neuropático postraumático y posquirúrgico y el síndrome de dolor regional complejo tipo II.
Según la revisión, se recomendaron los SSRIN, los ATC y los gabapentinoides (p. ej., gabapentina y pregabalina) como tratamientos de primera línea para el dolor neuropático. Los parches de capsaicina al 8 %, los parches de lidocaína y el tramadol se recomendaron como tratamientos de segunda línea, y los tratamientos de tercera línea fueron la toxina botulínica A y opioides más fuertes. En general, los efectos del tratamiento, incluso para los agentes de primera línea, se consideraron modestos, con un NNT de 3,6 (IC del 95 %: 3-4,4) para los ATC, 6,4 (IC del 95 %: 5,2-8,4) para los SSRIN, 6,3 (IC del 95 %: 5-8,3) para la gabapentina y 7,7 (IC del 95 %: 6,5-9,4) para la pregabalina. Los efectos secundarios de los ATC incluyen efectos anticolinérgicos y sedantes.
Los efectos secundarios comunes de los SSRIN incluyen molestias gastrointestinales e insomnio. Los efectos secundarios de los gabapentinoides incluyen efectos sedantes, molestias gastrointestinales y edema periférico. En consonancia con estos hallazgos de investigación, la práctica actual ha incorporado en gran medida los SSRIN, los ATC y, en particular, los gabapentinoides como elementos clave de un régimen multimodal para el dolor neuropático.
Tratamiento farmacológico del dolor nociplásico
El dolor nociplásico es el menos comprendido de todos los trastornos de dolor crónico, aunque se piensa que implica mecanismos de circuitos maladaptativos en el sistema nervioso central. El dolor nociplásico suele tratarse con analgésicos neuropáticos. La fibromialgia es el trastorno de dolor nociplásico prototípico. La fibromialgia se caracteriza por dolor musculoesquelético difuso sin distribuciones anatómicas o neurológicas obvias, depresión, fatiga y alteración del sueño.
Los síntomas depresivos no controlados predicen malos resultados durante el tratamiento de la fibromialgia, por lo que la depresión es una comorbilidad importante que se debe abordar en el tratamiento del dolor nociplásico crónico. Asimismo, una peor calidad del sueño se asocia con un mayor número de síntomas, incluidos dolor, quejas de memoria, ansiedad y dificultades de concentración, lo que subraya la importancia de abordar también el sueño en afecciones nociplásicas como la fibromialgia.
En 2022, una revisión sistemática y un metanálisis en red examinaron los ECA de farmacoterapias para la fibromialgia, específicamente amitriptilina, duloxetina, pregabalina y milnaciprán. Al presentar los tamaños del efecto como diferencias de medias estandarizadas (DME), en 35 estudios de 11 423 participantes, la duloxetina se asoció con la mayor reducción del dolor en comparación con el placebo (DME −0,33; IC del 95 %).
Dieciséis estudios con 4.452 pacientes evaluaron el sueño, y la amitriptilina se asoció con las mayores mejoras en el sueño en comparación con placebo (SMD -0,97, IC del 95%: -1,10 a -0,83). La duloxetina y la pregabalina se asociaron con las mayores mejoras en los síntomas de depresión, mientras que la amitriptilina y la pregabalina se asociaron con las mayores mejoras en la fatiga. En consonancia con estos resultados, los SSRIN, los ATC y los gabapentinoides se consideran elementos centrales en el régimen terapéutico para el dolor nociplásico, complementados además con paracetamol.
Debido a su tolerabilidad, los gabapentinoides a menudo han sido el tratamiento de primera línea. Desafortunadamente, el dolor nociplásico continúa mostrando un grado relativamente alto de resistencia al tratamiento, a pesar del éxito limitado con los agentes antineuropáticos disponibles.
Ketamina, una opción terapéutica emergente para el dolor crónico refractario
La ketamina es conocida como agente anestésico y analgésico desde hace más de medio siglo. Está aprobada por la Administración de Alimentos y Medicamentos (FDA) para el tratamiento del dolor agudo y la depresión y suele utilizarse como infusión en dosis bajas (0,3-0,6 mg/kg). Aunque sus efectos analgésicos suelen ser de corta duración, sus efectos antidepresivos y ansiolíticos pueden durar varias semanas. Varios estudios han examinado la eficacia de la ketamina para el dolor posquirúrgico y, al menos en el período posoperatorio inmediato, ha demostrado su eficacia para aliviar el dolor, reducir el uso de opioides y mejorar la rehabilitación. Además de su uso en el entorno perioperatorio, también hay datos positivos sobre la ketamina en el tratamiento del dolor traumático en las salas de urgencias.
La ketamina tiene una multitud de mecanismos analgésicos, a través de la inhibición de varios receptores, incluidos los canales de sodio. Sin embargo, su acción más pronunciada es el antagonismo de los receptores N-metil-D-aspartato que se sabe que desempeñan un papel clave en la fisiología del dolor crónico; la ketamina se ha estudiado para una variedad de condiciones de dolor crónico. Por ejemplo, se ha demostrado que la infusión perioperatoria de ketamina reduce la incidencia y la gravedad del dolor posoperatorio crónico. La ketamina también se ha estudiado en el síndrome de dolor regional complejo (SDRC) y la fibromialgia.
En ECA, las infusiones de dosis bajas en varios días consecutivos redujeron las puntuaciones de dolor durante hasta 12 semanas y en algunos casos incluso 6 meses. La ketamina en dosis bajas (0,3–0,5 mg/kg) ha demostrado un efecto analgésico agudo en la fibromialgia; Sin embargo, sus efectos pueden no ser duraderos. Otras afecciones de dolor crónico que se han tratado con ketamina incluyen dolores de cabeza refractarios y dolor por cáncer, con datos a veces contradictorios y la necesidad de más estudios de mayor calidad.
Enfoques no farmacológicos
Las terapias restaurativas incluyen fisioterapia, ejercicio y estimulación nerviosa eléctrica transcutánea (TENS). En 2017, se publicó una descripción general de las revisiones sistemáticas Cochrane de ECA de actividad física y ejercicio para el dolor crónico. En general, se observó que, aunque el ejercicio físico no cambió consistentemente las puntuaciones de dolor per se, sí mejoró significativamente la función física. Sin embargo, la calidad general de la evidencia actualmente disponible se consideró baja utilizando el sistema GRADE, debido a los pequeños tamaños de muestra y los períodos de seguimiento limitados en estos estudios.
En 2019, se publicó una descripción general de las revisiones sistemáticas Cochrane de ECA de TENS para el dolor crónico. Debido a la baja calidad de la evidencia basada en el sistema GRADE, los autores no pudieron concluir si la TENS fue beneficiosa para el dolor. Una revisión sistemática más reciente incluyó RCTs de TENS para cualquier dolor con un resultado primario de reducción del dolor durante o inmediatamente después de TENS. En 91 RCTs de 4.841 participantes, el dolor fue menor con TENS en comparación con placebo (SMD -0,96, IC del 95%: -1,14 a -0,78); la evidencia se consideró de calidad moderada según el sistema GRADE. En 61 estudios de 3.155 participantes, el dolor fue menor en TENS en comparación con otros tratamientos de atención estándar (SMD -0,72, IC del 95%: -0,95 a -0,50); sin embargo, esta evidencia se consideró de baja calidad.
Los pacientes con dolor crónico experimentan con frecuencia problemas de salud mental. Las comorbilidades del dolor crónico y los trastornos del estado de ánimo en particular son muy prevalentes. Los enfoques psicológicos y conductuales son especialmente relevantes en el modelo biopsicosocial del dolor. En 2020 se publicó una revisión sistemática de ECA para tratamientos psicológicos presenciales para el dolor crónico, excluyendo el dolor de cabeza y el dolor oncológico.
Los tipos de intervenciones incluyeron terapia cognitivo-conductual (TCC), terapia conductual (TC) y terapia de aceptación y compromiso (ACT). La TCC se centra en reducir los patrones de pensamiento desadaptativos y mejorar las habilidades de afrontamiento. Por el contrario, la TC se centra en métodos para reducir las conductas desadaptativas frente al dolor y aumentar las conductas adaptativas. La ACT es un tipo de TCC que se centra en la aceptación de pensamientos y sentimientos. La TCC fue la intervención más comúnmente practicada. En 23 estudios de 3235 participantes, la TCC tuvo un beneficio pequeño pero constante para el dolor (DME −0,09; IC del 95 %: −0,17 a −0,01).
La TCC también tuvo pequeños beneficios para la discapacidad y la angustia. La evidencia se consideró de calidad moderada utilizando el sistema GRADE. Mientras tanto, un análisis de ocho estudios de 647 participantes de BT en comparación con el control activo no mostró diferencias para el dolor, la discapacidad o la angustia. Cinco estudios de 443 participantes de ACT en comparación con el control activo tampoco mostraron diferencias para el dolor, la discapacidad o la angustia. La evidencia para BT y ACT se consideró de calidad baja a moderada utilizando el sistema GRADE.
Los enfoques de salud complementarios e integradores incluyen intervenciones mente-cuerpo, acupuntura y yoga. Se realizó una revisión sistemática y un metanálisis de ECA de acupuntura versus acupuntura simulada o ninguna acupuntura para el dolor espinal no específico, dolor de hombro, dolor de cabeza crónico u osteoartritis. En 39 ensayos con 20.827 participantes, los tamaños del efecto de la acupuntura fueron cercanos a 0,5 en comparación con la ausencia de acupuntura y 0,2 en comparación con la terapia simulada. Por lo tanto, es probable que estos enfoques de salud integradores de bajo riesgo tengan un papel que desempeñar como complemento de los tratamientos farmacológicos y conductuales actuales.
Terapias intervencionistas
Los procedimientos intervencionistas para el dolor pueden ser una parte importante del tratamiento multimodal para el dolor, según la afección dolorosa y las comorbilidades del paciente. Los procedimientos intervencionistas varían en complejidad. Las opciones para el dolor de columna incluyen inyecciones epidurales de esteroides, neurotomía de la rama medial por radiofrecuencia, ablación del nervio basivertebral, aumento vertebral y neuromodulación (incluida la estimulación de los nervios periféricos y la estimulación de la médula espinal [SCS]).
Por ejemplo, en el caso del dolor lumbar, los estudios han demostrado que las inyecciones epidurales de esteroides en la zona lumbar son eficaces a corto y medio plazo para aliviar el dolor radicular debido a la hernia discal y posiblemente a la estenosis espinal. Mientras tanto, la neurotomía por radiofrecuencia de la rama medial lumbar puede ser eficaz en pacientes que presentan un dolor relativamente específico mediado por las facetas. Las opciones para el dolor articular incluyen inyecciones articulares, terapias regenerativas y neurotomía por radiofrecuencia.
Ciertas afecciones de dolor neuropático también pueden tratarse con bloqueos de los nervios simpáticos, bloqueos de los nervios periféricos y neuromodulación, aunque la evidencia de los beneficios a largo plazo de algunos de estos tratamientos sigue siendo algo contradictoria. Para los pacientes que no responden a la cirugía de espalda o que no responden a otros tratamientos farmacológicos conservadores y a las inyecciones, la estimulación eléctrica de la médula espinal es un tratamiento aprobado por la FDA.
Esta modalidad de tratamiento se basa en el concepto de la teoría del control de la compuerta, por la cual las interneuronas en el asta dorsal de la médula espinal pueden ser activadas por las entradas de las neuronas sensoriales periféricas para inhibir las neuronas excitatorias de la médula espinal. Se ha planteado la hipótesis de que la estimulación eléctrica externa en el espacio epidural simula la activación de las interneuronas en la médula espinal.
Los cables de la estimulación eléctrica de la médula espinal se colocan para proporcionar cobertura al área del cuerpo donde se produce el dolor del paciente. La estimulación eléctrica de la médula espinal normalmente funciona en el rango de frecuencia de 40 a 60 Hz.
Los estudios han confirmado en general la eficacia analgésica de la estimulación de la médula espinal, en la que más del 50 % de los pacientes han experimentado alivio del dolor en un seguimiento promedio de 2 años, especialmente en pacientes que presentan radiculitis cervical o lumbosacra, síndrome de cirugía de espalda fallida, neuropatía periférica diabética y dolor torácico isquémico.
Sin embargo, a pesar de su eficacia, la estimulación de la médula espinal también tiene varios efectos secundarios. Un efecto secundario común es la parestesia, que puede volverse molesta para los pacientes con el tiempo, lo que limita el cumplimiento a largo plazo del dispositivo. Los avances recientes en la estimulación de frecuencia ultraalta (10 000 Hz) y la estimulación en ráfagas han mostrado evidencia limitada de limitar los efectos de la parestesia al tiempo que brindan un alivio superior del dolor.
Como terapia invasiva, la estimulación de la médula espinal se asocia con riesgos de infección. Además, debido a la alta movilidad de la columna, puede ocurrir un desplazamiento del cable, con una incidencia de hasta el 30 % en algunos informes. En general, la estimulación de la médula espinal se reserva para los síndromes de dolor que son refractarios y graves.
Tendencias e innovaciones recientes en la investigación clínica del dolor
A pesar de las opciones de tratamiento disponibles actualmente, muchos pacientes siguen sufriendo dolor. Si bien ha habido avances en la comprensión de la fisiopatología del dolor, lamentablemente ha habido menos avances en terapias novedosas en las últimas tres décadas. En el caso de los estudios de analgésicos en fase de investigación, la probabilidad de avanzar de los estudios de fase 2 a los de fase 3 fue de aproximadamente el 28%, y la probabilidad de aprobación de los medicamentos que se sometieron a estudios de fase 3 en los Estados Unidos fue de aproximadamente el 57%.
Entre las posibles razones se incluyen la dificultad de trasladar los hallazgos mecanísticos de los animales de orden inferior (roedores) a los seres humanos, el tamaño inadecuado de la muestra, la falta de sensibilidad del ensayo, el alto efecto placebo y la población de participantes heterogénea. El dolor es subjetivo y, en el modelo biopsicosocial del dolor, el dolor es una experiencia compleja que abarca componentes biológicos, sociales y psicológicos. Por lo tanto, también existe la dificultad de evaluar el dolor clínicamente, y la heterogeneidad de los síntomas complica aún más el diseño de los ensayos. En el párrafo siguiente, destacamos algunas innovaciones recientes seleccionadas en la investigación clínica del dolor.
Nuevos agentes farmacológicos para el dolor
Un éxito notable ha sido la aprobación de medicamentos para la migraña que tienen como objetivo el péptido o receptor relacionado con el gen de la calcitonina (CGRP) después del descubrimiento del papel del CGRP en la migraña. Sin embargo, recientemente ha habido un renovado enfoque en el descubrimiento de analgésicos tanto en el ámbito académico, impulsado por la Iniciativa a Largo Plazo de los NIH para Ayudar a Terminar con la Adicción, como en la industria de la biotecnología, a medida que han surgido nuevos objetivos que están pasando por rigurosos ensayos clínicos.
Los canales de sodio dependientes de voltaje son importantes para la generación y propagación de potenciales de acción. La subunidad α es la principal responsable de la función de los canales de sodio dependientes de voltaje. En los seres humanos, existen 9 isoformas, 7 de las cuales se encuentran en los tejidos neuronales. Los bloqueadores de los canales de sodio no selectivos, como los anestésicos locales, son útiles para el dolor, pero su uso está limitado por los efectos secundarios debido al bloqueo de los canales de sodio en el sistema nervioso central y los tejidos cardíacos cuando se administran sistémicamente.
Entre los canales de sodio, Nav1.7, Nav1.8 y Nav1.9 se encuentran principalmente en las neuronas sensoriales periféricas y están involucrados en la nocicepción, como lo demuestran los estudios de mutaciones de ganancia de función y pérdida de función en humanos. Por lo tanto, estos canales se han investigado como posibles objetivos terapéuticos. Una revisión de 2020 proporcionó un resumen de los ensayos clínicos en el momento de la publicación de compuestos dirigidos a Nav1.7 y Nav1.8.
Desde 2020, VX-548, un inhibidor oral altamente selectivo de Nav1.8, se estudió en dos ECA de fase 2, doble ciego, controlados con placebo para el dolor posoperatorio. En un ensayo, 303 adultos que se sometieron a una abdominoplastia e informaron una puntuación de dolor de al menos 4 en la Escala de calificación numérica (NRS) dentro de las 4 h posteriores a la finalización de la cirugía fueron asignados aleatoriamente en una proporción de 1:1:1 a uno de los siguientes regímenes durante 48 h: 100 mg de VX-548 seguido de 50 mg cada 12 h, 60 mg de VX-548 seguido de 30 mg cada 12 h, 5 mg de hidrocodona y 325 mg de acetaminofeno cada 6 h, o placebo cada 6 h.
Se permitió el uso de ibuprofeno a 400 mg como analgésico de rescate. En el otro ensayo, 274 adultos que se sometieron a una bunionectomía unilateral primaria con osteotomía distal del primer metatarsiano y fijación bajo anestesia regional y que informaron una puntuación de dolor de al menos 4 en la NRS dentro de las 9 h posteriores a la extracción de un catéter del nervio ciático poplíteo fueron asignados aleatoriamente en una proporción de 2:2:1:2:2 a uno de los siguientes regímenes durante 48 h: 100 mg de VX-548 seguido de 50 mg cada 12 h, 60 mg de VX-548 seguido de 30 mg cada 12 h, 20 mg de VX-548 seguido de 10 mg cada 12 h, 5 mg de hidrocodona y 325 mg de paracetamol cada 6 h, o placebo cada 6 h. Se permitió nuevamente el uso de ibuprofeno como analgésico de rescate.
El criterio de valoración principal de ambos ensayos con VX-548 fue la suma ponderada en el tiempo de la diferencia de intensidad del dolor (SPID) durante 48 h de VX-548 frente a placebo. Utilizando la última observación trasladada para el análisis de imputación para aquellos que interrumpieron la medicación del estudio, la diferencia media de mínimos cuadrados en la SPID48 para la dosis alta de VX-548 y placebo fue de 37,8 (IC del 95 % 9,2, 66,4) en el ensayo de abdominoplastia y de 36,8 (IC del 95 % 4,6, 69) en el ensayo de bunionectomía, y los valores más altos representan mayores reducciones del dolor.
Como criterio de valoración secundario, utilizando una reducción del dolor de al menos el 30% en la NRS después de 48 h como umbral de éxito, el 61% (IC del 95%: 50%, 72%) en el grupo de VX-548 en dosis alta, el 59% (IC del 95%: 48%, 71%) en el grupo de VX-548 en dosis media, el 54% (IC del 95%: 43%, 65%) en el grupo de hidrocodona-acetaminofén y el 48% (IC del 95%: 37%, 59%) en el grupo placebo cumplieron este umbral en el ensayo de abdominoplastia. En el ensayo de bunionectomía, el 83% (IC del 95%: 74%, 93%) del grupo de VX-548 en dosis alta, el 63% (IC del 95%: 51%, 75%) del grupo de VX-548 en dosis media, el 76% (IC del 95%: 61%, 90%) del grupo de VX-548 en dosis baja, el 68% (IC del 95%: 57%, 80%) del grupo de hidrocodona-acetaminofén y el 58% (IC del 95%: 46%, 70%) del grupo placebo cumplieron este umbral.
La mayoría de los efectos secundarios fueron leves o moderados, y la incidencia de dolor de cabeza y estreñimiento fue mayor en los grupos de VX-548 que en los de placebo. Las limitaciones del estudio incluyen la falta de informes sobre el uso de medicación de rescate y la inscripción de una mayoría de mujeres y una mayoría de participantes blancos. Aunque los resultados primarios de los estudios se evaluaron en comparación con placebo, los resultados fueron prometedores como alternativa a los opioides. Se están esperando resultados adicionales de dos RCT de fase 3 sobre dolor posoperatorio que se completaron recientemente.
Aunque estos estudios se centraron en el dolor agudo, recientemente se completó un RCT de fase 2 sobre neuropatía periférica diabética dolorosa y se está realizando un RCT de fase 2 sobre radiculopatía lumbar. Los resultados de estos ensayos pueden respaldar el uso de este nuevo agente para tratar el dolor neuropático crónico.
La tetrodotoxina (TTX), una neurotoxina que se encuentra en el pez globo y otros animales, bloquea ciertos canales de sodio dependientes del voltaje. Los canales de sodio dependientes del voltaje sensibles a la TTX, como el Nav1.7, se han visto implicados en el dolor crónico. Un ensayo clínico aleatorizado de fase 2, doble ciego y controlado con placebo, evaluó la seguridad y la tolerabilidad de múltiples dosis de TTX en el dolor neuropático crónico inducido por quimioterapia (CINP).
Los participantes con CINP basado en taxanos o platino fueron asignados aleatoriamente en una proporción de 1:1:1:1:1 para recibir placebo dos veces al día, TTX 7,5 μg dos veces al día, TTX 15 μg dos veces al día, TTX 30 μg una vez al día o TTX 30 μg dos veces al día, durante cuatro días mediante inyección subcutánea. El criterio principal de valoración de eficacia fue un cambio en la puntuación NRS a las 3 o 4 semanas posteriores al tratamiento desde el inicio. Ciento veintiún participantes completaron el estudio.
El cambio medio con respecto al valor inicial fue mayor en el grupo de 30 μg una vez al día (−1,7 ± 2,3), seguido del grupo de TTX 30 μg dos veces al día (−1,5 ± 1,8), con un tiempo medio para alcanzar el alivio máximo del dolor de aproximadamente 3 semanas. Los eventos adversos más frecuentes en los grupos de TTX fueron parestesia oral e hipoestesia oral. Dos participantes del grupo de TTX se retiraron debido a vértigo. Se está realizando un ensayo clínico aleatorizado de fase 2 de TTX a 30 μg inyectado por vía subcutánea dos veces al día durante 4 días frente a placebo para el tratamiento de la CINP.
Por lo tanto, los estudios recientes y en curso sobre moduladores de Nav1.7 y Nav1.8 probablemente generarán datos que potencialmente puedan dar lugar a analgésicos más nuevos sin potencial de adicción o abuso.
Innovaciones en terapias conductuales
Además de las innovaciones en el ámbito farmacológico, se siguen estudiando mejoras en las terapias conductuales. La terapia de reprocesamiento del dolor (PRT, por sus siglas en inglés) se desarrolló basándose en la comprensión del dolor en sí mismo como un proceso patológico primario. En un ensayo aleatorizado, 151 participantes con dolor lumbar crónico, principalmente axial, fueron asignados aleatoriamente a PRT frente a placebo con una inyección subcutánea de solución salina de etiqueta abierta en la espalda frente a la atención habitual. Los participantes se sometieron a una sesión de referencia con imágenes por resonancia magnética funcional (fMRI, por sus siglas en inglés) y luego fueron asignados aleatoriamente al grupo de tratamiento o control.
PRT consistió en una sesión de telesalud de 1 hora con un médico, que evaluó los componentes nociplásicos del dolor y brindó educación sobre los procesos del dolor, incluida la centralización del dolor en aquellos que se pensaba que tenían este componente. Luego, los participantes completaron sesiones de terapia de 1 hora dos veces por semana durante 4 semanas. El resultado primario fue el dolor promedio durante la última semana según el Formulario breve del Inventario del dolor evaluado 1 mes después de la sesión de referencia.
Al mes, los participantes del grupo PRT informaron una reducción media del dolor de 1,79 (IC del 95 %: -1,65 a -0,71; p < 0,001) en comparación con placebo y una reducción de 2,4 (IC del 95 %: -2,28 a -1,32; p < 0,001) en comparación con la atención habitual. Utilizando un análisis por intención de tratar, el 66 % (IC del 95 %: 53 %, 79 %) en el grupo PRT frente al 20 % (IC del 95 %: 30 %, 87 %) en el grupo placebo frente al 10 % (IC del 95 %: 2 %, 18 %) en el grupo de atención habitual informaron de dolor nulo o mínimo al mes. Al año de seguimiento, el 52 % en el grupo PRT, el 27 % en el grupo placebo y el 16 % en el grupo de atención habitual informaron de dolor nulo o mínimo.
En el grupo de terapia de resincronización cardíaca, la resonancia magnética funcional mostró una actividad relacionada con el dolor evocado reducida en la corteza prefrontal anterior y la corteza cingulada media anterior en comparación con el placebo, compatible con los mecanismos de disminución del procesamiento central aversivo al dolor. La principal limitación de este estudio es que su población de estudio se inclinó hacia una población relativamente más joven (edad media [DE] de 41,1 [15,6] años), bien educada y blanca. Actualmente se están realizando estudios de terapia de resincronización cardíaca a distancia para veteranos con dolor espinal crónico y para adultos de diversas razas/étnicas con dolor de espalda crónico.
El acceso y el costo pueden ser una barrera para las terapias conductuales, y por lo tanto, las intervenciones a distancia son un área de investigación activa. En un estudio piloto aleatorizado de adultos con osteoartritis de rodilla o cadera, 113 participantes fueron asignados a una versión automatizada basada en Internet de capacitación en habilidades de afrontamiento del dolor llamada PainCOACH frente a la atención habitual. El programa PainCOACH consistió en ocho módulos autodirigidos, que se completaban a un ritmo de uno por semana. La adherencia fue alta, con un 91% de los participantes asignados aleatoriamente a PainCOACH completando todos los módulos.
Aunque no fue diseñado para evaluar la eficacia, hubo mejoras en el dolor con respecto al mes anterior. El dolor se evaluó a las 8 semanas después del inicio del tratamiento y con la subescala de dolor de la Arthritis Impact Measurement Scale 2 en el grupo PainCOACH frente a la atención habitual, mostrando un tamaño del efecto de 0,33. PainCOACH también se ha estudiado en combinación con 7 sesiones de videoconferencia con un fisioterapeuta para hacer ejercicio en casa en un ensayo clínico aleatorizado de 148 adultos con dolor crónico de rodilla frente a material educativo basado en Internet.
Los resultados primarios fueron el dolor al caminar y la función física medida con el índice de osteoartritis de las universidades Western Ontario y McMaster (WOMAC) a los 3 meses. El dolor al caminar disminuyó de 6,1 (DE 1,4) a 3,3 (2,2) en el grupo de intervención y de 6,2 (1,3) a 5,1 (2,0) en el grupo de control a los 3 meses. La función física en el WOMAC disminuyó de 33,1 (8,0) a 18,3 (10,7) en el grupo de intervención y de 32,5 (8,3) a 27,6 (11,7) en el grupo de control a los 3 meses.
Estos resultados fueron similares a los 9 meses. PainCOACH se ha actualizado recientemente y la nueva versión se conoce como PainTRAINER. PainTRAINER sigue estudiándose en otros entornos ambulatorios y domiciliarios. Se está llevando a cabo un ensayo clínico aleatorizado de PainTRAINER frente a terapia cognitivo conductual remota individualizada frente a atención habitual en participantes con dolor crónico de alto impacto, que proporcionará información valiosa sobre la eficacia clínica y de costo-efectividad de estas intervenciones remotas en línea.
La terapia con realidad virtual (RV) es una intervención conductual atractiva y de bajo riesgo para el dolor crónico. En un ensayo clínico aleatorizado reciente, 1093 adultos con dolor lumbar crónico fueron asignados a una RV basada en habilidades o a una RV simulada. El programa de RV basado en habilidades consistió en 56 experiencias inmersivas que integraban habilidades como biorretroalimentación, atención plena, cognición y regulación emocional, y educación sobre el dolor.
En general, el número total de experiencias de RV completadas fue bajo. Al cabo de un año, el grupo de RV basado en habilidades informó una disminución en la puntuación de intensidad del dolor del Brief Pain Inventory de 1,7 (DE 2,1) desde el inicio en comparación con una disminución de 1,2 (DE 2,0) en el grupo de simulación (p < 0,001). En un análisis de pacientes que respondieron al tratamiento, en el que el éxito se definió como una reducción de 2 puntos en la intensidad del dolor desde el inicio, el 52 % del grupo de RV y el 42 % del grupo de simulación fueron pacientes que respondieron al tratamiento.
Innovaciones en terapias intervencionistas
La estimulación cerebral profunda (ECP) aplica corriente eléctrica al cerebro a través de cables implantados. Dos ensayos abiertos en Estados Unidos no tuvieron éxito. Recientemente, los datos de un ensayo clínico en curso sobre la ECP para el dolor neuropático crónico mostraron que los registros neuronales invasivos proporcionaron una predicción confiable de los estados de dolor crónico, lo que potencialmente puede impulsar la estimulación de circuito cerrado.
Las técnicas de estimulación cerebral no invasiva incluyen la estimulación magnética transcraneal repetitiva (EMTr) y la estimulación transcraneal con corriente continua (ECDC). La EMTr utiliza campos magnéticos para inducir corrientes eléctricas que modulen la actividad cortical. Una revisión sistemática publicada en 2018 no encontró efectos clínicamente significativos de la EMTr en dosis única o en dosis múltiples en el dolor crónico. Se han realizado estudios recientes para optimizar los objetivos y la dosis.
En un ensayo aleatorizado, controlado con placebo, doble ciego y multicéntrico, 149 participantes con dolor neuropático periférico crónico fueron asignados a rTMS aplicada a la corteza motora primaria (M1) contralateral al sitio del dolor, un objetivo principal para el dolor crónico; rTMS aplicada a la corteza prefrontal dorsolateral izquierda (CPDL), el objetivo convencional para la depresión; o rTMS simulada. El protocolo de rTMS consistió en 15 sesiones de rTMS durante 22 semanas. Cada sesión consistió en 30 trenes de pulsos de TMS aplicados a 10 Hz durante 10 s con un intervalo entre trenes de 20 s para una duración total de 15 min. El resultado primario fue el cambio en la intensidad media del dolor del Inventario Breve del Dolor durante las 22 semanas de tratamiento y en la semana 25 (interacción Grupo × Tiempo).
Para el resultado primario, M1-rTMS fue más eficaz que el simulacro, con un efecto significativo del tiempo. La estimulación magnética transcraneal dorsofrontal tuvo la misma eficacia que la estimulación magnética transcraneal simulada. A las 25 semanas, la disminución de la intensidad media del dolor fue de 1,5 (0,8) para el grupo de estimulación magnética transcraneal dorsofrontal frente a 0,9 (2,2) y 0,8 (1,5) para los grupos de estimulación magnética transcraneal dorsofrontal y simulación, respectivamente. Los efectos secundarios más comunes fueron dolor de cabeza y dolor en el sitio de estimulación.
La estimulación magnética transcraneal con corriente continua (tDCS) utiliza una corriente eléctrica de baja intensidad para modular la actividad cortical. Una revisión sistemática de 2018 no encontró un efecto en comparación con la simulación; la evidencia según GRADE se consideró de calidad muy baja a baja. Por lo tanto, se necesitan más estudios sobre técnicas de estimulación cerebral no invasiva.
Uso de criterios de valoración digitales en ensayos clínicos sobre el dolor
El dolor es una experiencia multidimensional y, tradicionalmente, los ensayos clínicos sobre el dolor han utilizado los resultados informados por el paciente (PRO, por sus siglas en inglés) para evaluar los dominios del dolor, incluida la intensidad del dolor, la función física, el estado de ánimo y la impresión global del participante sobre el cambio. Este sistema de informes se basa en el recuerdo de los participantes durante un período determinado, que puede estar sujeto a diversos sesgos.
Por lo tanto, han surgido nuevos criterios de valoración digitales como un área de investigación para los ensayos clínicos sobre el dolor. La evaluación momentánea ecológica es una metodología de autoinforme que evalúa cómo se desempeñan los participantes en su vida diaria en múltiples puntos temporales, lo que puede reducir el sesgo de recuerdo y aumentar la validez ecológica. Este método se ha utilizado en la investigación del dolor crónico desde la década de 1980, primero utilizando diarios de papel y, más recientemente, utilizando teléfonos inteligentes y relojes inteligentes para ingresar datos. Para reducir aún más la carga para los participantes, recientemente ha habido interés en utilizar datos recopilados pasivamente de dispositivos portátiles para rastrear objetivamente los resultados del dolor.
En un subestudio del estudio REALITY (Long-Term Real-World Outcomes Study on Patients Implanted with a Neurostimulator), multicéntrico, de un solo brazo y de etiqueta abierta, 15 participantes con dolor de espalda o CRPS respondieron a los PRO durante las visitas en persona al inicio y 3 y 6 meses después del implante de la ECP y mensualmente a través de una aplicación para teléfonos inteligentes. La intensidad del dolor se evaluó diariamente utilizando la aplicación para teléfonos inteligentes, y la actividad física y las mediciones cardíacas se recopilaron con un reloj inteligente, incluidos datos como el recuento de pasos, la distancia recorrida, la frecuencia cardíaca y la variabilidad de la frecuencia cardíaca.
La mediana de cumplimiento para el uso de la aplicación para teléfonos inteligentes, definida como completar los PRO al menos 3 veces durante el inicio y mensualmente durante 6 meses, fue del 88,8%. La mediana de cumplimiento para el uso del reloj inteligente fue del 84,7%, definido como usar el reloj durante al menos 7 días durante el período inicial y 180 días después del implante de la ECP. Utilizando datos recopilados pasivamente a través del reloj inteligente, así como datos del controlador SCS y datos meteorológicos, un modelo de aprendizaje automático de bosque aleatorio pudo predecir niveles de dolor leve, moderado y severo con una precisión de 0,768 ± 0,012.
Los modelos de aprendizaje automático también pudieron predecir otras categorías de PRO, incluida la Escala de Catastrofismo del Dolor, varios dominios de PROMIS-29 y el Índice de Discapacidad de Oswestry con alta precisión. Si bien este estudio está limitado por el tamaño relativamente pequeño de la muestra, muestra la viabilidad de usar dispositivos digitales para medir el dolor crónico en el entorno doméstico que se pueden probar en estudios futuros con tamaños de muestra más grandes.
Otros estudios han examinado el uso de mediciones portátiles de la actividad diaria en la artritis de rodilla, el dolor espinal no específico y el dolor posoperatorio en diferentes rangos de edad, y cuando se combinan con el aprendizaje automático, algunas de estas medidas han sido bastante exitosas en la predicción del dolor y el seguimiento de los resultados del tratamiento en cohortes más pequeñas.
Además de la actividad diaria registrada, el análisis del habla ya se ha utilizado para identificar trastornos del estado de ánimo, incluido el trastorno de estrés postraumático y la depresión, y se está explorando su uso para la detección del dolor. En un estudio observacional prospectivo de 60 pacientes con enfermedad espinal que consultaron con un departamento de neurocirugía, los pacientes usaron una aplicación de teléfono inteligente para informar sobre la intensidad del dolor diariamente.
Semanalmente, se realizó una grabación del habla de los pacientes leyendo un pasaje estandarizado de Charles Dickens. Un modelo de aprendizaje automático de K vecinos más cercanos predijo la intensidad del dolor con una precisión de 0,71. Las limitaciones del estudio incluyen el tamaño pequeño de la muestra. En el futuro, estos puntos finales digitales pueden hacer avanzar los ensayos clínicos, proporcionando métodos objetivos para capturar los efectos del tratamiento en tiempo real.
Uso de biomarcadores de neuroimagen en ensayos clínicos sobre el dolor
Los autoinformes subjetivos pueden complementarse con neuroimagen objetiva y mediciones neurofisiológicas. En las últimas tres décadas se ha investigado activamente el uso de la tomografía por emisión de positrones, la resonancia magnética, incluida la fMRI, y más recientemente la electroencefalografía para evaluar las funciones cerebrales en el contexto del dolor agudo y crónico. Estos estudios ya señalan regiones específicas del cerebro (p. ej., corteza cingulada anterior rostral y dorsal, corteza insular, etc.) que desempeñan papeles críticos en el procesamiento y la regulación de los componentes sensoriales y afectivos del dolor, pero más recientemente están mostrando los papeles de la conectividad funcional entre diferentes regiones para el mantenimiento del dolor crónico (p. ej., circuito corticoestriatal, etc.).
Dicha investigación puede proporcionar biomarcadores objetivos para evaluar los efectos terapéuticos del tratamiento e identificar posibles circuitos cerebrales diana para la neuromodulación. Mientras tanto, estudios genéticos y genómicos a gran escala en pacientes con dolor crónico, además de estudios en modelos animales de dolor crónico, pueden revelar nuevos objetivos moleculares (p. ej., receptores de ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico, canales regulados por nucleótidos cíclicos activados por hiperpolarización, etc.) para terapias farmacológicas no adictivas. La combinación de neuroimágenes con estudios genómicos nos permitirá desarrollar una gama de biomarcadores de neurociencia molecular, celular y de sistemas con funciones mecanicistas bien definidas.
Estos biomarcadores permitirán a los médicos adoptar un enfoque de medicina de precisión para el dolor crónico, al realizar diagnósticos más precisos de los síntomas y de la enfermedad y combinarlos con un plan de tratamiento personalizado, predecir la progresión de la enfermedad y monitorear las respuestas al tratamiento. Por ejemplo, los biomarcadores de neuroimágenes se pueden utilizar para enriquecer los ensayos clínicos, identificando aquellos que se piensa que tienen el mayor beneficio potencial de una terapia. Los biomarcadores también pueden utilizarse como medida de respuesta.
Conclusiones
El dolor crónico sigue siendo un desafío para su tratamiento. A pesar del arsenal de terapias disponibles, los pacientes a menudo experimentan un alivio inadecuado del dolor. Actualmente, un enfoque de “ensayo y error” sigue siendo típico en entornos clínicos, lo que puede conducir a efectos secundarios y retrasos en el tratamiento adecuado del dolor, y se necesitan urgentemente enfoques de medicina de precisión más personalizados. Existen nuevas terapias prometedoras para el dolor que abarcan agentes farmacológicos, así como terapias conductuales e intervencionistas. La incorporación de puntos finales digitales en tiempo real puede mejorar la eficiencia en la evaluación de los resultados en ensayos clínicos. El uso de biomarcadores y farmacogenómica también puede guiar los tratamientos dirigidos en el futuro.