Ronald Palacios Castrillo
Las células modificadas fuera del cuerpo y luego reintroducidas brindan una ventaja sobre la mayoría de las terapias de moléculas pequeñas en el sentido de que las células pueden diseñarse para reconocer moléculas objetivo en tejidos específicos y luego actuar localmente.
Dos estudios ahora demuestran avances en la ingeniería celular para el tratamiento de enfermedades humanas. Reddy et al. diseñaron células T humanas para crear un receptor sintético que reconociera células T hiperactivas como las que causan enfermedades autoinmunes y rechazo de órganos.
Las células modificadas más eficaces que se probaron fueron aquellas en las que el receptor sintético inició un programa que provocó la producción tanto de una citocina antiinflamatoria como de un receptor que actuó como sumidero para una citocina proinflamatoria producida localmente.
=> Recibir por Whatsapp las noticias destacadas
En modelos de ratón, dichas células podrían diseñarse con programas lógicos que protegieran los tejidos deseados sin una inmunosupresión sistémica perjudicial. Simic et al. modificaron las células T para producir un receptor sintético que reconociera un antígeno localizado en la matriz extracelular del cerebro.
El receptor sintético activó un circuito que estimulaba la producción de receptores de antígenos quiméricos que atacaban y mataban las células cancerosas en el cerebro, pero no las implantadas en otras partes del ratón. Un modelo de ratón de enfermedad cerebral neuroinflamatoria podría tratarse con células diseñadas para producir localmente una citocina antiinflamatoria.
El trabajo de Simic resumido abajo es sencillamente fantástico, muy original y potencialmente revolucionario si se obtienen resultados similares en pacientes. Esperamos con ansias los ensayos clìnicos de esta muy novedosa estratègia terapèutica.
Resumen trabajo de Simic,et.al., [SCIENCE 386, número 6726,2024.DOI: 10.1126/science.adl423711 1523]
El tratamiento de los trastornos del sistema nervioso central (SNC), como los tumores cerebrales, la neuroinflamación y la neurodegeneración, sigue siendo un desafío porque es difícil administrar terapias moleculares de manera eficaz al cerebro. Además, es difícil restringir la acción de estos agentes terapéuticos al cerebro para evitar toxicidades periféricas o sistémicas.
Las células inmunitarias han evolucionado para infiltrarse en diversos tejidos, integrar información sobre su entorno y remodelar los ecosistemas tisulares.
Las células T, por ejemplo, pueden atravesar la barrera hematoencefálica en condiciones sanas y patógenas. Estas propiedades las convierten en vehículos de administración ideales para el SNC.
En principio, si programamos las células para que administren de forma selectiva y autónoma cargas terapéuticas al cerebro, podríamos reducir la toxicidad sistémica fuera del objetivo y aumentar la eficacia. Simic,et.al., [SCIENCE 386, número 6726,2024.DOI: 10.1126/science.adl423711 1523] plantearon la hipótesis de que podría ser posible diseñar células inmunitarias para que actúen solo de una manera específica para cada tejido.
Una forma de aprovechar las células T para que administren cargas útiles de forma selectiva al cerebro sería diseñarlas para que reconozcan antígenos normales (no patológicos) específicos del SNC y utilizar esta señal anatómica para inducir localmente la producción de un agente terapéutico.
Este sistema de administración específico del SNC basado en células podría servir como una plataforma general para tratar diversas enfermedades del SNC.
RESULTADOS
Simic,et.al., [SCIENCE 386, número 6726,2024.
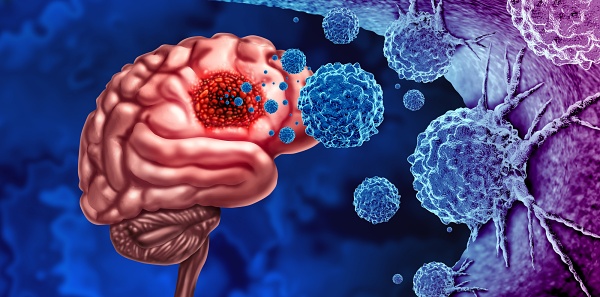
DOI: 10.1126/science.adl423711 1523] crearon un conjunto de células T que detectan el cerebro y que fueron programadas para administrar localmente cargas terapéuticas personalizadas para el cáncer o la neuroinflamación.
En primer lugar, identificaron un conjunto de ligandos extracelulares específicos del SNC utilizando datos de expresión disponibles públicamente para establecer posibles marcadores «GPS» cerebrales. Identificaron proteínas como el brevicano (BCAN), que son componentes de la matriz extracelular altamente única del cerebro y podrían aprovecharse para el reconocimiento específico de tejidos.
Desarrollaron anticuerpos contra estos antígenos específicos del SNC y los utilizaron para construir receptores Notch sintéticos activados por el SNC (synNotch), receptores diseñados que detectan un antígeno extracelular y responden induciendo una respuesta transcripcional.
Para demostrar el potencial terapéutico de este enfoque, utilizaron esta plataforma para inducir localmente un conjunto de cargas útiles codificadas genéticamente dirigidas a diferentes enfermedades del SNC.
Las células T que detectan el cerebro y que indujeron la expresión de CAR pudieron tratar cánceres cerebrales primarios y secundarios, incluidos modelos de glioblastoma y metástasis de cáncer de mama en ratones, sin atacar tejidos fuera del cerebro. Por el contrario, la expresión inducida por el SNC de la citocina inmunosupresora interleucina-10 (IL-10) mejoró la neuroinflamación en la encefalomielitis autoinmune experimental, un modelo de ratón de esclerosis múltiple.
CONCLUSIÓN
Esta estrategia de inducción celular dirigida a tejidos proporciona dos niveles de especificidad. En primer lugar, la célula muestra una especificidad restringida anatómicamente, ya que las células solo se inducen en el SNC, y en segundo lugar, la carga útil (p. ej., CAR, citocina, anticuerpo) tiene su propia especificidad de orientación molecular intrínseca.
Esta estrategia de orientación anidada y multiescala imita los principios de la especificidad biológica natural, evitando posibles reacciones cruzadas sistémicas no deseadas de la carga útil molecular mientras enfoca sus acciones de manera más efectiva en el tejido objetivo.
Estos resultados sugieren que las células que detectan el cerebro podrían utilizarse como plataforma general para tratar un conjunto más amplio de enfermedades del sistema nervioso central, incluidos los tumores cerebrales, las metástasis cerebrales, la neuroinflamación y la neurodegeneración.
Aunque aquí se centraron en el sistema nervioso central, este concepto podría aplicarse a un conjunto más amplio de tejidos. Las células terapéuticas dirigidas a los tejidos proporcionan un enfoque para integrar señales endógenas y patológicas para generar terapias que sean más específicas y eficaces.