Publicado el 4 de septiembre de 2024
N Engl J Med 2024;391:864-866 DOI: 10.1056/NEJMc2407150
AL EDITOR:
Las terapias con células T anti-CD19 con receptor de antígeno quimérico (CAR) han demostrado una eficacia terapéutica sustancial en pacientes con enfermedades autoinmunes como el lupus eritematoso sistémico (LES) al inducir una depleción profunda de células B[1].
Sin embargo, su costoso y lento proceso de fabricación, la necesidad de regímenes de acondicionamiento y una capacidad limitada para modificar la dosis de células T CAR una vez que ha comenzado la administración impiden su uso generalizado.
=> Recibir por Whatsapp las noticias destacadas
Los anticuerpos biespecíficos que se unen a las células T tienen dos sitios de unión que se dirigen tanto a CD3 como a un antígeno de célula B diana; este atributo da como resultado la activación de células T CD3+ y la posterior destrucción de células diana.
Ahora reportan sobre el uso del anticuerpo biespecífico teclistamab contra CD3 y antígeno de maduración de células B (BCMA), que está aprobado para el tratamiento del mieloma múltiple[2], en un paciente con LES grave. Se seleccionó teclistamab para su uso en nuestro paciente para explotar su capacidad de agotar las células B y las células plasmáticas[3], las cuales expresan BCMA y están implicadas en el impulso de la autoinmunidad en pacientes con LES[4,5].
Una mujer de 23 años con antecedentes de 6 años de LES presentó nefritis lúpica activa (clase II y V de la Organización Mundial de la Salud), anemia hemolítica autoinmune, lesiones vesiculoampollosas y poliartritis.
El tratamiento previo con hidroxicloroquina, metotrexato, azatioprina, dapsona, micofenolato de mofetilo, voclosporina, belimumab y anifrolumab no había controlado suficientemente sus síntomas.
Después de obtener el consentimiento informado por escrito, la paciente recibió inyecciones subcutáneas de las dosis recomendadas de teclistamab (0,03 y 0,6 mg por kilogramo de peso corporal), seguidas de una dosis adicional de 0,8 mg por kilogramo el día 7; posteriormente recibió la dosis completa de 1,5 mg por kilogramo en las semanas 2 y 5 (dosis finales).
El tratamiento con micofenolato de mofetilo se interrumpió antes de iniciar el tratamiento con teclistamab, y la terapia oral con prednisolona se interrumpió en la semana 6. Los eventos adversos incluyeron síndrome de liberación de citocinas de grado 2 (para el cual la paciente recibió tratamiento con tocilizumab), neumonía, sinusitis e hipogammaglobulinemia; la aparición de hipogammaglobulinemia puede justificar la repetición de la vacunación.
Los efectos secundarios observados son similares a los notificados en pacientes con mieloma múltiple que habían recibido teclistamab. El teclistamab también puede causar neutropenia, anemia y síndrome de neurotoxicidad asociada a células efectoras inmunitarias[2], ninguno de los cuales se observó en este paciente.
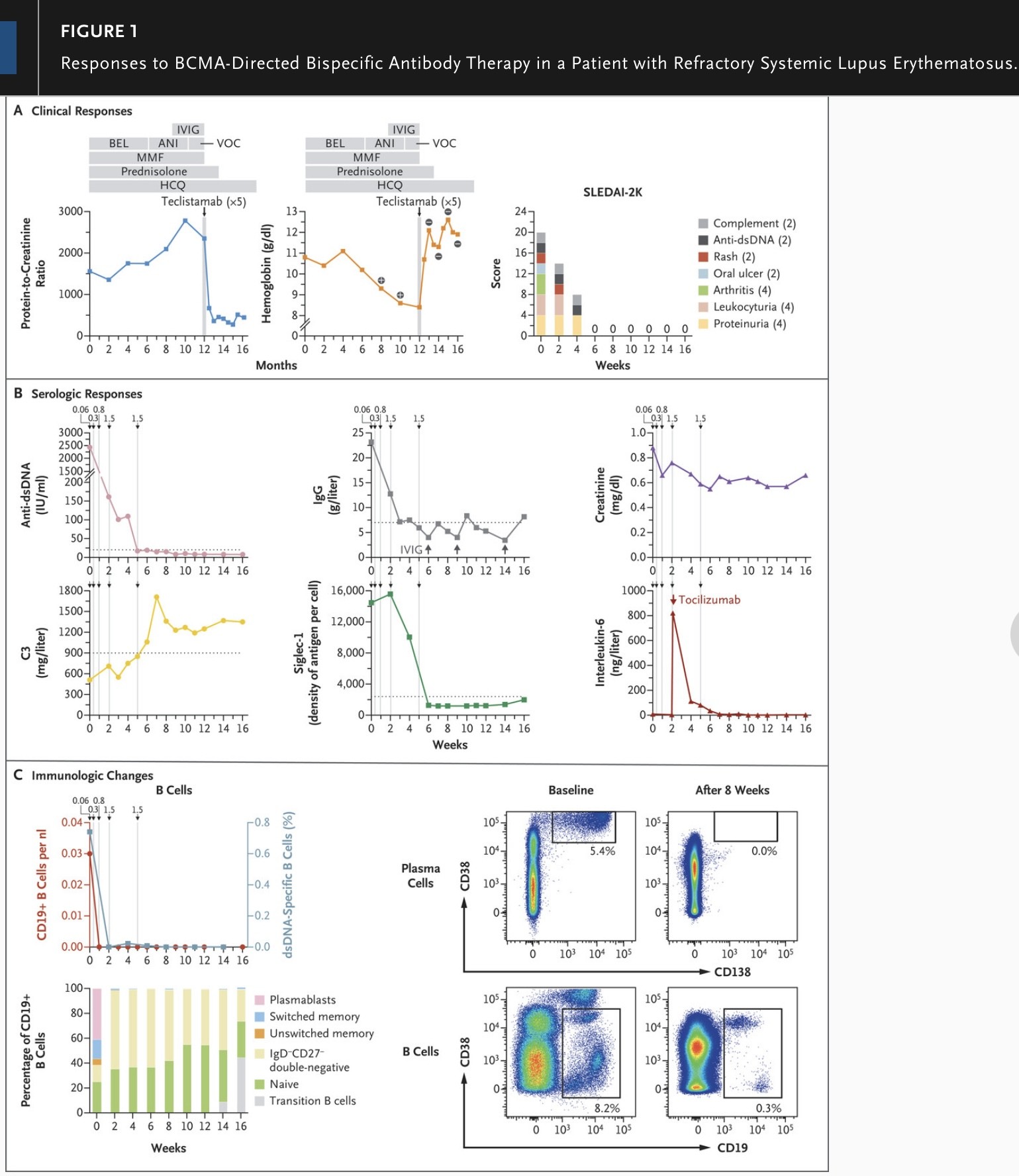
La relación proteína/creatinina en la orina (con la proteína medida en miligramos y la creatinina medida en gramos) disminuyó de 2352 (medida inmediatamente antes del inicio del tratamiento con teclistamab) a menos de 500 en la semana 6; también se observó un aumento en el nivel de hemoglobina en sangre, la normalización de la prueba de antiglobulina en la semana 4 y una resolución completa de las manifestaciones mucocutáneas y musculoesqueléticas después de completar el tratamiento con teclistamab (Figura 1A). Además, hubo una mejora gradual en la calidad de vida=.
El nivel de anticuerpos anti-ADN bicatenario disminuyó rápidamente, de 2440 UI por mililitro al inicio del tratamiento con teclistamab a menos del límite superior del rango normal en la semana 5, y permaneció indetectable hasta la semana 16; además, el nivel de complemento del paciente y la actividad del interferón tipo I se normalizaron (Figura 1B).
El tratamiento con teclistamab condujo a una rápida depleción de células B de sangre periférica (en la semana 1), así como a una vasta erradicación de células plasmáticas de médula ósea y células B (en la semana 8) (Figura 1C).
Este caso demuestra que el tratamiento a corto plazo con un anticuerpo biespecífico dirigido a BCMA indujo una remisión completa rápida y sin fármacos del LES al agotar las células plasmáticas de larga vida y las células B de memoria.
La respuesta en nuestro paciente fue notable y podría posicionar a los anticuerpos biespecíficos dirigidos a BCMA como un futuro tratamiento listo para usar, potencialmente con incidencias de respuesta similares a las obtenidas con terapias de células T CAR anti-CD19. Sin embargo, se necesita un período de seguimiento más largo, en particular hasta que se produzca la repoblación de células B, y el tratamiento de una población de pacientes más grande para determinar la incidencia y la duración de la respuesta.
Figura 1
El panel A muestra las proporciones de proteína y creatinina (la proteína se mide en miligramos y la creatinina en gramos) en la orina y los niveles de hemoglobina en sangre en relación con el historial de medicación del paciente durante los 12 meses anteriores al inicio del tratamiento con teclistamab y en relación con la reducción gradual de las dosis de glucocorticoides después de completar el tratamiento con teclistamab. Teclistamab (×5) se refiere a las cinco dosis que se administraron.
La prueba de antiglobulina directa del paciente fue positiva (+) antes del tratamiento, fue negativa (−) en la semana 4 y permaneció negativa durante todo el período de seguimiento. El gráfico de la derecha muestra la actividad de la enfermedad del paciente evaluada mediante el Índice de actividad de la enfermedad del lupus eritematoso sistémico 2000 (SLEDAI-2K).
La puntuación total varía de 0 a 108, donde 0 refleja una remisión completa, y se basa en la presencia o ausencia de 24 síntomas ponderados; el peso asignado a cada síntoma se muestra entre paréntesis.
El panel B muestra los cambios en los niveles de anticuerpos anti-ADN de doble cadena (dsDNA), los niveles de IgG, los niveles sanguíneos de creatinina, los niveles sanguíneos de C3, la expresión de Siglec-1 en monocitos (como un marcador sustituto de la actividad del interferón tipo I; medido como la densidad de antígeno por célula) y los niveles de interleucina-6, en relación con el momento del tratamiento con teclistamab (representado con flechas y dosis en miligramos por kilogramo de peso corporal).
Las líneas de puntos indican el límite superior del rango normal para los niveles de anticuerpos anti-dsDNA y Siglec-1 y el límite inferior del rango normal para los niveles de IgG y C3. La sustitución de 30 g de inmunoglobulina intravenosa (IVIG) por teclistamab y el tratamiento con tocilizumab se indican con flechas.
El panel C muestra los recuentos absolutos de células B CD19+, junto con la frecuencia de células B específicas de dsADN (gráfico superior izquierdo) y la distribución de subconjuntos de células B entre las pocas células B CD19+ restantes de sangre periférica a lo largo del tiempo (gráfico inferior izquierdo).
También se muestran en el panel C los diagramas de puntos de citometría de flujo, que ilustran la frecuencia de células plasmáticas CD38+ y CD138+ entre las células mononucleares de la médula ósea (fila superior) y la frecuencia de células B CD19+ de la médula ósea (fila inferior) al inicio y en la semana 8.
Los recuadros en los diagramas de puntos representan las puertas que se usaron para definir las poblaciones celulares y calcular las frecuencias entre las células. ANI denota anifrolumab, BCMA antígeno de maduración de células B, BEL belimumab, HCQ hidroxicloroquina, MMF micofenolato mofetilo y VOC voclosporina.