Ronald Palacios Castrillo
La sepsis, un síndrome de disfunción orgánica aguda potencialmente mortal debido a una respuesta desregulada a la infección, es una importante carga de salud mundial.
En todo el mundo, se estima que anualmente se producen 48,9 millones de casos de sepsis y 11 millones de muertes relacionadas.1. En los Estados Unidos, más de un tercio de las muertes hospitalarias se atribuyen a la sepsis[2], con costos que superaron los $38 mil millones en 2017, lo que hace que la sepsis sea la causa más común de muerte hospitalaria y la causa más cara de hospitalización.3.
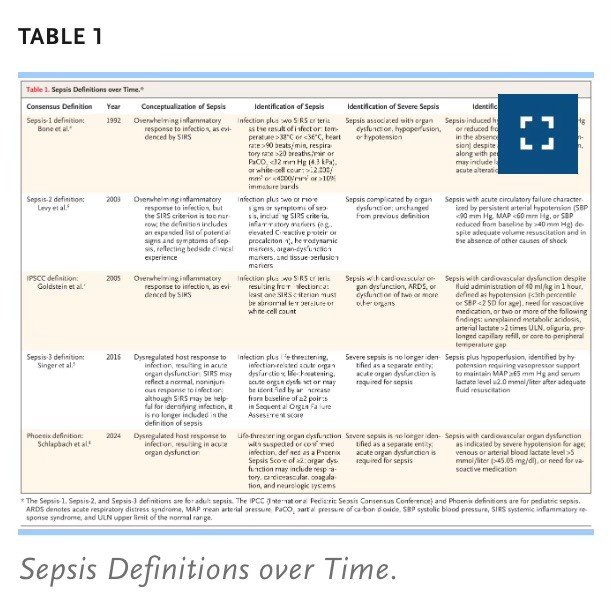
Derivada de la palabra griega sepo (σηπω, traducida como «me pudro»), la sepsis ha sido una de las principales causas de enfermedad y muerte durante milenios. Según la primera definición moderna, en 1992, la sepsis se describía como una respuesta inflamatoria sobreabundante a la infección, reconocida por la presencia del síndrome de respuesta inflamatoria sistémica (SIRS), que se define como dos o más anomalías de temperatura, frecuencia cardíaca, frecuencia respiratoria o recuento de glóbulos blancos.4. Posteriormente, la sepsis se reconceptualizó como una disfunción orgánica aguda potencialmente mortal debido a una respuesta desregulada del huésped a la infección5 (Tabla 1). El SIRS ya no se incluye en la definición de sepsis, ya que puede reflejar una respuesta no dañina del huésped, pero el reconocimiento del síndrome sigue siendo útil para identificar la infección.5.
=> Recibir por Whatsapp las noticias destacadas
Epidemiología mundial
Aunque la sepsis es un problema mundial, las causas, la incidencia y los resultados difieren según la región geográfica y la edad. Aproximadamente el 85% de los casos y un número desproporcionado de muertes relacionadas con la sepsis ocurren en países de ingresos bajos y medios,1 con la mayor incidencia estandarizada por edad en las áreas de mayor vulnerabilidad social.1.
En África subsahariana se ve particularmente afectada, con el 40% de los casos en todo el mundo.9. La considerable diversidad de los patógenos involucrados, incluidos los patógenos que causan malaria, fiebre tifoidea y dengue, así como el virus de la inmunodeficiencia humana (VIH) y su interacción con la tuberculosis, también supone una presión para el África subsahariana y otros países de ingresos bajos y medios[1,9].
PUNTOS CLAVE
SEPSIS Y CHOQUE SÉPTICO
- La sepsis es un síndrome de disfunción orgánica aguda potencialmente mortal debido a una infección bacteriana, fúngica, parasitaria o viral.
- Los factores que afectan el riesgo de sepsis incluyen la edad, el estado inmunológico, la virulencia de los patógenos y la carga de patógenos.
- La sepsis se asocia con complicaciones a largo plazo entre los sobrevivientes.
- Las características biológicas de la sepsis incluyen inflamación desregulada, inmunosupresión y lesión vascular.
- El manejo de la sepsis se centra en el control rápido de la infección y la reanimación hemodinámica.
- Se están realizando investigaciones para determinar si se debe modular la respuesta inmunitaria del huésped y cómo hacerlo para mejorar los resultados.
Los sitios más comunes de infección son los pulmones (que representan el 40 a 60% de los casos), el abdomen (15 a 30%), el tracto genitourinario (15 a 30%), el torrente sanguíneo y la piel o los tejidos blandos, con variaciones geográficas[10,11].
Se identifica un patógeno en aproximadamente el 60 a 70% de los casos[10], y el porcentaje puede aumentar a medida que las pruebas moleculares para los ácidos nucleicos de los patógenos se generalizan.12.
La causa más común es la infección bacteriana grampositiva o gramnegativa, seguida de la infección fúngica o viral, aunque la incidencia de sepsis viral puede aumentar drásticamente durante las pandemias.10. En los Estados Unidos, las especies de Candida son el tercer tipo de patógeno más común cultivado en sangre, después de las bacterias grampositivas y gramnegativas.13.
Los factores de riesgo de candidemia incluyen enfermedad crítica prolongada, colonización por Candida, catéteres permanentes, mucositis, enfermedad hepática avanzada, recepción de nutrición parenteral total e inmunodepresión. Otras causas comunes de sepsis fúngica son los hongos endémicos y Pneumocystis jirovecii. Los factores de riesgo para estos patógenos oportunistas incluyen inmunosupresión, neutropenia prolongada, exposiciones ambientales y enfermedad pulmonar crónica.
Los patógenos que provocan sepsis varían a lo largo de la vida; tanto las infecciones virales como las diarreicas son más comunes en la primera infancia que en etapas posteriores de la vida.14. En un estudio de prevalencia puntual global que incluyó unidades de cuidados intensivos (UCI) pediátricas en 26 países, el 21% de los casos de sepsis se atribuyeron a una infección viral.15.
La sepsis puede ocurrir en pacientes de cualquier edad, pero la incidencia varía notablemente a lo largo de la vida (Figura 1). La incidencia mundial es más alta entre los niños menores de 5 años de edad, con el nadir comenzando en la niñez media y la adolescencia, y se produce un aumento exponencial a partir de los 60 años aproximadamente.1.
De 11 millones de muertes por sepsis en 2017, el 26% se produjo en niños menores de 5 años de edad.1. La inmadurez del sistema inmunológico explica parte del exceso de riesgo en el período neonatal y de la primera infancia, ya que el inmunodeficiencia aumenta el riesgo de sepsis y mejora la patogenicidad de los organismos oportunistas.
La incidencia de sepsis también es alta entre las personas con enfermedades crónicas que deterioran la función inmunológica, en particular los pacientes con cáncer, inmunodeficiencia grave o enfermedad renal que requieren hemodiálisis. Más del 20% de las hospitalizaciones por sepsis entre los adultos estadounidenses se producen en pacientes con cáncer[18], y la incidencia de sepsis aumenta en un factor de aproximadamente 40 entre los pacientes que reciben hemodiálisis a largo plazo.19.
La evolución de las definiciones y el creciente reconocimiento de la sepsis han complicado la evaluación epidemiológica del trastorno.20.
Los mejores datos globales disponibles indican que la incidencia de la sepsis y la mortalidad asociada disminuyeron aproximadamente un 35% y un 50%, respectivamente, de 1990 a 2017[1].
En los Estados Unidos, las hospitalizaciones por sepsis han aumentado en las últimas dos décadas, pero este aumento parece explicarse en gran medida por un mayor reconocimiento y codificación diagnóstica de la sepsis.21. Los estudios basados en datos clínicos sugieren que la incidencia y los resultados de la sepsis son relativamente estables a lo largo del tiempo en los Estados Unidos.22.
Características biológicas
DESREGULACIÓN INMUNITARIA
No se ha definido la respuesta molecular bien regulada a la infección, pero la opinión predominante es que la sepsis es una respuesta inmunitaria desregulada que da lugar a una disfunción orgánica.
La progresión a la sepsis está influenciada por la virulencia y abundancia del patógeno, así como por las características del huésped, incluyendo la activación inmune innata, inmunosupresión relativa y mecanismos de tolerancia maladaptativos[23,24].
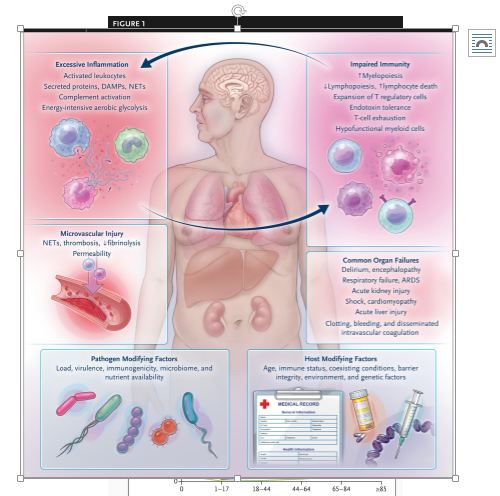
Muchas características de la respuesta inflamatoria esperada —elaboración de citocinas, mielopoiesis excesiva y generación de trampas neutrófilo-endoteliales (NET)— contribuyen a la lesión orgánica y perpetúan una homeostasis inmune alterada (Figura 2)[25].
Además, el perfil molecular ha revelado múltiples patrones de respuesta en la expresión génica[26,27], proteínas secretadas y metabolitos[28,29], y poblaciones de leucocitos[30,31], entre los pacientes. Subfenotipos moleculares específicos de alto riesgo pueden tener respuestas diferenciales a ciertas terapias[28,32] y son el foco de los ensayos clínicos.
El síndrome similar a la activación de macrófagos, un subtipo de alto riesgo, también tiene características de hiperinflamación y se encuentra bajo investigación en ensayos clínicos.33.
Patobiología de la sepsis.(FIGURA 2).
Junto con la inflamación excesiva, los pacientes con sepsis presentan supresión de los sistemas inmunológicos innato y adaptativo en diversos grados. Los neutrófilos, aunque más numerosos, son relativamente hipofuncionales.34.
Los monocitos de sangre periférica, que son las principales células efectoras inmunes, tienen una secreción alterada de citocinas, un fenómeno denominado tolerancia a las endotoxinas.35. Una subpoblación específica de monocitos, las células MS1, se expande durante la sepsis y aumenta la inmunosupresión[31,36].
La linfopenia absoluta (recuento absoluto de linfocitos, <1000 por campo de gran aumento) es común durante la sepsis, y la linfopenia persistente se asocia con un mayor riesgo de muerte[37].
El recuento reducido de linfocitos se debe a la apoptosis de los linfocitos[38] y a la linfopoiesis reducida[30], y las células T reguladoras expandidas suprimen la proliferación y las funciones efectoras de muchas otras células inmunes[39].
Aunque la hiperinflamación y la inmunosupresión concurrentes durante la sepsis resaltan la complejidad de diseñar intervenciones para restablecer la homeostasis, estos procesos aparentemente opuestos pueden estar vinculados. Los neutrófilos inmaduros regulados positivamente y las células MS1 estimulan la mielopoiesis en curso a expensas de la hematopoiesis típica[30,36].
Las respuestas tempranas a los patógenos y las señales de daño desencadenan un cambio en la producción de energía de la fosforilación oxidativa a la glucólisis aeróbica.40. Con la estimulación repetida con citocinas, los monocitos obtenidos de pacientes con sepsis quedan «inmunemente paralizados» y tienen glucólisis, fosforilación oxidativa y beta-oxidación deficientes.40.
Estas deficiencias metabólicas se revierten en gran medida en los sobrevivientes de la sepsis[40], lo que sugiere que la falla metabólica provocada por las necesidades energéticas muy altas para la defensa temprana del huésped puede ser la base de la inmunosupresión inducida por la sepsis.
Los linfocitos obtenidos de pacientes con sepsis a menudo expresan marcadores de agotamiento inmunológico[41,42], que pueden ser intrínsecos a la población específica de células T o reflejar una alta activación de las células T[43].
La estimulación crónica de las células T CD8+ puede producir células T agotadas e hipofuncionales, y los estudios han demostrado que la activación dramática de las células T en pacientes con sepsis está asociada con un mayor riesgo de muerte[44,45].
VASCULATURA DISREGULADA
La vasculatura es un sitio clave de lesión en la sepsis. El endotelio expresa abundantes receptores para citocinas, quimiocinas y señales de daño y, por lo tanto, está preparado para responder rápidamente a los patógenos y la lesión tisular.
Aunque la vasculatura es difícil de estudiar (las biopsias de vasos sanguíneos son raras), se han identificado múltiples defectos.
Los vasos pierden su glucocáliz, una barrera protectora que aísla el endotelio de las células sanguíneas circulantes y las plaquetas, lo que resulta en una predisposición a la formación de NET y la adhesión de leucocitos y plaquetas[46].
La activación del sistema del complemento es fundamental para la defensa del huésped[47], sin embargo, la activación exuberante del complemento incita un daño tisular sustancial y trombosis microvascular[48].
En el estado saludable, la permeabilidad de la barrera endotelial se ajusta para reclutar leucocitos y nutrientes al sitio de la infección, pero la regulación de la permeabilidad endotelial a menudo se pierde durante la sepsis.
Clínicamente, esta desregulación vascular se manifiesta como hipotensión, pérdida de líquido en el tercer espacio (pérdida de líquido intravascular hacia el intersticio) y, en casos raros, coagulopatía intravascular diseminada franca.
Los tratamientos para mejorar la función de barrera vascular han aumentado la supervivencia en modelos animales de sepsis[49], pero faltan datos de ensayos clínicos de estos tratamientos.
Varios tratamientos que se dirigen tanto a la inflamación como a la activación vascular, incluida la proteína C activada y las estatinas, han demostrado ser prometedores; sin embargo, a menudo se han observado señales de que la respuesta al tratamiento es heterogénea entre los subgrupos de pacientes[28,50].
Presentación clínica y evaluación
Las muchas combinaciones de sitio de infección, patógeno, disfunción aguda de uno o más órganos y estado de salud inicial dan como resultado una heterogeneidad sustancial de la presentación clínica.
Los pacientes suelen presentar signos y síntomas generales de infección (p. ej., fiebre o hipotermia y malestar) y síntomas específicos del lugar de la infección (p. ej., tos, disuria o eritema), así como síntomas de disfunción orgánica aguda (p. ej., confusión, oliguria o disnea).
Sin embargo, el reconocimiento oportuno de la sepsis puede ser un desafío porque las manifestaciones son heterogéneas, evolucionan con el tiempo y pueden ser sutiles al principio del proceso de la enfermedad.
Además, los signos y síntomas comunes no son específicos de la sepsis y pueden estar enmascarados por medicamentos (p. ej., betabloqueantes o agentes antipiréticos).
Se debe considerar la sepsis en todos los pacientes que presentan una infección grave o una disfunción orgánica aguda que no sea claramente atribuible a una causa no infecciosa.
En el caso de los pacientes que presentan una infección, los médicos deben buscar evidencia clínica y de laboratorio de disfunción orgánica aguda. La alteración del estado mental, la hipotensión y la taquipnea son particularmente sugestivas de sepsis entre los pacientes con infección, aunque la ausencia de estos signos no descarta la sepsis.5.
Los hallazgos de laboratorio comunes que son característicos de la sepsis incluyen leucocitosis o leucopenia, más del 10% de granulocitos inmaduros, hiperglucemia y niveles elevados de creatinina y lactato.
Incluso en ausencia de fiebre o signos localizados de infección, se debe considerar la sepsis en pacientes con alteración del estado mental, hipotensión, disnea y descompensación aguda de una enfermedad crónica, como la cetoacidosis diabética o la cirrosis descompensada.
La evaluación clínica se centra en confirmar el sitio y la causa de la infección, así como en evaluar la función y la perfusión del órgano.
Las pruebas comunes para evaluar la infección incluyen estudios radiológicos, cultivo microbiano, pruebas de antígenos (p. ej., pruebas para antígenos estreptocócicos y de legionella) y paneles de detección de patógenos por reacción en cadena de la polimerasa múltiple, según el sitio sospechoso.
En Estados Unidos se comercializan tres pruebas de diagnóstico molecular que determinan la probabilidad de sepsis, pero aún no se han incorporado a la práctica habitual. Se recomienda la medición del lactato en todos los pacientes para detectar hipoperfusión oculta.
Manejo
El manejo de la sepsis se centra en el control de la infección, la restauración de la perfusión y el soporte orgánico.
La restauración de la homeostasis inmunológica también es un objetivo, pero es el foco de la investigación en curso en lugar de un componente del manejo clínico actual. En esta sección, nos centramos en los principios generales del tratamiento para el control de la infección y la reanimación y destacamos áreas de investigación en curso.
CONTROL DE LA INFECCIÓN
El tratamiento de la infección incluye la terapia antimicrobiana, que está indicada para todas las infecciones bacterianas y fúngicas y para muchas infecciones parasitarias y virales que causan sepsis, y el control de la fuente de infección mediante procedimientos, que está indicado en algunas situaciones.
La terapia antimicrobiana inicial suele ser empírica, ya que rara vez se conoce el patógeno causante al comienzo del tratamiento.
Se justifica el inicio rápido de la terapia antimicrobiana porque los estudios observacionales han indicado que la mortalidad aumenta con los retrasos en la administración del tratamiento, en particular entre los pacientes en estado de shock.51.
El régimen antimicrobiano empírico debe cubrir los patógenos más probables sobre la base del sitio (o sitios) sospechoso de infección, los factores epidemiológicos locales y los factores de riesgo para organismos atípicos o resistentes.
El conocimiento de los perfiles epidemiológicos locales de los patógenos, incluidos los perfiles de resistencia a los antimicrobianos, es útil para seleccionar la terapia inicial.
Además, los médicos deben considerar el perfil de riesgo de cada paciente, incluidos los patógenos y las susceptibilidades en cultivos previos, las condiciones o tratamientos que pueden conferir una predisposición a infecciones específicas, una historia social que puede implicar exposición a patógenos atípicos y signos, síntomas y datos de diagnóstico que pueden sugerir el sitio o tipo de infección.
Los pacientes con exposición previa a antibióticos y contacto con el sistema de atención de la salud tienen un mayor riesgo de infección con bacterias resistentes, por lo que las directrices recomiendan una cobertura inicial más amplia para dichos pacientes[52,53].
Por el contrario, se debe suspender la cobertura para patógenos que es poco probable que sean la causa de la infección para evitar los efectos adversos asociados con el uso de antibióticos.
Por ejemplo, el uso de antibióticos antianaeróbicos agota la microbiota intestinal entérica sana, se asocia con resultados clínicos adversos[54,55], y se puede evitar en muchos pacientes.55.
A medida que se disponga de más información diagnóstica, la terapia antimicrobiana debe limitarse para cubrir el patógeno identificado (o patógenos) y eliminar la cobertura de los organismos resistentes que no se han identificado.
La duración de la terapia antimicrobiana debe adaptarse al sitio y al tipo de infección y guiarse además por la respuesta clínica, con cursos más cortos favorecidos en lugar de cursos de terapia más largos.53.
Incluso con una terapia antimicrobiana adecuada, algunas infecciones requieren control de la fuente para mejorar la posibilidad de curación o minimizar el riesgo de complicaciones.
El control de la fuente de infección comprende intervenciones quirúrgicas y procedimentales para eliminar la fuente de infección, reducir la carga de patógenos o corregir alteraciones anatómicas que impiden la eliminación normal de la infección.
Los procedimientos comunes para el control de la fuente de infección incluyen la extracción de órganos infectados (p. ej., apendicectomía), la extracción de dispositivos intravasculares infectados, el alivio del bloqueo anatómico proximal al sitio de la infección (p. ej., estenosis biliares o genitourinarias) y el drenaje de abscesos o acumulaciones de líquido infectadas.
Al igual que la terapia antimicrobiana, el control de la fuente de infección es sensible al tiempo y las demoras se asocian con un aumento de la mortalidad, en particular entre los pacientes en estado de shock[51,56].
Dado que todas las intervenciones conllevan riesgos, la consulta entre los equipos de cuidados críticos y de procedimientos es importante para determinar el beneficio y la urgencia del control de la fuente de infección mediante procedimientos.
RESTAURACIÓN DE LA PERFUSIÓN ADECUADA
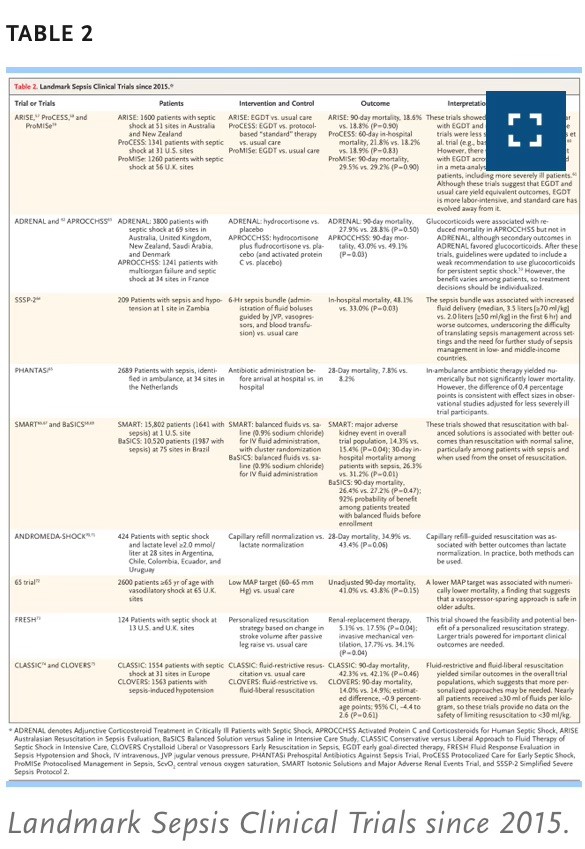
En el caso de pacientes con hipotensión o evidencia de perfusión inadecuada (p. ej., niveles elevados de lactato), la restauración oportuna de la perfusión es fundamental y es el foco de varios ensayos clínicos previos o en curso (Tabla 2). La administración intravenosa de líquido cristaloide es el tratamiento de primera línea para corregir la depleción del volumen intravascular y restaurar la precarga, aunque el enfoque de reanimación ha evolucionado con el tiempo[TABLA 2]
Ensayos clínicos de sepsis de referencia desde 2015.
Las pautas sugieren 30 ml por kilogramo de peso corporal como un volumen de líquido inicial razonable para la mayoría de los pacientes adultos.53. El líquido debe administrarse en bolos seriados (p. ej., 250 a 1000 ml para adultos), con un control estricto de la respuesta clínica en pacientes que pueden tener efectos secundarios inaceptables con un volumen de 30 ml por kilogramo.
Se informó que la implementación prospectiva de paquetes de reanimación que implican un bolo de líquido de 30 ml por kilogramo se asoció con una mejor supervivencia entre los pacientes con sepsis, incluidos aquellos con valores intermedios de lactato (2 a 4 mmol por litro), enfermedad renal crónica o insuficiencia cardíaca.76.
Tanto la reanimación insuficiente como la reanimación excesiva se asocian con daño, y los estudios observacionales muestran una relación en forma de U entre el volumen de líquido y los resultados[76,77]. Los daños de la reanimación excesiva pueden ser particularmente prominentes en entornos con disponibilidad limitada de oxígeno o respirador[78].
Sin embargo, los resultados de los ensayos que sugieren daño por volúmenes de reanimación más altos generalmente han utilizado volúmenes de líquido que superan con creces los 30 ml por kilogramo[64].
Por ejemplo, la aleatorización al protocolo de reanimación en el ensayo Simplified Severe Sepsis Protocol 2 (SSSP-2) resultó en una mediana de 3,5 litros de líquido (≥70 ml por kilogramo) administrados en las primeras 6 horas, en comparación con 2,0 litros (≥50 ml por kilogramo) administrados en las primeras 6 horas. por kilogramo) en el grupo de atención habitual, y se asoció con un aumento de la mortalidad.64.
El uso de soluciones equilibradas, como la solución de Ringer lactato, se prefiere a la solución salina normal al 0,9% en pacientes con sepsis, sobre la base de la evidencia acumulada de reducción de la mortalidad[66,79], en particular cuando la solución se utiliza durante toda la reanimación.68.
Para los pacientes con hipotensión continua y depleción de volumen después de la reanimación inicial, los enfoques de «liberación de líquidos» y «restricción de líquidos» para la reanimación continua han producido resultados similares (Tabla 2)[74,75].
Los enfoques personalizados para la reanimación que se basan en medidas fisiológicas dinámicas pueden ser más eficaces que un enfoque de liberalización de líquidos o de restricción de líquidos.
La respuesta a los líquidos se puede evaluar sobre la base de un cambio en el volumen sistólico con un pequeño bolo de líquido (p. ej., 4 ml por kilogramo[80]) o una maniobra pasiva de elevación de piernas[81], que causa un «autobolo» al aumentar el retorno de sangre al ventrículo derecho.
En un ensayo multicéntrico aleatorizado en el que participaron 124 pacientes con shock séptico, los pacientes asignados a recibir un ajuste de líquidos y vasopresores en función de un cambio en el volumen sistólico (medido mediante un monitor de gasto cardíaco no invasivo) tuvieron menos probabilidades que los pacientes asignados a la atención habitual de requerir terapia de reemplazo renal (5 % frente a 17 %, P = 0,04) y ventilación mecánica invasiva (18 % frente a 34 %, P = 0,04), hallazgos que respaldan la reanimación adaptada fisiológicamente[73]. Sin embargo, se necesitan ensayos más amplios con potencia para resultados clínicos importantes.
En el caso de los pacientes con hipotensión grave o persistente a pesar de la administración inicial de líquidos, está justificada la terapia con vasopresores intravenosos.
La noradrenalina, el vasopresor de primera línea[53], se puede administrar por medio de un acceso intravenoso central o con el uso de un catéter intravenoso periférico de alta calidad, con un control regular de la extravasación[82]. Las directrices recomiendan tener como objetivo una presión arterial media (PAM) inicial de 65 mmHg en lugar de objetivos de PAM más altos[53].
Sin embargo, el ensayo [65] sugiere que un objetivo más bajo de 60 a 65 mmHg puede ser seguro en algunos pacientes[72].
En este ensayo, que incluyó a 2600 pacientes con shock vasodilatador de 65 años de edad o más, la aleatorización a hipotensión permisiva (objetivo de PAM, 60 a 65 mmHg) resultó en un menor uso de terapia vasopresora y una mortalidad ajustada más baja a los 90 días que la atención habitual (odds ratio ajustado, 0,82; intervalo de confianza del 95% [IC], 0,68 a 0,98).72.
Además de la PAM, el nivel de lactato y el tiempo de llenado capilar brindan información adicional para guiar la reanimación y la dosificación de vasopresores.
Un metanálisis de cuatro ensayos pequeños mostró que orientar la reanimación hacia una reducción del nivel de lactato sérico, además de los objetivos de PAM, se asoció con una disminución de la mortalidad[83].
En el ensayo ANDROMEDA-SHOCK, 424 pacientes con shock séptico fueron asignados aleatoriamente para someterse a reanimación guiada por llenado capilar o reanimación guiada por lactato.
Los pacientes en quienes el enfoque de reanimación asignado falló a pesar de una PAM de 65 mmHg o mayor recibieron líquidos adicionales, objetivos de PAM más altos e ionotrópicos[70].
Los pacientes asignados para someterse a reanimación guiada por llenado capilar tuvieron una mortalidad numéricamente menor que los pacientes asignados a la reanimación guiada por lactato (34,9% frente a 43,4%; P = 0,06), y un reanálisis bayesiano mostró más de un 90% de probabilidad de menor mortalidad con reanimación guiada por llenado capilar en múltiples distribuciones de probabilidad asumidas.71.
Para los pacientes con una trayectoria clínica que empeora a pesar del tratamiento con agentes antimicrobianos, líquidos y vasopresores, es importante reconsiderar el control de infecciones y determinar si se justifican agentes antimicrobianos más amplios, estudios de imágenes para definir mejor el sitio de la infección o intervenciones de control de la fuente.
En el caso de pacientes que reciben apoyo vasopresor continuo, se debe considerar el uso de glucocorticoides complementarios en “dosis de estrés” (hidrocortisona en una dosis de 200 mg por día con o sin fludrocortisona).
Los metanálisis han llegado a conclusiones contradictorias con respecto a una reducción en la mortalidad, pero muestran consistentemente reducciones en la duración del shock, la ventilación mecánica y la estadía en la UCI con glucocorticoides adyuvantes[84,85].
Una reciente emulación de un ensayo de observación de objetivos mostró que la adición de fludrocortisona a la hidrocortisona fue superior a la hidrocortisona sola (diferencia ajustada en la mortalidad, −3,7 puntos porcentuales; IC del 95 %, −4,2 a −3,1; P < 0,001), sin una señal de daño, y la combinación se asoció con una menor mortalidad por todas las causas que con la hidrocortisona sola en un metanálisis de red bayesiana[86,87].
Aunque los glucocorticoides en dosis de estrés son beneficiosos en el paciente promedio, el beneficio varía entre los pacientes, por lo que los médicos deben sopesar la gravedad del shock frente al riesgo de eventos adversos asociados a los glucocorticoides al decidir si iniciar y continuar el tratamiento con glucocorticoides en dosis de estrés[88].
Para los pacientes con aumento de norepinefrina en caso de que se presenten complicaciones graves, se recomienda la adición de vasopresina (un vasopresor no catecolámico) para evitar la exposición a las catecolaminas.
El umbral de dosis para agregar vasopresina no está claro y actualmente se está evaluando en un ensayo multicéntrico.
Recuperación y resultados a largo plazo
Además de ser un trastorno potencialmente mortal, la sepsis contribuye al desarrollo de otras afecciones, como deterioro cognitivo, deterioro funcional y enfermedades crónicas nuevas o que empeoran.89.
Entre los adultos mayores, la hospitalización por sepsis se asocia con el desarrollo de nuevas limitaciones funcionales (p. ej., incapacidad para bañarse o vestirse de forma independiente) y un gran aumento en la prevalencia de deterioro cognitivo moderado a grave (6,1 % antes de la hospitalización frente a 16,7 % después de la hospitalización).90.
Las complicaciones a largo plazo también son comunes después de la sepsis pediátrica. En una cohorte prospectiva de 389 niños con shock séptico, el 35% de los niños sobrevivientes no habían recuperado su calidad de vida relacionada con la salud inicial un año después.91.
Como resultado del deterioro de la salud a largo plazo, muchos pacientes que estaban empleados antes de la sepsis no pueden volver a trabajar.
En un estudio en el que participaron 12.260 supervivientes de sepsis en Noruega que habían trabajado antes de ser hospitalizados por sepsis entre 2010 y 2021, el 40% no había vuelto a trabajar a los 6 meses.92.
Más allá de los problemas de salud que se desarrollan durante la hospitalización por sepsis, los pacientes tienen un mayor riesgo de sufrir un mayor deterioro de la salud, reingresos hospitalarios y muerte en los meses o años posteriores a la resolución de la sepsis, resultados que no se explican completamente por la edad o las condiciones preexistentes.89,93.
Un estudio longitudinal de supervivientes de sepsis mostró una activación persistente de marcadores inflamatorios e inmunosupresores en dos tercios de los participantes del estudio, lo que se asoció con un aumento de la mortalidad por todas las causas[94], un hallazgo que sugiere que el fracaso del sistema inmunológico para volver a la homeostasis puede impulsar el riesgo de infección recurrente o progresión de enfermedades crónicas.
Faltan terapias dirigidas para mejorar la recuperación de la sepsis, pero las intervenciones multicomponentes con seguimiento de atención primaria y evaluación proactiva de los síntomas se han asociado con una mejor supervivencia.95.
Áreas de controversia o incertidumbre e investigación futura
DIAGNÓSTICO
La sepsis se reconoce como un síndrome de disfunción orgánica aguda debido a una respuesta desregulada del huésped a la infección. Sin embargo, carecemos de una definición precisa de la respuesta desregulada del huésped y de una prueba diagnóstica para confirmar su presencia.
Además, tenemos una capacidad limitada para confirmar o caracterizar la infección en tiempo real. Hasta un tercio de los pacientes que han sido tratados por presunta sepsis bacteriana tenían una enfermedad no infecciosa en retrospectiva.96. Incluso entre los pacientes con sepsis, la causa de la infección no se determina en hasta un tercio de los casos.10.
Tanto las herramientas basadas en proteínas como las basadas en transcriptomas han recibido aprobación en EE. UU. y Europa para predecir el riesgo de sepsis, aunque aún no se sabe si su uso cambia los resultados. A medida que se introducen nuevas herramientas[97], se debe probar su implementación en el flujo de trabajo clínico y su efecto en los resultados centrados en el paciente.
SUBTIPOS DE SEPSIS
La heterogeneidad de la sepsis se ha citado durante mucho tiempo como un impedimento para la traducción de estudios preclínicos y la identificación de terapias dirigidas[98,99].
Durante la última década, varios estudios han identificado y descrito nuevos subtipos de sepsis pediátrica y adulta, incluidos subtipos basados en la expresión genética en leucocitos sanguíneos[26,27]; datos clínicos, incluidos patógenos[100,101]; y biomarcadores plasmáticos[28].
Además, en varias aplicaciones post hoc de estas clasificaciones a datos de ensayos clínicos, se han identificado diferencias cualitativas en la respuesta al tratamiento[32,100]. Se está trabajando para traducir estos descubrimientos en un mejor manejo en la cabecera del paciente[102,103].
HETEROGENEIDAD DEL EFECTO DEL TRATAMIENTO
Los ensayos clínicos arrojan un efecto promedio del tratamiento, que puede reflejar de manera deficiente el efecto esperado del tratamiento para un paciente individual con sepsis, dada la amplia heterogeneidad del trastorno.
Existe un gran interés en predecir los efectos del tratamiento en pacientes individuales para mejorar el manejo en la cabecera del paciente.
En un análisis post hoc de datos de ensayos clínicos que utilizaron aprendizaje automático para estimar los efectos de tratamientos individuales, hubo una marcada variación en el beneficio de los glucocorticoides para el choque séptico[104].
Se necesitan ensayos prospectivos para probar el apoyo a la toma de decisiones clínicas con el fin de guiar el manejo en función de los efectos de tratamientos individuales.
TRATAMIENTO DIRIGIDO
El manejo de la sepsis se centra en agentes antimicrobianos, control de la fuente, reanimación y apoyo para la falla orgánica. Faltan terapias dirigidas para abordar formas específicas de desregulación del huésped, incluida la permeabilidad vascular.
Se están estudiando varios agentes y dispositivos farmacológicos, y se están realizando esfuerzos para identificar y caracterizar los rasgos de respuesta del huésped en un marco de tiempo clínicamente procesable.
SEPSIS EN PAÍSES DE INGRESOS BAJOS Y MEDIOS
Aunque los países de ingresos bajos y medios tienen una proporción desproporcionadamente alta de casos y muertes por sepsis[1], la mayoría de los ensayos clínicos se han realizado en países de ingresos altos.
Es arriesgado extrapolar los hallazgos entre entornos, dada la importante variación geográfica de los patógenos, las enfermedades crónicas y los recursos de atención de la salud[78].
Una oportunidad importante para mejorar los resultados globales de la sepsis es mejorar la infraestructura de atención de la salud y la investigación en áreas que tienen la mayor carga de sepsis.
Conclusiones
La sepsis, definida como una disfunción orgánica aguda potencialmente mortal debida a una respuesta desregulada del huésped a la infección, es una de las principales causas de enfermedad y muerte en todo el mundo.
La enorme variedad de sitios de infección, patógenos causantes y órganos en los que se produce la disfunción aguda complica tanto el reconocimiento de la sepsis como la identificación de terapias dirigidas.
La desregulación de la respuesta inmunitaria del huésped es clave para la patogenia de la sepsis, pero el enfoque actual del tratamiento se centra en el manejo de la infección y la restauración de la perfusión.
Se están realizando investigaciones para identificar subtipos de sepsis que puedan ser objeto de acción y desarrollar terapias dirigidas para la desregulación del huésped.
Figura 1. Características epidemiológicas de la sepsis en los Estados Unidos según el grupo de edad.
Todos los datos son de 2021 y se extrajeron de la muestra nacional de pacientes hospitalizados con el uso de HCUPnet (una herramienta en línea que utiliza datos del Proyecto de Costos y Utilización de la Atención Médica) y se agruparon según el diagnóstico con el uso de categorías delSoftware de Clasificaciones Clínicas Refinadas (CCSR) de la Agencia para la Investigación y la Calidad de la Atención Médica.16,17 Las barras de 𝙸 representan errores estándar.
Figura 2. Patobiología de la sepsis.
La patobiología de la sepsis está dominada por la inflamación concurrente y la inmunidad hipofuncional, con una lesión microvascular prominente. Los neutrófilos, macrófagos y células T citotóxicas activadas elaboran péptidos inflamatorios y antimicrobianos y generan trampas neutrófilo-endoteliales (NET), que se unen a los patógenos pero dañan aún más el endotelio.
La médula ósea responde generando más granulocitos (mielopoyesis de emergencia) a expensas de la linfopoyesis, y la depleción de linfocitos se ve exacerbada por la apoptosis linfocitaria acelerada. Los neutrófilos y macrófagos tienen una producción deficiente de citocinas a nivel celular, y los linfocitos expresan marcadores de agotamiento.
La vasculatura es permeable y activa, con una tendencia hacia el aumento de la trombosis y la reducción de la fibrinólisis. Los factores del huésped y del patógeno influyen drásticamente en las formas en que se introducen, detectan y responden los patógenos, así como en la respuesta de resolución.
Dada esta variación en la respuesta, la investigación activa se centra en identificar las características que mejor indican una desregulación biológica específica y que, por lo tanto, pueden predecir una respuesta terapéutica.
El resultado del proceso patobiológico es la lesión orgánica y, a menudo, la insuficiencia multiorgánica. ARDS denota síndrome de dificultad respiratoria aguda y DAMP patrón molecular asociado al daño.i
Referencias Bibliográficas
1. Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet 2020;395:200-211.
2. Rhee C, Jones TM, Hamad Y, et al. Prevalence, underlying causes, and preventability of sepsis-associated mortality in US acute care hospitals. JAMA Netw Open 2019;2(2):e187571-e187571.
Go to Citation
3. Liang L, Moore B, Soni A. National inpatient hospital costs: the most expensive conditions by payer, 2017. Statistical brief no. 261. Rockville, MD: Agency for Healthcare Research and Quality, 2020.
Go to Citation
4. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest 1992;101:1644-1655.
5. Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 2016;315:801-810.
6. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference. Intensive Care Med 2003;29:530-538.
Go to Citation
7. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005;6:2-8.
Go to Citation
8. Schlapbach LJ, Watson RS, Sorce LR, et al. International consensus criteria for pediatric sepsis and septic shock. JAMA 2024;331:665-674.
Go to Citation
9. Cummings MJ, Bakamutumaho B, Price A, et al. Multidimensional analysis of the host response reveals prognostic and pathogen-driven immune subtypes among adults with sepsis in Uganda. Crit Care2022;26:36-36.
10. Prescott HC. The epidemiology of sepsis. In: Wersinga WJ, Seymour CW, eds. Handbook of sepsis, Cham, Switzerland: Springer International Publishing, 2018:15-28.
11. Weiss SL, Fitzgerald JC, Pappachan J, et al. Global epidemiology of pediatric severe sepsis: the sepsis prevalence, outcomes, and therapies study. Am J Respir Crit Care Med 2015;191:1147-1157.
Go to Citation
12. Kalantar KL, Neyton L, Abdelghany M, et al. Integrated host-microbe plasma metagenomics for sepsis diagnosis in a prospective cohort of critically ill adults. Nat Microbiol 2022;7:1805-1816.
Go to Citation
13. Timsit J-F, Ruppé E, Barbier F, Tabah A, Bassetti M. Bloodstream infections in critically ill patients: an expert statement. Intensive Care Med 2020;46:266-284.
Go to Citation
14. Randolph AG, McCulloh RJ. Pediatric sepsis: important considerations for diagnosing and managing severe infections in infants, children, and adolescents. Virulence 2014;5:179-189.
Go to Citation
15. Fitzgerald JC, Basu RK, Akcan-Arikan A, et al. Acute kidney injury in pediatric severe sepsis: an independent risk factor for death and new disability. Crit Care Med 2016;44:2241-2250.
Go to Citation
16. Agency for Healthcare Research and Quality. Healthcare Cost and Utilization Project (HCUPnet) (http://hcupnet.ahrq.gov/).
Go to Citation
17. Agency for Healthcare Research and Quality. Clinical classifications software refined (CCSR) for ICD-10-CM diagnoses. 2020 (https://www.hcup-us.ahrq.gov/toolssoftware/ccsr/ccs_refined.jsp).
Go to Citation
18. Hensley MK, Donnelly JP, Carlton EF, Prescott HC. Epidemiology and outcomes of cancer-related versus non-cancer-related sepsis hospitalizations. Crit Care Med 2019;47:1310-1316.
Go to Citation
19. Sakhuja A, Nanchal RS, Gupta S, et al. Trends and outcomes of severe sepsis in patients on maintenance dialysis. Am J Nephrol 2016;43:97-103.
Go to Citation
20. World Health Organization. Global report on the epidemiology and burden of sepsis: current evidence, identifying gaps and future directions. September 9, 2020 (https://www.who.int/publications/i/item/9789240010789).
Go to Citation
21. Lindenauer PK, Lagu T, Shieh M-S, Pekow PS, Rothberg MB. Association of diagnostic coding with trends in hospitalizations and mortality of patients with pneumonia, 2003-2009. JAMA 2012;307:1405-1413.
Go to Citation
22. Rhee C, Dantes R, Epstein L, et al. Incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014. JAMA 2017;318:1241-1249.
Go to Citation
23. Shankar-Hari M, Calandra T, Soares MP, et al. Reframing sepsis immunobiology for translation: towards informative subtyping and targeted immunomodulatory therapies. Lancet Respir Med2024;12:323-336.
Go to Citation
24. Wiersinga WJ, van der Poll T. Immunopathophysiology of human sepsis. EBioMedicine 2022;86:104363-104363.
Go to Citation
25. Medzhitov R. The spectrum of inflammatory responses. Science 2021;374:1070-1075.
Go to Citation
26. Sweeney TE, Azad TD, Donato M, et al. Unsupervised analysis of transcriptomics in bacterial sepsis across multiple datasets reveals three robust clusters. Crit Care Med 2018;46:915-925.
27. Cano-Gamez E, Burnham KL, Goh C, et al. An immune dysfunction score for stratification of patients with acute infection based on whole-blood gene expression. Sci Transl Med 2022;14(669):eabq4433-eabq4433.
28. Sinha P, Kerchberger VE, Willmore A, et al. Identifying molecular phenotypes in sepsis: an analysis of two prospective observational cohorts and secondary analysis of two randomised controlled trials. Lancet Respir Med 2023;11:965-974.
29. Rogers AJ, Leligdowicz A, Contrepois K, et al. Plasma metabolites in early sepsis identify distinct clusters defined by plasma lipids. Crit Care Explor 2021;3(8):e0478-e0478.
Go to Citation
30. Kwok AJ, Allcock A, Ferreira RC, et al. Neutrophils and emergency granulopoiesis drive immune suppression and an extreme response endotype during sepsis. Nat Immunol 2023;24:767-779.
31. Reyes M, Filbin MR, Bhattacharyya RP, et al. An immune-cell signature of bacterial sepsis. Nat Med2020;26:333-340.
32. Antcliffe DB, Burnham KL, Al-Beidh F, et al. Transcriptomic signatures in sepsis and a differential response to steroids: from the VANISH randomized trial. Am J Respir Crit Care Med 2019;199:980-986.
33. Kyriazopoulou E, Leventogiannis K, Norrby-Teglund A, et al. Macrophage activation-like syndrome: an immunological entity associated with rapid progression to death in sepsis. BMC Med 2017;15:172-172.
Go to Citation
34. Demaret J, Venet F, Friggeri A, et al. Marked alterations of neutrophil functions during sepsis-induced immunosuppression. J Leukoc Biol 2015;98:1081-1090.
Go to Citation
35. Monneret G, Lepape A, Voirin N, et al. Persisting low monocyte human leukocyte antigen-DR expression predicts mortality in septic shock. Intensive Care Med 2006;32:1175-1183.
Go to Citation
36. Reyes M, Filbin MR, Bhattacharyya RP, et al. Plasma from patients with bacterial sepsis or severe COVID-19 induces suppressive myeloid cell production from hematopoietic progenitors in vitro. Sci Transl Med 2021;13:eabe9599-eabe9599.
37. Drewry AM, Samra N, Skrupky LP, Fuller BM, Compton SM, Hotchkiss RS. Persistent lymphopenia after diagnosis of sepsis predicts mortality. Shock 2014;42:383-391.
Go to Citation
38. Shankar-Hari M, Fear D, Lavender P, et al. Activation-associated accelerated apoptosis of memory B cells in critically ill patients with sepsis. Crit Care Med 2017;45:875-882.
Go to Citation
39. Souza-Fonseca-Guimaraes F, Parlato M, Fitting C, Cavaillon J-M, Adib-Conquy M. NK cell tolerance to TLR agonists mediated by regulatory T cells after polymicrobial sepsis. J Immunol 2012;188:5850-5858.
Go to Citation
40. Cheng S-C, Scicluna BP, Arts RJW, et al. Broad defects in the energy metabolism of leukocytes underlie immunoparalysis in sepsis. Nat Immunol 2016;17:406-413.
41. Boomer JS, Shuherk-Shaffer J, Hotchkiss RS, Green JM. A prospective analysis of lymphocyte phenotype and function over the course of acute sepsis. Crit Care 2012;16(3):R112-R112.
Go to Citation
42. Wilson JK, Zhao Y, Singer M, Spencer J, Shankar-Hari M. Lymphocyte subset expression and serum concentrations of PD-1/PD-L1 in sepsis — pilot study. Crit Care 2018;22:95-95.
Go to Citation
43. Baessler A, Vignali DAA. T cell exhaustion. Annu Rev Immunol 2024;42:179-206.
Go to Citation
44. Lindell RB, Zhang D, Bush J, et al. Impaired lymphocyte responses in pediatric sepsis vary by pathogen type and are associated with features of immunometabolic dysregulation. Shock 2022;57:191-199.
Go to Citation
45. Mathew D, Giles JR, Baxter AE, et al. Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications. Science 2020;369:eabc8511-eabc8511.
Go to Citation
46. Uchimido R, Schmidt EP, Shapiro NI. The glycocalyx: a novel diagnostic and therapeutic target in sepsis. Crit Care 2019;23:16-16.
Go to Citation
47. Bain W, Li H, van der Geest R, et al. Increased alternative complement pathway function and improved survival during critical illness. Am J Respir Crit Care Med 2020;202:230-240.
Go to Citation
48. Mastellos DC, Hajishengallis G, Lambris JD. A guide to complement biology, pathology and therapeutic opportunity. Nat Rev Immunol 2024;24:118-141.
Go to Citation
49. London NR, Zhu W, Bozza FA, et al. Targeting Robo4-dependent Slit signaling to survive the cytokine storm in sepsis and influenza. Sci Transl Med 2010;2(23):23ra19-23ra19.
Go to Citation
50. McAuley DF, Laffey JG, O’Kane CM, et al. Simvastatin in the acute respiratory distress syndrome. N Engl J Med 2014;371:1695-1703.
Go to Citation
51. Seymour CW, Gesten F, Prescott HC, et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med 2017;376:2235-2244.
52. Wu H, Harder C, Culley C. The 2016 clinical practice guidelines for management of hospital-acquired and ventilator-associated pneumonia. Can J Hosp Pharm 2017;70:251-252.
Go to Citation
53. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021. Crit Care Med 2021;49(11):e1063-e1143.
54. Chanderraj R, Baker JM, Kay SG, et al. In critically ill patients, anti-anaerobic antibiotics increase risk of adverse clinical outcomes. Eur Respir J 2023;61:2200910-2200910.
Go to Citation
55. Chanderraj R, Admon AJ, He Y, et al. Mortality of patients with sepsis administered piperacillin-tazobactam vs cefepime. JAMA Intern Med 2024;184:769-777.
56. Rüddel H, Thomas-Rüddel DO, Reinhart K, et al. Adverse effects of delayed antimicrobial treatment and surgical source control in adults with sepsis: results of a planned secondary analysis of a cluster-randomized controlled trial. Crit Care 2022;26:51-51.
Go to Citation
57. The ARISE Investigators, ANZICS Clinical Trials Group. Goal-directed resuscitation for patients with early septic shock. N Engl J Med 2014;371:1496-1506.
Go to Citation
58. The ProCESS Investigators. A randomized trial of protocol-based care for early septic shock. N Engl J Med 2014;370:1683-1693.
Go to Citation
59. Mouncey PR, Osborn TM, Power GS, et al. Trial of early, goal-directed resuscitation for septic shock. N Engl J Med 2015;372:1301-1311.
Go to Citation
60. Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345:1368-1377.
Go to Citation
61. The PRISM Investigators. Early, goal-directed therapy for septic shock — a patient-level meta-analysis. N Engl J Med 2017;376:2223-2234.
Go to Citation
62. Venkatesh B, Finfer S, Cohen J, et al. Adjunctive glucocorticoid therapy in patients with septic shock. N Engl J Med 2018;378:797-808.
Go to Citation
63. Annane D, Renault A, Brun-Buisson C, et al. Hydrocortisone plus fludrocortisone for adults with septic shock. N Engl J Med 2018;378:809-818.
Go to Citation
64. Andrews B, Semler MW, Muchemwa L, et al. Effect of an early resuscitation protocol on in-hospital mortality among adults with sepsis and hypotension: a randomized clinical trial. JAMA 2017;318:1233-1240.
65. Alam N, Oskam E, Stassen PM, et al. Prehospital antibiotics in the ambulance for sepsis: a multicentre, open label, randomised trial. Lancet Respir Med 2018;6:40-50.
Go to Citation
66. Brown RM, Wang L, Coston TD, et al. Balanced crystalloids versus saline in sepsis. a secondary analysis of the SMART clinical trial. Am J Respir Crit Care Med 2019;200:1487-1495.
67. Semler MW, Self WH, Wanderer JP, et al. Balanced crystalloids versus saline in critically ill adults. N Engl J Med 2018;378:829-839.
Go to Citation
68. Zampieri FG, Machado FR, Biondi RS, et al. Association between type of fluid received prior to enrollment, type of admission, and effect of balanced crystalloid in critically ill adults: a secondary exploratory analysis of the BaSICS Clinical Trial. Am J Respir Crit Care Med 2022;205:1419-1428.
69. Zampieri FG, Machado FR, Biondi RS, et al. Effect of intravenous fluid treatment with a balanced solution vs 0.9% saline solution on mortality in critically ill patients: the BaSICS randomized clinical trial. JAMA 2021;326:1-12.
Go to Citation
70. Hernández G, Ospina-Tascón GA, Damiani LP, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: the ANDROMEDA-SHOCK randomized clinical trial. JAMA 2019;321:654-664.
71. Zampieri FG, Damiani LP, Bakker J, et al. Effects of a resuscitation strategy targeting peripheral perfusion status versus serum lactate levels among patients with septic shock. a Bayesian reanalysis of the ANDROMEDA-SHOCK Trial. Am J Respir Crit Care Med 2020;201:423-429.
72. Lamontagne F, Richards-Belle A, Thomas K, et al. Effect of reduced exposure to vasopressors on 90-day mortality in older critically ill patients with vasodilatory hypotension: a randomized clinical trial. JAMA2020;323:938-949.
73. Douglas IS, Alapat PM, Corl KA, et al. Fluid response evaluation in sepsis hypotension and shock: a randomized clinical trial. Chest 2020;158:1431-1445.
74. Meyhoff TS, Hjortrup PB, Wetterslev J, et al. Restriction of intravenous fluid in ICU patients with septic shock. N Engl J Med 2022;386:2459-2470.
75. The National Heart, Lung, and Blood Institute Prevention and Early Treatment of Acute Lung Injury Clinical Trials Network. Early restrictive or liberal fluid management for sepsis-induced hypotension. N Engl J Med 2023;388:499-510.
76. Liu VX, Morehouse JW, Marelich GP, et al. Multicenter implementation of a treatment bundle for patients with sepsis and intermediate lactate values. Am J Respir Crit Care Med 2016;193:1264-1270.
77. Lat I, Coopersmith CM, De Backer D. The Surviving Sepsis Campaign: fluid resuscitation and vasopressor therapy research priorities in adult patients. Crit Care Med 2021;49:623-635.
Go to Citation
78. Gendreau S, Frapard T, Carteaux G, et al. Geo-economic influence on the effect of fluid volume for sepsis resuscitation: a meta-analysis. Am J Respir Crit Care Med 2024;209:517-528.
79. Hammond NE, Zampieri FG, Di Tanna GL, et al. Balanced crystalloids versus saline in critically ill adults — a systematic review with meta-analysis. NEJM Evid 2022;1(2).
Go to Citation
80. Aya HD, Rhodes A, Chis Ster I, Fletcher N, Grounds RM, Cecconi M. Hemodynamic effect of different doses of fluids for a fluid challenge: a quasi-randomized controlled study. Crit Care Med2017;45(2):e161-e168.
Go to Citation
81. Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will this hemodynamically unstable patient respond to a bolus of intravenous fluids? JAMA 2016;316:1298-1309.
Go to Citation
82. Cardenas-Garcia J, Schaub KF, Belchikov YG, Narasimhan M, Koenig SJ, Mayo PH. Safety of peripheral intravenous administration of vasoactive medication. J Hosp Med 2015;10:581-585.
Go to Citation
83. Gu W-J, Zhang Z, Bakker J. Early lactate clearance-guided therapy in patients with sepsis: a meta-analysis with trial sequential analysis of randomized controlled trials. Intensive Care Med 2015;41:1862-1863.
Go to Citation
84. Rygård SL, Butler E, Granholm A, et al. Low-dose corticosteroids for adult patients with septic shock: a systematic review with meta-analysis and trial sequential analysis. Intensive Care Med 2018;44:1003-1016.
Go to Citation
85. Fang F, Zhang Y, Tang J, et al. Association of corticosteroid treatment with outcomes in adult patients with sepsis: a systematic review and meta-analysis. JAMA Intern Med 2019;179:213-223.
Go to Citation
86. Bosch NA, Teja B, Law AC, Pang B, Jafarzadeh SR, Walkey AJ. Comparative effectiveness of fludrocortisone and hydrocortisone vs hydrocortisone alone among patients with septic shock. JAMA Intern Med 2023;183:451-459.
Go to Citation
87. Teja B, Berube M, Pereira TV, et al. Effectiveness of fludrocortisone plus hydrocortisone versus hydrocortisone alone in septic shock: a systematic review and network meta-analysis of randomized controlled trials. Am J Respir Crit Care Med 2024;209:1219-1228.
Go to Citation
88. Prescott HC, Sussman JB. Smarter use of corticosteroids in treating patients with septic shock. JAMA Netw Open 2020;3(12):e2029323-e2029323.
Go to Citation
89. Prescott HC, Angus DC. Enhancing recovery from sepsis: a review. JAMA 2018;319:62-75.
90. Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA 2010;304:1787-1794.
Go to Citation
91. Zimmerman JJ, Banks R, Berg RA, et al. Trajectory of mortality and health-related quality of life morbidity following community-acquired pediatric septic shock. Crit Care Med 2020;48:329-337.
Go to Citation
92. Skei NV, Moe K, Nilsen TIL, et al. Return to work after hospitalization for sepsis: a nationwide, registry-based cohort study. Crit Care 2023;27:443-443.
Go to Citation
93. Prescott HC, Osterholzer JJ, Langa KM, Angus DC, Iwashyna TJ. Late mortality after sepsis: propensity matched cohort study. BMJ 2016;353:i2375-i2375.
Go to Citation
94. Yende S, Kellum JA, Talisa VB, et al. Long-term host immune response trajectories among hospitalized patients with sepsis. JAMA Netw Open 2019;2(8):e198686-e198686.
Go to Citation
95. Kowalkowski MA, Rios A, McSweeney J, et al. Effect of a transitional care intervention on rehospitalization and mortality after sepsis: a 12-month follow-up of a randomized clinical trial. Am J Respir Crit Care Med 2022;206:783-786.
Go to Citation
96. Klein Klouwenberg PM, Cremer OL, van Vught LA, et al. Likelihood of infection in patients with presumed sepsis at the time of intensive care unit admission: a cohort study. Crit Care 2015;19:319-319.
Go to Citation
97. Cajander S, Kox M, Scicluna BP, et al. Profiling the dysregulated immune response in sepsis: overcoming challenges to achieve the goal of precision medicine. Lancet Respir Med 2024;12:305-322.
Go to Citation
98. Cohen J, Vincent J-L, Adhikari NK, et al. Sepsis: a roadmap for future research. Lancet Infect Dis2015;15:581-614.
Go to Citation
99. Prescott HC, Calfee CS, Thompson BT, Angus DC, Liu VX. Toward smarter lumping and smarter splitting: rethinking strategies for sepsis and acute respiratory distress syndrome clinical trial design. Am J Respir Crit Care Med 2016;194:147-155.
Go to Citation
100. Seymour CW, Kennedy JN, Wang S, et al. Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA 2019;321:2003-2017.
101. Zhao H, Kennedy JN, Wang S, et al. Revising host phenotypes of sepsis using microbiology. Front Med (Lausanne) 2021;8:775511-775511.
Go to Citation
102. Gordon AC, Alipanah-Lechner N, Bos LD, et al. From ICU syndromes to ICU subphenotypes: consensus report and recommendations for developing precision medicine in the ICU. Am J Respir Crit Care Med 2024;210:155-166.
Go to Citation
103.Maslove DM, Tang B, Shankar-Hari M, et al. Redefining critical illness. Nat Med 2022;28:1141-1148.
Go to Citation
104. Pirracchio R, Hubbard A, Sprung CL, Chevret S, Annane D. Assessment of machine learning to estimate the individual treatment effect of corticosteroids in septic shock. JAMA Netw Open2020;3(12):e2029050-e2029050.