Ronald Palacios Castrillo
Resumen
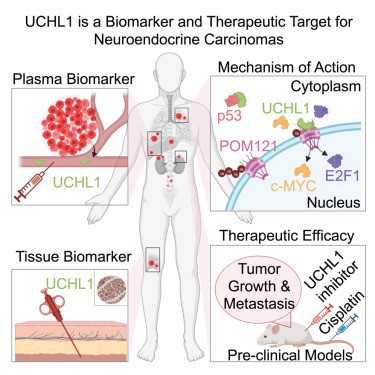
Los carcinomas neuroendocrinos, como el cáncer de próstata neuroendocrino y el cáncer de pulmón de células pequeñas, suelen tener un mal pronóstico y opciones terapéuticas limitadas. Liu,et.al.( Cell Reports Medicine., 2024DOI:https://doi.org/10.1016/j.xcrm.2023.101381 ) que la ubiquitina carboxi-terminal hidrolasa L1 (UCHL1), una enzima desubiquitinante, está elevada en tejidos y plasma de pacientes con carcinomas neuroendocrinos.
La pérdida de UCHL1 disminuye el crecimiento tumoral e inhibe la metástasis de estas neoplasias malignas. UCHL1 mantiene la diferenciación neuroendocrina y promueve la progresión del cáncer mediante la regulación de la nucleoporina, POM121 y p53. UCHL1 se une, desubiquitina y estabiliza POM121 para regular el transporte nuclear asociado a POM121 de E2F1 y c-MYC.
El tratamiento con el inhibidor de UCHL1, LDN-57444, ralentiza el crecimiento tumoral y la metástasis en los carcinomas neuroendocrinos.
=> Recibir por Whatsapp las noticias destacadas
La combinación de inhibidores de UCHL1 con cisplatino, el estándar de atención utilizado para los carcinomas neuroendocrinos, retrasa significativamente el crecimiento tumoral en entornos preclínicos.
Este estudio revela los mecanismos de la función de UCHL1 en la regulación de la progresión de los carcinomas neuroendocrinos e identifica a UCHL1 como un objetivo terapéutico y un indicador molecular potencial para diagnosticar y monitorear las respuestas al tratamiento en estas neoplasias malignas.
En Detalle
Las neoplasias neuroendocrinas se pueden clasificar en tumores neuroendocrinos bien diferenciados y carcinomas neuroendocrinos poco diferenciados.
Las neoplasias neuroendocrinas pueden originarse en diferentes sitios primarios, incluidos los pulmones, la próstata, el tracto gastrointestinal, el páncreas y otros, y pueden clasificarse y graduarse mediante dos marcadores clave, Ki67 y el índice mitótico.
Los carcinomas neuroendocrinos, como el cáncer de próstata neuroendocrino (NEPC) y el cáncer de pulmón de células pequeñas (SCLC), comparten características histológicas comunes, incluida la expresión de marcadores neuroendocrinos, un alto índice de etiquetado Ki67, un curso agresivo de la enfermedad, una rápida recaída después del tratamiento y un resultado clínico deficiente.
Estas características compartidas se han atribuido en parte a programas comunes de expresión genética y mecanismos oncogénicos subyacentes a su desarrollo., NEPC es un subtipo altamente agresivo de cáncer de próstata que es raro en enfermedades localizadas y sin tratamiento previo, pero común en cánceres de próstata recidivantes después Tratamiento con terapias antiandrógenas de segunda generación.
Asimismo, el SCLC, que representa aproximadamente el 15% de los cánceres de pulmón, se caracteriza por una alta expresión de marcadores neuroendocrinos y tiene un curso clínico agresivo.
Cada vez más estudios muestran que el neuroblastoma pobremente diferenciado comparte impulsores, vías de señalización y vulnerabilidades terapéuticas comunes con SCLC y NEPC. El neuroblastoma, un tumor derivado de la cresta neural con muchas similitudes fenotípicas con diferenciación neuroendocrina en otros órganos, es el tumor sólido extracraneal más común en niños.
Aproximadamente la mitad de los pacientes con neuroblastoma presentan enfermedad diseminada en el momento del diagnóstico, y la tasa de supervivencia a 5 años del neuroblastoma de alto riesgo es aproximadamente del 50 %.
Es necesario identificar objetivos terapéuticos y enfoques mínimamente invasivos para diagnosticar estas neoplasias malignas, idealmente en múltiples tipos de cáncer.
Las terapias actuales para los carcinomas neuroendocrinos y el neuroblastoma poco diferenciado incluyen combinaciones de quimioterapia, radiación e inmunoterapia, pero estos tratamientos solo extienden la supervivencia de los pacientes durante unos pocos meses.
Los análisis transcriptómicos y genómicos de los carcinomas neuroendocrinos han proporcionado una mejor comprensión de su desarrollo. Las mutaciones inactivadoras de los supresores de tumores, TP53 y RB1, son características de los carcinomas neuroendocrinos poco diferenciados, incluidos SCLC y NEPC.
Además, los altos niveles de expresión de E2F1, SOX2, EZH2, MYCN, BRN2 y ASCL1 desempeñan funciones esenciales en la promoción de la plasticidad del linaje e impulsar la diferenciación neuroendocrina, lo que los convierte en objetivos terapéuticos prometedores en cánceres con diferenciación neuroendocrina.
Por ejemplo, se observa amplificación genómica de MYCN en pacientes con SCLC, aproximadamente el 20 % de los pacientes con neuroblastoma y el 40 % % de pacientes con NEPC.
La amplificación de MYCN media la reprogramación metabólica al mejorar la absorción de ácidos grasos en el neuroblastoma. MYCN se une directamente al promotor EZH2 para promover la progresión del neuroblastoma.
E2F1 es un regulador clave de NEPC emergente del tratamiento e impulsa la plasticidad del linaje de NEPC al reprimir el receptor de andrógenos (AR).
El análisis bioinformático reveló que tanto las células basales primarias de la próstata con características similares a las de las células madre como las células NEPC comparten una red genética similar asociada con objetivos E2F.
Estos resultados sugieren que E2F1 desempeña un papel esencial en la diferenciación neuroendocrina en el cáncer. Sin embargo, todavía existe una necesidad urgente no satisfecha de identificar terapias basadas en mecanismos más eficaces para los carcinomas neuroendocrinos y el neuroblastoma poco diferenciado.
La ubiquitina carboxi-terminal hidrolasa L1 (UCHL1) es una proteasa con una función dual en la regulación de la estabilidad de las proteínas.
UCHL1 elimina y recicla la ubiquitina de las proteínas que se degradan para mantener el conjunto de ubiquitina celular y estabilizar las proteínas.
Además, UCHL1 puede ubiquitinar las proteínas objetivo y así mejorar su degradación proteica. UCHL1 es una proteína secretada, lo que la convierte en un biomarcador candidato ideal para la detección del cáncer mínimamente invasivo. Se ha informado sobre un posible papel oncogénico de UCHL1 en linfoma y cáncer colorrectal.
Sin embargo, el papel funcional y el potencial terapéutico de UCHL1 en carcinomas neuroendocrinos y neuroblastoma no se han informado previamente.
Los complejos de poros nucleares regulan el transporte nucleocitoplasmático de macromoléculas. Las funciones funcionales de los complejos de poros nucleares en los cánceres siguen siendo poco conocidas.
La nucleoporina POM121 es miembro de los miembros del complejo de poros nucleares y puede servir como biomarcador de pronóstico en cáncer de pulmón, cáncer colorrectal y carcinoma oral de células escamosas. POM121 promueve la tumorigénesis y metástasis del cáncer de pulmón.
En el contexto del cáncer de próstata, POM121 impulsa la progresión del cáncer al aumentar la importación nuclear de E2F1 y MYC.
En este estudio, Liu y colegas demostraron que UCHL1 se expresa altamente en neoplasias neuroendocrinas y es detectable en el plasma de pacientes con NEPC y SCLC.
Los resultados indican que UCHL1 podría servir como un biomarcador molecular para el diagnóstico de carcinomas neuroendocrinos y neuroblastoma y potencialmente para predecir y monitorear las respuestas a la terapia.
Este estudio revela además un papel funcional de UCHL1 en SCLC y NEPC. La pérdida de UCHL1 disminuye significativamente el crecimiento tumoral y la metástasis.
El análisis proteómico demuestra que las vías implicadas en la progresión del cáncer, como las dianas E2F, las dianas MYC y la señalización mTOR, se alteran tras la regulación negativa de UCHL1. UCHL1 se une directamente a p53 y POM121 para regular la progresión tumoral y la diferenciación neuroendocrina.
Al unirse, UCHL1 desestabiliza p53 asociado con la diferenciación neuroendocrina y estabiliza POM121, lo que permite una rápida importación de factores transcripcionales c-MYC y E2F1 previamente implicados en la progresión del cáncer.
Lo más importante es que los resultados mostraron que el tratamiento con un inhibidor de UCHL1 retrasa significativamente el crecimiento del carcinoma neuroendocrino y del neuroblastoma y disminuye la carga metastásica de NEPC y SCLC, tanto como agente único como en combinación con cisplatino.
Estos resultados en conjunto sugieren fuertemente que UCHL1 representa un potente objetivo terapéutico en los carcinomas neuroendocrinos y el neuroblastoma y es un indicador molecular de estas neoplasias malignas.
Clínicamente, el estándar de oro para el diagnóstico de cánceres con diferenciación neuroendocrina se basa en uno o varios conjuntos de biopsias de tejido invasivas y evaluación patológica.
Los esfuerzos recientes de investigación sobre el cáncer se han centrado en identificar métodos mínimamente invasivos para el diagnóstico, el seguimiento de la progresión de la enfermedad y la respuesta al tratamiento.
El DNA tumoral circulante y las células tumorales circulantes (CTC) han mejorado la sensibilidad y especificidad del diagnóstico de pacientes con NEPC.
En su estudio, Liu y colegas informan que los niveles plasmáticos de UCHL1 están elevados en pacientes con SCLC y pacientes con NEPC en comparación con pacientes con NSCLC y pacientes con PC localizada, respectivamente.
Estos resultados proporcionan información sobre la utilidad potencial de UCHL1 como indicador molecular mínimamente invasivo para pacientes con sospecha de carcinomas neuroendocrinos.
Los niveles plasmáticos de UCHL1 disminuyen después del tratamiento con LDN-57444, lo que sugiere la aplicación de UCHL1 plasmático como indicador de seguimiento del tratamiento.
Cada vez hay más pruebas que muestran que el complejo de poros nucleares regula el transporte nucleocitoplasmático de factores moleculares clave para impulsar la progresión del cáncer.
La inhibición del complejo de poros nucleares induce la muerte de las células cancerosas. POM121 se expresa altamente en múltiples cánceres e interactúa directamente con la importina-β, un componente de la maquinaria de importación nuclear, para regular dos factores de transcripción oncogénicos, E2F1 y c-MYC, en la PC avanzada.
Este estudio identifica que UCHL1 regula POM121 y que la pérdida de UCHL1 o la inhibición de UCHL1 disminuye la localización nuclear de E2F1 mediada por POM121. La sobreexpresión de POM121 en células knockout de UCHL1 rescata el nivel de E2F1 causado por la pérdida de UCHL1.
En conjunto, la inhibición de UCHL1 podría ser una potente estrategia terapéutica para revertir la diferenciación neuroendocrina impulsada por E2F1 y suprimir los complejos de poros nucleares.
KPT-330 es un potente inhibidor del transporte nuclear que se ha investigado en ensayos clínicos para pacientes con cáncer. Sin embargo, la aplicación clínica de KPT-330 enfrenta desafíos debido a la baja tolerabilidad y la alta toxicidad asociadas con los cambios en la importación/exportación nuclear global.
El estudio de Liu y colegas demuestra que el tratamiento con LDN-57444 o KPT-330 disminuye los niveles de E2F1 y c-MYC en carcinomas neuroendocrinos, lo que demuestra el potencial del uso de inhibidores de UCHL1 como reemplazo de los inhibidores del transporte nuclear en pacientes con carcinoma neuroendocrino.
Además de su efecto sobre E2F1 y c-MYC, UCHL1 también modula los niveles de p53 en carcinomas neuroendocrinos. La inactivación de p53 se observa en aproximadamente el 67 % de los pacientes con NEPC en comparación con el 31 % de los pacientes con adeno-CRPC.
Se requiere la pérdida simultánea de RB1 y p53 para que las células epiteliales de la próstata normales se transformen en NEPC y se observa en casi todos los pacientes con SCLC evaluados.
El estudio sugiere que el eje UCHL1-p53 representa un mecanismo adicional a través del cual UCHL1 puede potencialmente regular los carcinomas neuroendocrinos y merece una mayor investigación.
La regulación de la ubiquitinación de p53 por UCHL1 podría ser potencialmente indirecta y específica de la enfermedad porque se ha informado que UCHL1 podría estabilizar p53 en el contexto del carcinoma nasofaríngeo.
La identificación de objetivos terapéuticos eficaces es fundamental para mejorar la supervivencia de los pacientes con carcinomas neuroendocrinos y neuroblastoma poco diferenciado, que tienen malos resultados y beneficios limitados de las terapias actuales.
La combinación de un inhibidor de UCHL1 con quimioterapias basadas en platino puede mejorar la respuesta terapéutica en líneas celulares de CPCP in vitro.
Los resultados de Liu y colegas respaldan aún más el potencial traslacional de la terapia combinada de cisplatino e inhibición de UCHL1 para mejorar el resultado de los pacientes con carcinoma neuroendocrino. Los futuros diseños de ensayos para esta combinación podrían incluir una selección de pacientes con alta expresión de UCHL1 en sus tejidos cancerosos.
En conclusión, el estudio demuestra que UCHL1 es un indicador molecular de cánceres con diferenciación neuroendocrina y que UCHL1 regula el crecimiento y la metástasis de SCLC y NEPC.
Los mecanismos de acción de UCHL1 para impulsar la progresión de estas neoplasias malignas incluyen la desubiquitinación y la estabilización de la nucleoporina POM121, lo que da como resultado una mayor localización nuclear de E2F1.
Por el contrario, UCHL1 se une a p53 y promueve la degradación de p53. Es importante destacar que UCHL1 es un objetivo terapéutico dirigido al carcinoma neuroendocrino y al neuroblastoma y un indicador de plasma y tejido molecular para estas neoplasias malignas.
Como tal, las pruebas de inhibidores de UCHL1 y UCHL1 en plasma como biomarcador terapéutico complementario en entornos clínicos son inmensamente prometedoras para pacientes con NEPC, SCLC, neuroblastoma poco diferenciado y otros carcinomas neuroendocrinos.