Ronald Palacios Castrillo
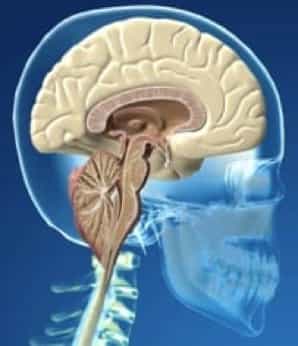
La malformación de Chiari, una anomalía de la fosa craneal posterior, también conocida como malformación de Arnold-Chiari, fue descrita en autopsias por Hans Chiari, un patólogo austriaco, en 1891. Definió cuatro configuraciones anatómicas distintas en las que las amígdalas cerebelosas (la parte más caudal del cerebelo) sobresalía por debajo del margen inferior del agujero magno.1. Posteriormente se han descrito varios subtipos, a menudo en asociación con otras anomalías, pero la característica esencial sigue siendo el descenso de las amígdalas cerebelosas por debajo de su posición normal, justo encima del borde del fosa posterior.
Clasificación
Aunque muchas características de la malformación de Chiari son similares en niños y adultos, esta revisión se centra en el tipo más común, la malformación de Chiari tipo 1 (CM1) en adultos, en la que solo las amígdalas cerebelosas descienden por debajo del agujero magno.
=> Recibir por Whatsapp las noticias destacadas
Esta malformación puede deberse a una fosa posterior congénitamente pequeña, o puede adquirirse como resultado de una alta presión desde arriba del cerebelo o una baja presión debajo del cerebelo que desplaza las amígdalas. La siguiente malformación de Chiari más común es la tipo 2, que se caracteriza por el descenso del vermis cerebeloso y el cuarto ventrículo por debajo del agujero magno, generalmente acompañado de un mielomeningocele abierto. Esta malformación fue revisada recientemente .2.
La malformación de Chiari tipos 3 (encefalocele occipital), 4 (hipoplasia cerebelosa) y 5 (hipoplasia cerebelosa y ectopia del lóbulo occipital en la fosa posterior) se observan en niños y recién nacidos y son más raras y más graves que la CM1. Los tipos 2, 3, 4 y 5, así como un tipo asociado con craneosinostosis (cierre prematuro de las suturas craneales), son síndromes congénitos en niños.3-5.
La CM1 congénita ocurre en pacientes con una fosa posterior constitucionalmente pequeña.6,7. En adultos, los síntomas de la CM1 se desarrollan con mayor frecuencia antes de los 45 años (edad media, 40 años), con una proporción aproximada mujer:hombre de 3:1 mientras que en el CM1 pediátrico, la edad media de presentación es de 8 años, con una proporción mujer:hombre aproximadamente igual(3,8–12).
A medida que las amígdalas cerebelosas sobresalen por debajo del agujero magno, puede producirse la obstrucción de los agujeros de Luschka y Magendie de la médula inferior y la compresión de la columna cervical superior, impidiendo el flujo de líquido cefalorraquídeo (LCR) desde el cuarto ventrículo hasta el espacio subaracnoideo espinal superior.
En algunos casos, esto va acompañado de una siringe (cavidad quística), que se localiza más comúnmente en la médula cervical, pero puede afectar cualquier parte de la médula espinal y rara vez el tronco del encéfalo, como se describe a continuación.
La hernia de las amígdalas cerebelosas hasta al menos 5 mm por debajo del agujero magno es la definición habitual de CM1. Sin embargo, algunos pacientes sintomáticos tienen hernias más pequeñas y algunos pacientes asintomáticos tienen hernias más grandes.9,13.
Un estudio que involucró a 2000 adultos asintomáticos mostró una prevalencia del 0,9% para el descenso de las amígdalas que estaba al menos 5 mm por debajo del agujero magno en imágenes por resonancia magnética, hallazgo que concuerda con la definición anatómica de CM1.14 El término síndrome de Chiari se refiere a la manifestación de síntomas atribuibles a la malformación (9,16,17).Aunque CM1 ocurre con mayor frecuencia como una condición esporádica, con una baja prevalencia familiar, en algunos casos se ha informado evidencia tentativa de una causa genética, con muchos genes implicados (ninguno
fuertemente) y ningún gen candidato que ofrezca una explicación unificadora para la malformación. 16,18. También se ha encontrado una asociación entre CM1 y trastornos del tejido conectivo como el síndrome de Ehlers-Danlos.19.
En un estudio, la prevalencia de trastornos del tejido conectivo con CM1 fue del 12,7%. Sin embargo, el tratamiento quirúrgico de la malformación (ver más abajo) había fracasado en muchos de los pacientes de esta serie, creando un posible sesgo de derivación que puede haber llevado a una sobreestimación de la prevalencia porque la tasa de fracaso quirúrgico aumenta entre los pacientes con lesiones del tejido conectivo. trastornos.20.
Fisiopatología
Como se mencionó anteriormente, las amígdalas cerebelosas bajas pueden provocar la obstrucción del flujo normal de salida del LCR del cuarto ventrículo.21,22. Se ha sugerido que esta obstrucción conduce a la disociación del flujo pulsátil normal del LCR entre los compartimentos craneal y espinal, lo que probablemente sea desempeñar un papel en el dolor de cabeza que a menudo acompaña a la malformación y en la formación de una cavidad llena de LCR (siringe).
Los otros síntomas principales de CM1 se deben más directamente a la hernia amigdalina descendente a través del agujero magno y a la presión sobre la médula inferior y la médula espinal cervical superior, como se describe a continuación.
En algunos casos, en particular aquellos con menos de 5 mm de descenso amigdalino, se produce una obstrucción parcial del flujo de LCR en sentido posterior en las salidas de LCR del cuarto ventrículo como resultado de membranas aracnoides, tumores o una arteria cerebelosa posteroinferior ectásica.
Aunque una fosa posterior congénitamente pequeña es la causa más común de hernia amigdalina cerebelosa, el descenso cerebeloso adquirido puede deberse a gradientes de presión creados por un efecto de tracción desde abajo o un efecto de empuje desde arriba. El tirón desde debajo del agujero magno es el resultado de una fuga de LCR espinal, una fístula venosa de LCR o un cordón anclado.23,24. El empuje desde arriba del agujero magno puede deberse a hidrocefalia, colecciones subdurales, un tumor cerebral o un quiste aracnoideo , con un tumor o quiste especialmente implicado cuando es de gran tamaño(9,13,17,25,26).
Signos y síntomas de la malformación de Chiari
Los síntomas atribuibles al descenso de las amígdalas cerebelosas hacia el agujero magno varían. El síntoma más común es el dolor de cabeza, que probablemente se debe a un aumento transitorio de la presión intracraneal debido al bloqueo parcial del flujo de LCR.
El dolor de cabeza suele ser suboccipital y sordo o pulsátil, pero puede localizarse en cualquier parte del cráneo y tener otras características, como migraña y malestar tensional. Los dolores de cabeza de Chiari se exacerban característicamente con actividades similares a las de Valsalva, como toser, reír, estornudar, hacer esfuerzos, levantar objetos pesados y cambiar la posición del cuerpo o la cabeza.
Un síntoma adicional, que es independiente de los dolores de cabeza pero a menudo está asociado con ellos, es la parestesia en una o ambas manos, que a menudo afecta a todos los dedos (sin distribución radicular). Este síntoma probablemente esté relacionado con la compresión de la médula dorsal o de las columnas dorsales de la médula cervical superior. Pueden ocurrir síntomas similares en los pies, aunque esta ubicación es menos común.
Otros signos y síntomas menos comunes pero característicos son la apnea del sueño; tinnitus, que puede ser pulsátil; hipoacusia o hiperacusia; dificultad para tragar; varias formas de nistagmo, incluido el nistagmo descendente (causado sólo por unos pocos trastornos más, como la toxicidad del litio y los tumores en la unión cervicomedular); paresia de la mirada levantada; oscilopsia; visión borrosa o doble; y mareos(8,9,27).
Se han detectado síntomas neurocognitivos y psiquiátricos mediante pruebas formales en pacientes con CM1, aunque no se ha identificado una causa y un efecto directos.28,29. No está claro, por ejemplo, si los síntomas cognitivos y psiquiátricos son el resultado del dolor crónico, pero algunos investigadores consideran que los síntomas se deben a un deterioro de los circuitos cerebelosos involucrados en la cognición.30. Se ha propuesto el síndrome de fatiga crónica como un síntoma CM1, aunque la asociación no se ha demostrado de manera convincente.31.
La siringe de la médula espinal puede ser sintomática o asintomática, siendo más probable que una siringe grande sea sintomática.
Los pacientes con siringe pueden presentar síntomas complejos que son independientes de los causados directamente por la hernia amigdalina: típicamente entumecimiento o disminución del dolor o sensibilidad a la temperatura en las manos y sobre los hombros, debilidad y atrofia de las manos, y brazos, piernas, cuello o dolor de espalda, así como incontinencia vesical o intestinal.
En pacientes con cefaleas posicionales que son más intensas cuando están de pie y menos intensas cuando están acostados, se debe considerar el diagnóstico de fuga de LCR espinal e hipotensión intracraneal como causa adquirida de hernia amigdalina.
Imágenes
Aunque el descenso de las amígdalas se puede identificar mediante tomografía computarizada (TC), las malformaciones de Chiari se visualizan mejor con resonancia magnética cerebral, particularmente imágenes sagitales, y con resonancia magnética de la columna cervical para detectar una siringe.
Como se mencionó anteriormente, se requiere un descenso de las amígdalas cerebelosas de al menos 5 mm por debajo del agujero magno para cumplir con los criterios de imagen para CM1(13,17,27). Las amígdalas a menudo también son puntiagudas (es decir, en forma de clavija), en lugar de normalmente redondeadas.
Aunque este hallazgo no es necesario para el diagnóstico, indica compresión y conformación amigdalina por las estructuras óseas dorsales de la fosa posterior.
En un informe de consenso que refleja ampliamente la práctica clínica, la hernia amigdalina cerebelosa entre 3 y 5 mm por debajo del agujero magno también se ha clasificado como CM1 en presencia de una siringe o forma de clavija de las amígdalas.9.
Esta medición se obtiene en un examen sagital medio. Imagen de resonancia magnética trazando una línea desde el basión hasta el opistión (los límites óseos anterior y posterior, respectivamente, del agujero magno, línea de McRea) y trazando una línea perpendicular hasta la cara más baja de las amígdalas cerebelosas, representando la longitud de esta última la Magnitud del descenso de las amígdalas.
Una consideración adicional para afirmar el diagnóstico es el grado de “apiñamiento” en la fosa posterior (reducción del espacio para que fluya el LCR) al nivel del agujero magno en una imagen axial potenciada en T2 .
Las imágenes del flujo de LCR sincronizadas con el corazón (MRI de flujo de cine), una técnica utilizada para evaluar el flujo de LCR al nivel del cuarto ventrículo y el agujero magno, normalmente muestran un flujo de LCR bidireccional con sístole y diástole.
La dinámica comprometida del LCR en la resonancia magnética de flujo de cine es característica de la CM1 sintomática y ha sido predictiva de la disminución de los síntomas después de la cirugía.22. No se requiere un estudio de flujo de cine anormal para el diagnóstico, pero proporciona evidencia de apoyo de la CM1 sintomática, con una sensibilidad del 76 % y una especificidad del 62 %. en una serie.32.
También se ha demostrado un aumento del movimiento de las amígdalas asociado al ciclo cardíaco en imágenes de resonancia magnética en pacientes con CM1 sintomática, pero no se ha establecido su papel en el diagnóstico. Este tipo anormal de movimiento amigdalino se reduce después de la descompresión quirúrgica de la fosa posterior.33.
Una característica de imagen que se encuentra a menudo en pacientes con CM1 es la compresión de la glándula pituitaria desde arriba, lo que produce LCR dentro de la silla turca, denominada silla vacía. Este hallazgo es consistente con un aumento de la presión intracraneal.
Se asocia más comúnmente con hipertensión intracraneal idiopática (pseudotumor cerebral), y su presencia puede ayudar a determinar que es probable que la malformación de Chiari se adquiera por aumento de la presión intracraneal en lugar de ser congénita.34.
Se desarrolla una siringe dentro de la médula espinal superior en 27 a 66% de los pacientes con CM1. La siringe está ubicada en el medio de la médula espinal dentro del canal central (hidromielia) y está revestida por células ependimarias normales o está ubicada excéntricamente en la médula espinal (siringomielia) y no está revestida por epéndimo.10,35. Una siringe en el La médula espinal cervical puede extenderse caudalmente a lo largo de la médula o rostralmente hasta el tronco del encéfalo.
Algunos pacientes tienen compresión del tronco encefálico inferior ventral o retorcimiento del tronco encefálico como resultado del desplazamiento hacia abajo del cerebelo (clasificado como malformación de Chiari tipo 1.5), que se aborda con un enfoque diagnóstico complejo (placas simples dinámicas y una tomografía computarizada) y procedimientos quirúrgicos especiales.
Dependiendo del grado de compresión ventral del tronco encefálico y de la inestabilidad mecánica occipital-cervical, se puede realizar la descompresión odontoides ventral y la fusión occipital-cervical además de la descompresión estándar de la fosa posterior.9,36,37.] Las causas próximas de la compresión ventral incluyen invaginación basilar (traslación superior de la parte superior de la vértebra C2 hacia el agujero magno), una apófisis odontoides en retroflexión (angulación posterior de la apófisis odontoides que causa la compresión del tronco encefálico), platibasia (angulación anormal de la base del cráneo y la columna vertebral) einestabilidad craneocervical..
Como se señaló anteriormente, la hernia amigdalina cerebelosa adquirida también puede ser el resultado de una fuga de LCR espinal, ya que el contenido de la fosa posterior es arrastrado hacia el canal espinal superior debido al gradiente de presión creado por la fuga.
En tales casos, la resonancia magnética craneal y espinal a menudo muestra realce dural después de la administración de gadolinio, un hallazgo consistente con hipotensión intracraneal.24,38.== Se realiza una resonancia magnética espinal para identificar la presencia y el sitio de la fuga de LCR, pero ambas son difíciles de detectar , y es posible que se necesiten estudios más elaborados, como la inyección de un medio de contraste yodado no iónico en el espacio del LCR.
Otra causa de presión reducida del LCR es una fístula venosa-LCR directa (drenaje del LCR espinal en una vena), que produce una hernia amigdalina secundaria hacia abajo.23,24.
Tratamiento
El doble objetivo del tratamiento es aliviar la compresión de la unión cervicomedular y normalizar el flujo de LCR en el agujero magno. Faltan tratamientos médicos validados que logren esto.
Los pacientes asintomáticos, en quienes CM1 puede haber sido detectado incidentalmente en imágenes realizadas por diversas razones, no requieren cirugía si no hay siringe. El Congreso de Cirujanos Neurológicos ha emitido directrices generadas a partir de una revisión sistemática que concluyó que la descompresión de la fosa posterior conduce a una disminución de los síntomas de la malformación de Chiari.39. Sin embargo, las directrices de consenso también indicaron que la evidencia para apoyar cualquier abordaje quirúrgico específico era insuficiente. 9.
El tratamiento del CM1 asintomático en pacientes con siringe es controvertido. Las pautas sugieren un seguimiento estrecho de estos pacientes, recomendándose la cirugía si la siringe se expande o aparecen síntomas asociados.5,9.
Los procedimientos quirúrgicos para descomprimir la fosa posterior varían en complejidad y extensión e incluyen la extirpación de la cara inferior del hueso occipital en la fosa posterior; ampliando la abertura del agujero magno y eliminando el arco posterior de C1; abrir la duramadre y luego hacer una incisión en la aracnoides, que puede sujetar las amígdalas hacia abajo, para liberar el tejido; resección de las membranas aracnoideas al nivel de la salida del cuarto ventrículo (que puede obstruir el flujo de LCR); y reducir el volumen de las amígdalas (mediante electrocauterización) o realizar una resección amigdalina completa. Cuando se abre la duramadre, se logra la expansión del espacio subaracnoideo con un injerto de duraplastia y el cierre de la duramadre de forma.
Como se mencionó anteriormente, ningún procedimiento quirúrgico ha sido validado como superior a otros, y la práctica varía según las instituciones y los cirujanos.
El uso de la duraplastia está respaldado por algunas revisiones sistemáticas, especialmente para pacientes con CM1 y siringomielia.35,40.
Resultados preliminares de un ensayo aleatorizado por grupos que compara la descompresión de la fosa posterior con y sin duraplastia en niños y adultos jóvenes sugieren tasas similares de complicaciones quirúrgicas y resultados clínicos similares.41. La extensión general del procedimiento intradural también es controvertida.9,40.
La hernia amigdalina adquirida debido a una fuga o masa de LCR se trata abordando la fuga o lesión subyacente.24. Las punciones lumbares están relativamente contraindicadas en pacientes con CM1 congénito que no se han sometido a cirugía, dado el riesgo de que la presión reducida del LCR espinal pueda causar más lesiones y hernia amigdalinas.
Resultados quirúrgicos
Los pacientes suelen experimentar un alivio inmediato de la parestesia de las extremidades y del tinnitus después de la descompresión quirúrgica del CM1. La mayoría de los demás síntomas disminuyen o desaparecen en varias semanas o meses. Por ejemplo, en varias series se ha informado una disminución de los dolores de cabeza y otros síntomas después de la cirugía en el 80% o más de los pacientes(3,8,29,35,42).
Las dos complicaciones postoperatorias más comunes con la descompresión de la fosa posterior son la aparición de cuerpo extraño meningitis aséptica por injerto de duramadre y fuga de LCR, que ocurren, respectivamente, hasta en el 32% y el 21% de los pacientes sometidos a cirugía.12,35,42.
l riesgo de meningitis química puede estar asociado con el tipo de injerto. Las tasas de meningitis química son menores con autoinjertos o aloinjertos que con injertos artificiales o bovinos.35,43.
La fuga de LCR se debe a que el LCR se filtra alrededor de la línea de sutura del injerto y a menudo se exagera por un aumento coexistente de la presión intracraneal. Después de la cirugía, algunos pacientes presentan un aumento transitorio o permanente de la presión intracraneal, incluida la hipertensión intracraneal idiopática.44.[ En pacientes con síntomas persistentes o recurrentes después de la cirugía, una punción lumbar puede ayudar a distinguir la meningitis química de la infección y el aumento de la presión intracraneal.
La meningitis química se puede tratar con glucocorticoides; la infección puede tratarse con agentes antibióticos apropiados y, cuando esté indicado, irrigación quirúrgica y desbridamiento; y las presiones elevadas del LCR pueden tratarse con un agente diurético (es decir, acetazolamida) o pueden requerir una derivación ventriculoperitoneal. Los pacientes con siringe que han sido sometidos a descompresión pueden experimentar una disminución de los síntomas asociados, y la regresión de la siringe ocurre en aproximadamente el 78% de los pacientes.3.
Las pautas de consenso indican que el alivio de los síntomas no se correlaciona con la resolución de la siringe, y no está claro por qué algunos pacientes, a pesar de haber sido sometidos a una adecuada descompresión, no presentan disminución de los síntomas relacionados con la siringe ni mejoría en los hallazgos de los estudios de imagen.
Un metanálisis de los resultados quirúrgicos ha respaldado un mayor alivio de los síntomas después de la descompresión ósea y la duraplastia (con o sin contracción o resección amigdalina) que después de la descompresión ósea únicamente. La mejoría diferencial es más evidente en pacientes con siringomielia.
Una cirugía más extensa se asocia con mayores tasas de complicaciones.35,40. Un metanálisis que comparó la descompresión ósea y la duraplastia con el procedimiento más extenso de descompresión ósea, duraplastia y disección subaracnoidea y la contracción amigdalina mostró un alivio similar de los síntomas con los dos procedimientos, pero las tasas de complicaciones fueron mayores con este último procedimiento.45.
Según un estudio con base de datos internacional, el 6,8% de los pacientes fueron reintervenidos por síntomas que habían recaído o no habían sido aliviados.
Estas circunstancias se producen por dos motivos principales: una descompresión insuficiente del procedimiento inicial o el desarrollo de cicatrices intradurales.
La resonancia magnética de flujo de cine puede ser útil para evaluar estos problemas. El flujo de cine anormal en pacientes que nunca mejoraron sugiere una descompresión insuficiente. El flujo de cine anormal en pacientes que inicialmente tuvieron una mejoría y luego tuvieron una recaída sintomática sugiere cicatrización subaracnoidea de la cirugía. Los pacientes que se someten a descompresión ósea únicamente sin duraplastia parecen tener una tasa más alta de recaída sintomática o falta de mejoría que conduce a una reoperación.46.9
Conclusiones
Con la amplia disponibilidad de imágenes cerebrales, el reconocimiento de las malformaciones de Chiari se ha vuelto común y determinar qué pacientes tienen síntomas asociados con esta anomalía anatómica puede ser un desafío. Muchos pacientes tienen síntomas atípicos o hallazgos imagenológicos dudosos. Para estos pacientes, la resonancia magnética de flujo de cine puede ser informativa.22. Se requieren investigaciones para identificar a los pacientes que se beneficiarían de la descompresión quirúrgica, delinear técnicas quirúrgicas apropiadas y mejorar nuestra comprensión de la asociación de CM1 con síntomas cognitivos y psiquiátricos.
Referencias Bibliográficas
1. Chiari H. Ueber veränderungen des kleinhirns infolge von hydrocephalie des grosshirns. Dtsch Med Wochenschr 1891;17:1172-1175.
2. Iskandar BJ, Finnell RH. Spina bifida. N Engl J Med 2022;387:444-450.
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Pediatric and adult Chiari malformation type I surgical series 1965-2013: a review of demographics, operative treatment, and outcomes. J Neurosurg Pediatr 2015;15:161-177.
4. Valentini LG, Saletti V, Erbetta A, Chiapparini L, Furlanetto M. Chiari 1 malformation and untreated sagittal synostosis: a new subset of complex Chiari? Childs Nerv Syst 2019;35:1741-1753.
5. Massimi L, Peretta P, Erbetta A, et al. Diagnosis and treatment of Chiari malformation type 1 in children: the International Consensus Document. Neurol Sci 2022;43:1311-1326.
6. Aydin S, Hanimoglu H, Tanriverdi T, Yentur E, Kaynar MY. Chiari type I malformations in adults: a morphometric analysis of the posterior cranial fossa. Surg Neurol 2005;64:237-241.
7. Biswas D, Eppelheimer MS, Houston JR, et al. Quantification of cerebellar crowding in type I Chiari malformation. Ann Biomed Eng 2019;47:731-743.
8. McDowell MM, Alhourani A, Pearce-Smith BA, Mazurkiewicz A, Friedlander RM. Cost-effectiveness of postoperative ketamine in Chiari decompression. World Neurosurg 2018;110:e599-e604.
9. Ciaramitaro P, Massimi L, Bertuccio A, et al. Diagnosis and treatment of Chiari malformation and syringomyelia in adults: international consensus document. Neurol Sci 2022;43:1327-1342.
10. Wilkinson DA, Johnson K, Garton HJL, Muraszko KM, Maher CO. Trends in surgical treatment of Chiari malformation type I in the United States. J Neurosurg Pediatr 2017;19:208-216.
11. Badie B, Mendoza D, Batzdorf U. Posterior fossa volume and response to suboccipital decompression in patients with Chiari I malformation. Neurosurgery 1995;37:214-218.
12. Bhimani AD, Esfahani DR, Denyer S, et al. Adult Chiari I malformations: an analysis of surgical risk factors and complications using an international database. World Neurosurg 2018;115:e490-e500.
13. Oldfield EH. Pathogenesis of Chiari I — pathophysiology of syringomyelia: implications for therapy: a Summary of 3 decades of clinical research. Neurosurgery 2017;64:66-77.
14. Vernooij MW, Ikram MA, Tanghe HL, et al. Incidental findings on brain MRI in the general population. N Engl J Med 2007;357:1821-1828.
15. Kumar A, Patni AH, Charbel F. The Chiari I malformation and the neurotologist. Otol Neurotol 2002;23:727-735.
16. Frič R, Eide PK. Chiari type 1 — a malformation or a syndrome? A critical review. Acta Neurochir (Wien) 2020;162:1513-1525.
17. Ciaramitaro P, Garbossa D, Peretta P, et al. Syringomyelia and Chiari Syndrome Registry: advances in epidemiology, clinical phenotypes and natural history based on a north western Italy cohort. Ann Ist Super Sanita 2020;56:48-58.
18. Mekbib KY, Muñoz W, Allington G, et al. Human genetics and molecular genomics of Chiari malformation type 1. Trends Mol Med 2023;29:1059-1075.
19. Ellington M, Francomano CA. Chiari I malformations and the heritable disorders of connective tissue. Neurosurg Clin N Am 2023;34:61-65.
20.m Milhorat TH, Bolognese PA, Nishikawa M, McDonnell NB, Francomano CA. Syndrome of occipitoatlantoaxial hypermobility, cranial settling, and Chiari malformation type I in patients with hereditary disorders of connective tissue. J Neurosurg Spine 2007;7:601-609.
21. Frič R, Eide PK. Comparison of pulsatile and static pressures within the intracranial and lumbar compartments in patients with Chiari malformation type 1: a prospective observational study. Acta Neurochir (Wien) 2015;157:1411-1423.
22. McGirt MJ, Nimjee SM, Fuchs HE, George TM. Relationship of cine phase-contrast magnetic resonance imaging with outcome after decompression for Chiari I malformations. Neurosurgery 2006;59:140-146.
23. Bin Wan Hassan WMN, Mistretta F, Molinaro S, et al. Overview of spontaneous intracranial hypotension and differential diagnosis with Chiari I malformation. J Clin Med 2023;12:3287-3287.
24. Schievink WI. Spontaneous intracranial hypotension. N Engl J Med 2021;385:2173-2178.
25. Wang J, Alotaibi NM, Samuel N, Ibrahim GM, Fallah A, Cusimano MD. Acquired Chiari malformation and syringomyelia secondary to space-occupying lesions: a systematic review. World Neurosurg 2017;98:800-808.e2.
26. Luy DD, Agarwal N, McDowell MM, Tonetti DA, Goldschmidt E, Friedlander RM. Acquired Chiari type I malformation associated with type IV dural arteriovenous fistula: case report. J Neurol Surg A Cent Eur Neurosurg 2024;85:94-99.
27. Taylor DG, Mastorakos P, Jane JA Jr, Oldfield EH. Two distinct populations of Chiari I malformation based on presence or absence of posterior fossa crowdedness on magnetic resonance imaging. J Neurosurg 2017;126:1934-1940.
28. Allen PA, Delahanty D, Kaut KP, et al. Chiari 1000 Registry Project: assessment of surgical outcome on self-focused attention, pain, and delayed recall. Psychol Med 2018;48:1634-1643.
29. Seaman SC, Deifelt Streese C, Manzel K, et al. Cognitive and psychological functioning in Chiari malformation type I before and after surgical decompression — a prospective cohort study. Neurosurgery 2021;89:1087-1096.
30. Schmahmann JD, Sherman JC. The cerebellar cognitive affective syndrome. Brain 1998;121:561-579.
31. Bragée B, Michos A, Drum B, Fahlgren M, Szulkin R, Bertilson BC. Signs of intracranial hypertension, hypermobility, and craniocervical obstructions in patients with myalgic encephalomyelitis/chronic fatigue syndrome. Front Neurol 2020;11:828-828.
32. Hofkes SK, Iskandar BJ, Turski PA, Gentry LR, McCue JB, Haughton VM. Differentiation between symptomatic Chiari I malformation and asymptomatic tonsilar ectopia by using cerebrospinal fluid flow imaging: initial estimate of imaging accuracy. Radiology 2007;245:532-540.
33. Radmanesh A, Greenberg JK, Chatterjee A, Smyth MD, Limbrick DD Jr, Sharma A. Tonsillar pulsatility before and after surgical decompression for children with Chiari malformation type 1: an application for true fast imaging with steady state precession. Neuroradiology 2015;57:387-393.
34. Ebrahimzadeh SA, Du E, Chang Y-M, Bouffard M, Loth F, Bhadelia RA. MRI findings differentiating tonsillar herniation caused by idiopathic intracranial hypertension from Chiari I malformation. Neuroradiology 2022;64:2307-2314.
35. Zhao JL, Li M-H, Wang C-L, Meng W. A systematic review of Chiari I malformation: techniques and outcomes. World Neurosurg 2016;88:7-14.
36. Algattas HN, Alattar AA, Okonkwo DO, et al. A novel classification and management scheme for craniocervical junction disorders with ventral neural element compression. J Neurosurg 2023;140:585-594.
37. Muthiah N, McDowell MM, Zenonos G, et al. Endoscopic endonasal resection of cranio-cervical junction chordoma and ventral Chiari decompression: a case report. Oper Neurosurg (Hagerstown) 2021;21(5):E421-E426.
38. Houk JL, Amrhein TJ, Gray L, Malinzak MD, Kranz PG. Differentiation of Chiari malformation type 1 and spontaneous intracranial hypotension using objective measurements of midbrain sagging. J Neurosurg 2021;136:1796-1803.
39. Pattisapu JV, Ackerman LL, Infinger LK, et al. Congress of Neurological Surgeons systematic review and evidence-based guidelines for patients with Chiari malformation: surgical interventions. Neurosurgery 2023;93:731-735.
40. Lin W, Duan G, Xie J, Shao J, Wang Z, Jiao B. Comparison of results between posterior fossa decompression with and without duraplasty for the surgical treatment of Chiari malformation type I: a systematic review and meta-analysis. World Neurosurg 2018;110:460-474.e5.
41. Comparing surgery with and without duraplasty for youth with Chiari malformation type I and syringomyelia. Patient-Centered Outcomes Research Institute, April 15, 2024 ().
42. Arnautovic A, Pojskić M, Arnautović KI. Adult Chiari malformation type I: surgical anatomy, microsurgical technique, and patient outcomes. Neurosurg Clin N Am 2023;34:91-104.
43. Farber H, McDowell MM, Alhourani A, Agarwal N, Friedlander RM. Duraplasty type as a predictor of meningitis and shunting after Chiari I decompression. World Neurosurg 2018;118:e778-e783.
44. Fagan LH, Ferguson S, Yassari R, Frim DM. The Chiari pseudotumor cerebri syndrome: symptom recurrence after decompressive surgery for Chiari malformation type I. Pediatr Neurosurg 2006;42:14-19.
45. Osborne-Grinter M, Arora M, Kaliaperumal C, Gallo P. Posterior fossa decompression and duraplasty with and without arachnoid preservation for the treatment of adult Chiari malformation type 1: a systematic review and meta-analysis. World Neurosurg 2021;151:e579-e598.
46. Tam SKP, Brodbelt A, Bolognese PA, Foroughi M. Posterior fossa decompression with duraplasty in Chiari malformation type 1: a systematic review and meta-analysis. Acta Neurochir (Wien) 2021;163:229-238.