Muchos pacientes con riñones trasplantados finalmente los pierden debido al rechazo mediado por anticuerpos, pero faltan terapias aprobadas. Parecen estar involucrados múltiples mecanismos, comenzando con procesos específicos del donante, dependientes e independientes de anticuerpos que pueden desencadenar la activación de las células asesinas naturales (NK), lo que conduce a reacciones inflamatorias y mediadas por el complemento posteriores.1. Nuevos conocimientos sobre cómo funcionan estos , y Las vías interactúan han dado lugar a nuevos objetivos potencialmente terapéuticos. Y aunque las bases serológicas, morfológicas y moleculares de estas reacciones se comprenden cada vez más, el desarrollo del rechazo mediado por anticuerpos es, en última instancia, devastador para el receptor de un trasplante de riñón.
¿Cuál es el enfoque actual para el tratamiento del rechazo mediado por anticuerpos? La orientación actual adolece de estar basada en el consenso, en lugar de basarse en la base más sólida de los datos de ensayos controlados aleatorios. Las opciones terapéuticas actuales(2) incluyen el uso de plasmaféresis e inmunoglobulina intravenosa, tratamientos que han mostrado evidencia clínica de éxito parcial. Lo mismo ocurre con el uso de anticuerpos anti-CD20 como el rituximab. Diversos tratamientos, como el anticuerpo anti-C5 eculizumab(3) y el inhibidor del proteasoma bortezomib(4), no han alcanzado los criterios de valoración deseados. No se ha demostrado que el uso de clazakizumab, un anticuerpo monoclonal dirigido a la interleucina-6, sea eficaz(5) .Actualmente se está llevando a cabo un ensayo aleatorizado del fármaco inmunosupresor tocilizumab.6. En 2019, el Grupo de Trabajo de la Sociedad de Trasplantes(7,8) advirtió que debido a Si simplemente no se disponía de pruebas concluyentes a favor de terapias específicas, los médicos deberían optimizar la inmunosupresión en un esfuerzo por estabilizar la función del injerto. Por lo tanto, el grupo de trabajo, comprensiblemente, abogó por “ensayos clínicos de agentes biológicamente plausibles, correctamente realizados y potenciados”.
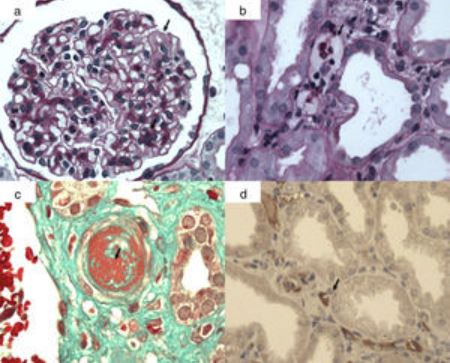
Mayer y sus colegas(9) documentan un enfoque para el rechazo mediado por anticuerpos en un ensayo controlado, aleatorizado y de fase 2 de felzartamab, un anticuerpo monoclonal IgG1 completamente humanizado contra CD38, una glicoproteína transmembrana expresada tanto por células inmunes como hematopoiéticas. particularmente células plasmáticas y células NK; posteriormente, estas células median la citotoxicidad celular dependiente de anticuerpos y la citotoxicidad directa mediada por citoquinas, respectivamente. Felzartamab elimina tanto las células NK como las células plasmáticas; estos últimos producen anticuerpos específicos del donante contra los antígenos leucocitarios humanos (HLA). Dado el éxito de los ensayos de este agente en pacientes con mieloma múltiple y los altos niveles de expresión de CD38 en células plasmáticas productoras de anticuerpos y células NK, los investigadores razonaron que este agente podría ser útil en el tratamiento del rechazo mediado por anticuerpos. El resultado primario del ensayo fue el perfil de seguridad y efectos secundarios de felzartamab, que mostró resultados positivos. Un resultado secundario clave fue la resolución del rechazo mediado por anticuerpos, como lo demuestran los niveles reducidos de inflamación microvascular, la intensidad media de fluorescencia disminuida de los anticuerpos específicos del donante y la inactividad de otros marcadores moleculares de lesión.
En este ensayo, 22 pacientes que habían tenido rechazo mediado por anticuerpos que había ocurrido al menos 180 días después del trasplante de riñón fueron aleatorizados (11 para recibir felzartamab y 11 para recibir placebo). Debido a la pequeña inscripción y al diseño exploratorio, el ensayo careció de poder estadístico. Sin embargo, los pacientes fueron evaluados con frecuencia (en 17 visitas durante el ensayo de un año de duración). La mediana de tiempo desde el trasplante hasta la inclusión en el ensayo fue de 9 años (rango intercuartil, 5 a 18). Siete pacientes tuvieron rechazo activo mediado por anticuerpos (4 en el grupo de felzartamab y 3 en el grupo de placebo) y 15 tuvieron rechazo crónico activo mediado por anticuerpos (7 pacientes y 8 pacientes, respectivamente); 3 pacientes tuvieron lesiones límite adicionales (2 pacientes y 1 paciente, respectivamente). La mayoría de los pacientes (59%) tenían anticuerpos específicos del donante HLA clase II. Después de un período de observación de 4 semanas, los pacientes recibieron nueve infusiones intravenosas semanales de 16 mg de felzartamab por kilogramo de peso corporal en 250 ml de solución salina al 0,9 % durante 3 a 90 minutos durante 4 semanas y luego una vez al mes durante 5 meses; los pacientes del grupo placebo recibieron solución salina sola.
=> Recibir por Whatsapp las noticias destacadas
La terapia con felzartamab no tuvo señales de seguridad importantes durante el ensayo. Un total de 21 pacientes completaron el ensayo después de que 1 paciente del grupo placebo sufriera pérdida del injerto causada por rechazo a las 14 semanas. Se realizaron biopsias al inicio del estudio, a las 24 semanas y a las 52 semanas en todos los pacientes que completaron el ensayo. Se desarrolló rechazo subclínico mediado por células T en 1 paciente del grupo de felzartamab a las 24 semanas, con resolución posterior. Sin embargo, este hallazgo puede ser preocupante, porque la terapia anti-CD38 puede afectar otros tipos de células, en particular las células Treg, lo que podría predisponer al paciente al rechazo mediado por células T. En este ensayo, la resolución del rechazo mediado por anticuerpos fue mayor con felzartamab que con placebo (82 % frente a 20 %). Después de la interrupción del tratamiento a las 24 semanas, hubo evidencia de recurrencia gradual del rechazo mediado por anticuerpos al cabo de 1 año, un hallazgo potencialmente problemático. Una preocupación adicional es que en el ensayo solo se inscribieron pacientes blancos y asiáticos, y ningún paciente de ascendencia africana.
Sin embargo, después de más de dos décadas de búsqueda de una terapia para el rechazo mediado por anticuerpos, este pequeño ensayo ofrece un rayo de esperanza. Actualmente, una vez que se ha desarrollado el rechazo mediado por anticuerpos, la pérdida del aloinjerto es casi inevitable. Además, el acceso a un trasplante posterior puede resultar complicado. Aunque todavía es demasiado pronto para afirmar que este ensayo exploratorio demuestra que un anticuerpo monoclonal anti-CD38 está claramente indicado para el tratamiento del rechazo mediado por anticuerpos, los resultados pueden considerarse alentadores. Si se demuestra eficacia en ensayos más amplios, el uso de felzartamab puede cambiar la práctica. Dada la complejidad de las vías de alorreconocimiento y los múltiples mecanismos efectores en el rechazo mediado por anticuerpos, puede ser necesario un enfoque sinérgico dirigido a las células B y plasmáticas, las células NK y las vías dependientes del complemento, por nombrar algunas. Dicho esto, la necesidad apremiante de una terapia definitiva para el rechazo crónico mediado por anticuerpos puede significar que los resultados de este pequeño y breve ensayo puedan aceptarse prematuramente, lo que afectaría la posibilidad de que se realicen otros estudios necesarios. Idealmente, ensayos aleatorios más grandes que comparen felzartamab con otras terapias confirmarán estos resultados alentadores.
Ronald Palacios Castrillo
Referencias Bibliográficas
1.
Rosales IA, Smith RN, Colvin RB. Histologic and molecular features of antibody-mediated rejection. Curr Opin Organ Transplant 2023;28:340-344.
Go to Citation
2.
Mayer KA, Budde K, Jilma B, Doberer K, Böhmig GA. Emerging drugs for antibody-mediated rejection after kidney transplantation: a focus on phase II & III trials. Expert Opin Emerg Drugs 2022;27:151-167.
Go to Citation
3.
Kulkarni S, Kirkiles-Smith NC, Deng YH, et al. Eculizumab therapy for chronic antibody-mediated injury in kidney transplant recipients: a pilot randomized controlled trial. Am J Transplant 2017;17:682-691.
Go to Citation
4.
Eskandary F, Regele H, Baumann L, et al. A randomized trial of bortezomib in late antibody-mediated kidney transplant rejection. J Am Soc Nephrol 2018;29:591-605.
Go to Citation
5.
Eskandary F, Dürr M, Budde K, et al. Clazakizumab in late antibody-mediated rejection: study protocol of a randomized controlled pilot trial. Trials 2019;20:37-37.
Go to Citation
6.
Streichart L, Felldin M, Ekberg J, et al. Tocilizumab in chronic active antibody-mediated rejection: rationale and protocol of an in-progress randomized controlled open-label multi-center trial (INTERCEPT study). Trials 2024;25:213-213.
Go to Citation
7.
Schinstock CA, Mannon RB, Budde K, et al. Recommended treatment for antibody-mediated rejection after kidney transplantation: the 2019 Expert Consensus From the Transplantation Society Working Group. Transplantation 2020;104:911-922.
Go to Citation
8.
Loupy A, Haas M, Roufosse C, et al. The Banff 2019 Kidney Meeting Report (I): updates on and clarification of criteria for T cell- and antibody-mediated rejection. Am J Transplant 2020;20:2318-2331.
Go to Citation
9.
Mayer KA, Schrezenmeier E, Diebold M, et al. A randomized phase 2 trial of felzartamab in antibody-mediated rejection. N Engl J Med 2024;391:122-132.