Ronald Palacios Castrillo
Aspectos destacados
- La secreción de mucina de las glándulas de Brunner promueve la proliferación de lactobacilos intestinales
- Las neuronas de la amígdala en el sistema nervioso central estimulan las glándulas de Brunner a través de los nervios vagos
- El estrés inhibe la amígdala central, suprimiendo así la actividad de las glándulas de Brunner
- La actividad alterada de las glándulas compromete las poblaciones de lactobacilos y la inmunidad del huésped
Resumen
Los estados psicológicos negativos afectan la inmunidad alterando el microbioma intestinal. Sin embargo, la relación entre los estados cerebrales y la composición del microbioma sigue sin estar clara. Chang,et,al.,[CELL.DOI:https://doi.org/10.1016/j.cell.2024.07.019], demostraron que las glándulas de Brunner en el duodeno acoplan circuitos cerebrales sensibles al estrés a la homeostasis bacteriana.
=> Recibir por Whatsapp las noticias destacadas
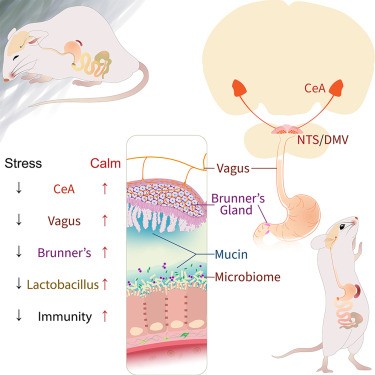
Las glándulas de Brunner mediaron el enriquecimiento de especies de lactobacilos intestinales en respuesta a la estimulación del nervio vago.
La ablación específica de células de las glándulas suprimió notablemente los recuentos de lactobacilos y aumentó la vulnerabilidad a las infecciones. En el prosencéfalo, mapearon un circuito polisináptico mediado por el nervio vago que conecta el núcleo central de la amígdala con las glándulas de Brunner.
El estrés crónico suprimió la actividad de la amígdala central y fenocopió los efectos de las lesiones glandulares. Por el contrario, la excitación de la amígdala central o de las neuronas vagales parasimpáticas activó las glándulas de Brunner y revirtió los efectos del estrés en el microbioma intestinal y la inmunidad. Los hallazgos revelaron un mecanismo cerebro-cuerpo manejable que vincula los estados psicológicos con la defensa del huésped.
En Detalle
Los microbiomas intestinales, es decir, las comunidades microbianas de la mucosa intestinal, promueven la digestión de nutrientes y la protección contra los patógenos transmitidos por los alimentos. Cada vez hay más evidencia que indica que los estados psicológicos afectan la inmunidad sistémica al alterar el microbioma del huésped, lo que destaca un vínculo causal entre la actividad cerebral y la homeostasis bacteriana intestinal.
De hecho, numerosos sujetos humanos y estudios preclínicos han informado asociaciones entre el estrés psicológico y los microbiomas alterados.
En primates no humanos, los modelos de estrés como la separación materna inducen disminuciones significativas en los niveles de la bacteria beneficiosa Lactobacillus concomitantemente con una creciente vulnerabilidad a infecciones oportunistas. En consonancia con esto, los estudios con roedores han demostrado que la administración de probióticos puede mejorar los marcadores emocionales y fisiológicos en modelos de ansiedad.
Estas influencias de los estados cerebrales en el microbioma intestinal pueden ocurrir a través de cambios en las interacciones entre las mucosas y las bacterias.
Por lo tanto, en los niños, el estrés psicosocial se asoció con una protección inmunitaria deficiente de las mucosas, lo que refleja tanto concentraciones más bajas de inmunoglobulina A secretora como un aumento de la incidencia de infecciones oportunistas.
Por el contrario, se observan efectos opuestos en la inducción de la relajación psicológica. De hecho, se presume que la supresión inducida por el estrés de los niveles de Lactobacillus en primates fue impulsada por la inhibición de la secreción de la mucosa intestinal. Lamentablemente, aún se desconoce cómo los estados cerebrales pueden controlar la secreción mucosa de tal manera que afecten al microbioma.
El objetivo principal de Chang y colaboradores fue identificar las vías neuronales que permiten que el cerebro impacte en el sistema mucosa-microbioma.
Las glándulas de Brunner, una estructura exocrina confinada a la submucosa duodenal, consisten principalmente en células productoras de moco.
Fundamentalmente, las glándulas de Brunner son el objetivo distintivo de las terminales nerviosas, y la estimulación neuronal es necesaria para la secreción de moco. Cabe destacar que una proporción significativa de estas terminales son de origen vagal.
Por lo tanto,Chang y colegas plantearon la hipótesis de que la inervación vagal de las glándulas mucosas de Brunner media la influencia de los estados psicológicos en el microbioma.
En consecuencia, investigaron este circuito neural-glandular utilizando enfoques específicos de células para la secuenciación de núcleos únicos, ablación, imágenes intravitales, estudios electrofisiológicos y de comportamiento.
Identificaron un circuito neuroglandular sensible al estrés que vincula los estados cerebrales con los cambios en el microbioma intestinal. Los circuitos cerebrales relacionados con las emociones controlan las glándulas de Brunner a través del nervio vago; las secreciones mucosas de estas glándulas apoyan la proliferación de microbios, en particular los lactobacilos.
De hecho, varias líneas de evidencia de primates no humanos, roedores de laboratorio y humanos demuestran que las bacterias intestinales del género Lactobacillus se reducen significativamente durante el estrés.
Se ha demostrado un circuito neuroepitelial para la secreción de moco intestinal en las células caliciformes. En concreto, las fibras sensoriales nociceptoras intestinales activan la vía del péptido relacionado con el gen de la calcitonina (CGRP)-Ramp1 para inducir el vaciamiento de las células caliciformes y la secreción de moco. Curiosamente, la alteración genética de los nociceptores intestinales también conduce a una inflamación grave y alteraciones en la microbiota intestinal, incluida una disbiosis transmisible.
Estos hallazgos indican que los nervios gastrointestinales extrínsecos desempeñan un papel fundamental en el control del microbioma al dirigirse a las células secretoras de moco.
Además, hallazgos recientes han implicado a las neuronas entéricas del colon en la relación entre el estrés psicológico y la inflamación intestinal. El estudio de Chang,en,al., se suma a esta imagen emergente al revelar un circuito neuroglandular a través del cual las fibras vagales se dirigen a las glándulas submucosas del intestino superior para promover la homeostasis bacteriana.
Los resultados implican a los BG en la generación de inmunidad alterada en respuesta a estresores crónicos. El modelo propuesto sugiere la siguiente secuencia de eventos: la liberación de mucina de los BG sirve como sustrato para la proliferación de Lactobacilli.
Cuando el estrés inhibe la liberación de moco, el crecimiento de los lactobacilos se suprime de manera similar. Los efectos de esto último incluyen una mayor permeabilidad intestinal, un tono simpático y anomalías del tejido linfoide (especialmente la contracción del bazo y el crecimiento excesivo de los folículos linfoides de la mucosa).
La inoculación con probióticos parece ser suficiente para mitigar estos efectos negativos: mientras que la administración de Lactobacillus + Bifidobacteria restauró la integridad de la barrera intestinal y disminuyó la actividad del nervio simpático, los animales tratados con antibióticos mostraron una mayor permeabilidad intestinal. Estos hallazgos concuerdan con los estudios que demuestran que las bacterias comensales, especialmente los lactobacilos, mejoran la función de la barrera intestinal al regular positivamente las proteínas de unión estrecha epitelial.
Por lo tanto, los hallazgos son directamente consistentes con la noción de que las fibras vagales eferentes promueven la función inmune y la señalización antiinflamatoria.
De particular interés son los efectos beneficiosos reportados de la señalización colinérgica vagal sobre la función del bazo, que son paralelos a sus hallazgos que vinculan las glándulas de Brunner con las características esplénicas. Este circuito propuesto puede, por un lado, aclarar los mecanismos por los cuales el nervio vago reduce los estados inflamatorios a través del bazo.
De hecho, demostraron que la estimulación vagal expande el tejido del bazo en oposición a los efectos simpáticos. Los efectos beneficiosos de la estimulación del nervio vago pueden estar mediados por una integridad mucosa mejorada.
La estimulación no invasiva (rama auricular) del nervio vago redujo la permeabilidad del intestino delgado en sujetos humanos tratados previamente con la administración intravenosa de hormonas del estrés. Este efecto es consistente con estudios preclínicos en los que la estimulación vagal revirtió los cambios inducidos por el estrés en la permeabilidad intestinal y atenuó los síntomas de la enfermedad inflamatoria intestinal.
Sin embargo, los mecanismos que vinculan la señalización colinérgica vagal y la integridad de la barrera intestinal siguen siendo desconocidos. Por lo tanto, este estudio sugiere que las glándulas de Brunner y su secreción de moco pueden explicar al menos parte de los efectos protectores de la estimulación vagal sobre la inmunidad de la mucosa intestinal.
En línea con esta idea, sus hallazgos demuestran que la actividad parasimpática vagal modula de forma bidireccional la composición del microbioma, incluso en respuesta a factores estresantes.
Además de la señalización colinérgica, la rama sensorial del nervio vago puede estar involucrada en la modulación del microbioma. De hecho, se encontró que la CCK, una hormona intestinal prodigestiva cuya acción depende de los ganglios sensoriales vagales, promueve la expansión de las poblaciones de Lactobacilli a través de los BG.
Esto sugiere la posibilidad de que las poblaciones de Lactobacilli se expandan en respuesta a la actividad de las fibras vagales que detectan nutrientes. Además, las fibras sensoriales vagales pueden detectar el contenido microbiano intestinal.
La administración de probióticos mejoró los marcadores fisiológicos en modelos de ansiedad en roedores, un efecto mediado por la detección vagal. De hecho, los ganglios sensoriales vagales detectan metabolitos bacterianos, mediando la generación de respuestas autónomas en respuesta a la señalización bacteriana.
Estos hallazgos concuerdan con las observaciones de que los ratones con lesiones en las glándulas de Brunner desarrollaron preferencias por pellets enriquecidos con fibra y soluciones para beber que contienen probióticos. Las fibras dietéticas promueven el crecimiento de Lactobacilli y Bifidobacteria y suprimen el síndrome metabólico en animales con microbiomas alterados.
En otras palabras, los efectos de los microbiomas alterados pueden detectarse a través de vías interoceptivas, lo que permite el desencadenamiento de respuestas conductuales compensatorias. Finalmente, se descubrió que la CeA, un área subcortical dentro de los lóbulos temporales, controla los BG y modula el microbioma.
Las neuronas de la amígdala central están fundamentalmente implicadas en el comportamiento emocional. La amígdala central desempeña un papel importante en el miedo y la ansiedad condicionados, y, por lo tanto, puede ser un vínculo crítico entre los estados psicológicos negativos y los microbiomas alterados.
Se Descubrió que la exposición a factores estresantes inhibía firmemente la actividad neuronal en la amígdala central y que la inhibición de la amígdala central recapitula los efectos del estrés en el microbioma intestinal y la inmunidad.
En consonancia con esta idea, se ha demostrado que las señales sensoriales vagales transmitidas por el intestino modulan los estados de ansiedad a través de la amígdala central. En consonancia con los hallazgos antes mencionados, L. rhamnosus, una especie de Lactobacillus que está regulada por CCK, redujo las conductas ansiosas y depresivas inducidas por el estrés al modular los niveles del prosencéfalo de ácido gamma-aminobutírico (GABA), el principal neurotransmisor de la amígdala central, a través del nervio vago.
Los hallazgos demuestran que la actividad de la amígdala central modula de forma bidireccional la composición del microbioma. Las alteraciones en el procesamiento de la amígdala pueden ser la base de trastornos psicológicos cuya gravedad se correlaciona con el grado de alteración del microbioma.