La interacción neuroinmune en la hematopoiesis, la inflamación y la reparación
Ronald Palacios Castrillo, M.D.,PhD.
Importancia
La hematopoiesis en estado estable y acelerada por estrés está controlada en parte por el sistema nervioso autónomo de los mamíferos; a su vez, la inervación sensorial participa de manera crucial en la titulación de la infiltración de leucocitos durante la inflamación para lograr la reparación tisular.
Una comprensión profunda de la intrincada comunicación neuroinmune durante dichos procesos puede permitir el desarrollo de estrategias de interferencia para frenar patologías como infecciones agudas y trastornos inflamatorios crónicos.
=> Recibir por Whatsapp las noticias destacadas
Aspectos destacados
-El proceso de hematopoyesis, tanto en estado estable como durante el estrés, está controlado por la inervación simpática rítmica/circadiana.
-La nocicepción titula el grado de entrada de células mieloides a los sitios de inflamación y la capacidad de dichas células para eliminar patógenos.
-La inervación simpática contribuye a la inflamación crónica, como en el caso de la aterosclerosis; regula el reclutamiento de leucocitos arteriales inducido por estrés y circadiano y controla la hematopoiesis que se acelera por factores de riesgo cardiovascular.
-Los trabajos recientes aportan cada vez más pruebas de la importancia de la nocicepción en la modulación de la reparación tisular, incluso en las superficies epiteliales.
Resumen
Las células inmunes innatas son los principales efectores durante la defensa del huésped y en la inflamación estéril. Su producción en la médula ósea está estrechamente regulada por factores de crecimiento y de nicho, y su actividad en los sitios de inflamación está orquestada por una red de alarminas y citocinas.
Sin embargo, trabajos recientes destacan un papel significativo del sistema nervioso periférico en estos procesos. Las vías neuronales simpáticas desempeñan un papel clave en la regulación de la homeostasis de las células sanguíneas, y las vías neuronales sensoriales median la señalización proinflamatoria o antiinflamatoria de una manera específica para cada tejido.
En este artículo, revisamos la evidencia emergente de la titulación fina de la hematopoiesis, el tráfico de leucocitos y la reparación tisular a través de la comunicación neuroinmune, y cómo su descarrilamiento puede acelerar la inflamación crónica, como en la aterosclerosis.
La inmunidad innata se vuelve periférica
El sistema inmunitario innato de los vertebrados se compone en gran medida de leucocitos que derivan de progenitores mieloides comunes durante la hematopoyesis [1].
Entre estos, los neutrófilos y los macrófagos son la primera línea de defensa del huésped, provocando respuestas para eliminar patógenos, con el objetivo final de restaurar la homeostasis tisular [2,3].
Los neutrófilos son las células inmunitarias innatas circulantes más abundantes en los seres humanos [4]; se reclutan rítmicamente en los tejidos inflamados a través del control circadiano y median la eliminación de patógenos y la reparación tisular [5,6].
Su producción, liberación desde la médula ósea y reclutamiento se pueden modificar durante la inflamación aguda o crónica a través de señales simpáticas del sistema nervioso autónomo periférico [5,7].
Box de conceptos 1
Control circadiano de la homeostasis y la inflamación
El cuerpo de los mamíferos está sujeto a variaciones entre el día y la noche. Este ciclo de diferencias entre el día y la noche regula el funcionamiento del cuerpo en condiciones fisiológicas normales.
El control homeostático de diversas funciones corporales está coordinado por ajustes graduales que se transmiten desde el cerebro a través de circuitos autónomos a los órganos periféricos.
Los vasos sanguíneos se encuentran muy cerca de los nervios simpáticos [39], lo que los hace particularmente susceptibles a los cambios tonales circadianos y a la entrada neuronal.
De manera similar, la médula ósea (MO) se beneficia de un suministro abundante de inervación autónoma que coordina estrechamente el proceso de formación de la sangre y la liberación controlada de células en la circulación [14,19]. En el contexto de la homeostasis inmunitaria, los neutrófilos se liberan y se eliminan sistemáticamente de la circulación a través de circuitos regulados circadianos.
Al ser las células inmunitarias más abundantes en el sistema circulatorio de los seres humanos [4], un cableado incorrecto de la fidelidad inmunitaria tiene implicaciones de largo alcance para la homeostasis tisular y la inflamación.
La oscilación circadiana de las señales simpáticas no solo afecta la liberación de progenitores sanguíneos de la médula ósea a través del control de CXCL12 [17,90], sino que también regula la expresión de moléculas de adhesión en el endotelio, lo que facilita aún más el reclutamiento celular [39,52].
Por lo tanto, las alteraciones o daños a la integridad anatómica de la vasculatura crean un doble problema. En primer lugar, se produce inflamación como respuesta típica a la integridad tisular deteriorada, y se reclutan neutrófilos y macrófagos.
En segundo lugar, las señales simpáticas de los nervios cercanos amplifican las respuestas inmunitarias activando las células mieloides. Por lo tanto, las enfermedades crónicas como la aterosclerosis presentan una situación precaria de un llamado «ciclo de inflamación de retroalimentación».
El sistema nervioso periférico de los vertebrados es una red compleja de nervios que residen principalmente fuera del cerebro y la médula espinal y se subdivide en dos grupos: sistemas autónomos (involuntarios) y somáticos (voluntarios) (revisados en [8]). Aunque los nervios autónomos periféricos se encuentran fuera del sistema nervioso central (SNC), sus neuronas (neuronas preganglionares) se originan aquí.
El sistema nervioso simpático (SNS) deriva de neuronas preganglionares en la región toracolumbar de la médula espinal; inerva casi todos los órganos de los mamíferos y es esencial para el mantenimiento homeostático. El sistema nervioso parasimpático (SNP) funciona de manera antagónica al SNS. A diferencia del SNS, los preganglios del SNP derivan del tronco encefálico y la región sacra de la médula espinal.
Esta polaridad anteroposterior confiere especificidad a la entrada parasimpática que reciben los órganos inervados [9]. El sistema sensorial es una subclase del sistema nervioso somático que consta de una clase diversa de neuronas que inervan la periferia musculoesquelética y son responsables del movimiento voluntario y del reconocimiento de diversos estímulos externos [10,11].
Las neuronas sensoriales transmiten colectivamente señales ambientales como el dolor, la temperatura, el tacto y la orientación. Hasta hace poco, el sistema nervioso autónomo periférico (SNA) se estudiaba principalmente como una entidad independiente. Sin embargo, cada vez hay más pruebas de que el SNA y las neuronas sensoriales están estrechamente interconectados y que la inmunidad implica una comunicación cruzada íntima con los glóbulos blancos.
En este artículo, analizamos los avances recientes que conectan la activación simpática con la hematopoiesis en estado estable y la inflamación, y cómo tanto la señalización sensorial como la simpática afinan la respuesta inflamatoria.
La activación simpática excesiva puede impulsar el desarrollo de la inflamación crónica, y analizamos los patomecanismos emergentes, así como el potencial terapéutico de dicho conocimiento. Por último, proporcionamos detalles sobre cómo la actividad nerviosa sensorial puede ralentizar la inflamación y regular la reparación.
Hematopoiesis
Control simpático de la hematopoiesis en estado estacionario
La hematopoiesis en humanos y ratones adultos se produce en la médula ósea (MO) en un proceso regulado de manera intrincada que produce todos los linajes de células sanguíneas maduras [12,13].
Anatómicamente, el parénquima de la MO está altamente inervado por fibras nerviosas simpáticas que regulan la proliferación de células madre hematopoiéticas (CMH) a través de un complejo paisaje de señales que actúan a través de interacciones acelulares y celulares [14–16]. Por ejemplo, la liberación simpática del neurotransmisor norepinefrina es necesaria para inducir la regulación negativa del ligando 12 de quimiocina con motivo C-X-C de la MO (CXCL12).
Esta regulación negativa permite la liberación de neutrófilos y progenitores sanguíneos a la circulación (Figura 1) [17]. Las neuronas simpáticas que adquieren un fenotipo colinérgico en el endostio de la médula ósea también controlan la hematopoiesis al prevenir el agotamiento de los progenitores de células madre [18].
Además de mantener el acervo estable de progenitores sanguíneos y neutrófilos en la médula ósea, la eliminación de células sanguíneas envejecidas también es un componente esencial de la homeostasis leucocitaria.
Si bien aún no se ha delineado el vínculo molecular exacto con la regulación simpática, es probable que el circuito regulador que permite la liberación de neutrófilos maduros de la médula ósea [17] pueda, en parte, regular la eliminación de células sanguíneas envejecidas de la circulación, aunque esto sigue siendo conjetural.
La importancia de la inervación simpática en estado estable se evidencia por el envejecimiento prematuro de las HSC de BM de ratón tras la pérdida de fibras nerviosas simpáticas positivas para tirosina hidroxilasa (TH+).
La ablación quirúrgica de los nervios TH+ en el fémur de ratones jóvenes de tipo salvaje (WT) eleva la proliferación de HSC en paralelo con la expansión de células madre mesenquimales (MSC).
Además de alterar el estado proliferativo de las células madre, el agotamiento de las fibras nerviosas TH+ reduce la expresión de los factores de nicho de BM Cxcl12 y el factor de crecimientode células madre (Scf).
Esta reducción, a su vez, induce a las HSC residentes a volverse pro-mielo- y granulopoiéticas en sus decisiones de destino posteriores, una observación común en células madre envejecidas [16,19]. Mecanísticamente, la eliminación o pérdida de la señalización del receptor β3-adrenérgico (ADRβ3) (p. ej., Adrb3–/–) dentro del nicho de la médula ósea de ratones jóvenes induce este cambio relacionado con el envejecimiento en el compartimento de las HSC [16,19].
Además, durante la hematopoiesis regenerativa , la señalización del receptor nicotínico de acetilcolina α7 (α7AChR) provoca un aumento en la producción de CXCL12 por parte de las MSC Nestin+, lo que retiene las poblaciones progenitoras de HSC dentro de la médula ósea de ratones que expresan el receptor alfa 2 de la familia del factor neurotrófico (Gfra2). La expresión de CXCL12 por parte de las MSC Nestin+ mitiga la hiperproliferación y mantiene la quiescencia de las HSC durante la hematopoiesis por estrés en ratones [18].
El bloqueo farmacológico de α7AChR en ratones WT reduce la expresión de CXCL12 en la médula ósea [18]. Además de regular la proliferación y liberación de células madre hematopoiéticas en la circulación a través de la actividad simpática, las señales simpáticas también suprimen la actividad de los osteoblastos para modular la homeostasis de las células madre hematopoiéticas.
Específicamente, en ratones neonatos de origen mixto C57BL/6 y 129/SvCPJ, la ablación genética de la dopamina β-hidroxilasa (DBH; ratones Dbh−/−), anula la liberación de G-CSF inducida por norepinefrina para inhibir los osteoblastos, lo cual es obligatorio para la liberación de células madre hematopoiéticas de la médula ósea [20].
La DBH desempeña un papel clave en la regulación simpática de la homeostasis del tejido adiposo blanco, ya que su eliminación elimina la lipólisis inducida por leptina en ratones [21], lo que sugiere que la disponibilidad de DBH es crucial para la actividad de la norepinefrina.
Además, se ha informado de la expresión celular autocrina de dopamina o de la actividad del receptor de dopamina en terminales simpáticas en modelos de enfermedad de esclerosis múltiple (EM) y enfermedad de Parkinson (revisado en [22]); esto indica que la dopamina puede influir o ayudar a predecir la actividad simpática específica del tejido [23].
Recientemente, un estudio mostró que el agotamiento de las células TH+ asistido por la toxina de la difteria (DTX) condujo a la inhibición de la síntesis de dopamina, lo que a su vez causó el desgaste de las HSC de la médula ósea [24].
Corroborando la participación de la dopamina en la homeostasis de las HSC, los investigadores realizaron además la eliminación genética de los receptores de dopamina de tipo D2 y D3 en células madre LSK+ (Lin− Sca-1+ c-Kit+).
La cantidad total de HSC y sus progenitores multipotentes (HSPC), células mieloides CD11b+ y granulocitos Gr-1+ se redujo en la médula ósea Drd2–/– y Drd3–/– en relación con los ratones WT [24]; esto sugirió que, para mantener la fidelidad de la hematopoiesis, la regulación simpática de la homeostasis sanguínea está estrechamente regulada en varias vías alternativas, aunque distintas.
El control simpático influye en la hematopoiesis durante la inflamación
El bazo es un órgano linfoide secundario que es rico en inervación simpática TH+ en humanos y ratones [25,26]. Además de la expresión de TH en el tejido linfoide, los glóbulos blancos también expresan receptores de superficie para neuropéptidos del SNS [27,28].
En comparación con la médula ósea, el bazo actúa principalmente como un reservorio de células sanguíneas en estado estacionario. Sin embargo, durante la granulopoiesis de emergencia, el bazo contribuye a la expansión y producción elevada de granulocitos a través de la liberación simpática local de noradrenalina (Figura 2) [29,30].
Las concentraciones plasmáticas de noradrenalina están fuertemente vinculadas a las cantidades de leucocitos circulantes en pacientes humanos diabéticos (determinadas a través de la concentración de hemoglobina glucosilada ≥47 mmol/mol).
Esto se acompaña de una alta residencia esplénica de leucocitos TH+, con una elevada expresión del receptor de neuropéptido Y (NPYR) y de catecolaminas, lo que sugiere que las señales simpáticas contribuyen funcionalmente a la (dis)homeostasis metabólica [21,27].
En consecuencia, la ablación genética del receptor β2-adrenérgico (ratones Adrb2−/−) o la ablación quirúrgica y química de los nervios simpáticos esplénicos en ratones diabéticos tipo 2 inducidos por una dieta rica en grasas (Apoe−/−) disminuye la mielopoiesis esplénica, el número total de progenitores de granulocitos-macrófagos (GMP) independientemente de la MB, y mejora la aterosclerosis diabética [27].
Además, la denervación esplénica de las neuronas simpáticas disminuye la proliferación de GMP y reduce el número total de células TH+ residentes en los ratones diabéticos.
El fenómeno por el cual las células madre y progenitoras proliferan y se expanden en el bazo durante la inflamación (hematopoiesis extramedular) parece conservarse en la aterosclerosis de ratones [31], el adenocarcinoma de pulmón [32] y los modelos de infarto de miocardio [33]. Esto es interesante, ya que se podría especular que todavía existen vías desconocidas a través de las cuales se puede manipular el SNS para frenar la progresión de tales cargas de salud.
La señalización colinérgica también regula la homeostasis leucocitaria para contrarrestar la entrada neuronal adrenérgica. El donepezilo, un bloqueador de la acetilcolinesterasa, se utiliza para tratar la enfermedad de Alzheimer y reduce los recuentos de leucocitos circulantes [34].
Mecanísticamente, la eliminación genética de la acetilcolinesterasa en las células B CD19 (ratones Cd19CreChatfl/fl) reduce la capacidad de las unidades formadoras de colonias de los progenitores mieloides en la médula ósea de ratón en relación con los controles.
Además, las células del estroma con expresión superficial de α7nAChR se unen a la acetilcolina de los linfocitos B CD19+B220+ y controlan la proliferación de las HSC.
Por lo tanto, la pérdida de acetilcolina de los linfocitos B provoca una expansión exagerada de los neutrófilos CD45+Ly6G+, los monocitos Ly6Chi y Ly6Clo y las células B B220+ [34]; Esto sugiere que la regulación colinérgica es crucial para evitar la hiperproliferación leucocitaria. Por naturaleza, la inflamación estresa el compartimento hematopoiético, por lo que requiere una respuesta adecuada.
Los estudios analizados aquí brindan información sobre los mecanismos moleculares que gobiernan la formación de células sanguíneas, incluidos algunos de los centros reguladores autónomos clave que controlan la homeostasis de las células madre y los leucocitos en contextos patológicos; esto abre caminos para aprovechar potencialmente dichos centros terapéuticamente.
Los circuitos neuronales sensoriales y simpáticos regulan la inflamación
Las neuronas nociceptoras son neuronas aferentes sensoriales especializadas del sistema nervioso somático que, para prevenir daños, reconocen y alertan al cuerpo sobre estímulos nocivos [35].
Están presentes en la piel, los músculos, las articulaciones y muchos órganos donde sirven para detectar rápidamente estímulos dañinos o potencialmente dañinos, interpretados como dolor. Los nervios sensoriales nociceptores también inervan la vasculatura [14,36] y secretan neuropéptidos como el péptido relacionado con el gen de la calcitonina (CGRP), la sustancia P y el neuropéptido Y (NPY) para regular la actividad inmunitaria local en sus vasos asociados.
La activación persistente e incontrolada de esta clase de neuronas a través de daño a los propios nervios o a través de aberraciones en su actividad está vinculada a la inflamación crónica; de hecho, influyen en las células inmunitarias de una manera específica del contexto para alterar las respuestas tisulares [37,38].
Asimismo, en enfermedades inflamatorias como la aterosclerosis, las señales simpáticas inducidas circadianamente reclutan células inmunitarias como los neutrófilos, propagando así la inflamación [39].
Regulación neuronal sensorial de la inflamación
Los nociceptores se diferencian de las neuronas sensoriales primarias porque, además de su capacidad para reconocer y transducir estímulos ambientales, expresan receptores que se unen a citocinas, patógenos e inmunoglobulinas [40].
Los hallazgos de un estudio con ratones que investigó el papel de los nociceptores Nav1.8+ en la inflamación de la piel causada por el virus del herpes simple 1 (HSV-1) mostraron que este nociceptor limita el reclutamiento de neutrófilos y la amplitud de la inflamación.
Específicamente, los ratones sin nociceptores Nav1.8+ (Nav1.8-Cre-DTA) exhiben una inflamación exagerada en los sitios de lesión causados por HSV-1, marcada por un aumento de 100 veces en la expresión de interleucina (IL)-1β, IL-6 y factor de necrosis tumoral (TNF)α en relación con los controles [41].
Además, durante la infección por neumonía por Staphylococcus aureus en ratones, la ablación química de los nociceptores de potencial transitorio del receptor vanilloide 1 (TRPV1)+ por resiniferatoxina en ratones WT o deficiencia de Trpv1–/–, facilita el reclutamiento robusto de neutrófilos Ly6G+ a los pulmones [42] y la piel [43], respectivamente; Esto sugiere que estos nociceptores limitan el reclutamiento de neutrófilos durante la infección por S. aureus.
Mecanísticamente, la liberación de CGRP de las neuronas TRPV1+ inhibe la capacidad de los neutrófilos para eliminar bacterias al mismo tiempo que impide la señalización antimicrobiana proinflamatoria en los macrófagos, como lo demuestra una mayor carga de infección en los pulmones de los ratones de control [42]. Cabe destacar que, de manera similar a los neutrófilos, las células T γδ en los pulmones también tienen una capacidad deteriorada para producir IL-17A a través de la actividad de CGRP [42].
Además, Streptococcus pyogenes induce la liberación de CGRP de los nociceptores TRPV1+ en los tejidos infectados. Esta liberación da como resultado un reclutamiento de neutrófilos deteriorado, anulando en consecuencia la respuesta de defensa a la infección bacteriana en los controles en relación con los ratones reporteros TRPV1 DTA (Trpv1-Cre/Dta) [44].
Además, Streptococcus pneumoniae manipula la liberación de CGRP en ratones, impidiendo en particular la expresión de efectores inmunitarios como CCL2 y CXCL10. Esto, a su vez, dificulta el reclutamiento de neutrófilos y monocitos en el cerebro infectado, lo que agrava la infección [45].
En el bazo, las neuronas nociceptoras TRPV1+ se localizan a lo largo de la vasculatura, llegando hasta la pulpa blanca y las zonas de células B [46].
La ablación dirigida de estas neuronas a través del tratamiento con DTX en ratones conduce a una marcada disminución en la proporción de células B B220+FashiGL7hi y células B de memoria IgG1+ en los centros germinales en relación con los ratones sin ablación de neuronas [47].
En el mismo estudio, se demostró que las células B reconocen CGRP a través de su expresión superficial de RAMP1. Los ratones Ramp1–/– exhiben una cantidad reducida de células B del centro germinal independientemente de sus precursores en la médula ósea [46].
Tal vez no sea sorprendente que la activación de TRPV1 esplénico a través de alimentos que contienen capsaicina mejore las respuestas inmunes humorales, lo que conduce a una mayor tasa de supervivencia durante la infección por el virus de la influenza en ratones en comparación con los controles [46].
Además, un estudio que utilizó ratones de rastreo de linaje Nav1.8 mostró que existen nociceptores Nav1.8+ en los ganglios linfáticos de los ratones. En ratones reporteros marcados con tdTomato (Nav1.8Cre/+; Rosa26LSL-eYFP/+), la inflamación mediada por lipopolisacáridos (LPS) indujo una expansión local de la inervación de los nociceptores en los ganglios linfáticos, que se asoció con un aumento del volumen de los ganglios linfáticos [48].
Aunque no se ha investigado directamente, es tentador especular que los aumentos del volumen de los ganglios linfáticos mediados por los nociceptores durante la inflamación podrían mejorar la proliferación de células linfoides y mieloides in situ al reconfigurar el estroma del bazo.
Estos diversos estudios no solo establecen conocimientos sobre cómo la inervación influye en la inmunidad de los órganos, sino que también nos brindan una comprensión de cómo los patógenos, en el contexto apropiado, pueden impulsar los circuitos sensoriales de los nociceptores para inducir daños colaterales durante la inflamación de los órganos.
Cabe destacar que la ablación farmacológica de las neuronas TRPV1 se utiliza para atenuar las sensaciones de dolor en pacientes humanos que presentan dolor crónico.
Sin embargo, parece que este nociceptor es crucial para las defensas humorales, como se indicó anteriormente. Se requieren estudios clínicos para determinar cómo estimular dichas neuronas de manera coordinada y regulada, y obtener respuestas beneficiosas específicas de los tejidos.
Regulación neuronal simpática de la inflamación crónica
Además de la activación de los nociceptores, las señales nerviosas simpáticas también contribuyen a los trastornos inflamatorios crónicos.
En la aterosclerosis, que es la patología subyacente del infarto de miocardio y el accidente cerebrovascular [49], los procesos inflamatorios son impulsados fuertemente por las células mieloides, incluidos los macrófagos y los neutrófilos [50,51]. Mediante la escisión química y quirúrgica de los nervios simpáticos TH+ combinada con ratones knock out de Adrb2−/−, se demostró que las señales simpáticas controlan rítmicamente el reclutamiento de células mieloides a la lesión aterosclerótica [39,52].
De hecho, el reclutamiento circadiano de células mieloides a las lesiones ateroscleróticas alcanza su punto máximo en la transición de la fase activa a la fase de reposo en ratones, lo que proporciona evidencia de la modulación circadiana en un proceso aterosclerótico clave [39] [52].
Además, la aparición de complicaciones cardiovasculares tiene un ritmo diurno sorprendente y ciclos acelerados de reclutamiento mieloide, donde la inervación simpática podría ser un factor contribuyente.
Mecanísticamente, el reclutamiento arterial circadiano está mediado por la oscilación de las moléculas de adhesión endotelial ICAM1 y VCAM1 [39].
En humanos, dos estudios longitudinales investigaron si el corazón de pacientes con enfermedad de Parkinson con sinucleinopatías experimentó una alteración fisiológica de la inervación simpática. En este estudio, se rastreó radiactivamente la dopamina como una lectura de la abundancia simpática.
En el primer estudio, la densidad del nervio simpático disminuyó correlativamente con la disminución de la dopamina radiomarcada en el ventrículo izquierdo de los pacientes [23].
En un segundo estudio, las reservas de dopamina radiomarcada en el miocardio de pacientes con riesgo de patologías relacionadas con la cognición fueron notablemente menores que en los controles sanos, lo que indica insuficiencia del nervio simpático [53].
Esta disminución de la dopamina se correlacionó con un diagnóstico posterior de enfermedad de cuerpos de Lewy. Sin embargo, el mecanismo exacto de este vínculo aún está por determinar; no obstante, estas investigaciones sugieren que la deficiencia simpática podría predecir ciertas patologías cognitivas humanas [53].
Dado que el SNS actúa como un integrador de señales a través del eje hipotálamo-hipófisis-suprarrenal (HPA) en el control homeostático de la fisiología de los mamíferos [54], las señales sistémicas aberrantes persistentes pueden reconfigurar los estados funcionales del tejido a través de una entrada simpática hiperactivada.
Por ejemplo, los voluntarios humanos estresados presentan recuentos sanguíneos más altos de neutrófilos Ly6GhighCD11bhighCD115low y monocitos CD11bhighCD115highLY6Chigh/lowLy6Glow que los individuos no estresados [55]. En el mismo estudio, los ratones WT fueron sometidos a estresores crónicos.
De manera similar a los humanos, el estrés sesgó la hematopoiesis de la médula ósea hacia la hiperproliferación y la movilización de GMP a través de la regulación negativa inducida por norepinefrina de la expresión de CXCL12 en la médula ósea [55].
De hecho, la glándula suprarrenal secreta glucocorticoides y catecolaminas como la noradrenalina en la circulación sistémica cuando el cuerpo se encuentra con estrés, lo que a su vez altera muchos procesos fisiológicos.
En los seres humanos, la ansiedad inducida por el estrés está vinculada a un aumento del gasto cardiovascular que depende de la excitación del nervio simpático [47].
Los voluntarios sin trastornos cardiometabólicos pero con ansiedad crónica mostraron una presión arterial media y sistólica elevada, que se correlacionó con un aumento de la actividad del nervio simpático [47]. Además, en un modelo de restricción, los ratones WT estresados perdieron rápidamente células B y T, así como monocitos Ly6Chi de la circulación, y regresaron a la médula ósea.
Además, en contraste con el retorno a la médula ósea de las otras células inmunes, el recuento de neutrófilos en sangre aumentó en la circulación y una retirada del factor estresante revirtió la neutrofilia [56].
Además, las neuronas productoras de glutamato anularon la neutrofilia inducida por el miedo durante el estrés de restricción. Esto es interesante ya que sugiere que múltiples circuitos regulan la neutrofilia en ratones estresados, y la naturaleza y el origen del factor estresante, es relevante en la respuesta inmune que sigue. Además, la inducción de estrés agudo resulta en un rápido agotamiento de células inmunes de la circulación, lo que lleva al reclutamiento de leucocitos en las placas ateroscleróticas de ratones Apoe−/− [57].
En relación con los controles, los ratones Apoe−/− estresados agudamente mostraron un mayor reclutamiento de neutrófilos y monocitos en las placas ateroscleróticas que fue mediado a través de la activación endotelial inducida por norepinefrina [57]; esto confirmó además la potencia de las catecolaminas sistémicas en el recableado de la vasculatura, promoviendo la inflamación, como se describió anteriormente [39,52].
La presencia persistente de factores estresantes se correlaciona con una carga elevada de leucocitos en las placas aterogénicas, a su vez alterando la estabilidad de la lesión, por lo que las células liberan metaloproteinasas de matriz en la placa [57].
Así, el estrés agudo desplaza los leucocitos hacia las lesiones ateroscleróticas y contribuye a su desestabilización. Por tanto, el grado de activación del SNS (ya sea de forma aguda o crónica) es relevante para determinar el estado inmunitario del ser humano o del ratón y, en consecuencia, la susceptibilidad a la inflamación.
En el contexto de las patologías cardiovasculares, el tono simpático hiperactivado crónico es muy perjudicial, como se ha comentado en los estudios.
Box de Conceptos 2
Ansiedad y estrés como reguladores de la inflamación
Las glándulas suprarrenales producen grandes cantidades de glucocorticoides y catecolaminas durante condiciones desfavorables para el cuerpo, con el objetivo de «amplificar» esencialmente todos los procesos metabólicos y fisiológicos y hacer frente a condiciones adversas.
La presión arterial elevada es un indicador universal de tales respuestas alteradas en caso de un factor estresante psicológico o físico (p. ej., una respuesta de «lucha o huida»).
Sin embargo, la presencia prolongada de factores estresantes sistémicos inicia una respuesta inflamatoria. Ante el estrés, las glándulas suprarrenales producen glucocorticoides que normalmente inhiben la inflamación [91].
Sin embargo, las concentraciones elevadas prolongadas de glucocorticoides pueden conducir a la resistencia a los glucocorticoides, mientras que las catecolaminas pueden conducir a la producción elevada de citocinas inflamatorias [92] y la salida de células sanguíneas y granulocitos de los tejidos a la circulación [20].
Estos mecanismos independientes también pueden conducir a un mayor número de células inmunes en circulación que se transportan a los tejidos [56,57].
La extravasación elevada de células inmunes en los tejidos durante el estrés provoca un desequilibrio en la homeostasis tisular y la inflamación.
En términos de integridad cardiovascular, la presión arterial prolongada es un potente factor de riesgo para el desarrollo de enfermedades cardiovasculares, y los neutrófilos desempeñan un papel clave en la mediación de la inflamación.
El metoprolol es un bloqueador adrenérgico que se ha empleado en muchos ensayos clínicos para inhibir la inflamación inducida por el sistema simpático en pacientes con aterosclerosis [93,94]. La capacidad de los neutrófilos para mediar el daño tisular local se ve particularmente atenuada con el tratamiento con metoprolol [86]. Sin embargo, es necesario comprender mejor las consecuencias no deseadas de la ingesta de betabloqueantes [95].
La reparación tisular y la antiinflamación están asociadas con la señalización neuronal somática
Aunque la reparación tisular y la antiinflamación no son mutuamente excluyentes, los eventos reguladores clave que gobiernan ambos procesos a menudo son distintos pero pueden superponerse en ciertos casos [58,59].
La señalización antiinflamatoria es esencial para reconfigurar el microambiente local después de la eliminación exitosa de una agresión inmunogénica, donde se activan los procesos de reparación para restaurar el tejido a un estado saludable [60,61]. El reclutamiento y la señalización de células inmunes para mediar estos procesos son realizados por nervios sensoriales que realizan funciones centinela en los sistemas orgánicos a través de señales estrictamente reguladas para polarizar las células inmunes en estados funcionales [62].
Las neuronas sensoriales median las respuestas antiinflamatorias
Además de la remodelación tisular, las neuronas sensoriales también median la antiinflamación. El pulmón en particular ofrece un profundo perfil de investigación para el papel de las neuronas sensoriales en la mediación de la antiinflamación; En comparación con la mayoría de los demás órganos cuyas fibras sensoriales derivan del ganglio de la raíz dorsal (DRG), las neuronas sensoriales del pulmón derivan principalmente del ganglio vago [63].
Además, existe una tendencia global creciente en la aparición de enfermedades respiratorias crónicas [64], lo que sugiere la necesidad de comprender mejor los mecanismos de la inflamación pulmonar [65].
En ratones WT, la ablación química de los nociceptores TRPV1+ seguida de una provocación con el alérgeno Alternaria alternata, causa inflamación pulmonar mediada por un mayor influjo de eosinófilos y células linfoides innatas tipo 2 (ILC2) en relación con los ratones de control tratados con vehículo [66]. Los nociceptores pulmonares TRPV1+ expresan CGRPβ, modulando la amplitud de la inflamación.
En consecuencia, la administración de CGRPβ 8–37, un antagonista de CGRP, empeora el resultado de la reacción alérgica al atenuar CGRP, lo que a su vez permite la expresión de citocinas tipo 2 por IL2C [66]. Además, las ILC2 pulmonares de ratones WT requieren CGRP para contrarrestar la inflamación de las vías respiratorias impulsada por la señalización de IL-33 [67] que es liberada por las células epiteliales durante la lesión pulmonar [68].
Dado que las ILC2 pueden reconocer CGRP a través de la expresión de RAMP1, la unión de CGRP restringe las funciones efectoras de inmunidad de tipo 2 de ILC2 durante la inflamación pulmonar inducida por IL-33 [67]. Mecanísticamente, la eliminación genética de Ramp1 (ratones Ramp1−/−) induce una expresión elevada de IL-5 e IL-13 en pulmones inflamados en comparación con los controles WT, lo que revela un papel protector de CGRP durante la inflamación de las vías respiratorias [67].
De manera similar, después de encontrarse con el helminto Nippostrongylus brasiliensis, las IL2C aumentan la expresión de la colina acetiltransferasa, lo que mejora la síntesis de acetilcolina [69]. Esto a su vez activa la expresión de IL-13 e IL-5, lo que facilita la erradicación robusta del helminto.
La inhibición genética y farmacológica de la colina acetiltransferasa (ratones Chattm1Jrs) altera la respuesta antiinflamatoria mediada por las ILC2 durante la infección por N. brasiliensis [69]. De manera similar, la eliminación condicional de la expresión de ACh (ratones transgénicos RoraCre+ChatLoxP) dificulta la síntesis de acetilcolina en las ILC2, lo que a su vez suprime su producción de IL-13, disminuyendo sus respuestas contra N. brasiliensis [70].
Además, durante la infección pulmonar por Klebsiella pneumoniae en ratones knock out de CGRP, se produjo un daño pulmonar grave en comparación con los ratones competentes para CGRP. El CGRP liberado de las neuronas sensoriales de las vías respiratorias en ratones competentes para CGRP fue endocitado por macrófagos alveolares, interrumpiendo la maduración del complejo inflamasoma NLRP3 y, en consecuencia, limitando la producción de IL-1β [71].
En resumen, los pulmones parecen depender en gran medida de la capacidad de los nociceptores residentes para contener la inflamación durante las agresiones de las vías respiratorias. Además, sin la función antiinflamatoria del CGRP en los pulmones infectados o dañados, las respuestas inmunitarias inflamatorias se exacerban notablemente.
Las neuronas sensoriales regulan la reparación tisular
La reparación tisular y la restauración de la homeostasis dependen de un cambio funcional eficaz de las células efectoras inmunitarias después de la terminación de la inflamación [72,73].
Estos efectores desvían el parénquima tisular y las células del estroma hacia la antiinflamación o la pro-reparación según el contexto tisular. En dos estudios murinos recientes, las neuronas nociceptoras modularon la salud del tejido intestinal.
En un ratón reportero Cre-tdTomato de nociceptores intestinales Nav1.8+ [Nav1.8-Cre-DTA; Rosa26-stop(flox)-tdTomato], la administración de DTX eliminó estas neuronas, lo que a su vez anuló la liberación de CGRP de los nociceptores.
Cabe destacar que las células caliciformes en el colon intestinal fueron activadas por CGRP para sintetizar y secretar moco para mantener la protección de barrera [74]. Mecanísticamente, la expresión de RAMP1 en las células caliciformes se unió al CGRP liberado de los nociceptores, lo que permitió la exocitosis de su contenido celular para mantener la formación de la barrera; a su vez, la pérdida genética de Ramp1 en las células epiteliales intestinales (ratones Ramp1Villin) y caliciformes (ratones Ramp1fl/fl) terminó la integridad de la barrera intestinal (p. ej., disminución de la producción y el espesor de moco en la homeostasis) [74].
En el contexto de la colitis inducida por dextrano sulfato de sodio (DSS) en ratones, la deficiencia de CGRP específica del intestino (ratones Calca−/−) anuló la producción de moco por las células caliciformes en comparación con los ratones WT, aumentando de forma destacada la susceptibilidad del colon a la hinchazón y elevando el daño fisiológico y estructural al intestino, lo que conduce a la pérdida de peso [74].
En otro estudio, la ablación de neuronas sensoriales Nav1.8+ (ratones Nav1.8cre/Rosa26DTA) afectó gravemente el proceso de reparación de lesiones cutáneas sometidas a heridas de biopsia por punción de espesor completo [75].
La respuesta de reparación alterada de los ratones a los que se les eliminó el nociceptor Nav1.8+ se relacionó con alteraciones en los fenotipos de neutrófilos y macrófagos, así como con su incapacidad para expresar la proteína matricelular, trombospondina-1, que es necesaria para la reparación y regeneración tisular [75,76].
Asimismo, los nociceptores TRPV1+ también exhiben funciones protectoras tisulares en el intestino del ratón [77]. Específicamente, la inhibición química de las neuronas sensoriales TRPV1+ causó un daño intestinal elevado en un modelo de ratón de enfermedad inflamatoria intestinal (EII) [78].
Para inducir la colitis, se trató a ratones Trpv1-Cre que expresaban receptores de diseño activados exclusivamente por fármacos de diseño (DREADD) con DSS, seguido de un tratamiento con N-óxido de clozapina para agotar los nociceptores TRPV1+ [79].
Después de la ablación, se produjo una grave disminución de las células caliciformes en el colon. Además, en relación con los ratones de control, se observó una pérdida de células caliciformes y un aumento de la afluencia de neutrófilos Ly6G+ en los ratones a los que se les eliminaron los nociceptores después de la colitis [78].
La eliminación de los nociceptores TRPV1+ agota la abundancia local de la sustancia P, que media la protección del tejido intestinal. Por lo tanto, la administración exógena de la sustancia P durante la colitis atenuó varios índices patológicos de esta afección/fenotipo en ratones, lo que indujo la reparación [78,80].
Regulación autónoma de la antiinflamación en eventos cardiovasculares
El infarto de miocardio (IM) es una patología mortal asociada con la aterosclerosis y la inestabilidad de la placa aterosclerótica. El IM suele comenzar con la formación de un coágulo sanguíneo dentro de una arteria coronaria.
El coágulo impide el flujo sanguíneo al músculo cardíaco, lo que finalmente conduce a la muerte celular [81,82]. El SNA contribuye a regular la función cardíaca durante los eventos de reperfusión isquémica y cada vez hay más evidencia que delinea algunos de los mecanismos neuroprotectores.
Por ejemplo, la activación farmacológica de α7nAChR con GTS21 disminuye el tamaño del infarto y la producción de especies reactivas de oxígeno (ROS) en la isquemia cardíaca de ratas en comparación con los corazones isquémicos tratados con vehículo [83].
Cabe destacar que los neutrófilos son los principales contribuyentes al estado y tamaño del infarto después del IM, que se distingue por un aumento en los recuentos de neutrófilos en el infarto. Además, su reclutamiento induce arritmia de los ventrículos cardíacos debido a su expresión de lipocalina-2, que es proarrítmica [84].
En particular, los receptores adrenérgicos β1 y β2 están implicados en patologías cardiovasculares humanas (revisados en [85]).
La interferencia farmacológica con estos receptores mostró que el metoprolol redujo el reclutamiento de neutrófilos en el corazón de ratón infartado en comparación con el tratamiento con vehículo [86].
La infiltración reducida de neutrófilos en el corazón lesionado evitó un daño extenso a la vasculatura general y disminuyó el tamaño del infarto, en relación con los controles.
Mecanísticamente, el metoprolol redujo la capacidad migratoria de los neutrófilos que requerían la señalización de los receptores adrenérgicos β2.
Además, la administración de metoprolol disminuyó su capacidad para formar agregados con plaquetas al inhibir su capacidad de anclaje mediada por P-selectina [86].
Existen varios estudios en humanos que investigan cómo los polimorfismos de los receptores adrenérgicos predisponen a los seres humanos a los riesgos de infarto de miocardio [87,88].
Por lo tanto, comprender los mecanismos moleculares que subyacen a las contribuciones de las diferentes subclases de receptores adrenérgicos a la modulación de los eventos cardiovasculares crónicos será útil para abordar el manejo de los trastornos relacionados con el corazón.
Observaciones finales
En los últimos años, los hallazgos innovadores sobre la interacción entre las neuronas y las células inmunitarias han mejorado la comprensión de que los sistemas nerviosos autónomo y sensorial son fundamentales para generar respuestas inmunitarias precisas y controladas durante las alteraciones fisiológicas de los tejidos.
Numerosos estudios apuntan a abordar la cuestión clave de cómo se pueden explotar las diferentes familias de receptores en las vías simpáticas (y parasimpáticas) para provocar respuestas inmunitarias protectoras, y no dañinas.
Tal vez el mayor desafío que enfrentan los investigadores sea mapear con éxito los receptores del SNA que son más relevantes en la mediación de cargas de salud crónicas como la aterosclerosis.
Además, es importante caracterizar con precisión las interacciones y vías neuroinmunes que existen entre las neuronas sensoriales y las células inmunitarias en la hematopoiesis, la inflamación y la reparación tisular.
Al definir mejor los detalles de las vías del SNA, podría ser posible reconfigurar los fenotipos de los leucocitos que propagan la inflamación en los tejidos y ralentizar o revertir la fisiopatología de ciertas enfermedades crónicas.
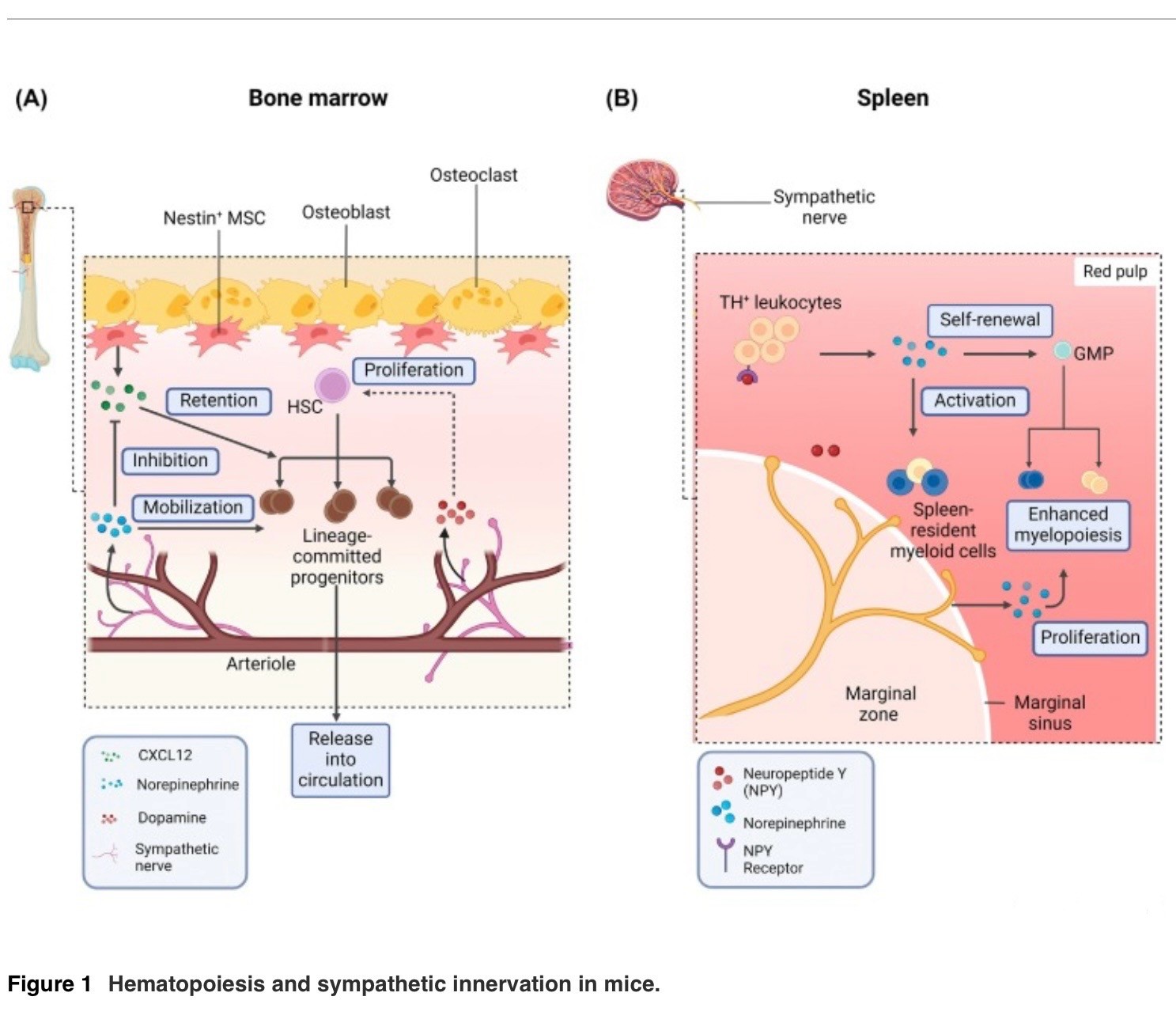
(A) La producción de sangre en la médula ósea (BM) es un proceso estrechamente regulado influenciado por factores celulares y acelulares. CXCL12, expresado por células madre mesenquimales Nestin+ (MSC) [19], es crucial para retener células madre hematopoiéticas (HSC) en la BM.
La liberación de noradrenalina por neuronas simpáticas causa la regulación negativa de CXCL12, lo que permite la movilización de células sanguíneas en la circulación [20]. La dopamina derivada de neuronas simpáticas liberada en la BM también ayuda a mantener la proliferación de células madre LSK (Lin− Sca-1+ c-Kit+), previniendo la pérdida de esas células [24].
(B) El bazo está abundantemente inervado por neuronas simpáticas TH+ (tirosina hidroxilasa-positivas) en humanos y ratones [25,26]. En entornos inflamatorios de bajo grado como la diabetes, las concentraciones de noradrenalina esplénica aumentan.
Esto, a su vez, conduce a la activación de las células mieloides residentes en el bazo, así como a una mayor proliferación de los progenitores de granulocitos y macrófagos (GMP) para la mielopoyesis. Los leucocitos TH+ en el bazo también producen catecolaminas, lo que amplifica la granulopoiesis esplénica [31]. Abreviatura: CXCL12, quimiocina 12 del motivo C-X-C.
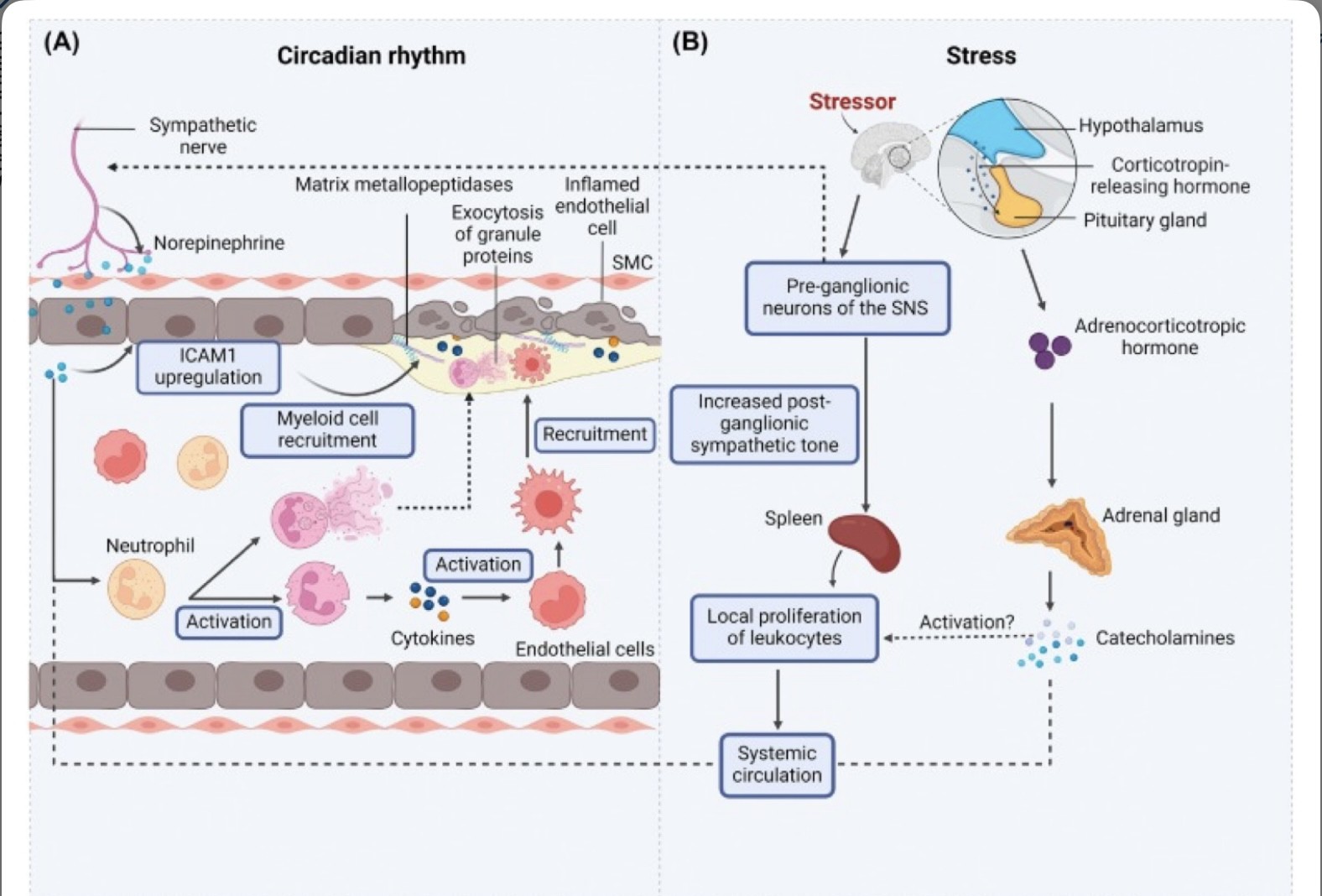
(A) El tono simpático regulado circadiano provoca la oscilación diurna de ICAM1 en las arterias, lo que facilita el reclutamiento de neutrófilos y macrófagos en las placas ateroscleróticas en ratones [39,52].
Los neuropéptidos simpáticos, como la noradrenalina, también son reconocidos a través de los receptores adrenérgicos expresados en los neutrófilos [86], lo que conduce a su activació Los neutrófilos polarizados secretan moléculas inflamatorias que activan a los monocitos, lo que amplifica la inflamación vascular.
Las células inmunes activadas reclutadas en las placas liberan quimiocinas y citocinas, así como proteínas que degradan la matriz extracelular en el microambiente de la placa, lo que exacerba la inflamación.
(B) La activación inducida por estrés del eje hipotálamo-hipófisis-suprarrenal conduce a concentraciones sistémicas elevadas de catecolaminas, lo que amplifica la inflamación sistémica.
El bazo promueve particularmente la mielopoyesis en condiciones estresantes [27], lo que a su vez conduce a la expansión de los leucocitos circulantes [89].
Las neuronas posganglionares del sistema nervioso simpático (SNS) también se activan crónicamente a partir del estrés crónico, lo que conduce a un cambio de los ajustes tónicos que mejoran la homeostasis a una activación persistente y, por lo tanto, a la inflamación. Abreviatura: SMC, célula del músculo liso.
References
1. Paul, F. …
Transcriptional heterogeneity and lineage commitment in myeloid progenitors
Cell. 2015; 163:1663-1677
Full Text (PDF)Scopus (692)PubMedGoogle Scholar
2. Nguyen, G.T. …
Neutrophils require SKAP2 for reactive oxygen species production following C-type lectin and Candida stimulation
iScience. 2021; 24, 102871
Full Text (PDF)Scopus (7)Google Scholar
3. Onyishi, C.U. …
Toll-like receptor 4 and macrophage scavenger receptor 1 crosstalk regulates phagocytosis of a fungal pathogen
Nat. Commun. 2023; 14:4895
Scopus (8)PubMedGoogle Scholar
4. Sender, R. …
The total mass, number, and distribution of immune cells in the human body
Proc. Natl. Acad. Sci. 2023; 120, e2308511120
5. Scheiermann, C. …
Adrenergic nerves govern circadian leukocyte recruitment to tissues
Immunity. 2012; 37:290-301
Full Text (PDF)Scopus (401)PubMedGoogle Scholar
6. Peiseler, M. ∙ Kubes, P.
More friend than foe: the emerging role of neutrophils in tissue repair
- Clin. Invest. 2019; 129:2629-2639
Scopus (209)PubMedGoogle Scholar
7. Nicholls, A.J. …
Activation of the sympathetic nervous system modulates neutrophil function
- Leukoc. Biol. 2018; 103:295-309
Scopus (50)PubMedGoogle Scholar
8. Murtazina, A. ∙ Adameyko, I.
The peripheral nervous system
Development. 2023; 150, dev201164
Scopus (3)PubMedGoogle Scholar
9. Biaggioni, I. …
Primer on the Autonomic Nervous System
Academic Press, 2023
10. Usoskin, D. …
Unbiased classification of sensory neuron types by large-scale single-cell RNA sequencing
Nat. Neurosci. 2015; 18:145-153
Scopus (1430)PubMedGoogle Scholar
11. Crawford, L.K. ∙ Caterina, M.J.
Functional anatomy of the sensory nervous system: updates from the neuroscience bench
Toxicol. Pathol. 2020; 48:174-189
Scopus (34)PubMedGoogle Scholar
12. Laurenti, E. ∙ Göttgens, B.
From haematopoietic stem cells to complex differentiation landscapes
Nature. 2018; 553:418-426
Scopus (489)PubMedGoogle Scholar
13. Calvanese, V. ∙ Mikkola, H.K.A.
The genesis of human hematopoietic stem cells
Blood. 2023; 142:519-532
Scopus (17)PubMedGoogle Scholar
14. Fujita, S. …
Quantitative analysis of sympathetic and nociceptive innervation across bone marrow regions in mice
Exp. Hematol. 2022; 112–113:44-59.e6
Full Text (PDF)Scopus (9)PubMedGoogle Scholar
15. Chhatar, S. ∙ Lal, G.
Role of adrenergic receptor signalling in neuroimmune communication
Curr. Res. Immunol. 2021; 2:202-217
Scopus (39)PubMedGoogle Scholar
16. Pinho, S. ∙ Frenette, P.S.
Haematopoietic stem cell activity and interactions with the niche
Nat. Rev. Mol. Cell Biol. 2019; 20:303-320
Scopus (589)PubMedGoogle Scholar
17. Méndez-Ferrer, S. …
Haematopoietic stem cell release is regulated by circadian oscillations
Nature. 2008; 452:442-447
Scopus (1038)PubMedGoogle Scholar
18. Fielding, C. …
Cholinergic signals preserve haematopoietic stem cell quiescence during regenerative haematopoiesis
Nat. Commun. 2022; 13:543
Scopus (28)PubMedGoogle Scholar
19. Maryanovich, M. …
Adrenergic nerve degeneration in bone marrow drives aging of the hematopoietic stem cell niche
Nat. Med. 2018; 24:782-791
Scopus (248)PubMedGoogle Scholar
20. Katayama, Y. …
Signals from the sympathetic nervous system regulate hematopoietic stem cell egress from bone marrow
Cell. 2006; 124:407-421
Full Text (PDF)Scopus (1115)PubMedGoogle Scholar
21. Zeng, W. …
Sympathetic neuro-adipose connections mediate leptin-driven lipolysis
Cell. 2015; 163:84-94
Full Text (PDF)Scopus (346)PubMedGoogle Scholar
22. Matt, S.M. ∙ Gaskill, P.J.
Where is dopamine and how do immune cells see it?: Dopamine-mediated immune cell function in health and disease
- NeuroImmune Pharmacol. 2020; 15:114-164
Scopus (159)PubMedGoogle Scholar
23. Lamotte, G. …
Long-term trends in myocardial sympathetic innervation and function in synucleinopathies
Parkinsonism Relat. Disord. 2019; 67:27-33
Full Text (PDF)Scopus (21)PubMedGoogle Scholar
24. Liu, Y. …
Dopamine signaling regulates hematopoietic stem and progenitor cell function
Blood. 2021; 138:2051-2065
Scopus (21)PubMedGoogle Scholar
25. Verlinden, T.J.M. …
Innervation of the human spleen: a complete hilum-embedding approach
Brain Behav. Immun. 2019; 77:92-100
Scopus (33)PubMedGoogle Scholar
26. Tanaka, S. …
Vagus nerve stimulation activates two distinct neuroimmune circuits converging in the spleen to protect mice from kidney injury
Proc. Natl. Acad. Sci. 2021; 118, e2021758118
27. Vasamsetti, S.B. …
Sympathetic neuronal activation triggers myeloid progenitor proliferation and differentiation
Immunity. 2018; 49:93-106.e7
Full Text (PDF)Scopus (82)PubMedGoogle Scholar
28. Nisimura, L.M. …
Tyrosine hydroxylase and β2-adrenergic receptor expression in leukocytes of spontaneously hypertensive rats: putative peripheral markers of central sympathetic activity
Braz. J. Med. Biol. Res. 2020; 53:e9615
Scopus (3)PubMedGoogle Scholar
29. Vida, G. …
α7-Cholinergic receptor mediates vagal induction of splenic norepinephrine
- Immunol. 2011; 186:4340-4346
Scopus (201)PubMedGoogle Scholar
30. Oda, A. …
Niche-induced extramedullary hematopoiesis in the spleen is regulated by the transcription factor Tlx1
Sci. Rep. 2018; 8:8308
Scopus (41)PubMedGoogle Scholar
31. Robbins, C.S. …
Extramedullary hematopoiesis generates ly-6Chigh monocytes that infiltrate atherosclerotic lesions
Circulation. 2012; 125:364-374
Scopus (383)PubMedGoogle Scholar
32. Cortez-Retamozo, V. …
Origins of tumor-associated macrophages and neutrophils
Proc. Natl. Acad. Sci. 2012; 109:2491-2496
Scopus (520)PubMedGoogle Scholar
33. Leuschner, F. …
Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis
- Exp. Med. 2012; 209:123-137
Scopus (405)PubMedGoogle Scholar
34. Schloss, M.J. …
B lymphocyte-derived acetylcholine limits steady-state and emergency hematopoiesis
Nat. Immunol. 2022; 23:605-618
Scopus (38)PubMedGoogle Scholar
35. Woolf, C.J. ∙ Ma, Q.
Nociceptors – noxious stimulus detectors
Neuron. 2007; 55:353-364
Full Text (PDF)Scopus (756)PubMedGoogle Scholar
36. Ruocco, I. …
Skin blood vessels are simultaneously innervated by sensory, sympathetic, and parasympathetic fibers
- Comp. Neurol. 2002; 448:323-336
Scopus (49)PubMedGoogle Scholar
37. Pinho-Ribeiro, F.A. …
Nociceptor sensory neuron–immune interactions in pain and inflammation
Trends Immunol. 2017; 38:5-19
Full Text (PDF)Scopus (636)PubMedGoogle Scholar
38. Laumet, G.
Peripheral somatosensory neurons listen and orchestrate the immune response
- Allergy Clin. Immunol. 2024; 153:977-979
Full Text (PDF)Scopus (2)PubMedGoogle Scholar
39. de Juan, A. …
Artery-associated sympathetic innervation drives rhythmic vascular inflammation of arteries and veins
Circulation. 2019; 140:1100-1114
Scopus (41)PubMedGoogle Scholar
40. Crosson, T. …
Profiling of how nociceptor neurons detect danger – new and old foes
- Intern. Med. 2019; 286:268-289
Scopus (19)PubMedGoogle Scholar
41. Filtjens, J. …
Nociceptive sensory neurons promote CD8 T cell responses to HSV-1 infection
Nat. Commun. 2021; 12:2936
Scopus (31)PubMedGoogle Scholar
42. Baral, P. …
Nociceptor sensory neurons suppress neutrophil and γδ T cell responses in bacterial lung infections and lethal pneumonia
Nat. Med. 2018; 24:417-426
Scopus (250)PubMedGoogle Scholar
43. Huang, C. …
TRPV1+ neurons alter Staphylococcus aureus skin infection outcomes by affecting macrophage polarization and neutrophil recruitment
BMC Immunol. 2023; 24:55
Scopus (2)PubMedGoogle Scholar
44. Pinho-Ribeiro, F.A. …
Blocking neuronal signaling to immune cells treats streptococcal invasive infection
Cell. 2018; 173:1083-1097.e22
Full Text (PDF)Scopus (275)PubMedGoogle Scholar
45. Pinho-Ribeiro, F.A. …
Bacteria hijack a meningeal neuroimmune axis to facilitate brain invasion
Nature. 2023; 615:472-481
Scopus (39)PubMedGoogle Scholar
46. Wu, M. …
Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity
Cell. 2024; 187:2935-2951.e19
Full Text (PDF)Scopus (3)PubMedGoogle Scholar
47. Bigalke, J.A. …
Blood pressure and muscle sympathetic nerve activity are associated with trait anxiety in humans
Am. J. Phys. Heart Circ. Phys. 2023; 324:H494-H503
48. Huang, S. …
Lymph nodes are innervated by a unique population of sensory neurons with immunomodulatory potential
Cell. 2021; 184:441-459.e25
Full Text (PDF)Scopus (101)PubMedGoogle Scholar
49. Soehnlein, O. ∙ Libby, P.
Targeting inflammation in atherosclerosis — from experimental insights to the clinic
Nat. Rev. Drug Discov. 2021; 20:589-610
Scopus (519)PubMedGoogle Scholar
50. Herrero-Cervera, A. …
Neutrophils in chronic inflammatory diseases
Cell. Mol. Immunol. 2022; 19:177-191
Scopus (221)PubMedGoogle Scholar
51. Döring, Y. …
Targeting immune cell recruitment in atherosclerosis
Nat. Rev. Cardiol. 2024; Published online April 25, 2024
https://doi.org/10.1038/s41569-024-01023-z
52. Pan, C. …
Time-Restricted feeding enhances early atherosclerosis in hypercholesterolemic mice
Circulation. 2023; 147:774-777
Scopus (12)PubMedGoogle Scholar
53. Goldstein, D.S. …
Cardiac noradrenergic deficiency revealed by 18F-dopamine positron emission tomography identifies preclinical central Lewy body diseases
- Clin. Invest. 2024; 134, e172460
54. Herman, J.P. …
Regulation of the hypothalamic-pituitary-adrenocortical stress response
Prakash, Y.S.
Comprehensive Physiology
Wiley, 2016; 603-621
55. Heidt, T. …
Chronic variable stress activates hematopoietic stem cells
Nat. Med. 2014; 20:754-758
Scopus (555)PubMedGoogle Scholar
56. Poller, W.C. …
Brain motor and fear circuits regulate leukocytes during acute stress
Nature. 2022; 607:578-584
Scopus (80)PubMedGoogle Scholar
57. Hinterdobler, J. …
Acute mental stress drives vascular inflammation and promotes plaque destabilization in mouse atherosclerosis
Eur. Heart J. 2021; 42:4077-4088
Scopus (65)PubMedGoogle Scholar
58. Wynn, T.A. ∙ Vannella, K.M.
Macrophages in tissue repair, regeneration, and fibrosis
Immunity. 2016; 44:450-462
Full Text (PDF)Scopus (2609)PubMedGoogle Scholar
59. Caballero-Sánchez, N. …
Regenerative inflammation: when immune cells help to re-build tissues
FEBS J. 2024; 291:1597-1614
Scopus (9)PubMedGoogle Scholar
60. Oliveira-Costa, K.M. …
Neutrophil accumulation within tissues: a damage x healing dichotomy
Biomed. Pharmacother. 2022; 145, 112422
61. Fischer, A. …
Neutrophils direct preexisting matrix to initiate repair in damaged tissues
Nat. Immunol. 2022; 23:518-531
Scopus (41)PubMedGoogle Scholar
62. Hoeffel, G. …
Sensory neuron-derived TAFA4 promotes macrophage tissue repair functions
Nature. 2021; 594:94-99
Scopus (77)PubMedGoogle Scholar
63. Su, Y. …
Identification of lung innervating sensory neurons and their target specificity
Am. J. Phys. Lung Cell. Mol. Phys. 2022; 322:L50-L63
64. Xie, M. …
Trends in prevalence and incidence of chronic respiratory diseases from 1990 to 2017
Respir. Res. 2020; 21:49
Scopus (124)PubMedGoogle Scholar
65. Agusti, A. …
Tackling the global burden of lung disease through prevention and early diagnosis
Lancet Respir. Med. 2022; 10:1013-1015
Full Text (PDF)Scopus (11)PubMedGoogle Scholar
66. Tamari, M. …
Sensory neurons promote immune homeostasis in the lung
Cell. 2024; 187:44-61.e17
Full Text (PDF)Scopus (7)PubMedGoogle Scholar
67. Wallrapp, A. …
Calcitonin gene-related peptide negatively regulates alarmin-driven type 2 innate lymphoid cell responses
Immunity. 2019; 51:709-723.e6
Full Text (PDF)Scopus (144)PubMedGoogle Scholar
68. Thio, C.L.-P. ∙ Chang, Y.-J.
The modulation of pulmonary group 2 innate lymphoid cell function in asthma: from inflammatory mediators to environmental and metabolic factors
Exp. Mol. Med. 2023; 55:1872-1884
Scopus (7)PubMedGoogle Scholar
69. Chu, C. …
The ChAT-acetylcholine pathway promotes group 2 innate lymphoid cell responses and anti-helminth immunity
Sci. Immunol. 2021; 6, eabe3218
70. Roberts, L.B. …
Acetylcholine production by group 2 innate lymphoid cells promotes mucosal immunity to helminths
Sci. Immunol. 2021; 6, eabd0359
71. Zhu, F. …
The neuropeptide CGRP enters the macrophage cytosol to suppress the NLRP3 inflammasome during pulmonary infection
Cell. Mol. Immunol. 2023; 20:264-276
Scopus (10)PubMedGoogle Scholar
72. Ortega-Gómez, A. …
Resolution of inflammation: an integrated view
EMBO Mol. Med. 2013; 5:661-674
Scopus (547)PubMedGoogle Scholar
73. Viola, J. ∙ Soehnlein, O.
Atherosclerosis – a matter of unresolved inflammation
Semin. Immunol. 2015; 27:184-193
Scopus (212)PubMedGoogle Scholar
74. Yang, D. …
Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection
Cell. 2022; 185:4190-4205.e25
Full Text (PDF)Scopus (60)PubMedGoogle Scholar
75. Lu, Y.-Z. …
CGRP sensory neurons promote tissue healing via neutrophils and macrophages
Nature. 2024; 628:604-611
Scopus (11)PubMedGoogle Scholar
76. Sweetwyne, M.T. ∙ Murphy-Ullrich, J.E.
Thrombospondin1 in tissue repair and fibrosis: TGF-β-dependent and independent mechanisms
Matrix Biol. 2012; 31:178-186
Scopus (178)PubMedGoogle Scholar
77. Perner, C. …
Substance P release by sensory neurons triggers dendritic cell migration and initiates the type-2 immune response to allergens
Immunity. 2020; 53:1063-1077.e7
Full Text (PDF)Scopus (137)PubMedGoogle Scholar
78. Zhang, W. …
Gut-innervating nociceptors regulate the intestinal microbiota to promote tissue protection
Cell. 2022; 185:4170-4189.e20
Full Text (PDF)Scopus (47)PubMedGoogle Scholar
79. Defaye, M. …
Gut-innervating TRPV1+ neurons drive chronic visceral pain via microglial P2Y12 receptor
Cell Mol. Gastroenterol. Hepatol. 2022; 13:977-999
Full Text (PDF)Scopus (20)PubMedGoogle Scholar
80. Suvas, S.
Role of substance P neuropeptide in inflammation, wound healing, and tissue homeostasis
- Immunol. 2017; 199:1543-1552
Scopus (234)PubMedGoogle Scholar
81. Palasubramaniam, J. …
Myocardial infarction – from atherosclerosis to thrombosis
Arterioscler. Thromb. Vasc. Biol. 2019; 39:e176-e185
Scopus (94)PubMedGoogle Scholar
82. Salari, N. …
The global prevalence of myocardial infarction: a systematic review and meta-analysis
BMC Cardiovasc. Disord. 2023; 23:206
Scopus (57)PubMedGoogle Scholar
83. Mavropoulos, S.A. …
Nicotinic acetylcholine receptor-mediated protection of the rat heart exposed to ischemia reperfusion
Mol. Med. 2017; 23:120-133
Scopus (34)PubMedGoogle Scholar
84. Grune, J. …
Neutrophils incite and macrophages avert electrical storm after myocardial infarction
Nat. Cardiovasc. Res. 2022; 1:649-664
Scopus (36)PubMedGoogle Scholar
85. Wang, Y. …
Sympathetic nervous system and atherosclerosis
Int. J. Mol. Sci. 2023; 24:13132
Scopus (3)PubMedGoogle Scholar
86. García-Prieto, J. …
Neutrophil stunning by metoprolol reduces infarct size
Nat. Commun. 2017; 8:14780
Scopus (155)PubMedGoogle Scholar
87. Matušková, L. ∙ Javorka, M.
Adrenergic receptors gene polymorphisms and autonomic nervous control of heart and vascular tone
Physiol. Res. 2021; 70:S495-S510
88. Lakkiss, B. ∙ Refaat, M.M.
β1 and α2C-adrenergic receptor polymorphisms are associated with lower incident ventricular fibrillation in patients with st-segment–elevation myocardial infarction
- Am. Heart Assoc. 2023; 12, e029102
Scopus (1)PubMedGoogle Scholar
89. Jiang, W. …
Spleen contributes to restraint stress induced changes in blood leukocytes distribution
Sci. Rep. 2017; 7:6501
Scopus (45)PubMedGoogle Scholar
90. Aoki, K. …
Identification of CXCL12-abundant reticular cells in human adult bone marrow
Br. J. Haematol. 2021; 193:659-668
Scopus (31)PubMedGoogle Scholar
91. Muzzi, C. …
The glucocorticoid receptor in intestinal epithelial cells alleviates colitis and associated colorectal cancer in mice
Cell Mol. Gastroenterol. Hepatol. 2021; 11:1505-1518
Full Text (PDF)Scopus (25)PubMedGoogle Scholar
92. Wilson, H.M. …
Characterization of the myocardial inflammatory response in acute stress-induced (Takotsubo) cardiomyopathy
JACC Basic Transl. Sci. 2018; 3:766-778
Scopus (89)PubMedGoogle Scholar
93. Clemente-Moragón, A. …
Metoprolol exerts a non-class effect against ischaemia–reperfusion injury by abrogating exacerbated inflammation
Eur. Heart J. 2020; 41:4425-4440
Scopus (68)PubMedGoogle Scholar
94. Dybro, A.M. …
Randomized trial of metoprolol in patients with obstructive hypertrophic cardiomyopathy
- Am. Coll. Cardiol. 2021; 78:2505-2517
Scopus (69)PubMedGoogle Scholar
95. Moore, C.L. …
Metoprolol impairs b1-adrenergic receptor-mediated vasodilation in rat_ cerebral arteries: implications for b-blocker therapy
- Pharmacol. Exp. Ther. 2021; 376:127-135