Ronald Palacios Castrillo. M.D. PhD.
Aspectos destacados
- B7-H4 contribuye a la tolerancia inmunitaria oncofetal
- La progesterona impulsa la expresión de B7-H4 a través del eje PR-P300-BRD4
- La expresión de B7-H4 está controlada por el potenciador de −58 kb
- El antagonista de PR o el degradador selectivo de BRD4 sensibiliza a los tumores B7-H4+ a la inmunoterapia
Resumen
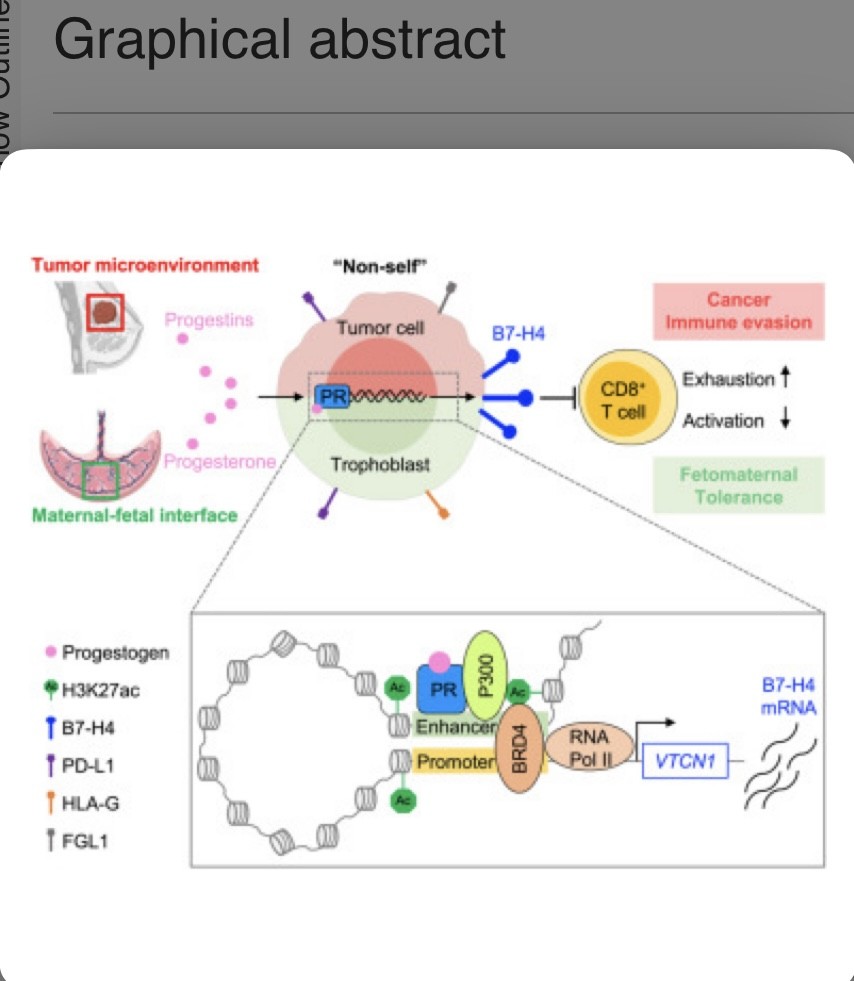
Los mecanismos de tolerancia inmunitaria son compartidos en el cáncer y el embarazo. A través del análisis cruzado de datos de secuenciación de ARN de células individuales de múltiples tipos de cáncer humano y la interfaz materno-fetal, Jiali Yu,et.al.,[Cell. Volume 187, Issue 17P4713-4732.E19August 22, 2024] descubrieron que B7-H4 (VTCN1) es un punto de control de tolerancia inmunitaria oncofetal.
Demostraron que la deficiencia genética de B7-H4 resultó en activación inmunitaria y reabsorción fetal en modelos de embarazo alogénico. Análogamente, B7-H4 contribuyó a la progresión del cáncer de mama inducida por MPA/DMBA, acompañada de agotamiento de células T CD8+.
=> Recibir por Whatsapp las noticias destacadas
El análisis de hormonas femeninas reveló que la progesterona estimulaba la expresión de B7-H4 en células de cáncer de mama y placenta. Mecanísticamente, el receptor de progesterona (PR) se unió a un potenciador de −58 kb recientemente identificado, mediando así la transcripción de B7-H4 a través del eje PR-P300-BRD4.
El antagonista de PR o el degradador de BRD4 potenció la inmunoterapia en un modelo murino de cáncer de mama B7-H4+. Por lo tanto, este trabajo desentraña una conexión mecanística y biológica de una hormona sexual femenina (progesterona) con la tolerancia inmunitaria oncofetal a través de B7-H4 y sugiere que el eje PR-P300-BRD4 es un objetivo para el tratamiento del cáncer B7-H4+.
En Detalle
El bloqueo de los puntos de control inmunitario (ICB) induce respuestas duraderas en diversos tipos de cáncer. Sin embargo, la mayoría de los pacientes con cáncer no responden a la inmunoterapia actual.
Los mecanismos de regulación inmunitaria clave fomentan redes supresoras en el microambiente tumoral (TME), lo que conduce a la evasión inmunitaria del cáncer y a la resistencia terapéutica al ICB.
Si bien la tolerancia inmunitaria hacia las células cancerosas genéticamente mutadas es perjudicial para el huésped, la tolerancia inmunitaria hacia las células normales de un feto semialogénico durante el embarazo es beneficiosa, lo que convierte al embarazo en un modelo fisiológico ideal para explorar los mecanismos de tolerancia inmunitaria.
Como la tolerancia inmunitaria es fundamental tanto para la progresión del cáncer durante la oncogénesis como para el desarrollo fetal durante el embarazo, no sorprende que varias vías inmunosupresoras compartidas, como PD-L1 (B7-H1, CD274),2,5,11 HLA-G,7,12,13 indolamina 2,3-dioxigenasa (IDO), y células T reguladoras (Tregs), se activen en el TME y la placenta.
En este trabajo, Jiali Yu,et.al.,’Cell. Volume 187, Issue 17P4713-4732.E19August 22, 2024] exploraron las moléculas y vías inmunorreguladoras compartidas por el TME y la placenta y descubrieron que B7-H4 (VTCN1) (también conocida como B7x, B7S1) es un posible punto de control de tolerancia inmunitaria oncofetal compartido. Se ha identificado a B7-H4 como un miembro inhibidor de la familia B7 y se cree que es una molécula de punto de control inmunitario en el contexto de la inmunidad tumoral.
La expresión elevada de B7-H4 a menudo se correlaciona con una supervivencia más corta del paciente con cáncer. Sin embargo, sigue siendo difícil determinar un papel inhibidor inmunitario de B7-H4 endógeno en células tumorales en el sistema inmunológico competente in vivo.
En el contexto del embarazo, se ha informado que B7-H4 se expresa en células del trofoblasto y macrófagos deciduales, y su expresión está asociada con complicaciones del embarazo. Sin embargo, sigue sin estar claro si B7-H4 desempeña un papel inmunológico activo en la tolerancia materno-fetal.
Además, se desconoce si las señales ambientales regulan la expresión de B7-H4 en células no inmunes, incluidas las células del trofoblasto en la placenta y las células tumorales en el TME, y de qué manera. En este trabajo, Jiali Yu,et.al.,[Cell. Volume 187, Issue 17P4713-4732.E19August 22, 2024] estudiaron el papel de la B7-H4 endógena en un modelo de cáncer de mama inducido y modelos de embarazo múltiple.
La comunicación cruzada entre el sistema inmunológico y otros sistemas, como el sistema nervioso y el endocrino, es crucial para generar respuestas inmunitarias adecuadas.
Estudios recientes sobre la intersección de los sistemas endocrino e inmunológico han arrojado luz sobre el papel de los andrógenos, una hormona sexual masculina, en la regulación de la función de las células T en los cánceres, incluido el cáncer de próstata.
Sin embargo, no se entiende bien si las hormonas sexuales femeninas alteran la inmunidad antitumoral mediada por células T en mujeres con cáncer y cómo lo hacen. Para llenar este vacío de conocimiento, los autores reportan el efecto de las hormonas femeninas en la expresión de B7-H4 en la placenta y el cáncer de mama y diseccionan los mecanismos moleculares subyacentes y la posible traducción.
La tolerancia inmunitaria actúa como un mecanismo clave para la progresión del cáncer y la resistencia a ICB y es fundamental para el desarrollo fetal exitoso durante el embarazo. Varias vías inmunosupresoras (como PD-L1, HLA-G, IDO y Tregs) se comparten en el TME y la placenta, dos ubicaciones anatómicamente diferentes. Jiali Yu,et.al.,[Cell. Volume 187, Issue 17P4713-4732.E19August 22, 2024] demostraron que B7-H4 es un punto de control de tolerancia inmunitaria oncofetal previamente no apreciado, que contribuye tanto a la evasión inmunitaria del cáncer como a la tolerancia inmunitaria materno-fetal.
Curiosamente, la señal de progesterona impulsa la expresión de B7-H4 para apoyar la supresión inmunitaria local en el TME y en la interfaz materno-fetal.
Esta regulación microambiental de B7-H4 da como resultado una compartimentación inmunitaria, lo que garantiza que el TME y la placenta sean sitios inmunoprivilegiados durante la progresión del cáncer y el embarazo. Además, esta regulación molecular es parte de una red inmunosupresora celular, que consta de componentes celulares clave en el TME y en la interfaz materno-fetal.
Al igual que el TME, las células T, las células NK, las células dendríticas y los macrófagos participan en el establecimiento de la tolerancia materno-fetal.
Las células del trofoblasto, incluidas las VCT, las EVT y las SCT, son los principales tipos de células de origen fetal ubicadas en la interfaz materno-fetal. Las células del trofoblasto contribuyen de manera crítica a la tolerancia inmunológica del feto. Además del patrón único de expresión de HLA, las células del trofoblasto expresan moléculas inmunoinhibitorias, como B7-H4 (este trabajo), HLA-G y PD-L1.
Se encontró que B7-H4 se expresa en EVT humanos que están expuestos al sistema inmunológico materno. También encontraron que las células T CD8+ están en estrecho contacto con EVT B7-H4+ en los sitios de anclaje de las vellosidades y el frente invasivo de EVT en la decidua con implantación.
En particular, aunque la placenta murina y humana son estructuralmente diferentes y están compuestas de diferentes subconjuntos de células del trofoblasto, las TGC de ratón, que se parecen a las EVT humanas, también expresan B7-H4. En consonancia con informes anteriores, se encuentran células T CD8+ limitadas en el área placentaria y decidual de ratón normal.
Curiosamente, la deficiencia de B7-H4 conduce a una mayor reabsorción fetal y a un aumento de la infiltración de células T CD8+ en el área placentaria y decidual de los fetos reabsorbidos.
En consonancia con esto, hemos detectado un aumento de quimiocinas que atraen células T, como CXCL9 y CXCL10, y un aumento de IFN-γ y TNF-α, que pueden inducir la expresión de quimiocinas en las células del estroma decidual y miometrial, como se informó anteriormente.
Estos datos sugieren la posibilidad de que B7-H4 sea una molécula «tolerogénica» y la posible participación de las células T CD8+ en la tolerancia mediada por B7-H4, añadiendo una capa adicional de compartimentación inmunitaria a niveles celulares, para salvaguardar al feto tanto en humanos como en ratones.
Se justifican más estudios para investigar los resultados funcionales de las interacciones entre las EVT B7-H4+ y las células inmunitarias maternas.
En particular, el sistema de cultivo de organoides del trofoblasto humano se ha empleado para investigar el impacto de las citocinas derivadas de las células inmunes en la diferenciación de las células del trofoblasto.
El uso de este sistema para simular directamente la comunicación inmunobiológica entre las células del trofoblasto y los subconjuntos específicos de células inmunes maternas (como las células T CD8+) de la misma placenta plantea desafíos tanto técnicos como éticos debido a la inaccesibilidad de muestras frescas de la interfaz materno-fetal en las primeras etapas de la gestación humana.
No obstante, la exploración de moléculas reguladoras inmunes en diferentes células compartidas por la EMT y la interfaz materno-fetal no solo proporciona información sobre cómo funcionan las diferentes vías inhibidoras inmunes en la EMT, sino que también proporciona la justificación para la terapia de combinación inmune.
La comunicación cruzada entre el sistema inmunológico y otros sistemas, incluido el sistema endocrino, modula las respuestas inmunitarias en la inmunidad infecciosa, la autoinmunidad y la inmunidad tumoral.36,37,38,39,40.
Estudios recientes que examinan la intersección de los sistemas endocrino e inmunológico han arrojado luz sobre el papel del andrógeno, una hormona sexual masculina, en la regulación del agotamiento de las células T en el TME.41,42,43.
En esta línea, demostramos que la progesterona, una hormona sexual femenina, amortigua la inmunidad de las células T tanto al cáncer como al feto a través de la inducción de la expresión de B7-H4. Parece que la señalización de la progesterona promueve la expresión de B7-H4, lo que contribuye al agotamiento de las células T y la progresión del cáncer.
Por lo tanto, llenamos un importante vacío de conocimiento sobre si una hormona sexual femenina afecta la función de las células T en el contexto de las respuestas inmunitarias tumorales y reproductivas y de qué manera.
Los niveles bajos de progesterona sérica se asocian con un alto riesgo de pérdida del embarazo y la suplementación de progesterona puede mejorar el resultado del embarazo en pacientes con antecedentes de pérdida recurrente del embarazo.91,92,93 Nuestro trabajo proporciona un posible mecanismo inmunológico subyacente a estas observaciones experimentales y clínicas.
Por lo tanto, la señalización de progesterona controla la expresión de B7-H4 y desempeña un papel inmunológico en la progresión del cáncer de mama y el embarazo.
B7-H4 actúa como un regulador negativo de las respuestas inmunes mediadas por células T.20,21,22 La sobreexpresión de B7-H4 en tumores a menudo se asocia con un mal pronóstico y una disminución de la supervivencia del paciente.23,24,25,26,27,28,29.
Su expresión en células presentadoras de antígenos puede mediar la inmunosupresión y puede ser regulada por los factores microambientales del tumor.23
Sin embargo, no se ha identificado el receptor o receptores funcionales de B7-H4. Antes de nuestro trabajo actual, se desconocía si las señales ambientales, como la progesterona, regulan la expresión de B7-H4 en células no inmunes, incluidas las células tumorales, y de qué manera.
Nuestras observaciones sugieren que la expresión de B7-H4 puede ser regulada por diferentes factores en diferentes tipos de células en el TME. Además, dada la falta de comprensión de la regulación de B7-H4 tumoral, no había un sistema bien establecido para estudiar un papel inmunoinhibitorio de B7-H4 autólogo en el tumor en el modelo inmunocompetente in vivo.
Estas deficiencias impiden el desarrollo clínico de agentes que se dirijan directamente a B7-H4 y su vía relacionada. Por lo tanto, puede que no sea sorprendente que los ensayos clínicos que utilizan anticuerpos monoclonales potenciales contra B7-H4 no hayan producido un efecto antitumoral impactante.94
Una estrategia de traducción alternativa es utilizar B7-H4 como un marcador molecular para el sistema de administración para dirigirse a las células tumorales B7-H4+.95,96 Nuestro estudio ha identificado un elemento cis-regulador, el potenciador de −58 kb, y ha desentrañado elementos trans-reguladores relacionados, que controlan la transcripción de B7-H4 a través del eje PR-P300-BRD4.
El antagonista de PR y los inhibidores de BRD4 se buscan clínicamente en diferentes indicaciones de la enfermedad.68,97 Como prueba de principio, demostramos que el antagonista de PR RU486 y el degradador de BRD4 BD-913682 pueden reducir la expresión de B7-H4 en cánceres de mama in vivo y sensibilizar la respuesta tumoral a ICB en un modelo preclínico.
Por lo tanto, aunque no será específico de B7-H4, la focalización del eje PR-P300-BRD4, incluida la reutilización de antagonistas de PR e inhibidores de BRD4, puede ser una estrategia razonable para tratar los cánceres B7-H4+, especialmente el cáncer de mama y varios tipos de cánceres ginecológicos.
En resumen, demostramos que B7-H4 actúa como un mecanismo de tolerancia inmunitaria previamente no apreciado compartido por el cáncer y el embarazo y está regulado por el eje PR-P300-BRD4 a través de un potenciador de −58 kb recientemente identificado.
Por lo tanto, la regulación y la inmunosupresión de B7-H4 mediadas por señales hormonales agregan un componente previamente desconocido al ecosistema oncofetal recientemente propuesto.98,99
Nuestros hallazgos generan conocimiento sobre cómo los sistemas endocrino e inmunológico apoyan cooperativamente la tolerancia inmunitaria fisiológica y patológica. Sugerimos que la focalización del eje PR-P300-BRD4 es una modalidad potencial para tratar a pacientes con cánceres B7-H4+.