Puntos claves
La isquemia cerebral aguda conduce a una memoria inmune innata persistente
La memoria inmune innata causa disfunción cardíaca crónica después de un accidente cerebrovascular
IL-1β induce inmunidad entrenada después de un accidente cerebrovascular a través de modificaciones epigenéticas
El bloqueo de IL-1β o del reclutamiento de monocitos previene la disfunción cardíaca
=> Recibir por Whatsapp las noticias destacadas
Resumen
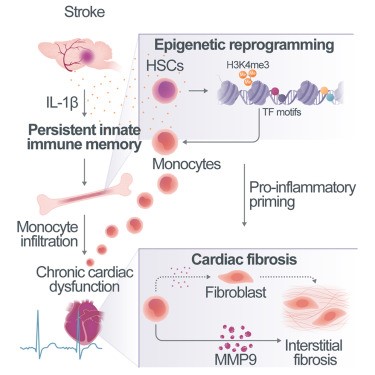
La carga médica del accidente cerebrovascular se extiende más allá de la propia lesión cerebral y está determinada en gran medida por las comorbilidades crónicas que se desarrollan de forma secundaria. Una hipótesis postula que estas comorbilidades podrían compartir una causa inmunológica común, pero los efectos crónicos posteriores al accidente cerebrovascular sobre la inmunidad sistémica están poco explorados., Simats, et.al., (Cell.DOI:https://doi.org/10.1016/j.cell.2024.06.028) identificaron la memoria inmune innata mieloide como una causa de disfunción de órganos remotos después de un accidente cerebrovascular. La secuenciación unicelular reveló cambios proinflamatorios persistentes en monocitos/macrófagos en múltiples órganos hasta 3 meses después de la lesión cerebral, especialmente en el corazón, lo que provocó fibrosis y disfunción cardíaca tanto en ratones como en pacientes con accidente cerebrovascular. La IL-1β se identificó como un factor clave de los cambios epigenéticos en la memoria inmune innata. Estos cambios podrían trasplantarse a ratones ingenuos, induciendo disfunción cardíaca. Al neutralizar la IL-1β post-ictus o bloquear el tráfico de monocitos proinflamatorios con un inhibidor de CCR2/5,se previno la disfunción cardíaca post-ictus. Estas terapias inmunodirigidas podrían potencialmente prevenir diversas comorbilidades mediadas por IL-1β, ofreciendo un marco para la inmunoterapia de prevención secundaria.
En Detalle
Se ha demostrado previamente que las lesiones cerebrales agudas inducen una respuesta inflamatoria sistémica estéril. La respuesta inflamatoria a una lesión estéril se inicia rápidamente mediante la liberación de alarminas inmunogénicas, como proteínas nucleares o DNA de células necróticas a la circulación sanguínea. Se caracteriza además por un aumento en los niveles de citoquinas en sangre, la movilización de células inmunes y cambios profundos en la composición y función de las células inmunes. A diferencia de la respuesta inflamatoria aguda que se produce en cuestión de horas o unos pocos días, los efectos crónicos de la lesión cerebral sobre la inmunidad sistémica se desconocen en gran medida. Pocos estudios que investigan principalmente biomarcadores sanguíneos han sugerido cambios crónicos en las concentraciones de citocinas circulantes y otros marcadores inflamatorios, como la interleucina (IL) -6, IL-1, proteína C reactiva (PCR), interferón (IFN) -γ y HMGB1. Sin embargo, aún falta un análisis detallado del compartimento inmunológico sistémico crónicamente comprometido después de una lesión cerebral, y los mecanismos subyacentes se desconocen en gran medida.
Las lesiones cerebrales agudas debidas a accidentes cerebrovasculares isquémicos son una de las principales causas de mortalidad y discapacidad a largo plazo en adultos. Además de la mortalidad y morbilidad tempranas debidas a la lesión cerebral isquémica en sí, la morbilidad a largo plazo después de un accidente cerebrovascular también se debe a la alta prevalencia de comorbilidades y complicaciones secundarias, como deterioro cognitivo y demencia, depresión posterior a un accidente cerebrovascular, eventos cardíacos, enfermedad vascular persistente. inflamación y alteraciones metabólicas inducidas por un accidente cerebrovascular. Sin embargo, la causa exacta de este mayor riesgo de comorbilidades secundarias a largo plazo después de un accidente cerebrovascular sigue siendo difícil de alcanzar.
Estudios recientes han demostrado cambios a largo plazo en la función de las células inmunes innatas después de infecciones bacterianas o vacunas. Este fenómeno se ha denominado memoria inmune innata o “inmunidad innata entrenada” en contraste con las adaptaciones específicas de antígenos en los linfocitos de larga vida (células T y B). Se ha demostrado en estudios de infección de prueba de concepto que la memoria inmune innata altera la capacidad de respuesta a los patógenos después de una reinfección. Esto representa un mecanismo evolutivo beneficioso para la eliminación de patógenos infecciosos, pero también puede resultar en funciones potencialmente patológicas durante el envejecimiento y autoinmunidad debido a una inflamación aberrante. Sin embargo, apenas se dispone de información sobre los mecanismos y las consecuencias de la inmunidad entrenada después de lesiones de tejidos estériles. Se han informado cambios epigenéticos en las células mieloides en modelos de trasplante de órganos, artritis experimental y en pacientes con lupus eritematoso sistémico. De manera similar, las alteraciones en la hematopoiesis y la preparación de monocitos proinflamatorios se han asociado con enfermedades cardiovasculares, particularmente aterosclerosis y comorbilidades asociadas. Simats y colegas postulan la hipótesis que las lesiones de tejidos estériles, como el accidente cerebrovascular, podrían provocar una memoria inmune innata a largo plazo similar y que estas consecuencias inmunológicas a largo plazo después del accidente cerebrovascular podrían generar comorbilidades secundarias.
La inflamación sistémica después de un accidente cerebrovascular se ha identificado como un factor crítico que afecta el pronóstico a corto y largo plazo de los pacientes con accidente cerebrovascular. Curiosamente, muchas de las condiciones de salud preexistentes o adquiridas que surgen después de un accidente cerebrovascular comparten mecanismos inflamatorios comunes. Estos mecanismos pueden potencialmente exacerbar el desarrollo de otras complicaciones médicas, lo que empeora el resultado a largo plazo. En consecuencia, abordar la inflamación sistémica se ha convertido en un foco de investigación traslacional, y ya se han realizado ensayos clínicos iniciales para minimizar las discapacidades funcionales en los pacientes y prevenir complicaciones secundarias.
Simats y colegas describen que el accidente cerebrovascular desencadena una inflamación persistente en múltiples órganos al inducir la memoria inmune innata. Específicamente, descubrieron que los cambios epigenéticos mediados por IL-1β en el compartimento mieloide desempeñan un papel en la fibrosis cardíaca, lo que conduce a una disfunción diastólica después de una lesión cerebral isquémica.
Las enfermedades cardiovasculares, como la fibrilación auricular, las valvulopatías y la insuficiencia cardíaca congestiva, son factores de riesgo bien conocidos de accidente cerebrovascular isquémico. Sin embargo, esta relación es bidireccional, ya que la incidencia de trastornos cardiovasculares también aumenta después de un accidente cerebrovascular inicial. Tras un accidente cerebrovascular, más del 60 % de los pacientes experimentan anomalías electrocardiográficas (ECG), al 25 % se les diagnostican arritmias graves y aproximadamente el 19 % desarrolla al menos un evento adverso cardíaco significativo. Curiosamente, un informe anterior demostró un papel causal de los monocitos en el desarrollo de arritmias auriculares. Estudios anteriores en ratones han demostrado que el accidente cerebrovascular provoca una disfunción sistólica crónica que dura hasta 8 semanas después de la lesión cerebral, lo que provoca una reducción retardada de la fracción de eyección del ventrículo izquierdo y un aumento del volumen del ventrículo izquierdo. El estudio SICFAIL, un estudio clínico prospectivo en el que participaron 696 pacientes con accidente cerebrovascular demostró una incidencia sorprendentemente alta de disfunción cardíaca después del accidente cerebrovascular. Se encontró que la disfunción diastólica era el tipo más prevalente de disfunción cardíaca y afectaba al 23% de los pacientes sin signos de disfunción sistólica. Este estudio destaca claramente la carga de disfunción cardíaca secundaria después de un accidente cerebrovascular isquémico. Aunque la disfunción diastólica es muy prevalente, no se evalúa de forma rutinaria en pacientes con accidente cerebrovascular y no se comprende bien su relevancia clínica en pacientes con accidente cerebrovascular isquémico agudo. En el trabajo de Simats y colegas, investigaron un pequeño subgrupo de la cohorte SICFAIL,y observaron que, en principio, la disfunción diastólica progresiva también puede ocurrir en pacientes con accidente cerebrovascular, de manera similar a nuestro modelo experimental de accidente cerebrovascular. De manera similar, demostraron en una cohorte de muestras de autopsias el desarrollo de fibrosis cardíaca después de un accidente cerebrovascular.
Se sabe que los pacientes con enfermedades inflamatorias sistémicas crónicas, como artritis reumatoide, psoriasis o artritis psoriásica, tienen un mayor riesgo de enfermedad cardiovascular. Por ejemplo, un estudio de cohorte poblacional reciente describió una mayor incidencia de enfermedades cardiovasculares en pacientes con enfermedad inflamatoria intestinal incluso en ausencia de factores de riesgo comunes como obesidad, alteraciones de los lípidos o hipertensión, lo que sugiere que la inflamación puede ser un factor clave subyacente a la enfermedad. desarrollo de estas complicaciones cardiovasculares. Por lo tanto, es razonable considerar que la respuesta inflamatoria sistémica desencadenada por la propia lesión cerebral isquémica puede predisponer aún más a los pacientes con accidente cerebrovascular a eventos vasculares secundarios (inflamatorios).
Simats y colegas, demostraron que los cambios proinflamatorios persistentes en las células mieloides después de un accidente cerebrovascular son un factor causal para el desarrollo de fibrosis cardíaca independientemente de otros factores predisponentes a los trastornos cardiovasculares. La memoria inmune innata, definida como cambios a largo plazo en el compartimento de las células inmunes innatas que alteran su capacidad de respuesta a una segunda estimulación, se ha descrito hasta ahora en modelos de infección y en vacunación, pero hasta ahora no se ha reconocido como un mecanismo patogénico después de lesiones esrériles del tejido, incluido el accidente cerebrovascular. Es importante destacar que la inmunidad innata (entrenada) a un patógeno no solo aumenta la capacidad de respuesta inmune innata al mismo patógeno, sino que también se demostró que afecta procesos inflamatorios no relacionados, como, por ejemplo, el efecto modificador de la enfermedad de la periodontitis para la progresión de la aterosclerosis. En este estudio, Simats y colaboradores encontraron la memoria inmune innata en respuesta a una lesión de tejido estéril, que vincula este evento agudo con el desarrollo de una patología secundaria crónica en un sitio de órgano remoto.
El estudio destaca los cambios epigenéticos mediados por IL-1β y el reclutamiento de células reprogramadas en el corazón sano como eventos críticos en el desarrollo de disfunción orgánica secundaria crónica después de un accidente cerebrovascular. En particular, los cambios epigenéticos inducidos por el aumento agudo de IL-1β después de un accidente cerebrovascular son comparables a las modificaciones epigenéticas observadas en estudios previos que utilizan modelos de infección. Según sus hallazgos, suprimir la IL-1β sistémicamente puede prevenir potencialmente los cambios epigenéticos posteriores a un accidente cerebrovascular y los efectos proinflamatorios resultantes sobre la homeostasis de órganos remotos. Esto concuerda bien con investigaciones anteriores que demuestran los beneficios cardiovasculares observados en el ensayo CANTOS utilizando la terapia anti-IL-1β. Sin embargo, el ensayo también reveló riesgos significativos de mayores tasas de infección asociados con este enfoque no específico que se dirige a una citoquina proinflamatoria clave involucrada en la eliminación de patógenos. Esta limitación plantea un desafío para el desarrollo futuro de este enfoque en la investigación traslacional.
Por lo tanto, en su estudio, exploraron una estrategia alternativa para limitar el reclutamiento de monocitos de la MO y la circulación a órganos remotos mediante el uso de un inhibidor de quimiocina dual dirigido a CCR2/5 (CVC). En particular, los estudios genéticos han proporcionado evidencia de la participación de la señalización CCL2-CCR2 en diversos trastornos cardiovasculares, lo que sugiere que apuntar a esta vía de señalización podría tener efectos beneficiosos sobre el reclutamiento de monocitos. Además, el CVC ha demostrado seguridad y eficacia en otras afecciones, incluido el VIH y la hepatosteatosis.
En conclusión, el estudio de Simats y colegas proporciona información mecanística sobre las comorbilidades secundarias inmunomediadas después de un accidente cerebrovascular, como la disfunción cardíaca y potencialmente otras. Han identificado la memoria inmune innata como un mecanismo causal que subyace a los cambios crónicos en las células inmunes innatas residentes en múltiples órganos, que contribuyen al desarrollo o progresión de la disfunción orgánica secundaria(ver figura). Estos descubrimientos ofrecen una justificación terapéutica para la prevención secundaria de las comorbilidades posteriores al accidente cerebrovascular.