Ronald Palacios Castrillo
Aspectos destacados
- Se describen los programas transcripcionales de “resistencia” e “inflamación sistémica”
- La sepsis se caracteriza por un bajo equilibrio entre “resistencia e inflamación sistémica”
- Este marco permite estratificar a los pacientes con sepsis para el pronóstico y el tratamiento
Resumen
Los pacientes con sepsis difieren en sus presentaciones clínicas y en la desregulación inmunitaria en respuesta a la infección, pero los procesos fundamentales que determinan esta heterogeneidad siguen siendo difíciles de entender.
=> Recibir por Whatsapp las noticias destacadas
En este artículo, el objetivo de Brandes-Leibovitz,et.al., [Cell Reports Medicine, 5, número 11,2024] es comprender qué tipos de desregulación inmunitaria caracterizan a los pacientes con sepsis.
Para ello, investigaron la patogénesis de la sepsis en el contexto de dos estados transcripcionales: uno representa la respuesta inmunitaria para eliminar patógenos (resistencia, R) y el otro está asociado con la inflamación sistémica (SI).
Observan que los pacientes con sepsis comparten una huella molecular de un bajo equilibrio R-SI, es decir, un R bajo en relación con el nivel de SI.
Las diferencias entre los pacientes con sepsis se explican por la amplia diversidad de estados de R y SI que caen bajo esta huella, como pacientes con SI alta, pacientes con R bajo o ambos. Muestran cómo este marco R/SI se puede utilizar para guiar la estratificación de los pacientes que es relevante para el pronóstico y el tratamiento de la enfermedad, superando las clasificaciones existentes de sepsis.
En Detalle
La sepsis es una afección patológica que resulta de respuestas inmunitarias desreguladas en pacientes con infecciones, lo que conduce a una sintomatología grave, disfunción orgánica y, a menudo, la muerte.
La sepsis es una de las causas más importantes de morbilidad y mortalidad tanto en países desarrollados como en desarrollo, con un estimado de 49 millones de casos y 11 millones de muertes a nivel mundial cada año. Los antibióticos y las unidades de cuidados intensivos han reducido significativamente la mortalidad por sepsis durante el siglo XX, pero el pronóstico de la sepsis se mantuvo en gran medida estable en las últimas dos décadas.
Se ha planteado la hipótesis de que la inmunoterapia será la próxima revolución en el tratamiento de la sepsis, pero esto nunca se ha materializado a pesar de una gran cantidad de ensayos clínicos con inmunoterapias antiinflamatorias que no han logrado mejorar el pronóstico de los pacientes.
Se cree que la heterogeneidad de la sepsis a nivel de microorganismo causal, fuente de infección y especialmente el tipo de desregulación inmunitaria ha llevado al fracaso de los ensayos de inmunoterapia para la sepsis.
De hecho, algunos pacientes con sepsis muestran características hiperinflamatorias (el llamado síndrome similar a la hiper-activación de macrófagos, MALS), otros pacientes muestran una interrupción de funciones inmunitarias críticas (inmunosupresión), y en algunos pacientes críticos con sepsis, estos dos tipos de desregulación inmunitaria pueden ocurrir al mismo tiempo o cambiar en el tiempo dependiendo de la fase de la enfermedad. Comprender la heterogeneidad de la desregulación inmunitaria en la sepsis es necesario para el desarrollo de mejores enfoques terapéuticos.
Estudios recientes han caracterizado los subtipos de sepsis basándose en transcriptomas de sangre completa, basándose principalmente en análisis sistemáticos dentro de pacientes con sepsis.
Sin embargo, existen varios desafíos para la identificación de subtipos inmunes en la sepsis. Primero, hay poca reproducibilidad (superposición) de subtipos en diferentes estudios de sepsis, lo que limita la capacidad de identificar objetivos compartidos para la inmunomodulación.
En segundo lugar, hay una falta de consistencia entre los conjuntos de datos actuales (p. ej., los conjuntos de datos difieren en cómo se define la sepsis, el tipo de infección y el grupo de edad) y es un desafío integrarlos.
En consecuencia, la mayoría de los estudios no integran información de múltiples cohortes. Por último, las diferencias entre la sepsis y las infecciones sin sepsis no suelen aprovecharse en el análisis de la sepsis, y los conjuntos de datos actuales se limitan a pequeñas cohortes y a un tipo particular de infección.
Dados estos desafíos, aún queda mucho por saber sobre la desregulación inmunitaria en pacientes con sepsis. En primer lugar, no se describe en detalle qué tipos de desregulación inmunitaria caracterizan a los pacientes con sepsis. En segundo lugar, no está claro cómo identificar los diferentes tipos de desregulación inmunitaria. Por último, muchas de las vías fisiopatológicas clave que pueden ser abordadas inmunoterapéuticamente en la sepsis siguen siendo desconocidas.
Para abordar estos objetivos, Brandes-Leibovitz,et.al., [Cell Reports Medicine, 5, número 11,2024] construyeron un modelo de desregulación inmunitaria en la sepsis combinando transcriptomas de diferentes cohortes de sepsis en combinación con varias cohortes de infecciones sin sepsis (denominadas «infecciones moderadas»).
Este enfoque fue diseñado para mejorar la reproducibilidad y permitir la identificación de desregulaciones específicas de la sepsis. Para integrar estos conjuntos de datos, explotamos programas transcripcionales predefinidos de inflamación y defensa del huésped descritos recientemente en un modelo experimental. Estos programas se basan en evaluaciones exhaustivas tanto de la persistencia del patógeno como de la inflamación tisular, una firma transcripcional de activación inmunitaria que se asocia con la detección y eliminación del patógeno invasor (resistencia [R]).
Además, recientemente se ha utilizado una evaluación exhaustiva de medidas inmunológicas y clínicas para describir una firma transcripcional que se asocia con el estado fisiológico de la inflamación sistémica (inflamación sistémica [SI]). Aquí, Brandes-Leibovitz,et.al., [Cell Reports Medicine, 5, número 11,2024] demuestra que estos dos programas son valiosos para un análisis sistemático de infecciones moderadas y sepsis y luego investigaron un compendio de cohortes de sepsis e infecciones moderadas en el contexto de estos programas. De este análisis se desprenden varios hallazgos clave.
En primer lugar, los estados transcripcionales de un programa de R bajo y un programa de SI alto, y en particular una relación R/SI baja, son una huella general de la sepsis: es reproducible en múltiples cohortes de sepsis y se puede utilizar para distinguir la sepsis de las infecciones sin sepsis.
En segundo lugar, los estados relativos de R/SI están asociados con la gravedad de la sepsis y la mortalidad. Por tanto, los resultados establecen dos tipos clave de desregulación molecular de la sepsis, un R bajo y un SI alto, cuyo equilibrio está vinculado a la sepsis, la gravedad de la sepsis y la mortalidad. Estos dos tipos de desregulación inmunitaria deben abordarse de forma diferente desde un punto de vista terapéutico, se proponen formas de identificarlos y se identifican vías asociadas a ellos. Por último, validaron la utilidad de los estados R/SI para la estratificación de los pacientes en endotipos, superando las clasificaciones existentes de la sepsis.
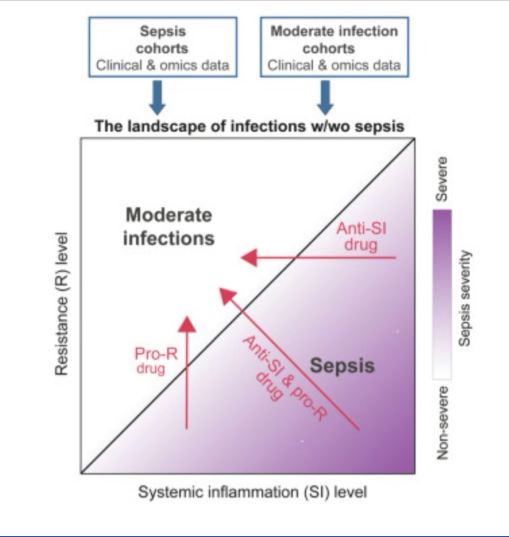
Brandes-Leibovitz,et.al., [Cell Reports Medicine, 5, número 11,2024] encontraron que los estados transcripcionales de dos programas celulares, R y SI, capturan la complejidad de la sepsis (Figura ).
El equilibrio entre los estados de R y SI (es decir, el “equilibrio R/SI”) separó de manera confiable a los pacientes con sepsis y las infecciones moderadas: los pacientes con sepsis se caracterizan por un R bajo en relación con el nivel de SI, mientras que las infecciones moderadas se caracterizan por el estado opuesto (Figura ). (2) R y SI explican las diferencias observadas entre los pacientes con sepsis en múltiples capas biológicas.
En particular, la patología, la gravedad y la mortalidad de la sepsis se asocian con un R bajo, un SI alto y un equilibrio R/SI bajo.
Finalmente, (3) el desacoplamiento entre la inducción de la actividad de SI y la represión de la actividad de R a nivel intrínseco celular puede explicar cómo coexisten tanto la hiperinflamación como la inmunosupresión en el mismo paciente (Figura ).
En los pacientes con sepsis, el sistema inmunitario muestra signos de respuesta inmunitaria débil (inmunodepresión) y exagerada (inflamación excesiva), cada una de las cuales implica una reprogramación celular compleja.
En este estudio, descubrieron que la sepsis se caracteriza por los fenotipos extremos de dos programas intrínsecos celulares distintos (supresión de R y SI excesiva), lo que implica que la supresión inmunitaria y la inflamación excesiva podrían reprogramarse por separado.
Se trata de pautas viables para bloquear la inflamación (ya hay varios fármacos candidatos disponibles, como los anticuerpos anticitocinas) o amplificar la resistencia (varios candidatos, como rIFNg, rIL-7, GM-CSF, etc.), según la fuente de disfunción en un paciente en particular (Figura ). En este punto, es necesario subrayar un aspecto importante.
Si bien el modelo R/SI puede orientar la selección de una terapia personalizada para cada estado R/SI, esto no excluye la posibilidad de utilizar diferentes tipos de enfoques inmunoterapéuticos según el proceso fisiopatológico que haya llevado a un estado R/SI específico.
Por ejemplo, se puede prever que un estado caracterizado por una fuerte supresión de la resistencia sin hiperinflamación se puede inducir a través de diferentes mecanismos: p. ej., una vía IL-12/IFNγ defectuosa o la sobreexpresión de moléculas inhibidoras.
Estos inmunotipos particulares pueden responder mejor al tratamiento con IFNγ recombinante o inhibidores de puntos de control, por dar solo un ejemplo. Se justifican estudios de seguimiento para definir los inmunotipos que caracterizan cada una de las disfunciones R y SI, sus respectivos marcadores de diagnóstico y los tratamientos de inmunoterapia objetivo.
Además, existe la ventaja del marco R/SI en la estratificación de pacientes. En particular, clasificaron a los pacientes con sepsis en endotipos inmunológicos según sus niveles de R/SI y luego compararon esta clasificación con una estratificación anterior de dos endotipos extremos (inmunosupresión y MALS). Utilizando una cohorte de validación independiente (PROVIDE), demostraron que la clasificación basada en R/SI presenta una fuerte capacidad pronóstica dentro de cada uno de estos endotipos anteriores, destacando el valor pronóstico agregado de los criterios basados en R/SI.
Además, utilizando la estratificación anterior, muchos pacientes con sepsis no alcanzaron los criterios de inmunosupresión o MALS y, por lo tanto, se los describió como «no clasificados» a pesar de un mal pronóstico de la enfermedad.
Esto llevó a una falla en la caracterización inmunológica de una gran proporción de pacientes con sepsis y condujo a la incapacidad de proponer un tratamiento inmunológico apropiado. Utilizando la clasificación basada en R/SI, ahora podemos proporcionar un pronóstico significativo de estos pacientes previamente no clasificados. Se demuestra que existen biomarcadores de proteínas plasmáticas que pueden identificar los endotipos basados en R/SI, lo que sugiere la traducibilidad del marco de estratificación R/SI a la práctica clínica.
Un aspecto importante a destacar es el hecho de que inicialmente los programas R y SI se derivaron de un contexto muy distinto (R: influenza; SI: inflamación crónica de bajo grado). Sin embargo, la alta covariación de estos programas en cohortes de sepsis e infecciones (Figuras S1C-S1E), así como el vínculo entre estos programas y las mediciones clínicas en diferentes modelos de sepsis e infecciones moderadas , argumentan firmemente a favor de su generalización para comprender la sepsis. Se observa que R y SI son programas celulares, es decir, los estados R y SI varían a nivel intrínseco de la célula (Figuras ), lo que abre el camino a la prueba ex vivo de intervenciones terapéuticas.
Esto es diferente de los estudios recientes de programas inmunológicos que se basan en transcriptomas de sangre completa sin determinar la relevancia a nivel intrínseco de la célula.
En general, al aprovechar los programas de un contexto en otro contexto, mejoraron nuestra comprensión de la sepsis. Esto sugiere una posible reutilización de los programas reguladores en respuesta a un entorno cambiante, que se puede aprovechar para mejorar la generalización del modelo en estudios futuros.
Este trabajo abre nuevas direcciones para futuras investigaciones. En primer lugar, las vías relacionadas con la sepsis identificadas, como la señalización de BMP2 y la formación de fibras elásticas , permitirían el desarrollo de enfoques terapéuticos en la sepsis.
En segundo lugar, las firmas transcripcionales de R y SI se pueden utilizar para evaluar inmunoterapias de la sepsis en un entorno ex vivo.
En tercer lugar, los estudios longitudinales futuros pueden brindar oportunidades para estudiar las trayectorias temporales de R y SI durante la sepsis.
Por ejemplo, dicho análisis puede mostrar cómo la trayectoria de la sepsis se desvía de las trayectorias de las infecciones moderadas.
En cuarto lugar, los programas de R y SI pueden mejorar la identificación de marcadores de diagnóstico. Por ejemplo, el ensayo clínico ImmunoSep (NCT04990232) se basa en mHLA-DR/Ferritin como marcador de inmunosupresión/hiperinflamación; mientras que estos marcadores están asociados con R y SI , los ensayos clínicos futuros podrían beneficiarse de una selección imparcial de marcadores de inmunosupresión R e hiperinflamación SI.
Finalmente, será de gran interés determinar cómo los estados R y SI contribuyen a otras condiciones relacionadas con el sistema inmunitario. Por ejemplo, R y SI podrían contribuir a la inducción de inmunidad entrenada después de la vacunación o durante enfermedades inflamatorias; los inmunotipos R/SI durante la sepsis podrían ser factores de riesgo potenciales de complicaciones posteriores a la sepsis; y el equilibrio R/SI podría usarse para la predicción temprana de la sepsis.
Tales investigaciones requerirían datos de alta resolución, no solo durante la infección sino también antes del diagnóstico y después de la recuperación, en grandes cohortes. En general, el marco de los estados R y SI se puede extender a aplicaciones adicionales en el estudio de enfermedades relacionadas con el sistema inmunitario.
Conclusiones
En el presente estudio, Brandes-Leibovitz,et.al., [Cell Reports Medicine, 5, número 11,2024] investigaron la patogénesis de la sepsis en el contexto de la interacción entre dos programas transcripcionales: uno que apunta a eliminar la invasión de patógenos (R) y el otro asociado con la SI. Utilizando un análisis integrador en múltiples cohortes de sepsis, concluyeron que los pacientes con sepsis se caracterizan por una huella molecular de un programa de R bajo en relación con el nivel de SI.
Sugieren que la heterogeneidad entre los pacientes con sepsis, probablemente explicada por la amplia diversidad de estados R y SI, se puede utilizar para orientar la estratificación de los pacientes que se utilizará en un enfoque de medicina de precisión hacia una inmunoterapia eficaz.
Si bien aún es necesario proporcionar pruebas sobre la eficacia de la inmunoterapia personalizada en la sepsis, se espera que el consorcio ImmunoSep publique pronto los resultados de un ensayo aleatorizado en el que la estratificación de los pacientes en función de la función inmunitaria (hiperinflamación o inmunoparálisis) orienta el tipo de inmunoterapia administrada . Es probable que esto represente un paso importante hacia una inmunoterapia eficaz en la sepsis.