El hambre es un instinto de supervivencia ancestral y evolutivo; Su importancia es evidente en las vías complejas y redundantes que involucran a los cinco sentidos que la regulan. Históricamente, cuando los humanos eran cazadores-recolectores con un suministro impredecible de alimentos, la regulación del hambre implicaba principalmente mantener un equilibrio metabólico entre la ingesta y el gasto calórico. La llegada de la agricultura hace 12.000 años aumentó la disponibilidad de alimentos asequibles, ricos en energía y sabrosos, lo que resultó en un efecto sustancial en la fisiología evolutiva del hambre que se había moldeado en los 2 millones de años anteriores. Una gran cantidad de investigación básica y traslacional sobre la fisiopatología del hambre ha revelado la complejidad de los procesos que regulan los hábitos alimentarios y están influenciados por factores socioeconómicos, culturales, psicológicos y conductuales.
La relativa estabilidad del peso corporal a lo largo del tiempo en una persona determinada sugiere una maquinaria metabólica altamente sofisticada que es capaz de regular una multitud de variables, tanto predecibles (p. ej., tasa metabólica basal) como impredecibles (p. ej., calidad y cantidad de alimentos ingeridos, efecto térmico de los alimentos, composición de macronutrientes y nivel de actividad física). Sin embargo, este preciso proceso regulador, que fue preparado evolutivamente para favorecer el consumo excesivo de calorías (y permisivo de un balance calórico positivo para permitir la acumulación de grasa como reserva de energía en los cazadores-recolectores) ahora está teniendo consecuencias médicas negativas.
Mecanismos que controlan el hambre
=> Recibir por Whatsapp las noticias destacadas
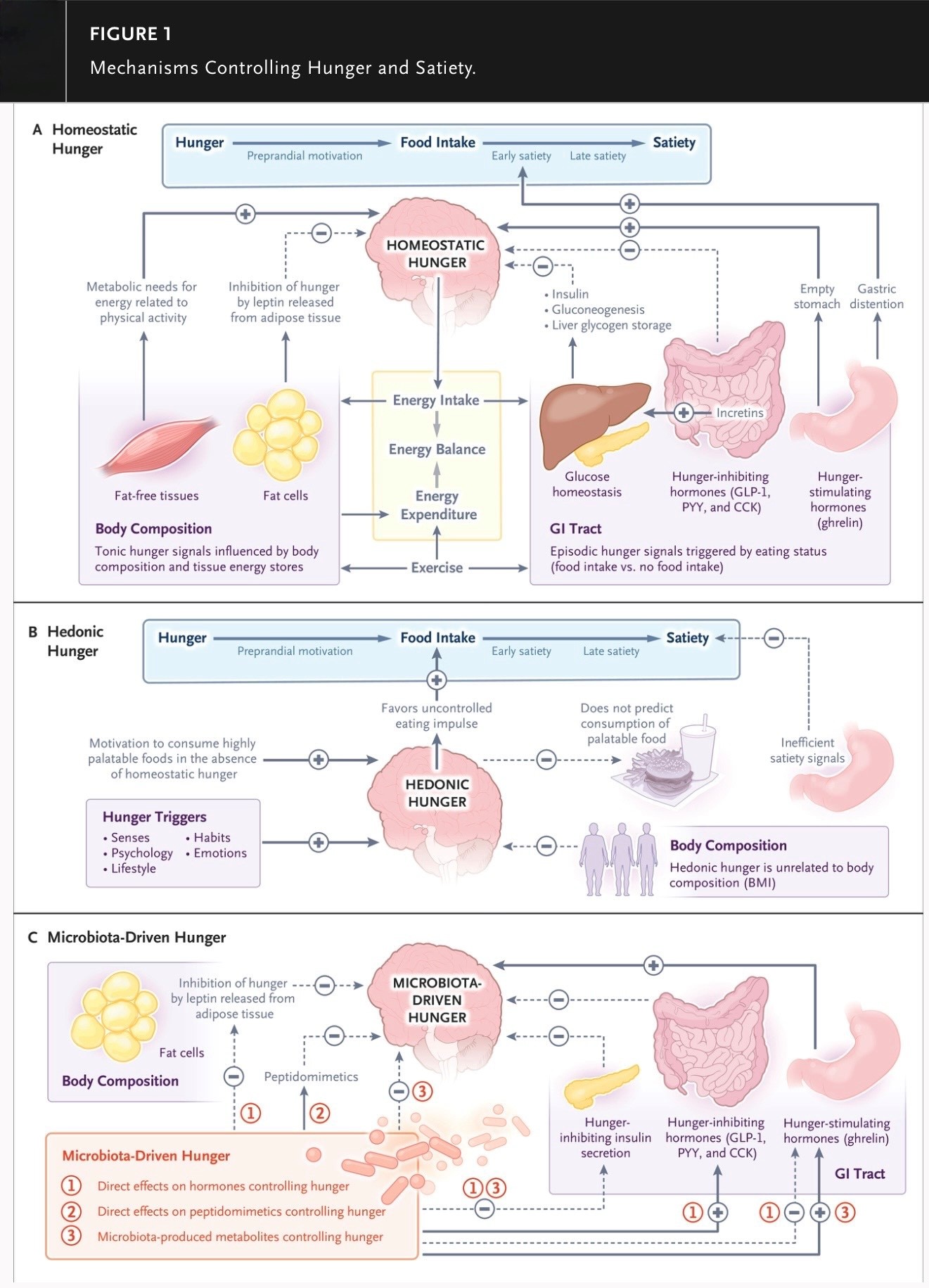
Para apreciar los intrincados mecanismos que intervienen en la regulación del hambre, es necesario distinguir entre el hambre (el impulso fisiológico de comer que se desencadena por la inanición (privación aguda de energía) para mantener el equilibrio energético) y el apetito, o hambre hedónica, en la que la ingesta de alimentos está impulsada por el placer en lugar de por la necesidad metabólica. En cualquiera de las situaciones, comer requiere una coordinación exquisita entre el cerebro y el intestino, uno de los ejemplos más sofisticados de la comunicación cruzada entre el eje intestino-cerebro. Funcional y evolutivamente, el hambre se puede caracterizar a través de tres mecanismos distintos pero altamente interconectados: homeostático, hedónico e impulsado por la microbiota (ver Figura 1).
La fisiología del hambre
El hambre está controlada por circuitos neuroendocrinos redundantes que mantienen el equilibrio metabólico.
El hambre homeostática se desencadena por la privación de alimentos e involucra señales neuroendocrinas, endocrinas y metabólicas que transmiten la necesidad de comer.
Por el contrario, el hambre hedónica ocurre en ausencia de una necesidad calórica aguda. Al aumentar la disponibilidad de alimentos, la agricultura ha favorecido el hambre hedónica sobre el hambre homeostática.
La composición y función de la microbiota intestinal puede influir en los circuitos del hambre; sin embargo, su papel exacto en el control de la ingesta de alimentos aún está por establecerse.
Los nuevos conocimientos sobre la fisiología del hambre ofrecen nuevos objetivos terapéuticos posibles para modular la ingesta de alimentos en condiciones patológicas, incluida la obesidad y la anorexia nerviosa.
Hambre Homeostática
El hambre homeostática, que es el mecanismo más ancestral que controla el hambre, involucra al eje cerebro-intestino, específicamente, el eje hipotálamo-intestino. Este modelo, descrito por primera vez por Walter Cannon en 1929, caracterizaba el hambre como un proceso pasivo desencadenado por el agotamiento de nutrientes y aliviado por la absorción de nutrientes. Actualmente existen evidencias sólidas, tanto en modelos animales como en humanos, de que los circuitos hipotalámicos que controlan el hambre están regulados por señales sensoriales que provienen principalmente del tracto gastrointestinal. Un estómago vacío estimula tanto el nervio vago como la secreción de grelina, considerada la “hormona del apetito”. Estas señales neurológicas y endocrinas aferentes se transmiten al hipotálamo, transmitiendo la necesidad de comer. Las fibras vagales aferentes estimulan la liberación de dopamina, que refuerza la señal de hambre, y la grelina aumenta el apetito a través de la activación de su receptor, GHSR1a, en las neuronas del hipotálamo productoras de ácido γ-aminobutírico (GABA), que detectan el hambre y que a su vez producen el péptido relacionado con el agutí (AgRP). Las neuronas AgRP son inhibidas rápidamente por la detección de alimentos a través de la vista, el olfato o el gusto.
Además de la grelina, la hipoglucemia parece desencadenar el hambre al regular la actividad de neuronas hipotalámicas específicas que responden a los niveles de glucosa sérica. Aparte de las señales neuroendocrinas, las contracciones gastrointestinales interprandiales de fase III inducidas por motilina parecen controlar el hambre y la regulación de la ingesta de alimentos en humanos, tanto en estados saludables como patológicos, a través de una vía colinérgica. Se ha identificado a los estímulos luminales, como los saborizantes amargos, como moduladores de la liberación de motilina, que afectan el hambre y la ingesta de alimentos.
Con la ingesta de alimentos, se inicia una vía igualmente intrincada que reprime el hambre mediante la distensión gástrica, detectada por mecanorreceptores específicos de tensión, estiramiento y volumen que luego transmiten señales al rombencéfalo a través de los nervios vago y espinal. Esta señal inicial de saciedad se refuerza posteriormente por la presencia de aminoácidos y ácidos grasos específicos en el tracto gastrointestinal, lo que conduce a la supresión del hambre (Figura 1A). El vaciamiento gástrico, así como la carga osmótica dentro del tracto gastrointestinal, proporciona más información relacionada con la calidad y cantidad de la comida y contribuye a la saciedad temprana. Una variedad de hormonas gastrointestinales, como el péptido similar al glucagón 1 (GLP-1), la colecistoquinina y el péptido YY (PYY), se secretan en presencia de alimentos digeridos dentro del intestino delgado proximal y conducen a una saciedad a mediano plazo mediante la generación de señales inhibidoras en el cerebro. La saciedad tardía se alcanza finalmente cuando, al finalizar los procesos digestivos, aumentan los niveles plasmáticos de aminoácidos, glucosa e insulina. Esta saciedad metabólica, junto con las señales sensoriales y la integración de todos estos procesos en el sistema nervioso central (SNC), completa el ciclo de control homeostático del hambre (Figura 1A).
Hambre Hedònico
Mientras que el hambre homeostática es típica de las personas que sufren privación de alimentos, el hambre hedónica (motivada por el placer) se caracteriza por un deseo de comer en ausencia de una necesidad calórica aguda (Figura 1B). En el hambre homeostática, el equilibrio entre hambre y saciedad, estrictamente regulado, se ajusta para mantener la homeostasis metabólica, lo que evita la ingesta excesiva de calorías. Sin embargo, en presencia de una disponibilidad sustancial de alimentos, los circuitos corticales hedónicos o de recompensa pueden reemplazar el control hipotalámico del equilibrio energético, lo que lleva a la ingestión de alimentos densos en energía, ricos en grasas y azúcares, no por necesidad, sino por placer. El hambre hedónica también está influenciada por emociones negativas y, con mayor frecuencia, positivas, lo que resulta en diferencias individuales en la conducta alimentaria. Por ejemplo, la ira, el miedo, la tristeza y la depresión a menudo se asocian con el consumo excesivo de alimentos dulces.
Está bien establecido que los bebés son propensos a preferir los sabores dulces y salados en comparación con los sabores amargos y ácidos, muy probablemente como parte de un mecanismo adaptativo para consumir alimentos seguros como la leche humana, que es dulce y favorece un mejor control de la saciedad que las fórmulas para bebés. Este sesgo hacia los alimentos grasos, dulces y salados en el contexto de un estilo de vida occidental en el que la disponibilidad de alimentos no es un factor limitante puede, en parte, ser responsable de las tendencias obesogénicas, particularmente entre los niños. De hecho, los padres occidentales son más propensos a dejar que sus hijos coman alimentos sabrosos y ricos en energía (“alimentación permisiva”), a pesar de su efecto perjudicial para la salud, por temor a que se rechacen opciones más saludables desde el punto de vista nutricional, como verduras, frutas o alimentos ricos en fibra, lo que da lugar a desnutrición.
Los patrones de alimentación también están influenciados por las preferencias gustativas, así como por las sensaciones placenteras en el sistema de recompensa del cerebro que se desencadenan por la anticipación de consumir alimentos sabrosos. Además, los factores socioeconómicos (el costo generalmente menor de los alimentos poco saludables en comparación con los alimentos saludables), las creencias culturales (la obesidad como signo de salud y riqueza en muchas sociedades) y las prácticas religiosas (restricciones alimentarias en ciertas religiones) pueden modificar el hambre hedónica. Además, los anuncios de alimentos pueden iniciar la liberación de dopamina de las áreas cerebrales relacionadas con la recompensa e incitar pensamientos y deseos relacionados con la alimentación. Además, los cannabinoides endógenos, las vías opioides endógenas y la señalización de orexina están involucrados en la recompensa hedónica de la ingesta de alimentos. El resultado clínico del consumo de alimentos altamente gratificantes y densos en calorías es un aumento excesivo de peso (que resulta en sobrepeso u obesidad), que se asocia con trastornos importantes, incluidas enfermedades cardiovasculares, hipertensión y diabetes mellitus tipo 2 y mayor riesgo de cáncer.
La escala Power of Food Scale (PFS), desarrollada en 2009 para cuantificar el hambre hedónica, evalúa los efectos psicológicos de vivir en entornos con abundancia de alimentos y ha proporcionado información sobre cuatro dominios relacionados. En primer lugar, la escala mide con precisión la motivación para consumir alimentos apetecibles; tanto los hombres como las mujeres con puntuaciones altas en PFS dirigen su atención visual hacia los alimentos apetecibles. La neuroimagen funcional en estas personas ha demostrado la activación de áreas de procesamiento en la corteza visual cuando se las expone a imágenes o descripciones de alimentos apetecibles. En cambio, aquellos con puntuaciones bajas en PFS no tienen la misma activación de los circuitos neuronales que conectan las regiones asociadas con el hambre, el antojo y la conducta de búsqueda de alimentos.
En segundo lugar, las personas con puntuaciones altas en PFS no necesariamente consumen más alimentos apetecibles, a pesar de la motivación para hacerlo. La evidencia sugiere que el hambre hedónica por sí sola no es suficiente para predecir la ingesta de alimentos, pero podría favorecer el consumo excesivo si coexiste con otras características individuales, como un control deficiente de los impulsos. Por lo tanto, es probable que el hambre hedónica solo esté asociada débilmente o de manera inconsistente con la ingesta de alimentos. En consecuencia, el tercer dominio, el índice de masa corporal (IMC), tampoco está sustancialmente relacionado con el hambre hedónica. Una explicación es que en una sociedad de abundancia y exposición constante a alimentos apetecibles, las personas piensan en alimentos deliciosos y los anhelan, independientemente de su IMC. Sin embargo, un estudio de pérdida de peso de 2021 sugiere que, al menos en un subgrupo de personas, una reducción del hambre hedónica se asocia con un IMC más bajo a los 12 meses. Por último, el hambre hedónica medida por la puntuación PFS parece estar relacionada con los trastornos alimentarios. Estudios limitados sugieren que existe un vínculo entre el hambre hedónica y un impulso alimentario descontrolado y que el grado de hambre hedónica está asociado con la magnitud del impulso alimentario.
Mientras que el hambre homeostática es un instinto de supervivencia sencillo que se desencadena por un único estímulo (privación calórica aguda), el hambre hedónica es multifactorial y extremadamente compleja, e involucra el aprendizaje, la cognición y la memoria. Por lo tanto, el hambre hedónica es muy difícil de abordar a nivel poblacional, pero debe abordarse con el uso de estrategias individualizadas basadas en el factor (o factores) en juego en cada persona determinada.
Hambre Impulsada Por La Microbiota
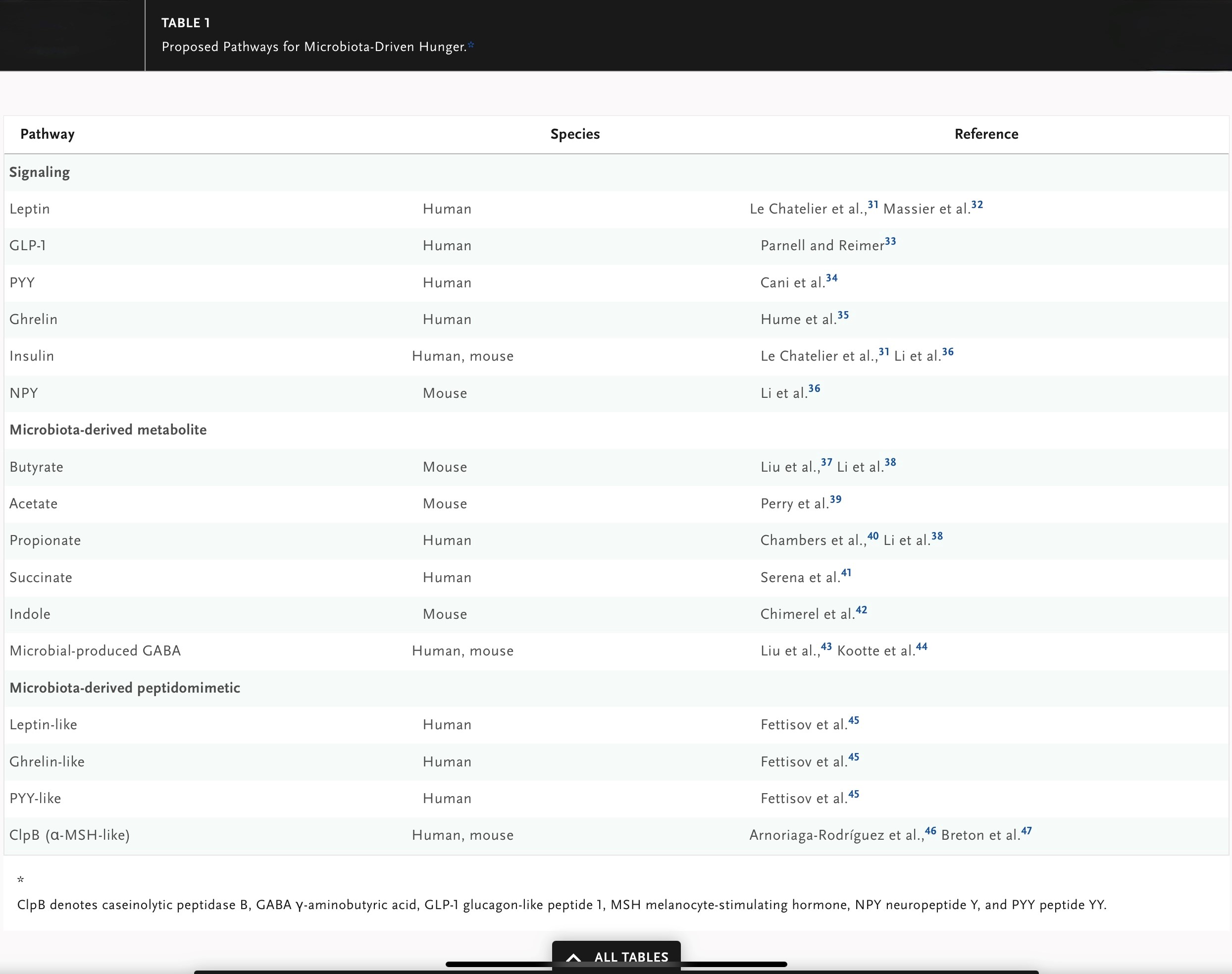
La microbiota intestinal son simbiontes que brindan protección al huésped contra patógenos y contribuyen a la programación del sistema inmunológico y al control de funciones metabólicas clave, incluido el metabolismo energético. Además, la microbiota proporciona energía al huésped mediante la liberación de enzimas y metabolitos tróficos (por ejemplo, ácidos grasos de cadena corta). Dado que el hambre depende en gran medida de la comunicación bidireccional intestino-cerebro, la microbiota intestinal también influye en los circuitos del hambre del huésped. Se han dilucidado varios mecanismos que involucran vías sistémicas y nerviosas, ya sea afectando indirectamente el hambre a través de hormonas o produciendo metabolitos que afectan directamente al hambre. La mayoría de las investigaciones en esta área son descriptivas, involucran modelos animales o se basan en estudios clínicos transversales con tamaños de muestra pequeños. Los ensayos clínicos dirigidos a modular la microbiota intestinal para reducir el hambre como medio de control del peso han generado datos contradictorios. Por lo tanto, es necesario aclarar con mayor detalle el papel exacto de la microbiota en la influencia del hambre en el huésped humano. A continuación se analizan algunos ejemplos de los mecanismos implicados en el hambre inducida por la microbiota y en la Tabla 1 se enumeran los mecanismos propuestos específicos de cada especie.
Efectos Microbiòticos Sobre Las Hormonas Humanas Que Controlan El Hambre
Los microorganismos pueden influir en la liberación de hormonas que controlan el hambre (p. ej., grelina, leptina e insulina) producidas por el intestino, el tejido adiposo y el páncreas (Figura 1C). La disminución de la diversidad de la microbiota (un signo de disbiosis) se ha asociado con mayores concentraciones séricas de leptina tanto en personas delgadas como obesas. En personas obesas, el aumento de la permeabilidad intestinal puede facilitar el paso de los componentes de la microbiota desde el lumen intestinal al tejido adiposo del huésped, alterando el metabolismo energético a través de la inhibición de la señalización de la leptina y dando como resultado disglucemia y, en algunos casos, diabetes mellitus tipo 2. Los prebióticos de la microbiota intestinal, incluida la inulina y la oligofructosa, parecen inhibir el hambre al aumentar la síntesis de GLP-1 y PYY mientras que inhiben concomitantemente la producción de grelina tanto en adultos delgados como obesos. Sin embargo, en estudios que involucraron a niños con obesidad, la suplementación de inulina enriquecida con oligofructosa condujo a una disminución de la ingesta de alimentos, que se asoció con un aumento posterior de las concentraciones de grelina, pero no afectó a las vías de GLP-1, PYY o insulina. Al igual que la leptina y la grelina, la insulina puede modificar el hambre al afectar a las neuronas AgRP48 y puede verse influenciada por la microbiota intestinal. De hecho, la diversidad reducida de bacterias intestinales se ha asociado con una mayor resistencia a la insulina. Además, en un estudio que incluyó ratones obesos, los probióticos alteraron la composición microbiana intestinal e inhibieron el hambre al disminuir la resistencia a la insulina e inhibir la expresión del neuropéptido Y. Los resultados inconsistentes entre los estudios que incluyeron adultos y aquellos que incluyeron niños pueden deberse a diferencias relacionadas con la edad, pero lo más probable es que se deban a diferencias en el diseño y la interpretación del estudio.
Metabolitos derivados de la microbiota que controlan El Hambre
Los metabolitos derivados de la microbiota (postbióticos) son mediadores clave de la señalización del eje microbiota-intestino-cerebro y contribuyen al hambre. Los ácidos grasos de cadena corta, incluidos el butirato, el propionato y el acetato, son los productos biológicos de la fermentación bacteriana de polisacáridos poco digeribles (por ejemplo, fibras). Después de unirse al receptor de ácidos grasos libres y al receptor acoplado a proteína G en los islotes pancreáticos, los ácidos grasos de cadena corta son capaces de estimular el hambre homeostática al favorecer la señalización relacionada con la grelina e inhibir la secreción de insulina. Sin embargo, también hay evidencia de que los ácidos grasos de cadena corta pueden suprimir el hambre al unirse al receptor de ácidos grasos libres y al receptor acoplado a proteína G , lo que puede conducir a la liberación de GLP-1, PYY, insulina y leptina. Además de estimular el hambre homeostática, los ácidos grasos de cadena corta (y específicamente, el propionato colónico) pueden reducir el hambre hedónica a través de la inhibición de los circuitos de recompensa del SNC. Finalmente, el acetato producido por las bacterias colónicas puede cruzar la barrera hematoencefálica e inhibir directamente las neuronas AgRP en el hipotálamo.
El succinato es otro producto biológico de las bacterias colónicas que puede afectar la homeostasis energética del huésped a través del control del hambre. Un estudio mostró que las personas con obesidad tienen mayores niveles de succinato circulante, y las intervenciones dietéticas para la pérdida de peso en dichas personas están asociadas con cambios en la composición de la microbiota y concentraciones reducidas de succinato circulante. Sin embargo, los experimentos en modelos animales han arrojado resultados inconsistentes.
El indol, otro metabolito derivado de la microbiota, puede suprimir el hambre al estimular la liberación de GLP-1. Además, un estudio mostró que el indol estimula la producción de triptófano, que a su vez provoca la liberación de 5-hidroxitriptamina de las células enteroendocrinas. Múltiples estudios han demostrado que la 5-hidroxitriptamina juega un papel fundamental en la supresión del hambre al mejorar la sensibilidad a la insulina y afectar a las neuronas AgRP.
La microbiota intestinal también produce GABA a partir del glutamato dietético. El GABA es una de las moléculas clave que median la comunicación intestino-cerebro, incluido el control del hambre a través de la activación de las neuronas AgRP. Las personas con obesidad tienen una abundancia reducida de microorganismos intestinales fermentadores de glutamato, con un aumento correspondiente en los niveles de glutamato circulante, hallazgos que corroboran el papel del glutamato en el equilibrio energético que se ha demostrado en modelos animales.
Peptidomimèticos para el control del hambre derivados de la microbiota
Varios estudios han demostrado que la microbiota intestinal puede producir proteínas (clasificadas como peptidomiméticos) que imitan la estructura y función de las proteínas que controlan el hambre, como PYY, grelina y leptina. Uno de los mejores ejemplos de un peptidomimético bacteriano es la peptidasa caseinolítica B (ClpB), producida por Escherichia coli, que tiene un efecto similar al de la hormona estimulante de los melanocitos α (α-MSH) supresora del hambre producida por el huésped humano. Específicamente, en Los modelos animales in vivo han demostrado que, al igual que la α-MSH, la ClpB aumenta los niveles séricos de GLP-1 y PYY y activa las neuronas hipotalámicas que suprimen el hambre. Estos datos sugieren que la microbiota intestinal también puede suprimir el hambre a través de peptidomiméticos específicos.
Control genètico del hambre
Aunque el efecto de los factores socioeconómicos, psicológicos y culturales sobre la conducta alimentaria es claro, el papel de la genética en la influencia de la preferencia alimentaria, el gusto y la calidad y cantidad de la ingesta de alimentos parece ser menos claro. No obstante, existen varios ejemplos de trastornos monogénicos poco frecuentes que causan hiperfagia y obesidad. El síndrome de Prader-Willi, una afección genética asociada con la deleción de la región 11-13q del cromosoma 15, es el ejemplo prototípico de un trastorno genético que puede causar hambre insaciable y el desarrollo de obesidad grave durante la infancia. Los niños con el síndrome de Prader-Willi tienen complicaciones de obesidad grave, incluyendo diabetes mellitus tipo 2 e insuficiencia cardíaca, y rara vez sobreviven más allá de los 25 a 30 años de edad. Las variantes genéticas con pérdida de función del gen de la leptina (LEP) en el cromosoma 7q31.3 o su receptor (LEPR) también conducen a una conducta alimentaria anormal, lo que resulta en una obesidad grave de aparición temprana. Estas raras formas de obesidad genética confirman el papel crucial de vías específicas en el control del hambre y la homeostasis. Sin embargo, las formas monogénicas de obesidad representan menos del 7% de los casos de obesidad infantil.
Consecuencias de los circuitos del hambre desregulados
Un corolario de la red compleja y redundante que controla el hambre y la saciedad es que la desregulación de los circuitos puede conducir a trastornos alimentarios, que van desde comer poco (anorexia) hasta comer en exceso (hiperfagia, obesidad y trastornos metabólicos relacionados, como la diabetes mellitus tipo 2). El creciente interés en la neurobiología de estos trastornos se ve impulsado por su creciente efecto en la salud pública. La restricción inadecuada y severa de la ingesta de alimentos, que conduce a una peligrosa pérdida de peso y a una reprogramación metabólica, son las características distintivas de la anorexia nerviosa, una enfermedad que afecta a un gran número de pacientes, en particular niñas y mujeres jóvenes, en los países industrializados. Las conductas observadas en pacientes con anorexia nerviosa pueden conceptualizarse como una forma extrema de adaptación metabólica a la inanición. De hecho, para preservar las funciones biológicas que son fundamentales para la supervivencia (por ejemplo, la oxigenación cerebral y el suministro de sangre al corazón), existe una reprogramación central y periférica de la señalización endocrina y neurológica que controla el equilibrio energético, el ejercicio físico, la biología reproductiva, el metabolismo óseo y la conducta alimentaria. Paradójicamente, los niveles de grelina están aumentados en pacientes con anorexia nerviosa, lo que sugiere que la restricción crónica de alimentos conduce a intentos compensatorios de estimular el hambre. Se desconoce por qué esta adaptación compensatoria apropiada no se traduce en un aumento del hambre, pero se ha propuesto una insensibilidad transitoria a la grelina y una reprogramación metabólica. Esta paradoja ha generado un gran interés y, en última instancia, podría conducir a objetivos para estrategias terapéuticas.
Además de la señalización periférica supuestamente aberrante, los pacientes con anorexia nerviosa tienen una función cerebral alterada, caracterizada por déficits en la secreción de dopamina y serotonina, que controlan la conducta alimentaria o las recompensas y el control de los impulsos o el neuroticismo, respectivamente. Además, los pacientes con anorexia nerviosa tienen una activación inapropiada del sistema corticolímbico, que controla el apetito y el miedo, y una actividad disminuida de los circuitos frontoestriatales, que regulan las conductas habituales. El análisis del microbioma fecal y los perfiles metabólicos en pacientes con anorexia nerviosa ha revelado diferencias en la composición y diversidad de la microbiota intestinal, en comparación con los controles sanos. Además, tanto los modelos animales como los estudios clínicos han sugerido que la disbiosis intestinal, al aumentar la permeabilidad intestinal, puede influir en el desarrollo de trastornos alimentarios relacionados con el tráfico excesivo de ClpB y lipopolisacárido desde el lumen intestinal hacia la circulación sistémica.
La ingesta excesiva de alimentos, como se mencionó anteriormente, se está convirtiendo en un importante problema de salud pública. Según la Organización Mundial de la Salud, en 2022 una de cada ocho personas en el mundo tenía obesidad y, durante los últimos 30 años, la prevalencia de la obesidad se ha duplicado entre los adultos y se ha cuadriplicado entre los adolescentes. Los datos de la población pediátrica son particularmente alarmantes: en todo el mundo, 37 millones de niños menores de 5 años y más de 390 millones de niños y adolescentes de 5 a 19 años tienen sobrepeso u obesidad. Las personas obesas, independientemente de su edad, tienen un mayor riesgo de padecer muchas enfermedades y problemas de salud graves, como hipertensión arterial, diabetes mellitus tipo 2, osteoartritis, problemas psicológicos (por ejemplo, ansiedad, depresión y los efectos del acoso y el estigma) y baja autoestima, en comparación con las personas con un peso saludable. Además, la obesidad y los problemas de salud asociados tienen un efecto económico sustancial en todo el mundo: la atención médica relacionada con la obesidad cuesta unos 173 000 millones de dólares anuales en los Estados Unidos.
Muchos programas de atención sanitaria, nutrición, físicos, sociales, económicos y educativos hasta ahora no han logrado afectar las crecientes tasas de obesidad en todo el mundo. Sin embargo, los nuevos descubrimientos en la neurobiología del hambre han llevado al desarrollo de posibles remedios farmacológicos para el problema. El ejemplo más destacado es el uso de agonistas del receptor GLP-1 en las últimas dos décadas, a partir de su aprobación inicial por la Administración de Alimentos y Medicamentos en 2005. Se ha demostrado que los agonistas del receptor GLP-1 mejoran el control de la glucosa en sangre, reducen el riesgo de enfermedades cardíacas en pacientes con obesidad y ayudan a los pacientes con sobrepeso u obesidad a perder peso al suprimir el hambre.
Sin embargo, el uso cosmético de estos agentes por celebridades, atletas y, lo más preocupante, adolescentes sin una indicación médica podría conducir a efectos adversos no deseados a largo plazo. Específicamente para la población pediátrica, se ha demostrado que los agonistas del receptor GLP-1 afectan negativamente el crecimiento y el desarrollo, ya que pueden causar un desequilibrio a largo plazo entre la ingesta y el gasto de energía, suprimir el apetito, tener efectos antihedónicos y causar fatiga. Estos cambios pueden traducirse en un equilibrio inadecuado entre la ingesta y el gasto de energía durante un período crítico del desarrollo en el que las calorías son necesarias no solo para las actividades diarias sino también para el crecimiento. Además, hay algunos informes sobre el uso indebido de agonistas del receptor GLP-1 entre niños con trastornos alimentarios y entre adolescentes que participan en deportes competitivos con agrupaciones competitivas basadas en el peso corporal.
Implicaciones
En los últimos años, hemos adquirido un conocimiento sustancial sobre la fisiología del hambre, lo que abre la posibilidad de tratamientos personalizados, estrategias de salud basadas en la población e intervenciones preventivas. En los Estados Unidos, los gastos anuales incluyen 800 mil millones de dólares en alimentos (de los cuales el 30% se desperdicia), 14 mil millones de dólares en publicidad de alimentos y 456 millones de dólares en salud y ejercicio, lo que suma un total de 814,5 mil millones de dólares en costos de alimentos y relacionados con los alimentos. Además, el costo de los nuevos medicamentos para el control del peso, como los agonistas del receptor GLP-1, casi con certeza aumentará aún más los gastos relacionados con la dieta.
Según el Instituto Internacional de Investigación sobre Políticas Alimentarias, se necesitan 100 mil millones de dólares anuales para terminar con el hambre en el mundo, una octava parte de lo que se gasta en costos relacionados con los alimentos en los Estados Unidos. Los cambios de políticas para abordar el hambre pueden resolver muchos problemas de salud relacionados con la nutrición y hacer que la producción de alimentos sea más sostenible y se distribuya de manera equitativa para beneficiar tanto a los países industrializados como a los países en desarrollo.
Resumen y conclusiones
Los mecanismos que rigen la fisiología del hambre son multidimensionales, complejos y aún no están completamente definidos. Los avances logrados en este campo en los últimos años nos han permitido comprender algunos de los mecanismos que intervienen y el efecto de los cambios evolutivos, en particular los relacionados con la obtención de alimentos, en la fisiopatología de la ingesta de alimentos. Ahora deberíamos aprovechar este conocimiento para desarrollar intervenciones personalizadas y medidas preventivas que promuevan el equilibrio metabólico y, en última instancia, la buena salud.
Figura 1
Mecanismos que controlan el hambre y la saciedad.
Los circuitos homeostáticos, hedónicos y dependientes de la microbiota controlan el inicio de la ingesta de alimentos a través de la interacción directa con áreas específicas del cerebro, la estimulación del hambre que controla las hormonas y las sustancias generadas por la microbiota que afectan las vías del hambre del huésped (Paneles A, B y C, respectivamente). Con la ingesta de alimentos, se activan mecanismos contrabalanceados que controlan la saciedad temprana, media y tardía para alcanzar un equilibrio metabólico entre la ingesta y el gasto calórico. Un desequilibrio de este equilibrio hambre-saciedad puede conducir a trastornos alimentarios y sus complicaciones metabólicas. CCK denota colecistoquinina, Gl gastrointestinal, GLP-1 péptido similar al glucagón 1 y PYY péptido YY.