PREFACIO
Recientemente han habido diferentes reacciones al uso de la vacuna contra el Covid-19, desde «explicaciones científicas», donde solo se repiten falacias o medias verdades hasta flagrantes faltas a la verdad de las autoridades de salud. Primordialmente han sido en lo referente a las dosis de la vacunación: la segunda, la tercera y la combinación heteróloga de vacunas. No me sorprendería se hable pronto de cuartas dosis.
Todo esto. a pesar de que en un país como Bolivia no han ni siquiera vacunado completamente (doble dosis) al 35% de su población (al momento de escribir este artículo). Quiero creer que gran parte de la confusión se debe a la falta de conocimiento científico del tema y por supuesto, a lo intrépido de algunos de los interlocutores. Esta es simplemente otra muestra más de lo que trajo también la pandemia por Covid-19: la desinformación frenética e intrépida diseminada por todos los medios de comunicación y la consiguiente clara pérdida de confianza y desgraciadamente, politización de las ciencias biológicas y médicas.
Todo esto me ha motivado a escribir este artículo que revisa a profundidad la respuesta inmunológica tanto a la infección natural por SARS-CoV-2 como a la inducida por vacunas contra COVID-19; haciendo mucho énfasis en los datos científicos publicados respecto a la duración y calidad de dichas respuestas inmunes. La revisión tiene como único fin proporcionar una base científica seria, firme y completa para que los médicos, personas interesadas en el tema y autoridades de salud puedan aconsejar y ejecutar políticas de salud sobre la utilidad de vacunación completa, vacunación heteróloga, terceras dosis, dosis de refuerzo, en quienes y cuándo, dictado por el conocimiento científico y no por otros motivos ajenos a la salud y bienestar de la población.
Introducción
=> Recibir por Whatsapp las noticias destacadas
Desde su aparición en diciembre de 2019, el SARS-CoV-2 ha seguido causando una carga considerable de enfermedades agudas y crónicas, lo que ejerce una enorme presión sobre los sistemas de salud de todo el mundo. Para romper las cadenas de transmisión y frenar el aumento de la morbilidad y la mortalidad asociadas con la pandemia, los gobiernos han empleado una variedad de intervenciones no farmacéuticas, que incluyen distanciamiento social, uso de máscaras, pruebas, rastreo de contactos, restricciones de viaje y cuarentena. Sin embargo, estas medidas han tenido un costo social y económico sin precedentes en su alcance(1).
Las mejoras en la capacidad de prueba, junto con los resultados sobre la eficacia de las nuevas vacunas (2, 3, 4) y su implementación para muchas poblaciones en todo el mundo, brindan mucha esperanza en comparación con las preocupantes perspectivas de salud pública de 2020. No obstante, los datos emergentes sobre nuevas variantes genéticas del SARS-CoV-2(5) junto con evidencia de re-infecciones potenciales,(6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19) amenazan la noción de protección inmunológica después de una infección natural y— de igual preocupación, si no más, después de la vacunación. Si la durabilidad de la inmunidad se ve obstaculizada por cambios en la arquitectura genética de las cepas circulantes de SARS-CoV-2, esto tendría implicaciones clave para relajar la rigurosidad de las intervenciones no farmacéuticas.
Para comprender el alcance de esta amenaza potencial, en esta revisión evaluamos la investigación sobre virus respiratorios comunes y coronavirus humanos pandémicos anteriores, y nos basamos en la gran cantidad de datos inmunológicos emergentes sobre la infección por SARS-CoV-2. Nos centramos en el desarrollo del conocimiento de la inmunidad celular y humoral al SARS-CoV-2, en respuesta tanto a la infección natural como a la vacunación, y presento mis puntos de vista sobre lo que significa la evidencia disponible en términos de la longevidad de la inmunidad protectora
Inmunidad al SARS-CoV-2 en contexto
El SARS-CoV-2 pertenece a la subfamilia Coronavirinae de virus de ARN de sentido positivo, que incluye cuatro géneros: Alphacoronavirus, Betacoronavirus, Gammacoronavirus y Deltacoronavirus. Dentro de los Coronavirinae hay virus que son frecuentemente responsables de infecciones leves del tracto respiratorio superior en humanos: HcoV-229E, HcoV-NL63 (alfacoronavirus), HcoV-OC43 y HcoV-HKU1 (betacoronavirus) (20). Otros betacoronavirus incluyen los virus pandémicos anteriores SARS-CoV y MERS-CoV, que se propagaron a las poblaciones humanas a partir de murciélagos y dromedarios(21). Aunque existen diferencias en la epidemiología de estos diversos coronavirus humanos, se pueden obtener conocimientos relevantes sobre la respuesta inmune del huésped a la infección. Por ejemplo, el SARS-CoV-2 ha desarrollado varios mecanismos para evadir la respuesta inmune innata a la infección, con mecanismos de reconocimiento del huésped y vías de evasión inmune viral que muestran algunas similitudes con las de coronavirus pandémicos anteriores(esto lo revisamos en detalle en https://eju.tv/2021/09/covid-19-evolucion-clinica-respuesta-inmune-y-tratamientos-inmunomoduladores-acordes-a-la-inmunopatogenia-de-la-infeccion-por-sarscov-2/)
Los estudios realizados a pacientes que se han recuperado del SARS-CoV han encontrado que las respuestas de IgG circulantes son detectables durante 2-3 años después de la infección,( 27, 28) y se han identificado anticuerpos neutralizantes después de más de 6 meses(29, 30) e incluso hasta 12 años después de la infección(31). De manera similar, en pacientes que se han recuperado del MERS-CoV, se han detectado anticuerpos neutralizantes hasta 18 meses después de la infección(32). Aunque en una cohorte pequeña, también se encontró una correlación entre la gravedad de la enfermedad y la longevidad de los anticuerpos: los pacientes asintomáticos eran seronegativos, mientras que aquellos que se recuperaban de una enfermedad grave tenían anticuerpos detectables 34 meses después de la infección(33). Los modelos animales de MERS-CoV han demostrado que la incapacidad para generar anticuerpos neutralizantes da como resultado una mayor inflamación y peores resultados clínicos tras la re-exposición viral, lo que sugiere un papel importante para los anticuerpos neutralizantes en prevenir la reinfección por coronavirus(34).
Entre otros virus respiratorios, incluidos los coronavirus estacionales, el virus sincitial respiratorio y el virus de la influenza, la infección tiende a producir anticuerpos neutralizantes que protegen transitoriamente contra la reinfección(35). Los estudios de infecciones naturales han demostrado que la inmunidad protectora menguante permite la reinfección con infecciones estacionales por coronavirus dentro de una ventana de 12 meses (aunque la variación de la cepa, no considerada en estos estudios, podría explicar en parte esta inmunidad de corta duración) (36, 37). En un estudio de adultos naturalmente infectados con virus respiratorio sincitial, el 73% (11 de 15) se reinfectaron en un período de 8 meses(38), y el riesgo de reinfección se correlacionó negativamente con el título de anticuerpos neutralizantes de la infección anterior (39).
Inmunidad humoral en la infección natural por SARS-CoV-2
La presencia de anticuerpos neutralizantes se considera típicamente como uno de los mejores correlatos de inmunidad efectiva para una variedad de patógenos (40). No obstante, los desafíos clave para comprender la inmunidad a largo plazo al SARS-CoV-2 son la falta de consenso sobre los correlatos inmunitarios de protección y la escasez actual de estudios de re-exposición humana. El primer estudio de desafío humano, que incluyó a 90 participantes de entre 18 y 30 años, comenzó en febrero de 2021 en el Imperial College de Londres, Reino Unido, (41) y aunque los datos aún no están disponibles, los primeros tres voluntarios completaron la cuarentena sin problemas inesperados (42). La respuesta inmune en animales ha demostrado que la infección por SARS-CoV-2 provoca una fuerte respuesta humoral (43, 44, 45), probablemente contribuyendo a la protección contra la reinfección hasta por 28 días en hurones (46) y 35 días en macacos Rhesus (47). En humanos, varios estudios han demostrado que casi todos los pacientes convalecientes desarrollan respuestas de anticuerpos neutralizantes detectables (48, 49, 50) y que, al igual que otras infecciones por virus respiratorios(35, 36, 37, 39), una respuesta humoral reduce sustancialmente el riesgo de reinfección(6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19).
Enfermedad Covid-19 de moderada a grave
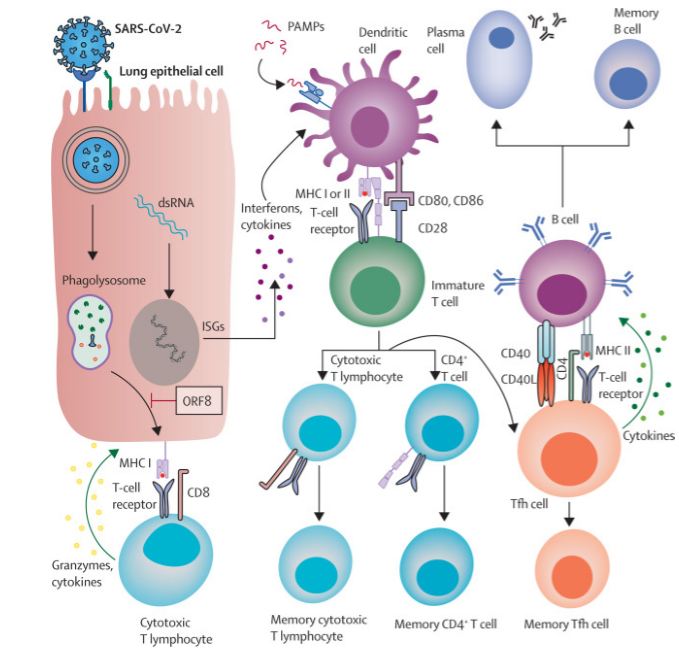
En casos críticos de COVID-19, en los que las personas requieren ventilación mecánica durante varias semanas como resultado del síndrome de dificultad respiratoria aguda, se generan anticuerpos contra una variedad de antígenos virales, y la mayoría de los anticuerpos neutralizantes se dirigen a los epítopos de la proteína de la espiga del virus(proteína de la envoltura viral que media la entrada en las células del huésped) y su dominio de unión al receptor (RBD; la parte de la proteína de espiga requerida para la unión viral al receptor de la enzima convertidora de angiotensina 2 [ACE2] del huésped) (22, 51, 52, 53, 54, 55 y detallado en https://eju.tv/2021/09/covid-19-evolucion-clinica-respuesta-inmune-y-tratamientos-inmunomoduladores-acordes-a-la-inmunopatogenia-de-la-infeccion-por-sarscov-2/ ). Aunque existe una heterogeneidad sustancial entre los individuos en la duración de las respuestas de anticuerpos (50),pacientes con enfermedad más grave, en comparación con la enfermedad más leve, tienden a tener títulos de anticuerpos neutralizantes iniciales más altos(56, 57, 58), pero la evidencia emergente sugiere que estas diferencias se pierden en unos pocos meses debido a la rápida disminución de los títulos de anticuerpos (57). Estas dinámicas de anticuerpos son consistentes con las de otras infecciones agudas, incluyendo coronavirus estacionales y pandémicos(33) y probablemente son el resultado de aumentos transitorios en las poblaciones de plasmablastos después de la infección (una etapa de corta duración entre los linfocitos B post-centro germinal y las células plasmáticas; figura 1) (57, 59, 60, 61, 62).
Figura 1.Descripción de la respuesta inmune adaptativa al SARS- CoV-2.
Aunque las mediciones precisas de la duración de los anticuerpos se ven obstaculizadas por las inconsistencias entre los inmunoensayos (63) y la corta duración de muchos estudios longitudinales publicados, ahora se encuentran disponibles varios estudios realizados durante períodos de tiempo más prolongados, que brindan información clave sobre la dinámica de los anticuerpos a largo plazo. Por ejemplo, un estudio encontró que la actividad neutralizante y anti-espiga de IgG y anti-RBD persistía en la mayoría de los pacientes (90% y 60%, respectivamente) 9-11 meses después del inicio de los síntomas (64). Otro estudio mostró que las respuestas de anticuerpos neutralizantes se acumularon 2 semanas después del inicio de los síntomas en 101 de 150 (67,3%) pacientes (en su mayoría ingresados en el hospital), y persistieron durante más de 8 meses después del inicio de los síntomas en todos menos en tres pacientes (65). En general, estos y otros datos (66, 67) son compatibles con respuestas de anticuerpos neutralizantes detectables que duran entre 8 y 12 meses en pacientes con enfermedad grave. Aunque esto representa la mejor estimación actual, a medida que aumenta el tiempo transcurrido desde la aparición del SARS-CoV-2, serán factibles períodos de seguimiento más prolongados, lo que aumentará aún más la precisión de tales estimaciones. A nivel funcional, los estudios han demostrado que las respuestas retardadas de los anticuerpos neutralizantes se asocian con desenlaces mortales y que la neutralización temprana se correlaciona con un aclaramiento viral más rápido (65, 68, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19). Además de los anticuerpos neutralizantes del suero, la evidencia emergente sugiere que la IgA presente en las mucosas del tracto respiratorio podría contribuir a la neutralización viral temprana a un nivel aún mayor que la IgG sérica (69), aunque las contribuciones relativas de estos dos aspectos de la inmunidad humoral en la protección contra la reinfección quedan por investigar a fondo.
Enfermedad leve
En pacientes con Covid-19 más leve que no requieren ingreso hospitalario, la duración de la respuesta humoral parece ser más variable. Un estudio longitudinal de trabajadores de la salud con enfermedad leve encontró que, aunque había una heterogeneidad sustancial entre los individuos en las respuestas de anticuerpos, los anticuerpos contra el dominio espiga S1 (que se correlacionaba bien con la neutralización viral) se volvieron indetectables en 31 de 143 (21.7%) pacientes a los 4-5 meses (70).
Estos resultados son generalmente concordantes con los de un estudio del Reino Unido de 2246 individuos con una presentación que varía desde enfermedad asintomática a leve a moderada, que mostró proporciones similares de reversión a seronegatividad a los 6 meses; sin embargo, como también lo demostraron otros autores (70, 71), los hallazgos estaban estrechamente relacionados con la elección del inmunoensayo (63).
Un estudio longitudinal de 15 pacientes que se recuperaban de una enfermedad leve, realizado durante un período de tiempo más corto, encontró tanto IgG anti-RBD circulante persistentemente como la generación de linfocitos B de memoria anti-RBD (MBC) capaces de producir anticuerpos neutralizantes 3 meses después de la exposición viral estimada (72).
De acuerdo con este hallazgo, un estudio de más de 30000 casos sospechosos o confirmados (el 95% de los cuales tenían síntomas leves o moderados) informó que el 90% de las personas que mostraron seroconversión tenían anticuerpos neutralizantes detectables que se correlacionaron con títulos de IgG anti-espiga. Además, estos anticuerpos dirigidos a espigas persistieron hasta 5 meses después del inicio de los síntomas (73), un período de tiempo respaldado por un estudio de 64 pacientes convalecientes después de una enfermedad leve a moderada(49), proporción de individuos que presentan respuestas humorales primarias débiles (74, 75). Por ejemplo, una investigación de 175 pacientes que se recuperaban de una enfermedad leve mostró que aproximadamente el 30% generaba títulos muy bajos de anticuerpos neutralizantes, y 10 pacientes tenían títulos por debajo del límite de detección (75); los títulos de anticuerpos se correlacionaron bien con la edad, con niveles más altos observados en pacientes mayores (75). En general, la duración de la respuesta inmune humoral es menos clara para pacientes con síntomas más leves, y aunque existe una variación sustancial dentro y entre los estudios, los datos son consistentes con una respuesta prolongada durante 5-6 meses.
Enfermedad asintomática
En pacientes asintomáticos, la disminución de los niveles de anticuerpos circulantes parece ser más pronunciada que en pacientes sintomáticos. Una comparación de 37 pacientes asintomáticos y 37 sintomáticos en China identificó una seroprevalencia de IgG similar durante la fase aguda de la enfermedad (81,1% y 83,8%, respectivamente) (76). Sin embargo, en la fase de convalecencia, 8 semanas después del inicio de los síntomas, el 40 % de los pacientes asintomáticos revirtió a la seronegatividad de IgG en comparación con sólo el 12,9% de los pacientes sintomáticos. También hubo una tendencia a la disminución de los títulos de IgG y las tasas de neutralización en casi todos los pacientes, lo que destaca la naturaleza de corta duración de la respuesta humoral circulante (76). Se extrajeron conclusiones similares de un análisis de 63 individuos asintomáticos en Wuhan, China, de los cuales el 5% no produjo anticuerpos neutralizantes; entre los que sí lo hicieron, los niveles circulantes comenzaron a disminuir después de 25 días (74). Un análisis de 254 personas positivas al SARS-CoV-2 mostró que los pacientes ambulatorios con síntomas más leves o sin síntomas tenían títulos de anticuerpos anti-RBD más bajos (IgA, IgM e IgG) que las personas con enfermedades graves que requieren atención hospitalaria (51). De manera similar, las disminuciones en los títulos de anticuerpos fueron más rápidas en aquellos con síntomas más leves. Los ensayos de neutralización de pseudovirus mostraron que la neutralización viral se correlacionó bien con los títulos de IgG anti-RBD, y los pacientes hospitalizados mostraron una mayor actividad de neutralización que los pacientes ambulatorios (51). En conjunto, estos estudios sugieren que, aunque la disminución de los títulos de anticuerpos específicos del SARS-CoV-2 es un aspecto intrínseco del curso de la enfermedad, la magnitud inicial de la respuesta y la velocidad de disminución varían con la gravedad de la enfermedad. No obstante, las disminuciones en los títulos de anticuerpos observadas en estos estudios son posiblemente consistentes con lo que se conoce sobre la dinámica humoral después de la infección con otros virus respiratorios, como el SARS-CoV y el MERS-CoV20( 32).
Linfocitos B de memoria
Aunque los anticuerpos circulantes proporcionan un medio sencillo de estimar la protección inmunitaria, no son la única medida de inmunidad a largo plazo. Después del aclaramiento viral, la población de plasmablastos productores de anticuerpos se contrae, dejando un conjunto de MBC (células de memoria B) especializadas (77), lo que probablemente explica la caída de los anticuerpos circulantes observada en varios estudios (57, 59), experimentan una expansión clonal extensa (80), aumentan en frecuencia, (77, 78, 79, 80, 81) y pueden generar potentes anticuerpos neutralizantes contra el RBD, después de la re-exposición (72, 78). Por lo tanto, la longevidad de las MBC capaces de producir anticuerpos neutralizantes podría contrarrestar los escollos de una respuesta de anticuerpos circulantes relativamente breve (78).
La producción de MBC también podría proporcionar una indicación útil del tiempo transcurrido desde la infección hasta la resolución de la enfermedad. Por ejemplo, se ha encontrado que la frecuencia de MBC se correlaciona negativamente con la duración de los síntomas (82) y aumenta después de la recuperación de la infección (83), lo que indica un papel potencial en la mejora de la gravedad de la enfermedad. Aunque sería beneficioso realizar más estudios que caractericen la dinámica de las CBM después de la infección y la vacunación (41, 84, 85), tales estudios requieren el uso de ensayos engorrosos que podrían no ser factibles en muchos entornos clínicos o incluso académicos.
Investigación futura: preguntas sin respuesta y estudios propuestos
¿Cuál es el umbral protector mínimo de los anticuerpos neutralizantes séricos anti-SARS-CoV-2?
Se necesitan estudios de provocación en humanos (41) en los que la dosis infecciosa pueda controlarse cuidadosamente y los títulos de anticuerpos neutralizantes medidos longitudinalmente después de la provocación y la re-exposición; las limitaciones de este enfoque incluyen la posibilidad de que la susceptibilidad aumente en condiciones artificiales (84).
¿Se mantiene la inmunidad protectora contra la re–exposición homóloga en ausencia de una respuesta de anticuerpos neutralizantes primarios suficientes?
Deben realizarse estudios de cohorte prospectivos en los que se haga un seguimiento de los individuos desde una infección primaria hasta una secundaria, con análisis serológicos y genómicos en cada momento; solo deben incluirse pacientes sin exposición previa conocida al SARS-CoV-2.
¿En qué medida la variación de la cepa después de la infección primaria influye en la probabilidad de reinfección?
Se necesitan estudios genómicos para examinar la probabilidad de reinfección con cepas homólogas en comparación con cepas heterólogas. También se requieren estudios inmunológicos in vitro e in vivo que controlen las diferencias en las cepas.
¿En qué medida la memoria inmunológica proporciona una protección duradera contra la reinfección?
Las poblaciones de linfocitos T y linfocitos B de memoria deben medirse a lo largo del tiempo en participantes con infecciones primarias; las tasas de reinfección deben compararse en grupos de pacientes clasificados de acuerdo con medidas de memoria inmunitaria (p. ej., capacidad neutralizante pseudo viral de linfocitos B de memoria a los 6 meses después de la infección)
¿Por qué algunas infecciones secundarias dan como resultado una enfermedad menos grave, mientras que otras causan una enfermedad más grave en relación con las infecciones primarias?
Se debe realizar un seguimiento de las cohortes de pacientes a lo largo del tiempo, con medidas de múltiples aspectos de la respuesta inmune, además de las características clínicas, después de la exposición primaria y secundaria; las limitaciones de este tipo de estudio podrían incluir la dificultad para controlar las diferencias genéticas en las cepas infectantes, lo que podría influir en la exposición y las variables de resultado.
¿Cómo se relacionan los repertorios inmunitarios específicos del compartimento con las respuestas inmunitarias de la sangre periférica?
Se necesitan más estudios para comparar el líquido de lavado broncoalveolar con muestras pareadas de sangre periférica de pacientes infectados(85).
Varios estudios han observado un aumento de las poblaciones atípicas de CBM (que no expresan ni regulan a la baja CD21 o CD27, las características distintivas clásicas de las CBM) en pacientes con enfermedad grave, lo que coincide con los hallazgos de infecciones crónicas como la malaria y el VIH (83, 86). Aunque la importancia funcional de estos CBM atípicos no se comprende por completo, su frecuencia disminuye con la recuperación y aumenta en los pacientes que mueren por COVID-19, lo que sugiere una asociación con un pronóstico malo de los pacientes (83). Es probable que persista durante más de 6 meses después de la infección primaria.
Aunque la contribución relativa de la memoria inmune a la protección duradera contra la reinfección con SARS-CoV-2 no está clara, la evidencia emergente sugiere que las CBM podrían evolucionar hacia perfiles no neutralizantes con el tiempo, particularmente en pacientes mayores, destacando el beneficio de la vacunación(87).
Inmunidad mediada por células en la infección natural por SARS-CoV-2
Existe evidencia substancial sobre el papel de la inmunidad celular en respuesta a la infección por virus respiratorios. Mientras que las respuestas de anticuerpos a una variedad de virus respiratorios, incluidos el SARS-CoV y el virus de la influenza A, son transitorias, la respuesta de los linfocitos T, que se dirige contra proteínas internas (en el caso de los linfocitos T citotóxicos) y conservadas, tiende a ser más prolongada(88). Por ejemplo, en un seguimiento de 6 años de pacientes infectados con SARS-CoV, se encontraron células T de memoria (MTC) en el 61% de los pacientes, mientras que las MBC estaban ausentes (27). Varios estudios de SARS-CoV y MERS -CoV también muestra la importancia de una respuesta de linfocitos T para mantener la protección inmunológica a largo plazo y disminuir la gravedad de la enfermedad clínica (88, 89, 90). De manera similar, la gravedad de COVID-19 se asocia negativamente con los recuentos de linfocitos T (la linfopenia es un signo clásico de COVID-19 grave) (91) y se asocia positivamente con la abundancia de citocinas proinflamatorias (92, 93, 94).
Por lo tanto, varios estudios apuntan a la considerable importancia de una respuesta mediada por células adecuadamente proporcionada para efectuar la eliminación del SARS-CoV-2. El enfoque principal de estos estudios, que han abarcado cohortes de pacientes de diversa gravedad clínica de varios países de todo el mundo, ha sido el análisis funcional de las células T que circulan en la sangre periférica, incluidos los repertorios clave de células T de ayuda CD4+(95) y células T citotóxicas CD8+(96) (figura 1). Sin embargo, la correlación entre las respuestas celulares periféricas y las respuestas residentes en el tejido puede ser deficiente (85, 97), lo que sugiere que los estudios futuros deberían centrarse en los repertorios inmunitarios específicos del compartimento tisular en cuestión.
Respuestas mediadas por células acorde a la gravedad de la enfermedad
Se han utilizado varias técnicas para definir las especificidades de los epítopos de la respuesta de los linfocitos T, ya que su amplitud tiene implicaciones importantes para la probabilidad de un escape inmunológico viral. En particular, se han utilizado megapools que combinan una gran cantidad de epítopos para mapear de manera integral las especificidades de unión del epítopo de las células T CD4+ y CD8+ en la totalidad del proteoma viral en pacientes convalecientes de una variedad de cursos de enfermedad, revelando varios hechos claves. Primero, las proteínas virales altamente expresadas tienden a tener una respuesta de células T CD4+ proporcionalmente grande montada contra ellas, con los tres objetivos principales que incluyen proteínas de espiga (27%), membrana (21%) y nucleocápside (11%) (98); una asociación que es corroborada por otra investigación sobre las especificidades de los epítopos reconocidos por linfocitos CD4 + y CD8+(99). En segundo lugar, las respuestas pico de linfocitos CD4+ específicas se correlacionan bien con la magnitud de los títulos de IgG anti-RBD, lo que indica una respuesta celular y humoral coordinada contra el virus(98). De hecho, una falla en la coordinación de las respuestas inmunes humoral y celular, se asocia con una enfermedad más grave(100, 101). En tercer lugar, los individuos asintomáticos pueden desarrollar una respuesta de MTC (linfocitos T de memoria) robusta incluso en ausencia de anticuerpos detectables (98, 101, 102, 103). Por último, los linfocitos T CD4+ y CD8+ tienen una gran amplitud de epítopos virales que pueden reconocer , entre 19 y 17 por persona, respectivamente, de acuerdo a un estudio(99). En conjunto, estos resultados muestran que la inmunidad mediada por células a la infección por SARS-CoV-2 es sólida y duradera ante pequeños cambios mutacionales.
De manera similar a la respuesta humoral, la magnitud de la respuesta mediada por células parece estar asociada con la gravedad de la enfermedad. Por ejemplo, en un estudio retrospectivo de dos centros de 1018 pacientes ingresados en el hospital con COVID-19 confirmado, todos los recuentos de linfocitos T fueron más bajos en los que no sobrevivieron en comparación con los que si sobrevivieron, una diferencia que fue particularmente pronunciada para los linfocitos T
CD8+. De hecho, un análisis multivariable ajustado por edad, sexo y condiciones subyacentes encontró que los números bajos de linfocitos T CD8+ era un factor de riesgo independiente para la mortalidad (104). Estos resultados concuerdan con los de un análisis longitudinal de una pequeña cohorte de pacientes con enfermedad grave, que reveló asociaciones entre la detección temprana de células T secretoras de IFN-γ específicas del SARS-CoV-2, un aclaramiento viral más rápido y una sintomatología más leve(105). Los recuentos de linfocitos T fueron un 60% más bajos en pacientes en cuidados intensivos que en aquellos con enfermedad más leve(106).
Hay también efectos negativos de la producción excesiva de citocinas proinflamatorias tanto en la evolución clinica de los pacientes(104 ) como en los recuentos de linfocitos T (106),lo que indica el efecto de la sobreproducción de citocinas proinflamatorias sobre la disminución en la sobrevida y proliferación de los linfocitos T. Acorde con la importancia de los linfocitos T para mitigar los resultados graves de la infección Covid-19, los recuentos de linfocitos T específicos contra SARS-CoV-2 disminuyen con el aumento de la edad (106), explicando la bien documentada probabilidad de un peor pronóstico en las personas mayores (107). De hecho, en los pacientes con una enfermedad más grave, hay una sobreexpresión en la membrana celular de PD-1( un marcador de agotamiento de las células T, que participa en la muerte de células por apoptosis)(106). Tomados en su conjunto, estos hallazgos sugieren que una respuesta eficaz de los linfocitos T protege contra la evolución hacia estados graves en la infección por SARS-CoV-2.
La memoria inmunitaria mediada por Linfocitos
El desarrollo de la memoria inmunitaria mediada por células puede proporcionar protección a largo plazo contra enfermedades graves tras una re-exposición al virus. Varios estudios de coronavirus pandémicos anteriores han demostrado que las respuestas de MTC duran más que las de las CBM (27, 108) y protegen contra el desarrollo de la enfermedad grave tras la re-exposición (88, 89, 90) Por ejemplo, ratones con MTC CD8+, pero sin MTC CD4+ o CBM, que reciben una dosis alta del SARS-CoV montaron una respuesta inmune eficaz, incluida la producción de citocinas y sustancias citolíticas, lo que condujo a una reducción en la carga viral y permitió que los ratones sobrevivieran a una dosis letal de SARS-CoV (90).La Investigación sobre aspectos de la respuesta mediada por células a la infección por SARSCoV-2 ha demostrado que la infección induce la generación de MTC citotóxicas de larga duración. Un estudio longitudinal estima que la vida media de los MTC CD8+ es de 125-225 días(81). La mayoría de estos MTC CD8+ se caracterizaron fenotípicamente como linfocitos de memoria efectores diferenciadas en forma terminal (81). La memoria inmune mediada por células es importante no solo por derecho propio, sino también porque su coordinación con la respuesta inmune humoral tiene un papel importante en la producción de MBC. Los linfocitos auxiliares foliculares T (THF), un subconjunto especializado de linfocitos T CD4+ que se encuentran en la zona de células B de los órganos linfoides secundarios (ganglios, placas de Peyer en Intestino y bazo), juegan un papel clave en este proceso. Estos linfocitos proporcionan co-estimulación a los linfocitos B del centro germinal para efectuar su selección positiva, proliferación y diferenciación en células plasmáticas secretoras de anticuerpos de larga vida y MBC (figura 1) (110). Por lo tanto, el análisis de las células THF que circulan en la sangre periférica proporciona un proxy útil para comprender el alcance de la memoria inmunitaria humoral resultante de la infección por SARS-CoV-2(111) .Los resultados mostraron una estabilidad considerable de estas células, incluyendo los THF específicos para la proteína espiga viral, durante periodos prolongados (>6 meses)(81). Notablemente, los linfocitos que expresan el receptor para quimiocina 6, que se asocia con una gravedad reducida de COVID-19 (100), comprenden una gran parte de las poblaciones de linfocitos THF (72 81, 100, 111) y persisten, o incluso aumentan(81) en frecuencia sobre largos períodos de tiempo. Se sabe que los linfocitos T reaccionan contra epítopos del virus más conservados que los anticuerpos(88) y que desempeñan funciones claves en la eliminación viral y la reducción de la gravedad de la enfermedad tras la re-exposición; conjuntamente con el establecimiento de grupos de linfocitos B que producen anticuerpos contra SARSCov-2 de alta afinidad ( 112), estos datos sugieren que la memoria inmunitaria mediada por células contra el SARS-CoV-2 proporciona una protección eficaz contra la re-infección
Inmunidad humoral y prevención de la re-infección.
Si bien muchos estudios han examinado la dinámica temporal de la respuesta humoral al SARS-CoV-2, un número más pequeño, pero creciente, ha evaluado si una disminución de la inmunidad humoral reduce la protección contra la re-infección, una cuestión que tiene implicaciones para la eficacia de las estrategias de control. Desafortunadamente, los informes de re-infección son confusos por varios factores, incluida la positividad duradera a los ensayos de RT-PCR (113), la diseminación viral persistente y la re-activación viral, todo lo cual dificulta y causa incertidumbre para distinguir los casos reales de re-infección de los casos de Infección singular con positividad prolongada. Algunos estudios han podido desentrañar estas dos posibilidades distintas utilizando la secuenciación genómica, ya sea sola o en combinación con información sobre el período de tiempo entre pruebas positivas, intercaladas por una o más pruebas negativas (6, 7, 8, 9, 10, 11, 12, 13, 14). Los casos en los que los períodos de tiempo entre las infecciones primarias y secundarias fueron breves y el cambio genético fue mínimo, en particular para algunos pacientes de China (14 ) podrían no representar casos reales de re-infección, pero sí casos de infección prolongada determinada por positividad en la prueba de PCR (los pacientes pueden seguir siendo positivos por PCR> 6 semanas después de la infección, especialmente cuando la muestra se toma del tracto respiratorio inferior, sangre o heces (113, 114). Este riesgo puede evitarse definiendo la re-infección sobre la base de un intervalo de tiempo mínimo entre las infecciones primarias y secundarias que sea mayor que la duración máxima conocida de la positividad de la PCR (p. Ej., 60 días o 90 días)(17, 19), o utilizando un periodo más corto pero en combinación con la confirmación genómica(18). Además de la evidencia de los estudios de casos, los hallazgos de grandes estudios epidemiológicos proporcionan datos informativos sobre el efecto protector de la respuesta de anticuerpos y el riesgo de re-infección. Por ejemplo, dos grandes estudios de cohortes prospectivos del Reino Unido, uno que siguió a 12541 trabajadores de la salud durante 7 meses(16) y otro que siguió a 20787 trabajadores de la salud durante 5 meses(15), estimaron que los individuos que eran seropositivos para IgG anti-espiga al inicio del estudio tenían un riesgo de infección reducido del 88% y 83%, respectivamente, en relación con los que eran seronegativos al inicio del estudio. En ambos estudios, la mediana del tiempo hasta la re-infección fué de 5-6 meses (15, 16).
Los datos de población general son actualmente escasos, pero un gran estudio danés de observación digital que utilizó un conjunto de datos a nivel de población danesa de 4 millones de individuos(19) se suma a los hallazgos de los estudios del Reino Unido. Los datos del estado serológico no estaban disponibles, pero el estudio de 12 meses mostró que la positividad de la PCR al inicio del estudio se asoció con un 77- 83% menos de riesgo de re-infección en comparación con la negatividad de la PCR al inicio del estudio. Sin embargo, las personas de 65 años o más que resultaron positivas a la PCR al inicio del estudio tenían una probabilidad de re-infección del 47%, lo que sugiere que la longevidad de la respuesta inmune esterilizante podría reducirse en las personas ancianas.
El estudio también mostró que la protección estimada contra la re-infección no cambió en el tiempo transcurrido desde la infección primaria, lo que sugiere que la protección contra la re-infección podría, de hecho, durar 12 meses o más.
La discrepancia entre los resultados del tiempo de re-infección de los estudios del Reino Unido y Dinamarca podría explicarse potencialmente por la elección del entorno del estudio. Dado que los trabajadores de la salud tienden a estar más cerca de los pacientes infecciosos y, por lo tanto, es probable que reciban cargas virales más altas y encuentren una mayor variedad de cepas virales que los individuos de la población general, se podría esperar que los períodos de re-infección sean más cortos en esa subpoblación.
Otro estudio de cohorte retrospectivo, que involucró a 3,2 millones de personas en los EE. UU., mostró que las personas que eran seropositivas para anticuerpos IgG, IgA o IgM al inicio, tenían un riesgo diez veces menor de dar positivo en la prueba de PCR 90 días después, en comparación con aquellos que fueron seronegativos al inicio (17). Corroborando estos hallazgos, los resultados de un estudio de cohorte prospectivo en Qatar indicaron que, durante un período de 7 meses, la incidencia de re-infección entre individuos inicialmente seropositivos fue casi un 95% menor que en individuos inicialmente seronegativos. Al igual que en la cohorte danesa, no hubo evidencia de disminución de la inmunidad contra la re-infección durante el período de 7 meses de observación (18). Aunque los estudios observacionales están limitados por el corto período de tiempo desde la aparición del SARS-CoV-2, la evidencia actual sugiere que la re-infección puede ocurrir dentro de 5 –12 meses de la infección primaria, período similar al de otras infecciones virales respiratorias agudas (15, 16, 17, 18, 19, 35, 36, 37, 39, 115, 116, 117, 118 , 119, 120, 121, 122). No obstante, no está claro si el tiempo de re-infección sugerido por los datos disponibles podría acortarse con el escape de la neutralización por variantes de preocupación (COV), incluido (pero no limitado a alfa (B. 1.1.7), variantes beta (B.1.351) y gamma (P.1), y el linaje B.1.617, un subtipo del cual es la variante delta (B.1.617.2) (123, 124, 125, 126, 127, 128). Si bien los estudios de otros virus respiratorios como el coronavirus humano y la influenza A sugieren que la re-infección homóloga es infrecuente (84, 115), la imagen es menos clara para el SARS-CoV-2. En general, la investigación destacada aquí demuestra que la respuesta humoral es un elemento clave de la respuesta del huésped a la protección del SARS-CoV-2 contra la re-infección.
Inmunidad adaptativa después de la vacunación contra el SARS-CoV-2
Evidencia de ensayos de vacunas
Además de las infecciones naturales, también existe evidencia de una respuesta inmune robusta y potencialmente duradera que surge de las vacunas autorizadas contra el SARS-CoV-2 (4,129). Se ha desarrollado una gran variedad de vacunas contra el SARS-CoV-2, 11 de las cuales han demostrado su eficacia en ensayos de fase 3 y más de 270 están en desarrollo(130, 131). Se sabe que las vacunas de vectores adenovirales en particular, como las desarrolladas para el ébola(132) y la malaria(133) y, más recientemente, el SARS-CoV-2 (4,129) inducen una fuerte respuesta de inmunidad celular. Por ejemplo, un ensayo de fase 1/2 de la vacuna del vector de adenovirus SARS-CoV-2 ChAdOx1 nCoV-19 (Oxford-AstraZeneca) mostró que la vacunación provocaba una respuesta de células T específica contra la espiga del virus tan pronto como 7 días después de la vacunación, que se mantuvo hasta el día 56 (129). Un ensayo de seguimiento de fase 2/3 utilizando un ensayo de inmunospot ligado a enzima de IFN-γ ex vivo en células mononucleares de sangre periférica mostró que los linfocitos T específicos contra la espiga viral alcanzaron su punto máximo 14 días después de la dosis inicial y se mantuvieron en niveles altos en todos los grupos de edad hasta el día 42, último día de medición, (134). Otras vacunas contra el SARS-CoV-2 también se han mostrado muy buenas. Los primeros datos de ensayos clínicos sobre la vacuna de ARNm BNT162b2 (Pfizer-BioNTech) demostraron una efectividad del 95% contra la enfermedad, medida al menos 7 días después de la segunda dosis, en personas mayores de 16 años; sin embargo, los datos posteriores han mostrado reducciones en la efectividad contra las variantes en circulación reciente (125,135). En un ensayo de fase 1/2 de esta vacuna, se generaron respuestas fuertes y correlacionadas de linfocitos T CD4+ y CD8+ contra una variedad de epítopos de la espiga viral, 7 días después de la segunda dosis (136).
Además, la vacuna mRNA mRNA-1273 (Moderna) provocó una sólida respuesta de linfocitos T CD4+ , con producción simultánea de IL-2, factor de necrosis tumoral e IFN-γ(137). Aunque los planes de implementación de la vacuna implican la dosificación de tipos de vacunas homólogas, los resultados de un estudio in vivo sugieren que la dosificación con tipos heterólogos podría conducir a una respuesta mediada por células aún más robusta, (138) y, por lo tanto, podría proporcionar una protección más duradera contra los síntomas graves.
Hay muy buena evidencia que la vacunación heteróloga usando AstraZeneca como primera dosis y Pfizer como segunda dosis genera una robusta respuesta inmune humoral y celular. Empiezan a publicarse datos que apoyan el uso de una dosis de refuerzo con vacunas homóloga ó heteróloga 6 meses después de la segunda dosis en esquemas que usaron vacunas Pfizer y Moderna. Recientemente, el fabricante de la vacuna Johnson&Johnson reportó resultados que favorecen el uso de una segunda dosis de la vacuna después de 6 meses de la primera dosis, en personas mayores de 60 años o con su sistema inmunocomprometido.
Numerosos ensayos han mostrado fuertes respuestas humorales en los participantes después de la vacunación. Por ejemplo, se observó un aumento en la IgG anti-espiga después de la administración de la segunda dosis de la vacuna AstraZeneca, que se correlacionó bien con los títulos de anticuerpos neutralizantes en todos los grupos de edad (134). Además, un ensayo de fase 1/2 de la vacuna BNT162b2 identificó que los títulos de neutralización después de la dosis primaria excedían los observados entre los pacientes convalecientes con infección natural; Sin embargo, investigaciones más recientes han encontrado que los infectados antes de la vacunación desarrollan respuestas inmunes similares o más fuertes que las de los individuos vacunados con dosis doble y no expuestos previamente (136, 139). Las respuestas humorales después de la vacunación con ARNm-1273 también fueron sustanciales, con neutralización del suero detectable en todos los participantes después de la segunda dosis (137)
Correlatos de protección
Los ensayos de vacunas de fase 3, junto con los datos emergentes sobre casos reducidos, ingresos hospitalarios y muertes (140, 141) demuestran el éxito del lanzamiento de la vacuna en varios países del mundo. Estos ensayos, realizados antes de que se detectaran los COV, utilizaron el título de anticuerpos neutralizantes como un correlato de protección (es decir, un marcador inmune, o umbral, asociado con la protección contra infecciones o enfermedades) (139). Primero, en ausencia de correlatos confiables de protección, es probable que el desarrollo de vacunas de la siguiente generación se retrase sustancialmente con respecto a la aparición de nuevas variantes, ya que se deben realizar ensayos de campo grandes y costosos para establecer la efectividad de la vacuna contra estas variantes más nuevas. Frente a las mutantes de escape de la vacuna, estos ensayos controlados aleatorios pueden volverse poco éticos (o, en poblaciones de baja incidencia, inviables). En segundo lugar, la identificación de correlatos específicos de protección permitiría comparaciones directas de diferentes vacunas a través de umbrales inmunológicos, en lugar de a través de tasas brutas de efectividad (130, 142). Por último, aunque no de manera exhaustiva, la información sobre correlatos de protección podría usarse para informar los parámetros del modelo matemático, con el potencial de usarlos para predecir la durabilidad de la protección derivada de la vacuna y para informar sobre intervenciones pandémicas y post-pandémicas.
Para infecciones agudas como el SARS-CoV-2, los anticuerpos neutralizantes (o no neutralizantes, pero funcionales) a menudo se consideran un correlato apropiado de protección (35, 131, 143), una suposición respaldada por la evidencia sobre la protección contra la reinfección (6-19). No obstante, delinear umbrales de títulos específicos es un desafío problemático por varias razones; por ejemplo, los correlatos de protección probablemente difieran entre la infección y la vacunación, y entre los diferentes tipos de vacunas, y podrían verse alterados por la exposición previa (136, 139, 144, 145 ),variantes emergentes e inmunodeficiencia (143). Además, el hecho de que se preste especial énfasis a los correlatos de la protección contra la infección o la enfermedad, determinará los marcadores y los umbrales que se identifiquen como importantes. Un ejemplo notable es la vacunación contra el sarampión, para la cual los títulos de anticuerpos específicos brindan protección contra la enfermedad pero no siempre contra la infección (143, 146). Aunque los correlatos de protección de la vacuna contra el SARS-CoV-2 permanecen no bien definidos (143, 147) un análisis estadístico de los datos de fase 3 de siete vacunas indicaron que los títulos de anticuerpos neutralizantes o títulos de IgG medidos entre 1 y 4 semanas después de la segunda dosis (ambos calibrados con un estándar común) podrían explicar el 78% y el 94%, respectivamente, la variación en la eficacia de la vacuna(130). Es importante destacar que estos hallazgos son consistentes con las asociaciones reportadas entre la reducción de la neutralización viral de los COV y la reducción de la efectividad de la vacuna (128, 148, 149, 150, 151); de igual modo, también apoya la noción planteada anteriormente de que los anticuerpos inducidos por la vacuna no necesitan ser neutralizantes para tener un efecto protector (131). Otro estudio que examinó los correlatos inmunitarios de la protección mediante la incorporación de datos de siete ensayos de vacunas y de muestras de suero convaleciente en un modelo predictivo, estimaron que los títulos de neutralización requeridos para la protección contra formas graves de COVID-19 eran más de 6,5 veces más bajos que los encontrados contra infecciones detectables (152). Esto sugiere que aunque las reinfecciones podrían ser probables con la disminución de la inmunidad protectora, estos casos generalmente deberían ser más leves. Este modelo también sugirió que las vidas medias de los anticuerpos neutralizantes eran similares entre la infección natural y la vacunación(152).
Sin embargo, se requiere más investigación para corroborar estos hallazgos, y es probable que otros marcadores inmunológicos tengan una influencia importante en la inmunidad protectora después de la vacunación (p. Ej., MBC)(153) y podrían explicar los casos de protección en presencia de títulos bajos de anticuerpos neutralizantes (131). Se necesitará una delimitación más detallada de los correlatos de protección, incluidos los umbrales de títulos de anticuerpos protectores (152), además de otros marcadores inmunológicos importantes, para ayudar a los estudios epidemiológicos y al desarrollo y lanzamiento de vacunas de próxima generación en los próximos meses y años.
Vacunas de una sola dosis inicial
La mayoría de las vacunas COVID-19 autorizadas utilizan una estrategia (homóloga) de dos dosis de refuerzo primario, con solo unas pocas excepciones, incluida la vacuna de dosis única de adenovirus-vector Ad26.COV2.S (Johnson&Johnson,Janssen) (154). Si esta estrategia general debe aplicarse independientemente de la historia de infección individual ha sido cuestionada por los datos emergentes. La evidencia acumulada sugiere que la respuesta inmune posterior a la vacuna en individuos infectados antes de la vacunación primaria podría ser similar, o incluso más robusta, que en individuos no expuestos que reciben dosis de refuerzo convencionales (136, 139, 144, 145).
Sin embargo, es importante señalar que siguen existiendo muchas incertidumbres que podrían hacer que el suministro diferencial de segundas dosis en función del estado de exposición (144) sea una estrategia arriesgada. Por ejemplo, no está claro si los individuos expuestos y vacunados con dosis primarias tendrían una protección similar contra la re-infección con COV en comparación con los individuos no expuestos que reciben dosis convencionales de refuerzo, aunque los estudios in vitro sugieren que esto podría ser posible (153). Los datos sobre la protección de la vacuna contra los COV son claros: dos dosis brindan una protección sustancialmente mayor contra la infección por COV que una dosis, independientemente de la vacuna(125, 135).Además, la dinámica a largo plazo de las células inmunitarias relevantes puede diferir sustancialmente según cuál de estas dos estrategias se utilizan; los primeros datos(136, 139, 144, 145, 153) solo están comenzando a emerger para permitir una evaluación rigurosa de esta cuestión. Un enfoque más cauteloso, pero que aún reconoce la importancia de la evidencia presentada, podría ser priorizar las segundas dosis para las personas no expuestas previamente, (144) pero seguir proporcionando segundas dosis a las personas expuestas cuando sea logísticamente posible. Este enfoque está respaldado por datos que muestran que las infecciones por irrupción entre los receptores de una segunda dosis ocurren con menos frecuencia en individuos previamente expuestos que en los no expuestos (incidencia acumulada de 3 meses de 0,42% entre los receptores de dosis de refuerzo de BNT162b2 previamente expuestos en comparación con 0,9% entre los receptores de dosis de refuerzo no expuestos previamente) (155). A pesar de esto, en entornos de escasos recursos con existencias limitadas de vacunas, centrar las segundas dosis en los que anteriormente no estaban expuestos (153) podría proporcionar un medio de asignación de recursos que reduzca la carga sobre los sistemas de salud pública.
Respuesta inmune frente a variantes preocupantes
La aparición de varias variantes a finales de 2020 con sustituciones en el RBD (en particular Lys417Asn, Glu484Lys y Asn501Tyr)(156) que aumentan la afinidad de unión a ACE2(157) ha generado preocupaciones sobre la eficacia de las vacunas. Aunque hay pocos datos (y menos datos revisados por pares) sobre la respuesta de los linfocitos T a los COV, los que existen son alentadores. Por ejemplo, un estudio de 121 trabajadores de la salud que recibieron la vacuna BNT162b2 no mostró cambios en la activación de las células T CD4+ cuando las muestras de suero se estimularon con combinaciones de proteínas de espiga variantes alfa y beta en comparación con la proteína S de la cepa original (158) Además, los hallazgos de un estudio que tomó muestras de suero de individuos 14 días después de recibir su segunda dosis de la vacuna BNT162b2 o mRNA-1273 mostró que los MTC eran igualmente reactivos a la cepa ancestral y a los COV (alfa, épsilon [B.1.429, también conocido como CAL20C], y gamma), con la excepción de la variante beta, para la cual las respuestas CD4 + y CD8+ fueron 29% y 33% más bajas, respectivamente(159). Otro estudio encontró que las respuestas de linfocitos T CD8+ de individuos convalecientes reconocieron la mayoría de epítopos de variantes circulantes, con la excepción de una mutación de espiga (Asp80Ala) de la variante beta(160). Aunque los dos últimos estudios no se basan en muestras de suero de individuos vacunados, estos datos sugieren que la reacción cruzada de linfocitos T debe proporcionar cierto nivel de protección contra los COV. Sin embargo, como los correlatos de protección no están bien definidos (143, 147) el grado de mutación epitópica que conduciría al escape inmunológico de esta reactividad cruzada sigue sin estar claro, aunque la evidencia emergente sugiere que el escape de la neutralización por los COV podría ser considerable. En conjunto, estos resultados sugieren que la vacunación contra el SARS-CoV-2 provoca una fuerte respuesta mediada por células que podría ser resistente a los cambios en el genoma viral, incluidos los del RBD. No obstante, existe una escasez de pruebas sobre la respuesta mediada por células a los COV, lo que limita nuestra comprensión.
También están surgiendo datos sobre la respuesta humoral a los COV, y varios estudios señalan una reducción de la neutralización viral en respuesta tanto a la infección natural como a la vacunación(123, 124, 156, 161, 162, 163, 164).
Los más notables son los informes múltiples de la variante beta que evade la neutralización del suero de los individuos vacunados. Por ejemplo, entre los individuos que recibieron dos dosis de la vacuna BNT162b2 o mRNA-1273, un estudio encontró que la actividad neutralizante contra la variante Beta era 10-12 veces menor que la demostrada contra la cepa original (156). Además, estos efectos parecen traducirse en una disminución de la eficacia de la vacuna: un ensayo sudafricano de la vacuna AstraZeneca mostró una disminución sustancial en la eficacia contra COVID-19 leve a moderado (medido ≥14 días después de la segunda dosis) causada por la variante beta (eficacia del 10%) en comparación con las variantes sudafricanas anteriores (eficacia del 75%) (148). Estos resultados también concuerdan con los de un análisis intermedio de un ensayo de la vacuna de proteína de espigas de nanopartículas NVX-CoV2373 (Novavax ; aún no publicado formalmente), que mostró menor eficacia contra la variante beta que contra variantes anteriores(149) Entre otras variantes, la neutralización viral de muestras de suero de individuos que han recibido dos dosis de BNT162b2 o las vacunas mRNA-1273 ,también disminuyen contra las variantes gamma y zeta (P.2), de 4 a 7 veces y de 3 a 6 veces, respectivamente (124). Varios estudios que utilizaron suero de personas que recibieron BNT162b2 o las vacunas de ARNm-1273 han mostrado una neutralización marginalmente reducida frente a la variante alfa(163, 164) o perfiles de neutralización prácticamente inalterados frente a varias variantes (124, 156, 165) -eficacia de la vacuna contra la infección sintomática de 81,5% (cepa BetaCoV / Australia / VIC01 / 2020) a 70,4% (variante alfa) para la vacuna ChAdOx1 nCoV-19 (medida> 14 días después de la dosis de refuerzo) (150) y de 95,6% a 85,6% para la vacuna NVX-CoV2373 (punto de tiempo de medición aún no informado) (151). Los primeros datos sobre el linaje B.1.617, que tiene dos mutaciones RBD, sugieren que puede evadir la neutralización por anticuerpos inducidos por infección o vacunación con eficiencia moderada (126, 127). Se ha informado que la eficacia después de una dosis única de las vacunas BNT162b2 o ChAdOx1 nCoV-19 contra la enfermedad sintomática a través de la infección de la variante delta es de 33,5%, aumentando a 87,9% (BNT162b2) o 59,8% (ChAdOx1 nCoV-19) después de dos dosis (medidas ≥3 semanas después de la vacunación) (135). No obstante, la aparición de los síntomas se ha registrado de forma deficiente en los datos de las pruebas y se considera poco fiable. Además, los datos genómicos completamente secuenciados son escasos; por lo tanto, se requieren más datos publicados que corroboren estos hallazgos.
Otro método para evaluar la durabilidad de la inmunidad obtenida por la vacuna contra los COV es examinando los datos emergentes sobre las infecciones de avance (las que ocurren en individuos vacunados). En una cohorte de 417 personas en la ciudad de Nueva York, EE. UU., se identificaron dos infecciones irruptivas en personas que habían recibido su segunda dosis 19 y 36 días antes (166). Los datos de secuenciación indicaron que la variante del SARS-CoV-2 en cada paciente tenía un pico clave de mutaciones, incluida una mutación Glu484Lys en un paciente, que se reconoce que facilita la evasión viral a la neutralización por anticuerpos. El análisis del suero de este paciente reveló altos niveles de anticuerpos neutralizantes (166) apoyando aún más la noción de escape viral a la neutralización (presumiblemente provocados por la vacuna). Otro estudio, de Israel, que secuenció genomas de 817 hisopeados nasofaríngeos de individuos vacunados con BNT162b2 mostró que las variantes alfa y beta estaban representadas de manera desproporcionada en las infecciones intercurrentes (definidas como aquellas que ocurren ≥14 días después de la primera dosis, o ≥7 días después de la segunda dosis). Específicamente, comparado con los controles no vacunados, una mayor proporción de individuos vacunados con las dos dosis mostró evidencia de infección por la variante beta, mientras que una mayor proporción de individuos vacunados con la primera dosis se infectaron con la variante alfa(167).
De los diseños de estudio que permiten estimar la prevalencia, hasta ahora se han identificado infecciones de avance entre los receptores de primera dosis con una prevalencia del 2,6% (vacunados con BNT162b2 o mRNA-1273, sin secuenciación) (169) y entre los receptores de las dos dosis con una prevalencia del 0,48% (vacunados con BNT162b2 o ARNm-1273, variante alfa o variante similar a iota [linaje B.1.526])(166), 0,89% (vacunados con BNT162b2, todas las variantes alfa)(155) y 2 % (Vacunados con BNT162b2 o mRNA-1273, no se realizó secuenciación) (169). Otro estudio, que no agrupó a los participantes por dosis de vacuna, encontró una prevalencia de infecciones por irrupción de 1,13% entre las personas que recibieron las vacunas BNT162b2 o mRNA-1273, aunque no se realizó una secuenciación para identificar las variantes(168). Debido al tiempo relativamente corto desde que comenzó el lanzamiento de la vacuna, queda por ver si las infecciones irruptivas serán sustancialmente más frecuentes en los próximos meses.
No obstante, estos primeros datos sugieren que la durabilidad de la inmunidad inducida por la vacuna se ve afectada por los COV. Sin embargo, es alentador que las infecciones irruptivas parezcan ocasionar con poca frecuencia una transmisión progresiva y que ocurran con menos frecuencia en personas previamente expuestas que han sido vacunadas(155).
En general, los datos sobre la respuesta inmune a los COV demuestran la necesidad de vacunas contra el SARS-CoV-2 ampliamente protectoras (como también sugirieron varios otros (6, 163)). Aunque la tasa de mutación de los coronavirus es notablemente más baja que, por ejemplo, la del virus de la influenza A, y por lo tanto, en la mayoría de las personas vacunadas, es poco probable que la protección se pierda por completo después de los 12 meses (170).En el corto y mediano plazo actual, las vacunas deberán actualizarse para mantener su eficacia; de hecho, este desarrollo ya está en marcha para las variantes gamma y beta(148). Precisamente cuando este cambio deba ocurrir será guiado por los avances en nuestra capacidad para clasificar específicamente los correlatos inmunitarios de la protección(147). Además, es probable que, incluso con una mayor comprensión de los correlatos de la protección, el desarrollo y el despliegue de vacunas se retrasará sustancialmente con respecto a los brotes causados por nuevos COV y, por lo tanto, la vacunación por sí sola podría ser inadecuada para evitar nuevas epidemias. Se debe prestar especial atención a las poblaciones de mayor riesgo, incluidos los pacientes inmunodeprimidos y los que reciben medicamentos inmunosupresores, que podrían no generar respuestas inmunitarias duraderas, en particular cuando la vacunación no se coordina correctamente con la terapia inmunosupresora (como se demostró entre los pacientes inmunodeprimidos que reciben vacunas antineumocócicas y antigripales)(171). Entre la población general, la menor prevalencia del SRAS-CoV-2 provocada por la vacunación y las intervenciones no farmacéuticas debería conducir a una menor tasa de aparición de nuevas variantes (172), mientras se desarrollan vacunas secundarias .
A partir del 1 de octubre de 2021, algunos países (e.g.U.S.A.,Alemania, Francia, Italia) han comenzado a ofrecer terceras dosis de vacunación ( referente a vacunas Pfizer, Moderna y Johnson&Johnson) a personas de mayor riesgo, incluidos pacientes gravemente inmunodeprimidos, personas mayores y trabajadores de la salud (173, 174). A diferencia de los países mencionados arriba , han habido dos países, Bolivia y Paraguay, cuyas autoridades de salud, decidieron suministrar terceras dosis principalmente con AstraZeneca ( en Bolivia) y Pfizer o AstraZeneca (en Paraguay), a todas las personas mayores de 18 años, que recibieron previamente una o dos dosis de las vacunas SputnikV ó Sinopharm. Debe hacerse hincapié que esas determinaciones intrépidas que contrastan con las de U.S.A., y países Europeos, carecen de estudios científicos que avalen el uso de AstraZeneca en terceras dosis.
Las autoridades de salud de Argentina, que si llevó a cabo estudios preliminares para el uso de AstraZeneca como SEGUNDA dosis en personas que recibieron SputnikV como primera dosis con resultados aún no publicados en revistas científicas, han iniciado dicho esquema de vacunación. Sin embargo, las mismas autoridades han postergado el uso de AstraZeneca como tercera dosis posterior a evaluación hasta el 2022. El esquema puesto en marcha en USA y Europa con las vacunas Pfizer, Moderna y Johnson&Johnson, ha sido objeto de discusión, pero podría estar respaldada por datos que muestran una disminución de la inmunidad contra la infección con la variante delta desde la última vacunación (175) y por estudios que sugieren que una tercera dosis aumenta la magnitud y amplitud de la neutralización viral (176). Se han planteado preocupaciones sobre la equidad de tal decisión, en particular, la equidad de ofrecer terceras dosis en países de ingresos altos, mientras que muchos países de ingresos bajos y medianos tienen existencias de vacunas insuficientes para obtener una primera y una segunda dosis (177). También se está considerando la cuestión de si las terceras dosis deben administrarse a la población en general, y no solo a subpoblaciones específicas (173).
Las decisiones de las autoridades de salud de Bolivia y Paraguay escapa toda explicación científica y más bien parecen tener otros motivos diferentes a los de prevenir la reinfección de sus habitantes.
Conclusiones
En esta revisión, hemos evaluado la evidencia sobre la respuesta inmune adaptativa a la infección y vacunación por SARS-CoV-2, y discutimos las contribuciones relativas de la inmunidad humoral y mediada por células para brindar protección contra la reinfección.
La duración y amplitud de la respuesta humoral a la infección por SARS-CoV-2 varía notablemente según la edad y la gravedad de la enfermedad, con respuestas neutralizantes detectables presentes hasta 1 año después de la infección. Los linfocitos B de memoria generados contra la proteína espiga viral y su dominio de unión al receptor se mantienen durante muchos meses después de la recuperación de la infección y son capaces de generar potentes anticuerpos neutralizantes tras la re-exposición viral. Evidencia de modelos animales, estudios de casos de pacientes y grandes estudios observacionales sugiere que el tiempo de reinfección es de aproximadamente 5 a 12 meses, y que los individuos que inicialmente fueron seropositivos para anticuerpos IgG tienen un menor riesgo de reinfección . La respuesta mediada por células es más poliepitópica que la del sistema humoral, y la magnitud de la respuesta es mayor en pacientes más jóvenes con enfermedad menos grave; una potente respuesta de linfocitos T de memoria específica contra la proteína espiga viral, persiste durante 5-8 meses después de la infección y podría aumentar incluso en presencia de títulos bajos de anticuerpos neutralizantes, lo que reduce la gravedad de la enfermedad tras la re-exposición La vacunación provoca una respuesta inmune específica de picos de mayor especificidad y magnitud que la de la infección natural, pero los datos emergentes sugieren que las respuestas inmunitarias protectoras, la neutralización predominantemente viral y la eficacia de la vacuna contra la infección se ven perjudicadas frente a variantes de interés. Dada la considerable mutación epitópica viral, es probable que las vacunas contra el SARS-CoV-2 deben actualizarse estacionalmente o anualmente para mantener la inmunidad protectora a nivel de la población, como es el caso de otros virus respiratorios endémicos. También, podrían ser necesarias otras intervenciones para prevenir la aparición de más brotes importantes y reducir la incidencia de enfermedades.
Aunque los correlatos inmunitarios de la protección no están bien definidos, los anticuerpos neutralizantes y las respuestas funcionales de los linfocitos T se utilizan a menudo para inferir la solidez de la respuesta inmunitaria a la exposición al SARS-CoV-2. Tras la infección natural, la respuesta mediada por linfocitos T se dirige a una mayor variedad de epítopos que la respuesta humoral y, por lo tanto, podría ser más duradera frente a cambios genéticos en epítopos virales inmunogénicos clave. No obstante, la respuesta de anticuerpos neutralizantes también comprende un aspecto clave de la protección contra la reinfección. Es probable que la coordinación entre los dos tipos de respuesta inmune adaptativa sea importante para mitigar las consecuencias más graves de la infección. Las poblaciones de linfocitos T y B de memoria específicas permanecen estables o incluso aumentan de número muchos meses después de la exposición al SARS-CoV-2, lo que podría reducir la probabilidad de una enfermedad grave tras la reinfección. La evidencia disponible sugiere que la reinfección podría ocurrir dentro de los 5 a 12 meses de una infección natural y es más probable en individuos que son seronegativos para anticuerpos IgG. Es posible que se requieran intervenciones para inhibir la transmisión del SARS-CoV-2 incluso en lugares donde el umbral de inmunidad colectiva se ha alcanzado de forma natural o artificial, y los aumentos observados en la gravedad y la transmisibilidad impulsarán aún más el imperativo de intervenciones no farmacéuticas localizadas o nacionales.
En comparación con la respuesta inmune a la infección natural, la vacunación provoca una respuesta de mayor magnitud y mayor especificidad, centrada principalmente en el RBD. La creciente evidencia de la reducción de la neutralización y la efectividad de la vacuna contra las variantes emergentes, junto con los datos emergentes sobre infecciones avanzadas, sugiere que las vacunas deberán actualizarse a corto y mediano plazo.
Estas actualizaciones serán de gran ayuda mediante una mayor investigación de los correlatos inmunitarios de protección de las vacunas. En última instancia, la duración de la inmunidad protectora contra la infección natural y la vacunación determinará la frecuencia de los brotes (por ejemplo, anuales, bienales o más esporádicos)(181) y la carga sobre los sistemas de salud por las enfermedades sintomáticas y, a su vez, dictarán las políticas de salud pública de las naciones de todo el mundo en los años venideros.
Referencias:
Dada la longitud del artículo, no se publican las 181 referencias bibliográficas citadas en esta revisión, las entregaré a las personas interesadas que me contacten para ello ([email protected]).
Por Ronald Palacios Castrillo, M.D.,Ph.D