Los síntomas gastrointestinales son comunes en niños y adultos y a menudo incluyen dolor abdominal después de comer. Millones de personas tienen síntomas crónicos que se han etiquetado como dolor gastrointestinal funcional o síndrome del intestino irritable (SII) o colon espástico, sin una causa identificable. Esta situación es frustrante para los pacientes y sus proveedores de atención médica, ya que hay pocos tratamientos efectivos disponibles y los que están disponibles no brindan un alivio satisfactorio a muchos pacientes. Para dificultar aún más las cosas, no hay un marcador bioquímico objetivo para diagnosticar SII. Los médicos más cuidadosos tratan de eliminar otras causas orgánicas de enfermedad gastrointestinal antes de establecer el diagnóstico de SII; es decir, SII lo consideran, correctamente, como un diagnóstico de exclusión y no, como frecuentemente se ve en la práctica médica, un diagnóstico sencillo y de primera intención. Además, los médicos suelen tener la impresión de que el SII está en la cabeza (un trastorno en el “software” del paciente).
Una teoría predominante del SII se relaciona con el eje intestino-cerebro. Esta teoría sostiene que los síntomas pueden ser causados por nervios demasiado sensibles en el tracto gastrointestinal y la forma en que se procesan sus señales en el cerebro. De hecho, los nervios intestinales de tales pacientes son hipersensibles a una variedad de estímulos y, por lo tanto, las funciones diarias, como el estiramiento gastrointestinal y la motilidad alimentaria, pueden resultar más dolorosas en estos pacientes que en las personas no afectadas. Durante períodos de estrés emocional o físico (por ejemplo, ansiedad o infección), los síntomas se agravan debido a la estrecha interacción entre el cerebro y el intestino.
Se plantea la hipótesis de que una interacción entre el sistema inmunológico y el sistema nervioso entérico provoca síntomas gastrointestinales idiopáticos. La gastroenteritis infecciosa es un factor de riesgo de SII; muchas infecciones entéricas conducen a SII de nueva aparición, y los pacientes con SII a menudo informan que sus síntomas comenzaron en el momento de una infección gastrointestinal. Además, los aumentos en el número de mastocitos y en la liberación de mediadores, incluidas sustancias neurotrópicas, pueden estar involucrados en la hipersensibilidad visceral.
Los mastocitos son glóbulos blancos que residen en varios tejidos cerca de las interfaces mucosas, especialmente aquellos que están próximos a los vasos sanguíneos y las fibras nerviosas. Se les conoce clásicamente por su papel fundamental en las reacciones alérgicas; albergan receptores de alta afinidad para la IgE y pueden liberar mediadores rápidamente, como la histamina, después de la exposición a alérgenos.
=> Recibir por Whatsapp las noticias destacadas
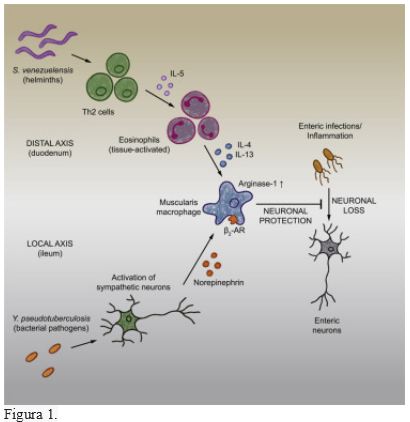
Ahrents,T., y colaboradores reportan en Cell Reports (DOI: https://doi.org/10.1016/j.cell.2021.10.004) sus hallazgos que indican que el sistema nervioso entérico (ENS) controla varias funciones intestinales, incluida la motilidad y la manipulación de nutrientes, que pueden verse interrumpidas por neuropatías inducidas por infecciones o muerte de células neuronales. Investigaron posibles mecanismos de tolerancia que previenen la pérdida neuronal y la alteración de la motilidad intestinal después de la exposición a patógenos. Descubrieron que después de las infecciones entéricas (intestinales), los macrófagos de la muscularis(una capa de la pared intestinal) (MM) adquieren un fenotipo protector de tejidos que previene la pérdida neuronal, la dismotilidad y mantiene el equilibrio energético durante el desafío posterior con patógenos no relacionados. La neuroprotección inducida por bacterias se basaba en la activación de neuronas simpáticas que inervan el intestino y la señalización a través de receptores adrenérgicos β2 (β2AR) en MM. Por el contrario, la neuroprotección mediada por helmintos(tipo de parásitos como Ascaris Lumbricoides) dependía de los linfocitos T y de la producción sistémica de interleucina (IL) -4 e IL-13 por parte de los eosinófilos, que inducían MM a expresar arginasa y evitaban la pérdida neuronal desencadenada por otra infección no relacionada ubicada en una región intestinal diferente. En conjunto, estos datos sugieren que distintos patógenos entéricos desencadenan un estado de enfermedad o tolerancia tisular que preserva el número y la funcionalidad de ENS (Figura 1).
Figura 1.
Un estudio reciente de Aguilera-Lizarraga y sus colegas ( Nature 2021;590:151-156) sugiere que un mecanismo inmunitario periférico que involucra a los mastocitos locales estimulados por la IgE local inducida por alimentos puede ser la base de los síntomas asociados con el SII y el dolor abdominal funcional; estos hallazgos impulsan la consideración de nuevas estrategias terapéuticas para atacar los mastocitos y las alergias.
Aguilera-Lizarraga y col. investigó si la tolerancia normal a los antígenos orales (alimento) en ratones se rompería si los ratones fueran infectados simultáneamente con una bacteria intestinal experimental (Citrobacter rodentium) y alimentados con antígenos de clara de huevo (ovoalbúmina). Una vez que la infección intestinal desapareció, los ratones ingirieron de nuevo la ovoalbúmina; esta vez, tenían dolor abdominal, evaluado por las contracciones de los músculos del estómago, que se midieron con el uso de un dispositivo implantado que cuantificó la hipersensibilidad visceral. Estos ratones también tenían diarrea y un tiempo de tránsito intestinal reducido. Por el contrario, los ratones que no recibieron ovoalbúmina durante la infección intestinal no tuvieron efectos similares ni otras anomalías. Además, en ratones infectados con bacterias tratados con ovoalbúmina, los anticuerpos IgE específicos de ovoalbúmina estaban presentes en el colon, el sitio colonizado por C. rodentium, pero no estaban presentes en el intestino delgado ni en el suero. En estos ratones, la ingestión de agentes que interferían con la alergia, incluidos anti-IgE, estabilizadores de mastocitos y antagonistas del receptor de histamina H1, atenuó las respuestas patológicas y sintomáticas. Además, los ratones que fueron modificados genéticamente para ser deficientes en mastocitos o en el receptor de histamina H1 fueron protegidos en un grado similar al de los ratones de control. La estimulación de los nervios esplácnicos colónicos, que transmiten señales de dolor visceral a la médula espinal, indujo una mayor excitabilidad neuronal en ratones alérgicos que en ratones de control, y este efecto fue bloqueado por el tratamiento con antihistamínicos.
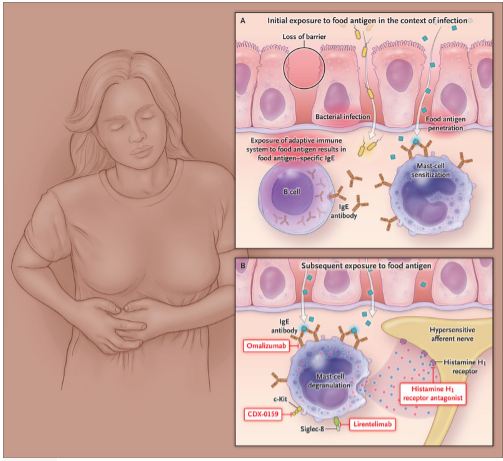
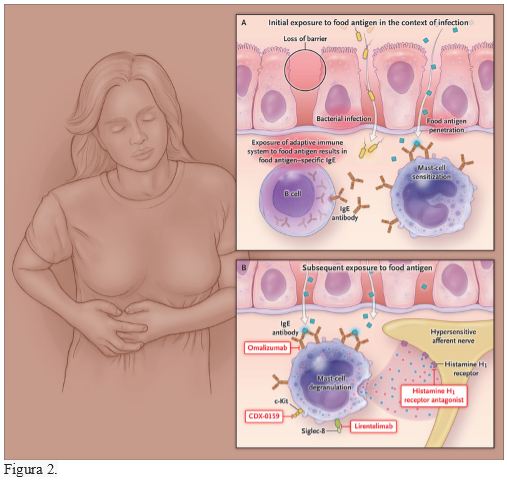
Estos hallazgos indican que una infección bacteriana gastrointestinal puede romper la tolerancia oral a un antígeno de la dieta y dar como resultado una respuesta inmune adaptativa hacia ese antígeno, lo que a su vez puede conducir a una mayor permeabilidad intestinal y a una señalización anormal de dolor cuando se produce la reexposición al antígeno (Figura 2).
Figura 2.
¿Estos resultados se aplican a los pacientes? Los investigadores exploraron si 12 pacientes con SII y 8 personas no afectadas (controles) tenían evidencia de respuestas de mastocitos desencadenadas por alimentos. Los resultados no mostraron evidencia de IgE sistémica contra alimentos comunes, hallazgos que fueron consistentes con los de los estudios en ratones. Sin embargo, cuando los investigadores inyectaron alérgenos comunes en la mucosa rectal, cada paciente con SII tuvo una reacción localizada a al menos dos de los antígenos; 2 de los 8 participantes del grupo de control tuvieron una reacción a un solo alérgeno.
¿Debería el estudio de Aguilera-Lizarraga y col., cambiar nuestra visión de los síntomas gastrointestinales funcionales y el SII? Posiblemente, pero aún hay más por saber, en parte porque los hallazgos en los pacientes con SII se basa en una prueba de investigación no convencional (inyección de antígenos en la mucosa rectal) en un número muy pequeño de participantes humanos. Además, queda por determinar cuáles de los mediadores de mastocitos, si los hay, están implicados en la enfermedad humana. De igual modo, es necesario el examen de mastocitos en muestras de biopsia gastrointestinal humana que no se realiza de forma rutinaria y puede requerir la medición de la proximidad de los mastocitos a las terminaciones nerviosas, una tarea desafiante.
Los datos de otros estudios realizados proporcionan también evidencia de que las dosis altas y prolongadas de un antagonista del receptor de histamina H1 reducen la hipersensibilidad visceral, los síntomas y el dolor abdominal en pacientes con SII (Gastroenterology 2016;150(4):875-887).
Además de la terapia antihistamínica, existen terapias dirigidas existentes y emergentes que bloquean las vías alérgicas y pueden tener valor en el tratamiento de los síntomas funcionales del SII y otras enfermedades (Figura 2).
Es cada vez más evidente que la alergia alimentaria no es una enfermedad que implica solo reacciones sistémicas mediadas por IgE. Más bien, existe un espectro de respuestas alérgicas inducidas por los alimentos, con anafilaxia sistémica mediada por IgE en un extremo y respuestas alérgicas específicas del tejido gastrointestinal en el otro extremo. En el medio están las enfermedades en las que segmentos específicos del tracto gastrointestinal son los sitios de respuestas alérgicas locales inducidas por alimentos, como las respuestas de mastocitos específicas del colon descritas por Aguilera-Lizarraga y col. y las respuestas eosinofílicas específicas del esófago en la esofagitis eosinofílica. Una diferencia fundamental entre las respuestas alérgicas descritas por Aguilera-Lizarraga y col. y la alergia alimentaria clásica es que los anticuerpos IgE específicos de ovoalbúmina identificados por Aguilera-Lizarraga y col. eran detectables solo en el tejido colónico, lo que indicaba una respuesta inmune local más que sistémica contra los antígenos de la dieta. La naturaleza específica de tejido de esta respuesta probablemente implica una interacción de factores genéticos y ambientales, como se ha descubierto para la esofagitis eosinofílica, cuyo riesgo está asociado con variantes genéticas en una vía de la mucosa esofágica (J Clin Invest 2019;129:1419-1430 ).
En conclusión, los datos recientes apoyan la hipótesis de que las dolencias gastrointestinales comunes, como el SII y el dolor abdominal funcional, pueden ser trastornos alérgicos locales inducidos por alimentos asociados a infecciones bacterianas o parasitarias experimentadas antes o durante la aparición del síndrome de intestino irritable(SII) y no tanto a un trastorno primario del “software” en el cerebro de los pacientes frecuentemente diagnosticados con SII (cerca de 30% de los pacientes que acuden al médico general o a gastroenterólogos). Muchos pacientes que padecen de SII se sentirán aliviados al saber que sus síntomas gastrointestinales tienen una explicación orgánica y que no son únicamente los trastornos psicoemocionales los causantes de sus síntomas. Los médicos que diagnostican y tratan a pacientes con SII deberán también modificar sus enfoques tanto al diagnóstico como al manejo de estos pacientes. Con los datos resumidos en este artículo, podríamos considerar ahora el uso de antihistamínicos contra receptores H1 como parte del tratamiento para SII.
Ronald Palacios Castrillo, M.D.,PhD.