Semanas atrás se divulgó y viralizó en los medios el transplante de un corazón de cerdo a un ser humano.
Recientemente, Griffith y sus colegas reportan su experiencia y hazaña en una revista científica sobre el trasplante de un corazón de cerdo modificado genéticamente a un paciente con miocardiopatía no isquémica que estaba recibiendo oxigenación por membrana extracorpórea (ECMO)( N Engl J Med. DOI: 10.1056/NEJMoa2201422).
Al igual que con otros órganos, los corazones disponibles para trasplante están en escasez, y el paciente no era un candidato para la lista de espera para un corazón humano. Después del trasplante del corazón de cerdo modificado, el paciente fue destetado de ECMO. El corazón trasplantado funcionó normalmente, sin aparente rechazo inmunológico. La falla diastólica del corazón transplantado ocurrió 49 días después del trasplante por razones que aún no se conocen, y el soporte vital se retiró al día 60.
La función normal de un corazón de cerdo en un ser humano y evitar el rechazo del injerto durante más de un mes es un logro respaldado por décadas de investigación en inmunología de transplantes, embriología, genética y cría de animales.
¿Cuáles fueron las modificaciones genéticas?
=> Recibir por Whatsapp las noticias destacadas
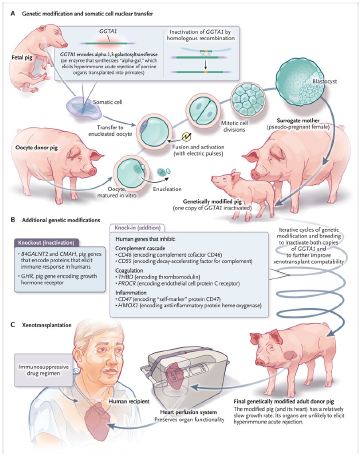
Las modificaciones genéticas del cerdo donante (incluido su corazón) se dividieron en dos categorías: las que inactivaron genes de cerdo y las que introdujeron genes humanos. En total, se introdujeron 10 modificaciones diferentes, la mayoría para evitar el rechazo del injerto por parte del sistema inmune humano.
INACTIVACIÓN DE GENES DE CERDO
El carbohidrato galactosa-alfa-1,3-galactosa (“alfa-gal”) es una estructura de azúcar que forma parte de muchas moléculas en la mayoría de los mamíferos. Por un capricho de la evolución, los humanos y algunos primates no humanos no expresan alfa-gal. Debido a que alfa-gal es omnipresente en el mundo animal y, por lo tanto, existen muchas oportunidades de exposición, los humanos tienen anticuerpos naturales anti-alfa-gal, y estos anticuerpos median un potente rechazo agudo hiperinmune.Esta reacción inmunológica se conoce en la clínica como Sindrome Alfa-Gal ó Alérgia a la carne que revisamos y compartimos anteriormente (https://eju.tv/2022/05/una-picadura-de-la-garrapata-lone-star-puede-causar-alergia-a-la-carne-roja-de-por-vida/) .
Cuando un órgano porcino se perfunde con sangre humana, la unión de los anticuerpos contra alfa-gal en las células que recubren la vasculatura, activa la cascada del complemento en la sangre humana, lo que provoca una trombosis en el órgano del cerdo. Por lo tanto, Griffith et al. inactivó el gen GGTA1, que codifica la enzima que sintetiza alfa-gal. También inactivaron otros dos genes que codifican proteínas desencadenantes del rechazo en el genoma del cerdo (Figura 1). De igual manera, eliminaron el gen del receptor de la hormona del crecimiento del cerdo, lo que redujo el crecimiento intrínseco del corazón porcino (y del resto del cerdo) y, por lo tanto, lo adaptó a las limitaciones anatómicas de la vasculatura y la cavidad torácica humana.
Adición de Genes Humanos
Resulta que la inactivación de genes que codifican proteínas porcinas problemáticas es insuficiente para prevenir el rechazo inmunológico. En las células humanas se expresan ciertas proteínas que inhiben la cascada de activación del complemento, las vías de coagulación (independientes de la cascada del complemento),y vías inflamatorias. Las proteínas inhibidoras homólogas del cerdo son demasiado diferentes de las proteínas inhibidoras humanas para suprimir estas vías en el ser humano. Griffith et al., por lo tanto, introdujo seis genes humanos diferentes que codifican proteínas inhibidoras en el genoma del cerdo (ver abajo).
¿Cómo obtener un cerdo con todas las células idénticamente modificadas?
La base para modificar genéticamente un animal completo se estableció hace 26 años con la “clonación” de una oveja a partir del núcleo de una célula mamaria de una oveja Finn Dorset de cara blanca. Primero se aisló el núcleo de esta célula y luego se inyectó en el ovocito enucleado de una oveja escocesa Blackface. (Todo el proceso se denomina transferencia nuclear de células somáticas). Una serie de pulsos eléctricos aplicados al ovocito recién nucleado desencadenó una «reprogramación» de su DNA nuclear. El ovocito nucleado, una vez trasplantado a una oveja pseudoembarazada( i.e. un útero de alquiler), se convirtió en un feto y luego en un cordero recién nacido de cara blanca (llamado Dolly), que se convirtió en una oveja que concibió y dio a luz a sus propios corderos. Este descubrimiento allanó el camino para la modificación genética de animales completos porque mostró cómo la constitución genética de un núcleo «donante» podría replicarse en cada célula que surge de divisiones celulares , desde el embrión de dos células hasta el blastocisto, feto, bebé, y animal adulto.
Fué por este medio que se diseñó el primer cerdo desprovisto de alfa-gal (Figura 1). Este cerdo mutante ha sido criado por más de 11 generaciones. Obtuvo la aprobación de la Administración de Drogas y Alimentos como una nueva solicitud de medicamento para animales hace solo 2 años. Las otras nueve modificaciones (tres inactivaciones y seis adiciones) se han «aplicado en capas» a través de la clonación iterativa, produciendo una serie de cerdos que, según se determinó a través de la experimentación con primates no humanos e in vitro, se han vuelto cada vez más adecuados como donantes de órganos para humanos.
¿Puede la modificación genética reducir el riesgo de zoonosis?
En teoría, sí. Hay dos fuentes de zoonosis en el trasplante de cerdo a humano: virus incrustados en el genoma porcino y patógenos porcinos exógenos. El genoma del cerdo contiene secuencias de retrovirus endógenos porcinos (PERV), DNA viral que, en determinadas condiciones, puede transcribirse en proteínas y generar retrovirus porcinos que, a su vez, pueden infectar células humanas. Una forma de prevenir la transmisión de PERV podría ser mediante la inactivación genética del DNA de PERV, y varios estudios in vitro han respaldado esta estrategia.
Griffith y sus colegas eligieron una estrategia diferente. El cerdo que utilizaron de origen provino de una línea de cerdos que habían sido examinados cuidadosamente para detectar una clase particular de PERV y, después del trasplante, se vigiló al paciente para detectar todas las clases de PERV. No se encontró ninguno. En cuanto a los patógenos porcinos no PERV, una pantalla semanal del plasma del paciente, que involucra la secuenciación metagenómica dió positivo para citomegalovirus porcino (pCMV) 20 días después del trasplante. No está claro si esta infección contribuyó a la disfunción del xenoinjerto o al deterioro clínico del paciente. El análisis preliminar de muestras de las regiones torácica y abdominal del paciente, obtenidas después de su muerte, no mostró signos de infección por pCMV
En detalle, el cerdo fue modificado genéticamente para alterar ciertos genes, incluidos los que codifican enzimas que sintetizan tres antígenos sacáridos reconocidos por anticuerpos humanos naturales, así como para expresar ciertos genes humanos, los que codifican CD46 y CD55 (que regulan el complemento), la trombomodulina y el receptor endotelial para la proteína C (que regula la coagulación, la inflamación y la fibrinólisis), CD47 (que impide que los macrófagos se dirijan hacia ellos) y la hemooxigenasa 1 (que resiste la inflamación). Estas modificaciones abordan parcialmente las incompatibilidades moleculares que se cree que hacen que los xenoinjertos sean especialmente vulnerables a la inmunidad, la trombosis y la inflamación.
Para el receptor, se utilizó un régimen intenso de inmunosupresión, incluidos anticuerpos que eliminan los linfocitos T y los linfocitos B y anticuerpos que interrumpen las interacciones CD40-CD40L (contrarrestando las respuestas de los linfocitos B dependientes de los linfocitos T de ayuda, que se ha encontrado que limitan la supervivencia de los xenoinjertos en primates no humanos ). Después del trasplante en el receptor fuertemente inmunosuprimido, el xenoinjerto funcionó aceptablemente durante 7 semanas pero luego fracasó repentinamente por razones que aún no están claras, y el receptor murió 11 días después, el día 60 después del trasplante.
Dados los fracasos pasados, uno podría preguntarse justificadamente si este xenotrasplante reciente proporciona un vistazo al tratamiento futuro de la insuficiencia orgánica o simplemente cumple con un sofismo de larga data de que el xenotrasplante es y siempre será el futuro de los trasplantes.
Independientemente de si este xenoinjerto lanzó el futuro de los trasplantes, este informe ofrece una idea de cuán rápida y profundamente la ingeniería genética y biológica y la biología celular y del desarrollo pueden organizarse potencialmente para tratar de resolver los problemas de la medicina. Hace treinta años, se postuló que la incompatibilidad de la regulación del complemento entre especies subyacía en el fracaso invariable de los xenotrasplantes, y se propuso como solución la ingeniería genética de cerdos. Probar esa idea tomó 5 años porque la ingeniería genética se basaba en la inserción aleatoria de DNA y la reproducción a través de varias generaciones para asegurar la modificación de la línea germinal. En contraste, las técnicas utilizadas para generar los cerdos que usaron Griffith y sus colegas permiten que se introduzcan múltiples modificaciones específicas del sitio en las células somáticas (o células madre pluripotentes en otros contextos), que, en combinación con la reprogramación y la clonación por transferencia nuclear, generan animales fundadores.
Hoy en día, la ingeniería genética se expande enormemente, controla con precisión y acelera la modificación, lo que permite probar algunas características y modificaciones ad hoc antes de generar animales. Por ejemplo, cuando se encontraron cambios hipertróficos en xenoinjertos cardíacos experimentales, los autores se concentraron rápidamente en el gen del receptor de la hormona del crecimiento endotelial en animales existentes y realizaron pruebas con xenoinjertos experimentales. La clonación de los cerdos corrigió los cambios genéticos introducidos y los antecedentes genéticos de los cerdos, lo que acelera la evaluación de las características impartidas, pero potencialmente retrasa el descubrimiento de los antecedentes óptimos de los animales de origen.
Los enfoques moleculares, celulares y genéticos utilizados para generar cerdos para xenotrasplantes representan una fracción de las técnicas actualmente dirigidas a la diabetes, la hipertensión y las enfermedades vasculares, entre otras afecciones. Debido a que estas condiciones causan muchos de los casos de insuficiencia de órganos y crea la demanda de órganos para trasplantes, uno podría preguntarse si los avances informados por Griffith y sus colegas presagian una disminución de la demanda de trasplantes de órganos. Probablemente la respuesta es no.
Dado que el envejecimiento se asocia con una disminución progresiva de la función del corazón, los riñones y otros órganos, los avances que amplían la esperanza de vida en última instancia aumentarán la prevalencia de la insuficiencia orgánica y, potencialmente, la demanda de trasplantes.
Pero una pregunta más importante puede ser si las técnicas como las que se usan para diseñar cerdos podrían aplicarse para generar tejidos y órganos humanos para implantarlos en pacientes con insuficiencia orgánica. Las células madre pluripotentes y las células de otros tipos se exploran cada vez más para la generación de órganos autólogos a través de la organogénesis o la ingeniería de tejidos tridimensionales. El uso de órganos autólogos, modificados para resistir la enfermedad subyacente, presumiblemente evitaría la necesidad y los efectos tóxicos de la inmunosupresión de por vida.
Es probable que el advenimiento de tales implantes autólogos disminuya la demanda de alotrasplantes( de otra persona); irónicamente, sin embargo, esto podría aumentar la demanda de xenotrasplantes en dos contextos. Si se persigue la organogénesis, los animales diseñados para apoyar el desarrollo de tejidos humanos (xenoinjertos inversos) podrían limitar los costos y resolver ciertos desafíos. Además, los pacientes que esperan el desarrollo de implantes autólogos requerirían tratamiento de insuficiencia orgánica durante meses o más mientras se genera el implante. Los xenoinjertos ofrecen ventajas (disponibilidad, costo y características definidas) sobre los aloinjertos como fuentes de soporte temporal.
Varios pasos podrían avanzar en la aplicación clínica del xenotrasplante para cualquier propósito que puedan cumplir los xenoinjertos. El conjunto de modificaciones genéticas del cerdo utilizado por Griffith et al. se ha encontrado que beneficia los xenotrasplantes en primates no humanos. Si las mismas modificaciones u otras beneficiarían los xenotrasplantes en receptores humanos seguirá siendo incierto hasta que este xenoinjerto clínico y otros sean completamente estudiados. La reducción en el número y el alcance de las modificaciones genéticas de los cerdos podría beneficiar la función a largo plazo de los xenotrasplantes, ya que la inserción desfavorable de secuencias genéticas se ha asociado con el envejecimiento del miocardio. Aún más importantes serán los esfuerzos para disminuir la intensidad y la toxicidad de la inmunosupresión. . Dado que la inmunidad a los xenoinjertos puede involucrar vías más estrechas de activación de linfocitos T que los aloinjertos, quizás la inmunosupresión pueda enfocarse para reducir los efectos tóxicos a largo plazo para los receptores y los injertos (y posiblemente los autoinjertos).
Ronald Palacios Castrillo, M.D.,PhD.