Ronald Palacios Castrillo, M.D.,PhD.
INTRODUCCIÓN
Las respuestas inmunitarias aberrantes a sustancias inocuas conducen a reacciones de hipersensibilidad, que han sido clasificadas en cuatro tipos por Gell y Coombs: mediada por inmunoglobulina E (IgE) (tipo 1), reacciones citotóxicas mediadas por IgG/IgM (tipo 2), mediada por complejos inmunes. (tipo 3), o mediada por células (tipo 4). Algunas reacciones de hipersensibilidad pueden implicar más de un tipo de reacción (1).
Los tipos 1 a 3 ocurren en segundos o en unas pocas horas, mientras que las reacciones de tipo 4 tienen un período de latencia de 2 a 3 días. En particular, la reacción de hipersensibilidad tipo 4 involucra subgrupos de células T de ayuda 1 (TH1), TH2, TH17, citotóxicas y mixtas, en las que las reacciones mixtas y TH2 pueden desempeñar un papel en la inflamación alérgica.
Las alergias también se clasifican como mediadas por IgE, no mediadas por IgE o mixtas (mediadas por IgE y no mediadas por IgE). Las enfermedades alérgicas más comunes y mejor estudiadas son las enfermedades atópicas, que tienen mecanismos fisiopatológicos subyacentes comunes y se cree que están mediadas, al menos en parte, por IgE. Las enfermedades atópicas comunes incluyen rinitis alérgica, dermatitis atópica, asma alérgica y alergia alimentaria (Tabla 1).
=> Recibir por Whatsapp las noticias destacadas
En las últimas décadas, la prevalencia de trastornos alérgicos asociados a IgE ha aumentado en todo el mundo (2). La prevalencia global de rinitis alérgica, dermatitis atópica, asma y alergia alimentaria se estima en alrededor del 29,4 % (3), 26,1 % (4), 3,4 % (5) y 10 % (6), respectivamente. Numerosas encuestas nacionales e internacionales informan una prevalencia creciente de IgE sérica total y específica en las últimas décadas (7-10).
El cambio climático, y las crecientes concentraciones de contaminantes ambientales están alterando el metaexposoma (definido como la exposición ambiental total que afecta a todos los sistemas vivos y sus genomas). Estos efectos ambientales globales son factores clave que inducen más alergias, asma y trastornos inmunológicos de novo, así como una mayor gravedad en las personas con enfermedades preexistentes al afectar las respuestas inmunitarias tempranas, el microbioma y las barreras de tejido superficial.
Durante más de 100 años, el manejo personalizado de enfermedades alérgicas específicas para alérgenos ha contribuido al desarrollo de la medicina de precisión. Como disciplina médica general, los estudios de medicina de precisión han introducido biomarcadores, fenotipos, endotipos, genotipos, regiotipos y teratipos de enfermedades alérgicas.
Los estudios multiómicos, los análisis de big data y la biología de sistemas han demostrado la complejidad y la variabilidad dinámica de las enfermedades alérgicas entre individuos, así como entre regiones (11). Se han logrado avances sustanciales en la comprensión del mecanismo subyacente a las enfermedades atópicas. Esto ha llevado a cambios en las pautas para la prevención de la alergia alimentaria, el desarrollo de terápias biológicas e inhibidores de moléculas pequeñas y mejoras en los protocolos de Inmunoterápia, incluido el uso de adyuvantes biológicos y probióticos.
Aquí, reviso la comprensión actual de los mecanismos celulares de tolerancia inmunológica utilizados para tratar las reacciones alérgicas, así como el papel de la genética, la epigenética, la barrera epitelial, el microbioma, las infecciones virales, el medio ambiente y el cambio climático en la patogénesis de alergia.
También reviso la evidencia del consumo temprano de alérgenos para la prevención de alergias, los tratamientos aprobados y en desarrollo, y los desafíos y necesidades futuras en la investigación de alergias.
MECANISMOS DE INMUNOTOLERANCIA Y ALERGIA
Los estudios celulares in vitro y en animales han proporcionado información sobre los mecanismos moleculares subyacentes a la tolerancia y las reacciones alérgicas en las enfermedades mediadas por IgE.
La tolerancia inmunológica saludable a los alérgenos es un proceso activo en el que las células T reguladoras (Treg) desempeñan un papel central, y su desregulación contribuye a la sensibilización alérgica y la enfermedad alérgica (Figs. 1 y 2 ). Las respuestas tolerogénicas comienzan principalmente con la absorción de alérgenos potenciales, en la mucosa gastrointestinal del intestino delgado.
Las células dendríticas pueden capturar antígenos y luego migrar a los ganglios linfáticos regionales donde inducen la diferenciación de las células T ingenuas en células Treg y facilitan su alojamiento en el intestino. Las células Treg pueden inhibir la inflamación alérgica dependiente de TH2 y reducir la desgranulación de los mastocitos, a través de la producción de interleucina-10 (IL-10), factor de crecimiento transformante-β (TGF-β) e IL-35 (12, 13).
Las células Treg promueven la producción de IgA por parte de las células B, lo que se ha demostrado permite la presencia de microbios beneficiosos en el intestino (15), pero parece no ser esencial para prevenir la alergia alimentaria (16, 17). También se ha demostrado que los anticuerpos desempeñan un papel en el desarrollo de la tolerancia frente a los alérgenos (18, 19). Las células Treg inducen IgG4 en las células B, y las propias células B reg(linfocitos B reguladores) son las principales productoras de IgG4 (20, 21).
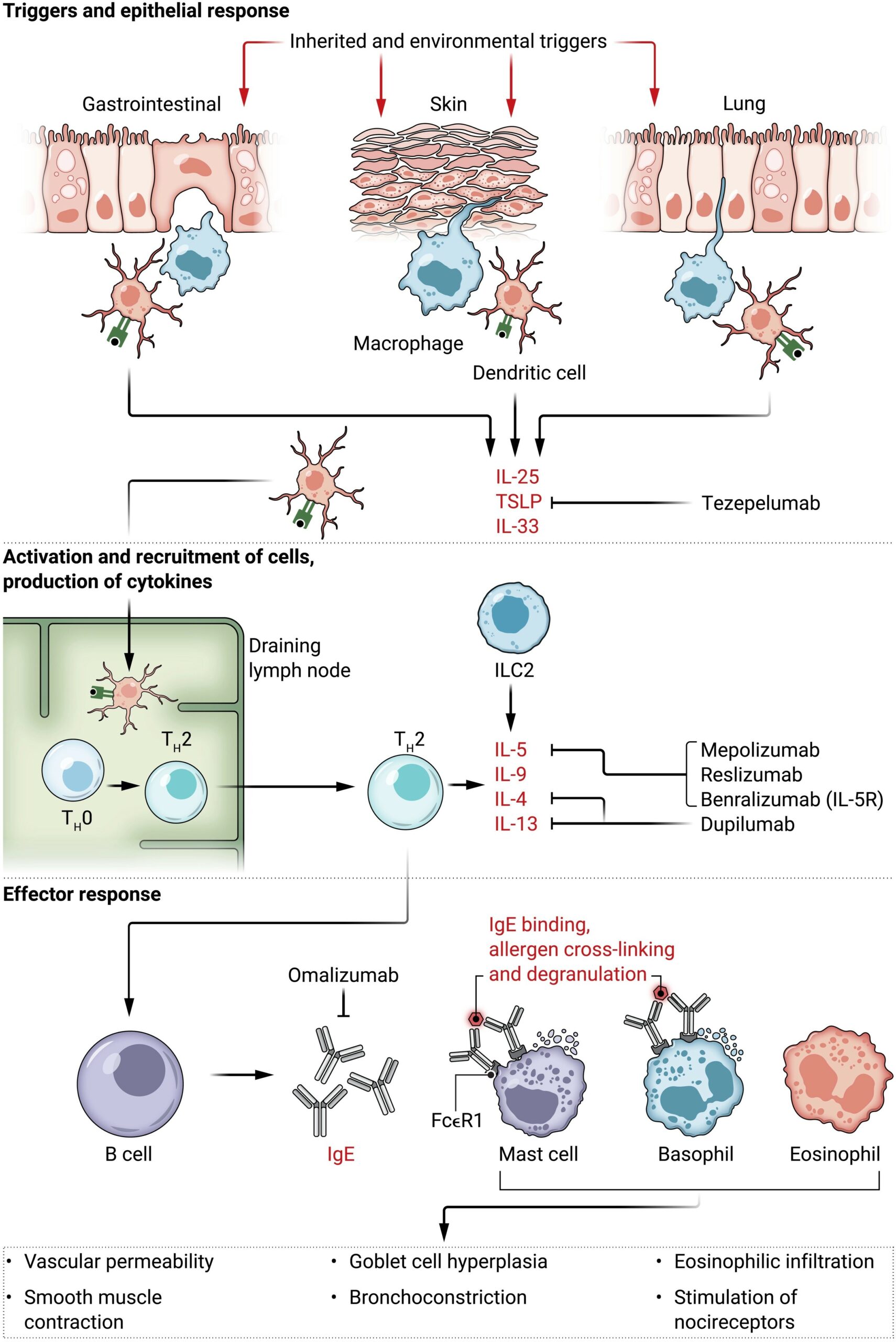
Los defectos epiteliales aumentan la entrada de antígenos, agentes infecciosos y otros factores estresantes en el pulmón, la piel o el tracto gastrointestinal. A esto le sigue una liberación de citocinas proinflamatorias derivadas del epitelio, como IL-25, IL-33 y linfopoietina stromal tímica (TSLP).
Estas citocinas permiten que las células dendríticas y de otro tipo ceben a las células vírgenes (TH0) para que se polaricen en TH2.
Las células TH2 liberan citocinas proinflamatorias, como IL-4, IL-5, IL-9 e IL-13. Las citocinas derivadas del epitelio también activan las células linfoides innatas tipo 2 (ILC2), que también liberan IL-5 e IL-13. Estas citocinas favorecen el cambio de clase de anticuerpo secretado por las células B a IgE, que se une a la superficie de las células efectoras, como los mastocitos y los basófilos, a través del receptor Fc de IgE de alta afinidad FcεR1, lo que lleva a la sensibilización.
IL-5 favorece la eosinofilia en los tejidos y la circulación. En las personas sensibilizadas, la exposición posterior a los alérgenos provoca el entrecruzamiento de la IgE unida a los receptores FcεR1 en los mastocitos y basófilos sensibilizados, lo que lleva a la liberación de mediadores proinflamatorios preformados y sintetizados de nuevo, como histamina, prostaglandinas, leucotrienos, citoquinas . Estos conducen a síntomas de broncoconstricción, aumento de la permeabilidad vascular, contracción del músculo liso e infiltración eosinofílica.
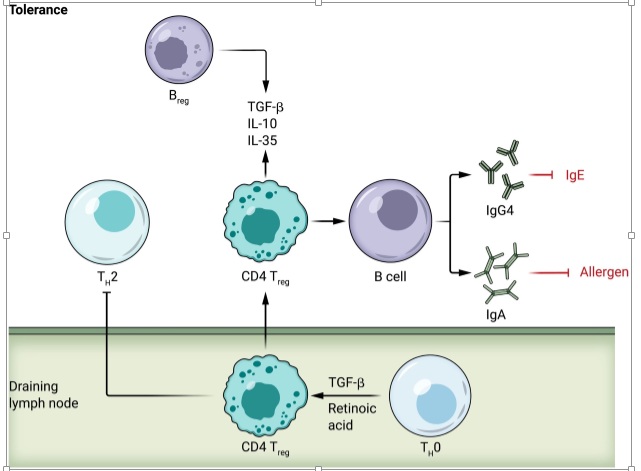
En tolerancia, las células T vírgenes (TH0) se diferencian a células Treg después de la exposición a TGF-β y ácido retinoico. Las células Treg impulsan respuestas antiinflamatorias a través de la liberación de IL-10, IL-35 y TGF-β. Estas citoquinas también son producidas por células Breg.
Las células Treg también promueven el cambio de anticuerpo secretado por células B a IgA e IgG4, las cuales promueven la tolerancia al unirse a alérgenos o bloquear la acción de IgE.
Sin embargo, algunas personas desarrollan reacciones alérgicas aberrantes a alérgenos inocuos que están mediadas por IgE, mastocitos y basófilos. Estas reacciones alérgicas mediadas por IgE incluyen una fase de sensibilización, una fase de activación y una fase efectora.
Se cree que la sensibilización se facilita en las superficies de la barrera (como la piel, el tracto gastrointestinal o el tracto respiratorio) con una mayor permeabilidad debido a la pérdida de la integridad de la barrera, ya sea por la exposición a factores que dañan la barrera epitelial, a saber, una lesión química o la presencia de una mutación con pérdida de función del gene de la filagrina (22). Este proceso inicial conduce a la sensibilización al alérgeno.
Durante la fase de activación, la exposición adicional a los alérgenos específicos conduce a la formación de complejos de los anticuerpos IgE unidos al receptor Fcε 1 (FcεR1) y la subsiguiente desgranulación de mastocitos y basófilos. Durante la fase efectora final, múltiples mediadores proinflamatorios intervienen en las reacciones alérgicas a través de la producción de moco, vasodilatación, contracción del músculo liso, estimulación de los nociceptores y otros efectos inflamatorios (Figura. 1) (23, 24).
Aunque el papel de la IgE en las reacciones alérgicas es claro, se ha debatido su función evolutiva. Más recientemente, se ha planteado la hipótesis de un papel protector evolutivo. La investigación ahora muestra que los mastocitos y las respuestas inmunitarias de tipo 2 relacionadas con la IgE pueden mejorar la defensa del huésped contra ciertas toxinas venenosas, como el veneno de abeja (25) o una toxina importante del veneno de abeja (26), y que esto puede funcionar, en parte, a través de efectos de los anticuerpos IgE sobre la eficiencia de desintoxicación de los mastocitos (27).
ETIOLOGIA DE LA ALÉRGIA
Tanto la genética como el medio ambiente juegan un papel en la etiología de la enfermedad alérgica. La heredabilidad genética de las enfermedades alérgicas es alta y se ha estimado que es del 35 al 95% para el asma, del 33 al 91% para la rinitis alérgica, del 71 al 84% para la dermatitis atópica y del 15 al 82% para la alergia alimentaria (28,29).
En la última década se han publicado varios estudios que implican genes asociados con enfermedades alérgicas. Los ejemplos de variantes genéticas asociadas con enfermedades alérgicas incluyen aquellas involucradas en la función de barrera de la piel (filagrina); proliferación y diferenciación epidérmica (OVOL1); alarminas derivadas de epitelio (IL-33); presentación de antígenos (HLA-DQ); regulación de células TH1, TH2 y Treg (IL-4 y Foxp3); y síntesis de esfingolípidos (ORMDL3) (30, 31).
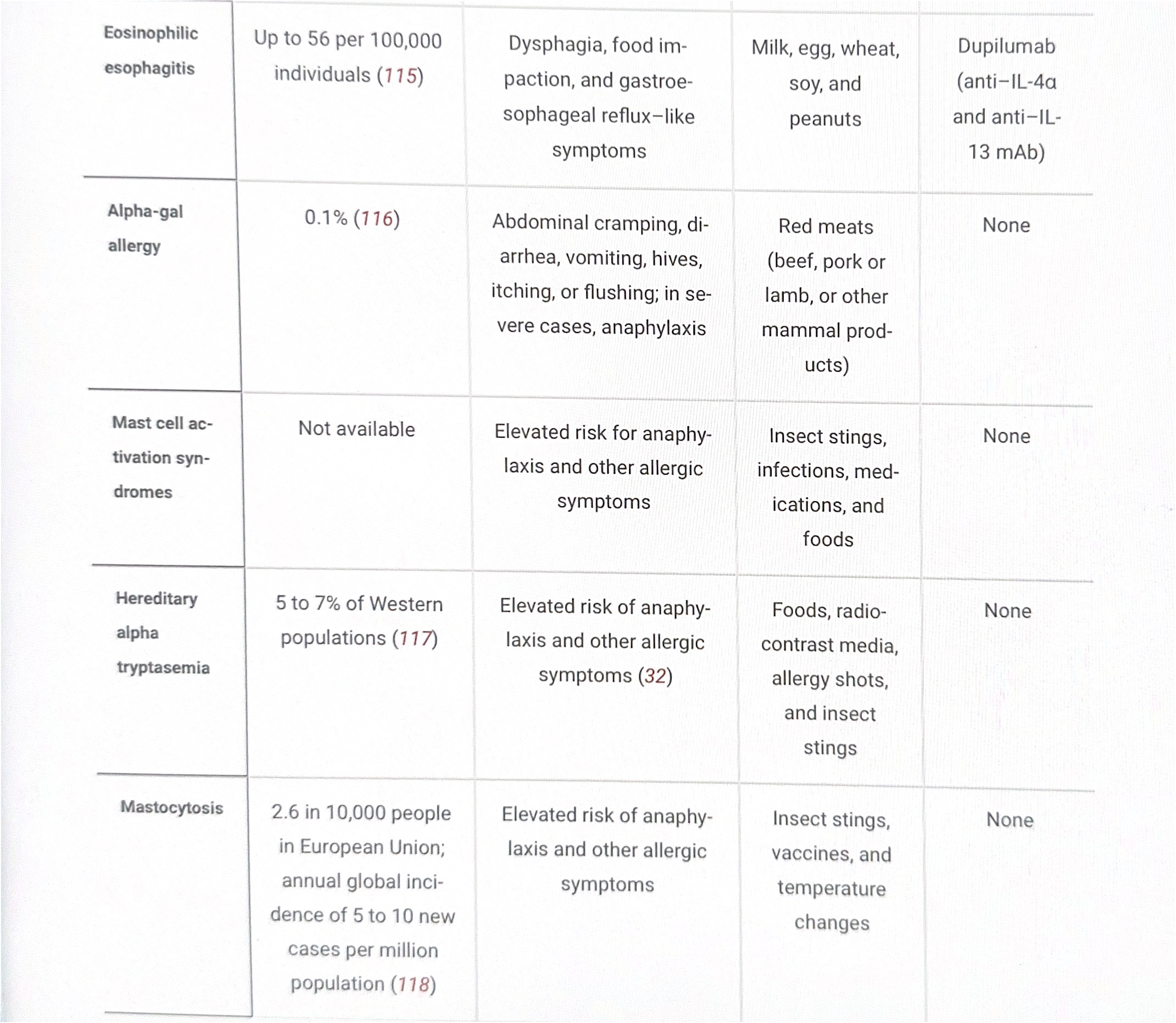
Los síndromes de activación de mastocitos se definen por una activación sistémica severa y recurrente de mastocitos, generalmente en forma de anafilaxia, con un aumento sustancial relacionado con el evento de las concentraciones séricas de triptasa más allá de la línea de base del individuo.
La alfa triptasemia hereditaria, un rasgo genético definido por copias adicionales del gene TPSAB1 que codifica la alfa triptasa, se ha relacionado con un riesgo elevado de desarrollar anafilaxia y síndromes de activación de mastocitos (32). La mastocitosis es una enfermedad heterogénea con crecimiento y acumulación anormal de mastocitos acompañada de síntomas relacionados con los mediadores de mastocitos. La mutación más frecuente encontrada en la mastocitosis sistémica es la KIT p.D816V, cuya presencia constituye uno de los criterios diagnósticos (33).
En el asma, uno de los hallazgos genéticos más replicados en el asma infantil es el gen ORMDL3. Un estudio encontró aumentos en la expresión de ORMDL3 en el asma alérgica tanto en células mononucleares de sangre periférica de niños asmáticos como en células epiteliales bronquiales humanas estimuladas con IL-13, IL-4 o con ambas citoquinas (34).
Las células T que expresan el antígeno asociado a linfocitos cutáneos (CLA) contribuyen a la inflamación patógena en la dermatitis atópica.
Aunque está claro que las enfermedades atópicas tienen un componente genético y son más frecuentes en personas con antecedentes familiares de enfermedades alérgicas, los cambios genéticos hereditarios no pueden explicar el rápido aumento de muchas enfermedades alérgicas.
Varios estudios han mostrado aumentos en las enfermedades alérgicas entre los migrantes de una región de baja prevalencia de enfermedades atópicas a una región con mayor número de enfermedades alérgicas, lo que respalda el papel del medio ambiente en el desarrollo de la alergia. Un cuestionario transversal distribuido a más de 90000 niños de 0 a 17 años inscritos en la Encuesta Nacional de Salud Infantil 2007-2008, indicó que los niños nacidos fuera de los Estados Unidos tenían una menor prevalencia de enfermedades alérgicas que aumentaban después de residir en los Estados Unidos durante una década (35).
Una revisión sistemática que comparó inmigrantes de primera y segunda generación encontró que la prevalencia de trastornos alérgicos era generalmente más alta en inmigrantes de segunda generación en comparación con inmigrantes de primera generación (36). Estos resultados están respaldados por una serie de otros estudios (37-40).
Se han propuesto la hipótesis de la higiene y la hipótesis de los «viejos amigos» para explicar los aumentos recientes en la prevalencia de enfermedades alérgicas con el entorno cambiante. La hipótesis de la higiene fue presentada por primera vez por Strachan en 1989. Sugiere que con una mayor higiene y falta de exposición a microbios e infecciones parasitarias, el sistema inmunitario no recibe el estímulo necesario para desarrollar respuestas tolerogénicas. Sin embargo, la hipótesis no logra explicar el aumento de la alergia incluso en áreas que carecen de servicios básicos de higiene y la falta de disminución de la enfermedad alérgica en aquellos expuestos a enfermedades virales infantiles.
Un refinamiento de la hipótesis de la higiene es la «hipótesis de los viejos amigos», que sugiere que los aumentos en la alergia y el asma reflejan una falta de exposición a viejos amigos beneficiosos, que son microbios que coevolucionaron con los humanos. Estos incluyen los microbios comensales en gran medida no dañinos adquiridos de la piel, el intestino y el tracto respiratorio de otros humanos, así como organismos como helmintos, Helicobacter pylori y el virus de la hepatitis A,C, que podrían persistir de por vida y necesitan ser tolerados (41).
Ahora se sabe que las alteraciones ambientales en nuestro metaexposoma median al menos algunos de sus efectos al regular epigenéticamente la expresión génica de genes clave involucrados en enfermedades alérgicas inflamatorias (42-45).
Los estudios de asociación de todo el genoma demostraron que dos polimorfismos de un solo nucleótido en la región genómica HLA-DQ y HLA-DR asociados con la alergia al cacahuete estaban regulados epigenéticamente a través de la metilación en múltiples sitios CpG dentro de esta región (46). Además, hallazgos recientes respaldan el papel de los mecanismos epigenéticos en la patogenia de la dermatitis atópica al afectar las moléculas de señalización inflamatorias en las células T CLA+ CD4+ que se alojan en la piel y también han descubierto moléculas que participan en las vías de la dermatitis atópica (47).
MEDIO AMBIENTE, CAMBIO CLIMÁTICO Y ALERGIA
En las últimas décadas, ha habido cambios importantes en el metaexposoma, y la evidencia actual sugiere que estos cambios están alimentando la creciente prevalencia de enfermedades alérgicas. Los cambios en el metaexposoma incluyen aumentos de contaminantes antropogénicos en el agua, el suelo y el aire; mayor uso de alimentos procesados y antibióticos; mayor exposición a alérgenos ambientales; y disminución de la exposición a microbios beneficiosos y parásitos
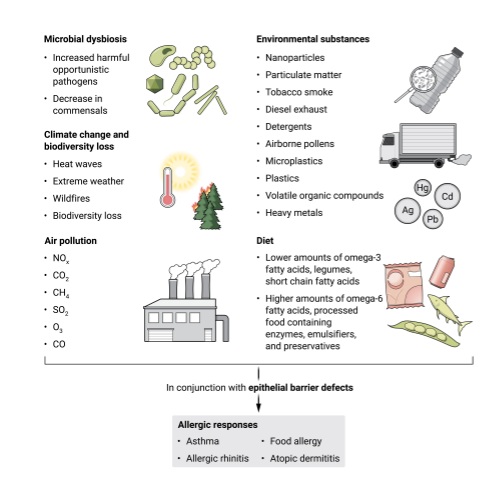
Los factores asociados con la alergia incluyen la disbiosis microbiana, los efectos del cambio climático, la pérdida de biodiversidad, los cambios en la dieta y una mayor exposición a los contaminantes (Figura 3).
Algunas de las elecciones dietéticas indicadas en la figura 3, como alimentos ricos en legumbres, ácidos grasos de cadena corta y ácidos grasos omega-3, promueven la salud y pueden prevenir enfermedades alérgicas. Los efectos de estos factores se ven exacerbados por los defectos de la barrera epitelial, que provocan asma, rinitis alérgica, dermatitis atópica y alergia alimentaria.
Varios estudios han demostrado la activación de vías alérgicas por alteraciones del metaexposoma. Es probable que los contaminantes alteren la inmunidad a través de efectos epigenéticos en las células inmunitarias que cambian la expresión génica, al influir en la composición y función del microbioma pulmonar e intestinal, al impulsar la inflamación y la disfunción del epitelio de la piel, o a través de la toxicidad directa (48).
En un estudio realizado en Fresno, CA, las personas expuestas a altas concentraciones de CO, NO2 y partículas con un diámetro aerodinámico de ≤2.5 μm (PM2.5) tuvieron alteraciones en las regiones metiladas diferencialmente de FOXP3 e IL10, lo que indica una expresión reducida de genes asociados con la tolerancia inmunológica (49, 50). La exposición a la contaminación por incendios forestales se asoció con aumentos de IL-1β y proteína C reactiva (51).
La contaminación aumenta el riesgo de enfermedades alérgicas, y los estudios muestran que las exacerbaciones del asma se reducen con la electrificación del transporte o la reducción de las emisiones de diésel (52). Además de la contaminación, los eventos del cambio climático han llevado a una mayor frecuencia; duración; y la gravedad de las exposiciones al polen, las tormentas de polvo, las infecciones, los incendios forestales y las tormentas eléctricas, todo lo cual puede empeorar las alergias y el asma (53).
El campo de la alergia, el asma y la inmunología se encuentra en una intersección importante entre la protección de la salud planetaria y la biodiversidad y, al mismo tiempo, la protección de la salud humana. Además, los efectos invernadero sobre el polen influyen en la frecuencia y gravedad del asma y la rinitis alérgica. La temperatura, las concentraciones de CO2 y los eventos de precipitación afectan la duración, la concentración, la alergenicidad y la distribución geográfica de la temporada de polen (55-57).
Los eventos climáticos extremos, como el asma por tormentas eléctricas (causado por una liberación repentina de grandes cantidades de polen) pueden provocar eventos fatales (58). Otros eventos climáticos que afectan la alergia y el asma incluyen inundaciones intensas e incendios forestales.
El aumento de la humedad después de una inundación induce la proliferación de moho, lo que aumenta las concentraciones de esporas de moho en interiores y aumenta el riesgo para los pacientes con asma o rinitis alérgica (59). Además, el polvo del desierto puede influir en la salud respiratoria y se ha incluido en la larga lista de factores ambientales que afectan las enfermedades alérgicas y respiratorias (60).
Las poblaciones vulnerables, como los niños, las mujeres embarazadas y los pueblos indígenas, son particularmente susceptibles a los efectos del cambio ambiental y climático con respecto a los síntomas de alergia y asma. Por ejemplo, aunque el aumento del calor agrava los efectos en la salud del humo de los incendios forestales y la contaminación, pocos edificios y casas en áreas de pobreza tienen aire acondicionado o filtros adecuados para reducir la exposición al humo y la contaminación debido a los altos costos. Muchos niños están afuera en los patios de las escuelas la mayor parte del día y, por lo tanto, tienen una mayor exposición a la contaminación del aire, las tormentas de polvo y el polen, lo que puede provocar un aumento del asma y la rinitis alérgica (61).
EL PAPEL DE LA BARRERA EPITELIAL, EL MICROBIOMA Y LA INFECCIÓN EN LAS ENFERMEDADES ALÉRGICAS
Disfunción de la barrera epitelial
Se ha encontrado que el aumento en la prevalencia y la exacerbación de muchas enfermedades alérgicas está asociado con una mutación de pérdida de función del gene de la filagrina o daño a la capa epitelial, probablemente inducido por la exposición a partículas, escape de diesel, humo de cigarrillo, y ropa, detergentes para lavavajillas, limpiadores domésticos, microplásticos, nanopartículas, emulsionantes alimentarios y otras sustancias no identificadas (62, 63).
La hipótesis de la barrera epitelial propone que una barrera epitelial defectuosa facilita la translocación de sustancias externas desde la superficie apical de las células epiteliales hacia las áreas interepiteliales y hacia la circulación sanguínea. La colonización por patógenos oportunistas, la disminución de la biodiversidad microbiana, la disbiosis microbiana, la translocación de bacterias debajo del epitelio, la inflamación periepitelial y los mecanismos de reparación deteriorados, junto con la migración de células inflamatorias a los tejidos afectados, conducen a la disfunción de la barrera epitelial, lo que produce una enfermedad crónica afectando la piel y las mucosas (62).
Una carga adicional y potencialmente importante sobre la integridad de las barreras epiteliales fué la introducción de nuevas composiciones de surfactantes y enzimas proteolíticas en los detergentes para ropa y lavavajillas a mediados de la década de 1960.
Ahora hay varias líneas de evidencia epidemiológica que relacionan el desarrollo de asma, rinitis alérgica y dermatitis atópica con la exposición directa a detergentes (62, 64, 65). Dos tensioactivos principales, a saber, SDS y dodecilbenceno sulfonato de sodio, están presentes en detergentes para ropa, jabones, champús y productos de limpieza para el hogar y se ha demostrado que dañan las barreras de unión estrecha del epitelio pulmonar y cutáneo incluso en concentraciones extremadamente bajas (dilución 1:100000). )(64). Además, los estudios en hámsters han demostrado que los emulsionantes presentes en los alimentos procesados aumentan la permeabilidad intestinal, lo que provoca daños en la mucosa (66).
Microbioma
Se ha demostrado que la disbiosis del microbioma de la piel, el intestino y los pulmones contribuye a la patogenia de las enfermedades alérgicas. Ejemplos de bacterias asociadas con enfermedades alérgicas incluyen Staphylococcus aureus, Clostridium difficile, Escherichia coli, Streptococcus sp. y Haemophilus sp.
Se ha demostrado que los bebés que desarrollan dermatitis atópica tienen una mayor prevalencia de S. aureus en la primera infancia, antes de que se observen los síntomas. Además, S. aureus se observa en altas concentraciones en áreas de la piel con mayor gravedad de la enfermedad (67). S. aureus altera la barrera epidérmica mediante la producción de proteasas y toxinas y, al penetrar en la epidermis, estimula las citocinas TH2, como IL-4 e IL-13 (68). Otras bacterias están asociadas con un menor riesgo de enfermedades alérgicas. Los ejemplos incluyen Staphylococcus epidermidis, Lactobacillus y Corynebacterium (69).
Los estudios muestran que la composición del microbioma cutáneo en la vida neonatal es crucial para dar forma a las respuestas inmunitarias adaptativas a los comensales, como S. epidermidis, y la interrupción de estas interacciones podría tener implicaciones duraderas para la salud (70).
Las bacterias intestinales comensales pueden activar las células B productoras de IL-10 del intestino a través del receptor tipo Toll 2, la respuesta primaria de diferenciación mieloide 88 y las vías de la fosfatidilinositol-3-quinasa (71) y mantener la homeostasis de la mucosa intestinal y la tolerancia inmunitaria (71). Las infecciones con bacterias como Streptococcus pneumoniae y Haemophilus influenzae también se han relacionado con el asma (72).
Infección
La inflamación de los bronquiolos pequeños y el tejido circundante (bronquiolitis) está fuertemente asociada con la infección por rinovirus (RV) y virus sincitial respiratorio (RSV), con bronquiolitis asociada con RSV más prevalente en bebés más pequeños y la temporada de invierno y bronquiolitis asociada con RV más prevalente en los últimos meses, otoño y principios de la primavera y en bebés mayores y niños pequeños.
Alrededor de un tercio de los bebés hospitalizados con bronquiolitis desarrollan asma más tarde en la vida (73). Mediante la reacción en cadena de la polimerasa (PCR), se han detectado virus en el 100 % de los pacientes con bronquiolitis, entre el 85 y el 95 % de los niños con sibilancias recurrentes o exacerbaciones del asma y en el 80 % de los adultos con exacerbaciones del asma (74).
Las infecciones virales, particularmente en bebés más pequeños cuyos pulmones aún se encuentran en una etapa crítica de desarrollo, podrían provocar efectos a largo plazo y un mayor riesgo de asma. Algunos estudios sugieren que la sensibilización alérgica o la exacerbación del asma pueden ocurrir después de una infección viral a través del daño al epitelio pulmonar y la liberación de citocinas proinflamatorias (74).
El tratamiento con el anticuerpo anti-IgE, omalizumab, disminuye el RV en las secreciones nasales y disminuye el número de exacerbaciones de asma (75). Se ha sugerido que el deterioro de la producción de interferón tipo I permite la replicación viral descontrolada y la inflamación TH2 (75).
PREVENCIÓN DE ENFERMEDADES ALÉRGICAS
Gran parte de la investigación clínica sobre la prevención de las alergias y el asma se ha producido gracias a un sólido conjunto de pruebas epidemiológicas y mecánicas. Sobre la base de los datos actuales, las intervenciones que pueden prevenir las enfermedades alérgicas incluyen la exposición temprana a los alérgenos y el mantenimiento o reparación de las barreras epiteliales.
Además, evitar el polen y otros contaminantes del aire evitaría las exacerbaciones alérgicas. Se ha demostrado que la diversidad de la dieta administrada en las primeras etapas de la vida (infancia y niñez temprana) es importante para disminuir el riesgo de alergias, probablemente debido a la activación de las vías tolerogénicas por parte de las células Treg y sus mediadores. Roduit et al. (76) demostraron que una mayor diversidad de alimentos alergénicos complementarios introducidos en el primer año de vida se asoció inversamente con alergia alimentaria hasta los 6 años de edad, sensibilización alimentaria y mayor expresión de un marcador de células Treg. Recientemente, D’Auria et al. (77) corroboraron este hallazgo en otro estudio epidemiológico.
Learning Early About Peanut Alergia (LEAP) proporcionó la primera evidencia convincente de que la alergia al maní se puede prevenir mediante la introducción temprana del maní en la dieta infantil (78, 79). Estos hallazgos han llevado a cambios en las pautas de introducción de alimentos en todo el mundo (2). Desde entonces, otros estudios han respaldado este hallazgo para el maní y otros alimentos. Una revisión sistemática y un metanálisis de seis ensayos controlados aleatorios, que incluyeron a más de 3000 participantes, mostraron una asociación entre la introducción temprana del huevo y un menor riesgo de alergia al huevo (80).
Una revisión sistemática encontró pruebas limitadas a sólidas que sugieren que la introducción de alimentos alergénicos en el primer año de vida (después de los 4 meses) puede prevenir la alergia al maní y al huevo (81). Esto está respaldado por una revisión sistemática y un metanálisis de Burgess et al. (82), que no encontró evidencia de estudios observacionales de que la introducción de sólidos antes de los 4 meses protegiera contra la alergia alimentaria, pero sí hubo evidencia de protección contra la sensibilización alimentaria.
La introducción de huevo de 4 a 6 meses y maní de 4 a 11 meses redujo el riesgo de alergia al huevo, alergia al maní y sensibilización al huevo (82). Más recientemente, un estudio piloto demostró la seguridad y eficacia del consumo diario de pequeñas cantidades de alérgenos múltiples por parte de los bebés para la prevención de alergias alimentarias (83). Se necesitan más estudios sobre el mecanismo para confirmar qué células y mediadores están implicados en el desarrollo de la tolerancia en los primeros años de vida.
Actualmente se está estudiando la reparación de las barreras cutáneas a través de humectantes como un método potencial de prevención para reducir la incidencia de alergias.
La optimización de los humectantes es un enfoque particular de la investigación actual porque se ha demostrado que algunos emolientes causan daño, mientras que otros reparan la barrera de la piel (84, 85) Los humectantes que imitan el pH fisiológico y la composición de lípidos de la piel ( 1:1 de ceramidas, colesterol y ácidos grasos libres) se están probando ahora en una serie de ensayos clínicos.
Estudios de Sindher et al. (86) han demostrado que estos humectantes reducen la pérdida de agua transepidérmica y aumentan las proporciones de IgG4:IgE (87), lo que sugiere mejoras en la función de barrera de la piel y una disminución de la sensibilización alérgica. La prevención de enfermedades alérgicas y respiratorias es un beneficio anticipado de los planes para mitigar y adaptarse al cambio climático.
Las estratégias de adaptación incluyen el uso de filtros para prevenir la exposición al polen. Se necesitan sistemas y aplicaciones de monitoreo para proporcionar información sobre el polen y los contaminantes en tiempo real, lo que puede alertar a las personas sobre altas cargas de polen y contaminantes en el exterior.
Los filtros de aire de partículas de alta eficiencia pueden permitir la reducción de la contaminación del aire interior; sin embargo, estos deben estar ampliamente disponibles para los países o familias de ingresos bajos y medianos (88).
TRATAMIENTOS PARA ENFERMEDADES ALÉRGICAS
Los tratamientos para la enfermedad alérgica incluyen antihistamínicos, corticosteroides, antagonistas de los receptores de leucotrienos, agonistas beta de acción corta, productos biológicos, inhibidores de la cinasa de Janus (JAK) o inmunoterápia específica para alérgenos (Tabla 2).
En 2003, la Administración de Alimentos y Medicamentos (FDA) de EE. UU. aprobó el primer medicamento biológico, omalizumab, un anticuerpo monoclonal (mAb) anti-IgE, para el tratamiento de enfermedades alérgicas (asma). Doce años después, la FDA aprobó el próximo medicamento biológico para el asma, el mepolizumab, que se une a la IL-5.
Durante 2015 a 2022, también se pusieron a disposición del público otros cuatro productos biológicos para el asma, que se dirigen a diferentes citoquinas involucradas en la vía alérgica. Se ha demostrado que dupilumab, un inhibidor de IL-4R, mejora de manera efectiva los resultados en muchas enfermedades alérgicas (Tabla 2).
Otros productos biológicos también han progresado clínicamente. Por ejemplo, se diseñó un cóctel de dos anticuerpos IgG monoclonales completamente humanos para unirse y bloquear específicamente un alérgeno felino importante, Fel d1, evitando que se una y active los anticuerpos endógenos que causan alergias.
Este cóctel de anticuerpos se encuentra actualmente en estudios de fase 3. Para la alergia al maní, PVX108, que está compuesto por una mezcla de péptidos que representan secuencias de alérgenos de maní críticos para el reconocimiento por parte de las células T específicas de maní, se está evaluando en ensayos clínicos. Las terápias y dianas biológicas adicionales se muestran en la Tabla 3.
Los tratamientos de Inmunoterápia con inmunomoduladores y el aumento de la tolerancia se asocia con aumentos en las proporciones de IgG4:IgE (89). Para la rinitis alérgica, la inmunoterápia subcutánea ha sido el estándar de oro. Sin embargo, en los últimos años, la inmunoterápia sublingual (SLIT) ha surgido como una alternativa eficaz y más segura. Cuatro tabletas SLIT aprobadas por la FDA han sido aprobadas desde 2014 (90). La inmunoterápia oral (OIT) se ha mostrado más prometedora para la alergia alimentaria. En 2021, se aprobó Palforzia, una terápia específica para la alergia alimentaria (alergia al maní).
Sin embargo, muchas personas sufren de más de una alergia alimentaria y tienen condiciones alérgicas comórbidas. La OIT para las alergias alimentarias distintas de la alergia al cacahuete y para el tratamiento de múltiples alérgenos alimentarios simultáneamente es todavía experimental sin formulaciones o protocolos estandarizados.
Aunque la evidencia sobre el papel de la microbiota intestinal en la regulación inmunológica está bien establecida, los ensayos clínicos no han demostrado que los probióticos sean eficaces para el tratamiento de la enfermedad alérgica. En un estudio aleatorizado que comparó probiótico más ITO de maní con ITO de maní solo, los investigadores no encontraron diferencias en la eficacia entre los dos grupos de tratamiento (91).
Otra clase de fármacos que se han mostrado prometedores son los inhibidores de la tirosina quinasa (BTK) Bruton y JAK (92). La vía de señalización JAK/transductor de señal y activador de la transcripción (STAT) bloquea simultáneamente múltiples citoquinas patógenas a través de la inhibición de las vías transductoras JAK/STAT corriente abajo. En la dermatitis atópica, se ha observado un aumento de la señalización de los cuatro miembros de la familia JAK, JAK1, JAK2, JAK3 y tirosina quinasa 2.
Se han desarrollado varios inhibidores de JAK/STAT (o inhibidores de JAK) que se dirigen a múltiples miembros de JAK simultáneamente o, más específicamente, se dirigen a JAK únicos; estos medicamentos se están evaluando en ensayos clínicos para alérgicos y otros trastornos inmunitarios. Para la dermatitis atópica, las formulaciones orales y tópicas de estos medicamentos se encuentran en ensayos clínicos.
Actualmente, dos inhibidores de JAK orales (abrocitinib y upadacitinib) y un inhibidor de JAK tópico, ruxolitinib, están aprobados por la FDA para la dermatitis atópica. Baricitinib fué aprobado por la Agencia Europea de Medicamentos (EMA) para la dermatitis atópica y se encuentra en ensayos clínicos en los Estados Unidos (92). Además, una aplicación potencial de BTK es la prevención de la anafilaxia mediada por IgE.
La terápia a corto plazo con ibrutinib, un inhibidor de BTK, suprimió las respuestas de las pruebas cutáneas y eliminó la activación de los basófilos mediada por IgE en adultos con alergia al maní ó a las nueces (93).
RETOS Y NECESIDADES FUTURAS
Esta revisión pretendía cubrir el «estado del arte» con respecto a la definición, la etiología, los factores ambientales contribuyentes y las estratégias de tratamiento y prevención de los trastornos alérgicos. Una cosa es cierta: las alergias, incluidas aquellas con el potencial de mediar en resultados fatales, recientemente han aumentado notablemente en prevalencia, y las alergias ahora afectan entre el 25 y el 30 % de la población humana (3-6).
Los efectos acumulativos de los rápidos cambios actuales en nuestro clima sobre la incidencia y la gravedad de los trastornos alérgicos indican que las alergias aumentarán tanto en prevalencia como en su impacto clínico (94).
En este preocupante escenario de la creciente incidencia y gravedad de las enfermedades alérgicas, ha habido varios avances en el diagnóstico, la prevención y el tratamiento de los trastornos alérgicos, pero siguen existiendo enormes desafíos.
Estos se pueden dividir en (i) establecer un diagnóstico completo, incluida la identificación de los alérgenos específicos que causan la enfermedad, en pacientes individuales (y excluyendo los alérgenos falsos), (ii) monitorear la eficacia y la duración de las estrategias de tratamiento existentes en los afectados por alergias, ( iii) mejorar las opciones para un diagnóstico y tratamiento precisos, incluida la necesidad de una atención primaria adecuada, y (iv) proporcionar estrategias efectivas para evitar realmente el desarrollo de alergias en primer lugar. Por ejemplo, en varios estudios se ha buscado la identificación temprana de defectos de la barrera cutánea en bebés y la predicción del desarrollo de eccema infantil en los próximos meses.
Un método desarrollado recientemente para la detección de barreras cutáneas mediante espectroscopia de impedancia eléctrica puede ser útil en este contexto, y se han iniciado varios estudios (95).
Es fundamental establecer un diagnóstico firme de la enfermedad alérgica e identificar todos los alérgenos desencadenantes, especialmente porque a muchos pacientes se les ha dicho que son «alérgicos» a varios alérgenos para los que en realidad tienen poca o ninguna reactividad clínica (96). El simple establecimiento de la presencia de anticuerpos IgE “antialérgenos” en el torrente sanguíneo no es suficiente para el diagnóstico (96). Agregar pruebas cutáneas contra alérgenos candidatos puede ayudar a identificar a aquellos con reactividad clínica clara a alérgenos particulares, pero esa prueba puede producir reacciones adversas o resultados falsos positivos (97, 98).
Las pruebas de activación de basófilos convencionales son superiores a las pruebas de IgE porque pueden mostrar si los basófilos circulantes de un individuo son reactivos al antígeno candidato cuando se analizan
Ex-vivo (99, 100). Actualmente, las pruebas de activación de basófilos se realizan solo en unos pocos centros de investigación seleccionados y no están disponibles como prueba clínica de rutina.
Las pruebas de activación de microbasófilos en el punto de atención, utilizando un dispositivo integrado de aislamiento de basófilos microfluídicos, i-BID, representan un enfoque simple y prometedor para extender los beneficios de las pruebas de activación de basófilos a los laboratorios clínicos (101). Además, también se están realizando ensayos de mastocitos para su posible uso en el diagnóstico de alergias (102).
Por último, dado que se ha demostrado que múltiples factores ambientales inician o exacerban las enfermedades alérgicas, se deben desarrollar herramientas eficaces para abordar tales exposiciones. Por ejemplo, más de 200000 productos químicos se introdujeron en los seres humanos después de la década de 1960, y muchos de ellos ahora forman parte del exposoma humano (103). Sería útil realizar estudios sobre cómo estos productos químicos pueden influir en las alergias y el asma (63).
En resumen, se han hecho progresos en cuanto a nuestra comprensión de los factores que contribuyen al desarrollo de enfermedades alérgicas y en cuanto a los enfoques para reducir la incidencia de estos trastornos.
Sin embargo, quedan desafíos sustanciales. La correcta evaluación y manejo de las enfermedades alérgicas y la multimorbilidad del asma para la medicina de precisión o la validación de biomarcadores predictivos son temas de futuro fundamentales a estudiar (104-106).
Las herramientas mejoradas de biología de sistemas, como los organoides y los modelos animales humanizados de enfermedades ayudarán en el estudio adicional de los mecanismos. Se espera que una comprensión más amplia de los factores que contribuyen al desarrollo de alergias y la manifestación de alergias en los órganos diana, así como mejoras adicionales en nuestras herramientas para analizar de forma segura dicha reactividad alérgica, darán como resultado una reversión de la tendencia actual hacia una mayor incidencia y gravedad de estos trastornos potencialmente devastadores.



REFERENCIAS BIBLIOGRÁFICAS
Las 121 referencias están en el link abajo.
https://1drv.ms/w/s!AnVaf1zfJIy_rbhHySeqa1Oz-nXeyQ?e=kSLuQi