La Administración de Drogas y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) brinda una actualización sobre los informes de carcinoma de células escamosas (SCC, por sus siglas en inglés) en el tejido cicatricial (cápsula) que se forma alrededor de los implantes mamarios. Previamente, el 8 de septiembre de 2022, la FDA emitió un comunicado de seguridad informando al público sobre informes de cánceres, incluidos SCC y varios linfomas, en la cápsula que se forma alrededor de los implantes mamarios. Los diversos linfomas no son los mismos que los linfomas descritos anteriormente por la FDA como linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL).
Esta actualización incluye información de la revisión de la literatura y los informes de dispositivos médicos (MDR) de la FDA. La FDA tiene conocimiento de 19 casos de SCC en la cápsula alrededor del implante mamario a partir de la literatura publicada. Ha habido informes en la literatura de muertes por progresión de la enfermedad. Si bien la FDA sigue creyendo que las ocurrencias de SCC en la cápsula alrededor del implante mamario pueden ser raras, la causa, la incidencia y los factores de riesgo aún se desconocen.
Los proveedores de atención médica y las personas que tienen o están considerando implantes mamarios deben saber que se han informado a la FDA y en la literatura casos de SCC y varios linfomas en la cápsula alrededor del implante mamario. La FDA continúa pidiendo a los proveedores de atención médica y a las personas con implantes mamarios que informen a la FDA los casos de SCC, linfomas o cualquier otro cáncer alrededor de los implantes mamarios. Además, seguimos colaborando con otras autoridades reguladoras, expertos científicos, fabricantes de implantes mamarios y registros para recopilar toda la información disponible sobre los cánceres en la cápsula que rodea los implantes mamarios.
=> Recibir por Whatsapp las noticias destacadas
Recomendaciones para personas que tienen o están considerando implantes mamarios
La FDA continúa recomendando lo siguiente:
Si está considerando implantes mamarios o si los tiene, obtenga más información sobre los riesgos y beneficios de los implantes mamarios.
Si tiene implantes mamarios, no necesita cambiar su atención médica de rutina ni su seguimiento.
Tenga en cuenta que se han informado casos de SCC y varios linfomas (aparte de BIA-ALCL) en la cápsula alrededor del implante mamario.
Supervise sus implantes mamarios durante todo el tiempo que los tenga. Si nota algún cambio en sus senos o implantes, hable de inmediato con su cirujano o proveedor de atención médica.
Si no tiene síntomas, la FDA no recomienda la extracción de implantes mamarios únicamente debido a la preocupación relacionada con el riesgo de desarrollar SCC o varios linfomas.
Si tiene implantes mamarios y experimenta un problema, la FDA le recomienda que presente un informe a través de MedWatch, el programa de información de seguridad y notificación de eventos adversos de la FDA. Su informe, junto con información de otras fuentes, puede brindar información que ayude a mejorar la seguridad del paciente.
Actualmente, estas recomendaciones no cambian ni afectan las recomendaciones proporcionadas anteriormente por la FDA sobre el linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL).
Recomendaciones para los proveedores de atención médica
La FDA continúa recomendando lo siguiente:
Continúe brindando atención y apoyo de rutina a sus pacientes con implantes mamarios.
Tenga en cuenta que se han informado casos de SCC y varios linfomas (aparte de BIA-ALCL) en la cápsula alrededor del implante mamario.
Al examinar muestras de implantes mamarios (por ejemplo, seroma, cápsula, dispositivos) para la evaluación diagnóstica, caracterice todos los hallazgos y posibles diagnósticos.
Recomendaciones actualizadas para proveedores de atención médica
Incluya información sobre SCC y varios linfomas en la cápsula alrededor del implante mamario en sus conversaciones con personas que tienen o están considerando implantes mamarios.
Para las pacientes que han sido diagnosticadas con SCC o varios linfomas en la cápsula alrededor del implante mamario, desarrolle un plan de tratamiento individualizado en coordinación con un equipo multidisciplinario de expertos que incluya oncología quirúrgica, cirugía plástica, cirugía mamaria, radiología, oncología y patología.
Informe todos los casos de SCC, linfomas y cualquier otro tipo de cáncer en la cápsula alrededor del implante mamario a la FDA. La notificación rápida de eventos adversos puede ayudar a la FDA a identificar y comprender mejor los riesgos asociados con los dispositivos médicos.
Incluya la siguiente información en el informe, si la conoce:
Presentación clínica e historial de implantes mamarios
Estudios de imagen realizados
Patología del tejido de la cápsula.
terapia de tratamiento
Resultados
Actualmente, estas recomendaciones no cambian ni afectan las recomendaciones proporcionadas anteriormente por la FDA sobre el linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL).
Los implantes mamarios son dispositivos médicos que se implantan debajo del tejido mamario o del músculo pectoral para aumentar el tamaño mamario (aumento) o para reemplazar el tejido mamario que se ha extraído (reconstrucción) debido a un cáncer o un traumatismo, o que no se ha desarrollado correctamente debido a una grave anomalía en la mama. Los implantes mamarios también se utilizan en cirugías de revisión, que buscan corregir o mejorar el resultado de una cirugía original.
Hay dos tipos de implantes mamarios aprobados para la venta en los Estados Unidos: rellenos de solución salina y rellenos de gel de silicona. Ambos tipos tienen una cubierta exterior de silicona. Varían en tamaño, grosor de la concha, textura de la superficie de la concha y forma (contorno).
Los implantes mamarios no son dispositivos de por vida. Cuanto más tiempo tenga sus implantes, más probable será que se los quiten o reemplacen.
Resultados de la revisión de la literatura publicada de la FDA
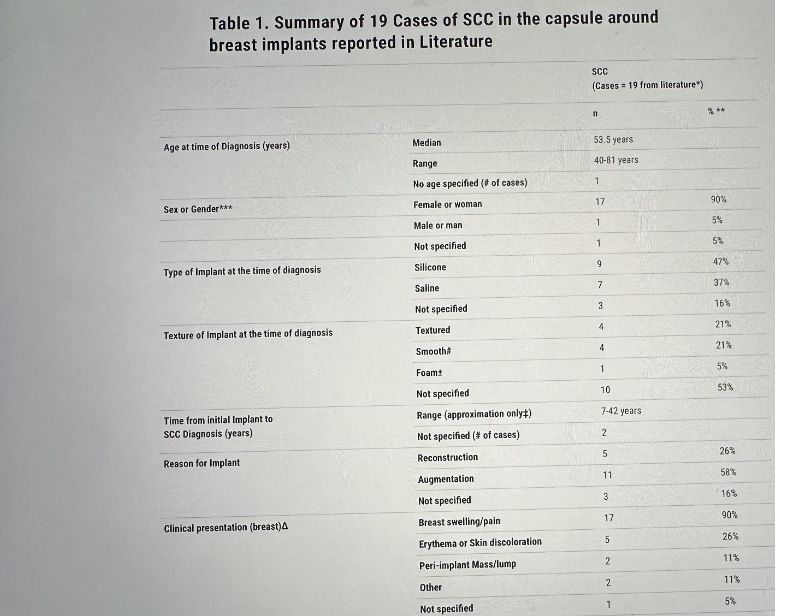
Después de revisar la literatura publicada, incluidos resúmenes y artículos completos hasta enero de 2023, la FDA tiene conocimiento de 19 casos de SCC en la cápsula alrededor de los implantes mamarios. De los 19 casos de la literatura, 17 se informaron en mujeres, 1 se informó en un hombre y no hubo información disponible para 1 caso. La edad de los pacientes en el momento del diagnóstico osciló entre 40 y 81 años. La mayoría de los casos involucraron hinchazón y/o dolor en el seno como síntomas. Otros síntomas informados incluyeron bultos y decoloración de la piel. Los implantes mamarios, cuando el motivo del implante estaba disponible, se habían colocado para la reconstrucción y el aumento mamario.
En general, el diagnóstico se estableció mediante un examen anatomopatológico del tejido de la cápsula. Los estudios de imágenes a menudo se usaban en el diagnóstico, como la tomografía computarizada (TC) del tórax, o la resonancia magnética nuclear (RMN) de la mama, o la TC en combinación con la tomografía por emisión de positrones (PET) como PET-CT. El diagnóstico de SCC en la cápsula alrededor del implante mamario ocurrió aproximadamente de 7 a 42 años (cuando los datos estaban disponibles) después de la colocación inicial del implante. El SCC estaba ubicado en la cápsula alrededor del implante mamario, a menudo en la parte posterior (detrás del implante) sin estar presente en el tejido mamario. En la literatura se reportaron tres reportes de muerte por la enfermedad.
En resumen, ha habido informes en la literatura de SCC en la cápsula alrededor del implante mamario tanto para implantes mamarios texturizados como lisos, y para implantes mamarios de solución salina y silicona, cuando la información del implante estaba disponible. En la mayoría de los casos, las personas fueron diagnosticadas años después de la colocación inicial del implante.
Resultados de la revisión de la FDA de MDR
Hasta el 15 de enero de 2023, la FDA ha recibido 24 informes de dispositivos médicos (MDR) sobre SCC relacionados con implantes mamarios. La FDA reconoce las limitaciones de los datos de MDR, incluido el informe duplicado de casos dentro de los MDR y entre los MDR y la literatura. Por lo tanto, las MDR no representan necesariamente casos únicos. Además, la incidencia de SCC en la cápsula alrededor de los implantes mamarios no se puede determinar a partir de este sistema de notificación solo debido a la posible subnotificación, la notificación duplicada de eventos y la falta de información sobre el número total de pacientes que tienen implantes mamarios. Con base en la revisión de las MDR, la información descrita sobre SCC relacionada con los implantes mamarios es similar a la información de la literatura sobre la edad de la paciente, el tipo de implante, el motivo del implante, el tiempo hasta el diagnóstico y la presentación clínica.
Los MDR enviados a la FDA son solo una fuente que la FDA utiliza para monitorear la seguridad de los dispositivos médicos, además de los estudios posteriores a la comercialización obligatorios, la literatura publicada y los datos del mundo real de los registros y bases de datos.
Compartido, traducido y editado por Ronald Palacios Castrillo