La identificación de las causas de las cardiopatías congénitas (CC) es un requisito previo para la prevención precisa y el tratamiento personalizado de las CC. Zhao et al.(1) muestran que el ácido palmítico (PA) sérico gestacional predispone a la descendencia a la cardiopatía coronaria al perturbar la vía de señalización MARS/K-Hcy/GATA4.
La cardiopatía congénita (CC), que se refiere a un amplio espectro de malformaciones estructurales que ocurren en el corazón, las válvulas y los grandes vasos sanguíneos endotorácicos durante la cardiogénesis embrionaria, representa el tipo de defecto congénito humano más prevalente, con una prevalencia estimada del 1% en recién nacidos y hasta el 10 % de los mortinatos en todo el mundo(2,3 ).Aunque la cardiopatía coronaria pequeña puede resolverse espontáneamente, la cardiopatía coronaria grave puede dar lugar a una peor calidad de vida relacionada con la salud, menor rendimiento en el ejercicio, hipertensión arterial pulmonar, disfunción pulmonar restrictiva, daño renal, deterioro función hepática, neurodesarrollo retrasado, lesión cerebral, tromboembolismo, endocarditis infecciosa, insuficiencia cardíaca congestiva, arritmias cardíacas y muerte cardíaca súbita(2,3). Recientemente se ha logrado un avance sorprendente en los procedimientos quirúrgicos e intervencionistas cardiovasculares pediátricos, así como en los cuidados intensivos perioperatorios, lo que permite que aproximadamente el 95 % de los niños que padecen cardiopatía coronaria sobrevivan hasta la edad adulta, en consecuencia y produciendo una población cada vez mayor de personas adultas afectadas que alcanzan la edad reproductiva y, en la actualidad, los adultos ya superan en número a los niños que viven con CC(3) , incluidos el cáncer, la hipertensión pulmonar, la disfunción renal, la trombosis, la aortopatía, la insuficiencia cardíaca, las arritmias y la muerte cardíaca(3,4 ).Obviamente, la cardiopatía coronaria ha impuesto una tremenda carga socioeconómica a los seres humanos, lo que subraya la necesidad urgente de desentrañar la base molecular que sustenta la cardiopatía coronaria. .
El corazón de cuatro cámaras es el primer órgano funcional que se desarrolla durante la embriogénesis, y su morfogénesis implica un proceso biológico complejo que está finamente controlado de manera temporal y espacial por una red intrincadamente coordinada, que comprende principalmente factores transcripcionales, moléculas de señalización, proteínas miocárdicas, modificadores epigenéticos y microARN(4,5). Cada vez más pruebas han demostrado de manera convincente que los factores patógenos genéticos y ambientales pueden alterar el proceso de desarrollo cardíaco, lo que resulta en CHD(6,7). Sin embargo, hasta la fecha, una etiología definitiva responsable de CHD se identifica en solo ∼ 50% de los individuos afectados(7). Recientemente, estudios emergentes han corroborado el efecto clave del trastorno metabólico materno durante el embarazo en la incidencia de CHD fetal y han revelado que una dieta rica en grasas contribuye a la CHD a través de múltiples vías(1,8,9). En el estudio actual, Zhao et al.(1) demostraron mediante análisis clínicos e investigaciones in vitro e in vivo en modelos de ratones que aumentaron los niveles de ácido palmítico (PA) en suero materno condujeron a CHD mediante la modificación postraduccional de GATA4, revelando un nuevo objetivo molecular potencial para la profiláxis prenatal de CHD.
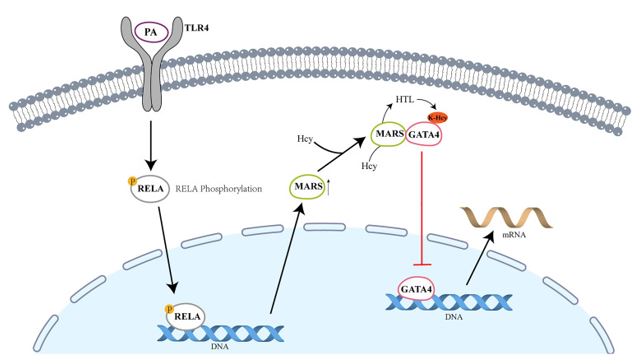
=> Recibir por Whatsapp las noticias destacadas
Los autores realizaron cromatografía de gases junto con un detector de ionización de llama o un espectrómetro de masas de muestras de suero de mujeres embarazadas para explorar la asociación de diferentes tipos de ácidos grasos libres (FFA) y niveles totales de FFA con CHD fetal. Analizaron las muestras de suero de 32 mujeres embarazadas con niños con CHD y 16 mujeres embarazadas con fetos sanos y encontraron que los niveles séricos de FFA y FFA totales de mujeres embarazadas con fetos con CHD estaban significativamente elevados. El análisis estadístico mostró que los niveles maternos de PA y FFA totales estaban fuertemente relacionados con el riesgo de cardiopatía coronaria en los fetos. Con base en estos hallazgos, establecieron un modelo de ratón con una dieta rica en PA. En comparación con los ratones con una dieta normal, la incidencia de cardiopatía coronaria en la descendencia de ratones preñados con una dieta rica en PA aumentó significativamente (2,97 % frente a 31,96 %). Los experimentos de western blot confirmaron que las expresiones de metionil-tRNA sintetasa (MARS) y homocisteinilación de lisina (K-Hcy) en embriones de ratón alimentados con una dieta alta en PA aumentaron significativamente, y la expresión de K-Hcy podría inhibirse mediante la suplementación. N-acetil-L-cisteína (NAC). Sin embargo, el nivel de homocisteína no cambió significativamente, y el nivel de proteína K-Hcy no pudo reducirse con la suplementación con ácido fólico, lo que implicaba que la PA promovía la expresión de MARS y aumentaba el nivel de K-Hcy por otras vías además del ácido fólico. Además, la base de datos JASPAR se utilizó para predecir los posibles factores de transcripción que se unen a la región promotora de MASR y confirmó que PA activó la vía NF-κB, lo que incrementó la unión entre RELA y la región promotora de MARS y aumentó la expresión de MARS. Además del descubrimiento de nuevos vínculos entre PA y MARS, los autores también exploraron cómo las señales de K-Hcy activadas promovieron el desarrollo de CHD. Los autores evaluaron los factores de transcripción relacionados con la cardiopatía coronaria de acuerdo con las características de la cardiopatía coronaria de los individuos y la descendencia afectada de ratones preñados y observaron la interacción entre GATA4 y MARS. Se descubrió que la modificación de K-Hcy inducida por MARS se produjo en el residuo de lisina 300 de GATA4 (K300), que inactivó GATA4 y bloqueó su unión al promotor del gene diana corriente abajo y aumentó los niveles de expresión de los factores de transcripción endoteliales/endocárdicos, proporcionando una explicación para CC inducida por PA. Por el contrario, los investigadores establecieron un modelo de ratón knockout para Mars, y la ablación de Mars redujo con éxito la incidencia de CHD en la descendencia de ratas preñadas alimentadas con PA.
En resumen, este estudio indica que el aumento de la PA sérica materna durante el embarazo aumenta la expresión de MARS mediante la activación de la vía NF-κB y aumenta la modificación K-Hcy de GATA4, lo que predispone a la descendencia a CHD (Figura 1). El mecanismo regulador postranscripcional explica la patogenia molecular de la cardiopatía coronaria asociada a PA, lo que sugiere una estrategia preventiva novedosa para la cardiopatía coronaria fetal en mujeres embarazadas con alta circulación de PA. El trabajo futuro debe ampliar las funciones específicas de las diferentes proteínas modificadas con K-Hcy en la organogénesis cardíaca y la aparición de CHD.
Ronald Palacios Castrillo, M.D.,PhD.
References
- Zhao R. Cao L. Gu W.J. Li L. Chen Z.Z. Xiang J. Zhou Z.Y. Xu B. Zang W.D. Zhou X.Y. et al.Gestational palmitic acid suppresses embryonic GATA-binding protein 4 signaling and causes congenital heart disease.
Cell Rep. Med. 2023; 4100953https://doi.org/10.1016/j.xcrm.2023.100953 - Tsao C.W. Aday A.W. Almarzooq Z.I. Alonso A. Beaton A.Z. Bittencourt M.S. Boehme A.K. Buxton A.E. Carson A.P. Commodore-Mensah Y. et al.Heart Disease and Stroke Statistics – 2022Update: A report from the American Heart Association.
Circulation. 2022; 145: e153-e639https://doi.org/10.1161/CIR.0000000000001052 - Shi H.Y. Xie M.S. Yang C.X. Huang R.T. Xue S. Liu X.Y. Xu Y.J. Yang Y.Q. Identification of SOX18 as a new gene predisposing to congenital heart disease.
Diagnostics. 2022; 12: 1917https://doi.org/10.3390/diagnostics12081917 - 4. Niwa K. Kaemmerer H. von Kodolitsch Y. Current diagnosis and management of late complications in adult congenital heart disease.
Diagn. Ther. 2021; 11: 478-480https://doi.org/10.21037/cdt-21-165 - Wang G. Wang B. Yang P. Epigenetics in congenital heart disease.
J. Am. Heart Assoc. 2022; 11e025163https://doi.org/10.1161/JAHA.121.025163 - 6. Lee K.S. Choi Y.J. Cho J. Lee H. Lee H. Park S.J. Park J.S. Hong Y.C. Environmental and genetic risk factors of congenital anomalies: An umbrella review ofsystematic reviews and meta-analyses.
Korean Med. Sci. 2021; 36: e183https://doi.org/10.3346/jkms.2021.36.e183 - Choudhury T.Z. Garg V. Molecular genetic mechanisms of congenital heart disease.
Curr. Opin. Genet. Dev. 2022; 75101949https://doi.org/10.1016/j.gde.2022.101949 - Collins 2nd, R.T. Yang W. Carmichael S.L. Bolin E.H. Nembhard W.N. Shaw G.M. National Birth Defects Prevention StudyMaternal dietary fat intake and the risk of congenital heart defects in offspring.
Pediatr. Res. 2020; 88: 804-809https://doi.org/10.1038/s41390-020-0813-x
9. Mires S. Reddy S. Skerritt C. Caputo M. Eastwood K. Maternal metabolomic profiling and congenital heart disease risk in offspring: A systematic review of observational studies.
Prenat. Diagn. 2023; https://doi.org/10.1002/pd.6301