Es necesario comprender la etiología del cáncer colorrectal de inicio temprano para abordar la creciente incidencia.
El cáncer colorrectal de aparición temprana (EOCRC, por sus siglas en inglés), también llamado cáncer colorrectal de aparición temprana, se define como el CCR diagnosticado en personas menores de 50 años. EOCRC está aumentando a nivel mundial y se prevé que se convierta en la principal causa de muerte por cáncer en personas de 20 a 49 años en los EE. UU. para 2030 (1). Desde la década de 1990, la incidencia ajustada por edad de EOCRC ha aumentado a un ritmo alarmante de 2 a 4% por año en muchos países, con aumentos aún más pronunciados en personas menores de 30 años (1).
Esto es a pesar de una reducción en la incidencia general de CCR que probablemente se atribuya a una mejor detección y prevención en personas mayores. Las razones exactas y la fisiopatología detrás de la creciente incidencia de EOCRC aún se desconocen. Actualmente, solo existen estudios limitados y se han centrado en aspectos únicos de la etiología de EOCRC. Se necesita un enfoque multidisciplinario para ampliar la comprensión de este problema cada vez más frecuente.
=> Recibir por Whatsapp las noticias destacadas
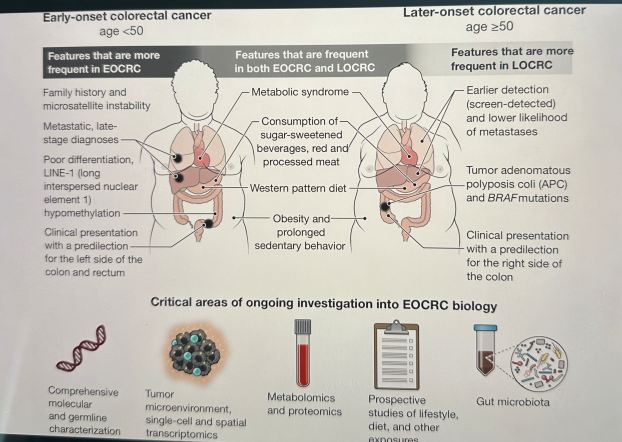
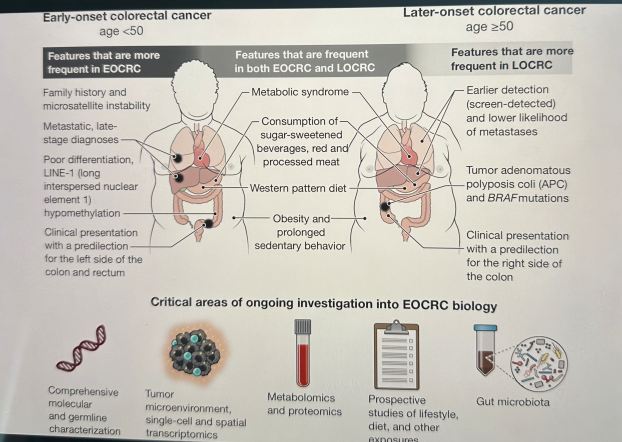
Los EOCRC exhiben una presentación clínica distinta con predilección por el lado izquierdo del colon y el recto, y se presentan con mayor frecuencia con síntomas como dolor abdominal y sangrado rectal (1). A los pacientes con EOCRC a menudo se les diagnostica una enfermedad en etapa más avanzada, lo que podría deberse a la falta de exámenes de detección que puedan detectar lesiones tempranas, pero también plantea la cuestión de una biología más agresiva.
De hecho, los pacientes con EOCRC metastásico no tienen una supervivencia superior en comparación con aquellos con CCR metastásico de aparición tardía (LOCRC) a pesar de menos comorbilidades, mejor estado funcional, uso más frecuente de cirugía y radioterapia, mayor intensidad de la dosis de quimioterapia y menos eventos adversos del tratamiento. (2).
El aumento en la incidencia de EOCRC refleja un efecto de «cohorte de nacimiento», en el que el mayor riesgo se transmite de generación en generación debido a cambios temporales en los factores de riesgo ambientales que afectan de manera desproporcionada a los nacidos en las últimas décadas en comparación con los nacidos antes (1).
Los pacientes con EOCRC tienen una prevalencia relativa más alta de predisposición hereditaria al cáncer, siendo el síndrome de Lynch la causa más común. Esta condición se caracteriza por una deficiencia en la vía de reparación de errores de emparejamiento del DNA que da como resultado altos niveles de inestabilidad de microsatélites con un mayor número de mutaciones, lo que predispone al CCR y otros tipos de cáncer.
Aunque el subdiagnóstico de los casos de síndrome de Lynch puede ser un posible factor contribuyente, esta y otras variantes germinales patogénicas de alta penetrancia no explican el aumento observado de EOCRC. Se han diseñado puntajes de riesgo poligénico (PRS) para seleccionar individuos más jóvenes para la detección personalizada de CRC, y su rendimiento mejora cuando se integra con puntajes de riesgo ambiental.
Sin embargo, las variantes incorporadas en estos PRS se obtienen de los loci del estudio de asociación del genoma completo (GWAS) del riesgo general de CCR (en todas las edades). Por lo tanto, se necesitan grandes GWAS dedicados a EOCRC, así como análisis de interacciones gene-ambiente, para refinar aún más cualquier contribución genética que sea específica de la presentación de inicio joven.
Se ha demostrado o propuesto que varios factores de riesgo ambientales, incluidas las exposiciones en la vida temprana, contribuyen al aumento de la incidencia de EOCRC. La obesidad y otras condiciones relacionadas con el síndrome metabólico han aumentado globalmente en las últimas décadas, y estos factores también están asociados con el riesgo de CCR.
Entre los participantes en el Estudio de Salud de Enfermeras (2), una cohorte prospectiva de enfermeras sanas de 25 a 42 años de edad en el momento de la inscripción a las que se les ha dado seguimiento con cuestionarios de dieta y estilo de vida validados durante décadas, obesidad en la adolescencia y la edad adulta (3) y comportamiento sedentario prolongado (4 ) se asociaron con un mayor riesgo de EOCRC. En otro estudio, los pacientes con condiciones metabólicas como hipertensión, hiperlipidemia, hiperglucemia y diabetes mellitus tipo 2 también tenían más probabilidades de desarrollar EOCRC (5). También se han implicado factores dietéticos que ahora se consumen cada vez más durante la niñez y la adolescencia, como las bebidas azucaradas( sodas como CocaCola,Pepsi, etc), la carne roja procesada ( no la natural) y las dietas de patrón occidental ( muchos preservantes y enlatadas).
Posiblemente debido a la occidentalización de las dietas y el estilo de vida, la incidencia de EOCRC ahora también está aumentando en países de bajos y medianos ingresos. Además, se ha propuesto que una serie de otros factores de riesgo potenciales están relacionados con el EOCRC, incluido un mayor uso de antibióticos, toxinas ambientales más ubicuas y tasas más altas de cesáreas y otros procedimientos quirúrgicos (1).
Desafortunadamente, los estudios observacionales solo arañan la superficie de nuestra comprensión de la biología de EOCRC, y los esfuerzos para desentrañar la probable etiología multifactorial de EOCRC se ven obstaculizados por varios desafíos. Los estudios epidemiológicos sólidos con datos dietéticos y de estilo de vida validados, repetidos y recopilados prospectivamente a lo largo de la vida continua (el «exposoma») son de vital importancia para medir con precisión las exposiciones, sus posibles factores de confusión y la ventana de tiempo y la latencia del cáncer de los factores de riesgo culpables.
Sin embargo, tales estudios son raros en adultos y en gran medida ausentes entre niños o adolescentes, posiblemente debido a la complejidad y el costo de realizar y mantener tales cohortes. Además, lo ideal es que estas cohortes prospectivas incluyan la recolección combinada de muestras biológicas en serie, como sangre, tejido y heces a lo largo del tiempo, para permitir una investigación detallada de los mecanismos subyacentes provocados por las exposiciones ambientales en el tumor, el microambiente tumoral (TME) y microbiota intestinal. Estudiar las interacciones entre el exposoma, el tumor-TME y el huésped será fundamental para descubrir las causas fundamentales del aumento de EOCRC.
Algunos estudios han intentado perfilar el panorama mutacional somático de los EOCRC utilizando paneles de secuenciación de última generación. Dichos análisis encontraron que las mutaciones somáticas en genes que codifican miembros de vías de señalización que se sabe que son impulsores oncogénicos estaban presentes de manera diferencial: la poliposis coli adenomatosa (APC) y BRAF estaban mutadas con menos frecuencia en EOCRC (6, 7), mientras que TP53 y β-catenina (CTNNB1) las mutaciones ocurrieron con más frecuencia en EOCRC (7). Sin embargo, un estudio posterior no encontró diferencias entre las mutaciones somáticas EOCRC y LOCRC cuando se tuvo en cuenta la lateralidad del tumor (8). Dichos estudios destacan algunos de los desafíos y advertencias en la definición del panorama molecular de EOCRC, que incluyen el ajuste de variables clínicas y patológicas de confusión.
Específicamente, la lateralidad del tumor, así como la frecuencia de alta inestabilidad de microsatélites, que difieren entre EOCRC y LOCRC, afectan el panorama mutacional somático. Los tumores del lado izquierdo, en comparación con sus contrapartes del lado derecho, tienen diferentes orígenes embriológicos y están expuestos a factores que varían a lo largo del intestino, los cuales pueden explicar los diferentes perfiles mutacionales observados en varias regiones del colon. Además, aunque los paneles de secuenciación de próxima generación dirigidos son útiles en la práctica clínica para identificar alteraciones procesables en CCR, no pueden caracterizar el espectro completo de alteraciones moleculares en tumores de inicio joven.
Sin embargo, la secuenciación del genoma completo permite la identificación de elementos no codificantes, neoantígenos y firmas mutacionales (distintos patrones de mutaciones) que pueden vincularse con mutágenos macro o microambientales específicos y patogénesis del CCR, como un alto consumo de carne roja procesada antes del diagnóstico (9 ) y Escherichia coli genotóxica que expresan la isla de policétido sintasa (pks) (10). La desconvolución de las firmas mutacionales de un gran número de EOCRC y la integración con los datos epidemiológicos podrían descubrir procesos mutagénicos que contribuyen a la tumorigénesis a lo largo del continuo de edad y fortalecer el apoyo a la causalidad.
Más allá de la genómica, la hipometilación de los elementos transponibles del elemento nuclear 1 intercalado largo (LINE-1) es una característica epigenética que es más común con la disminución de la edad del diagnóstico de CCR (1). Los esfuerzos de secuenciación de RNA de una sola célula (scRNA-seq) en CRC (predominantemente de pacientes mayores) desinvolucionaron 88 subconjuntos de células y 204 programas de expresión génica asociados (11), ofreciendo una visión sin precedentes de los estados celulares anormales de CRC. El perfil transcripcional y epigenético de una sola célula de las lesiones premalignas hereditarias y esporádicas también revela cambios a lo largo del continuo de la tumorigénesis (12). La aplicación de estos enfoques en EOCRC podría resultar valiosa para revelar una fisiopatología contrastante en comparación con LOCRC que puede apuntar a la etiología de EOCRC (ver la figura).
El TME en los EOCRC también merece una investigación, especialmente porque puede ser moldeado fácilmente por factores de riesgo ambientales. La contextura inmunitaria (el tipo, la densidad y la ubicación de las células inmunitarias en el TME colorrectal) tiene importancia pronóstica (13), y los estudios epidemiológicos moleculares han demostrado cómo los factores del estilo de vida pueden afectar el TME de los cánceres incidentes, como la asociación de fumar con riesgo de CCR con infiltrados bajos de células T (14).
Los esfuerzos de scRNA-seq han revelado centros de interacción organizados espacialmente coordinados de células malignas y no malignas en CRC primarios que diferían entre los CRC competentes y deficientes en la reparación de errores de emparejamiento y destacaron el papel de las células inmunitarias y del estroma en la progresión maligna (12). Estos conjuntos de datos se pueden aprovechar para futuras investigaciones mecanicistas y descubrimiento de objetivos farmacológicos. Los enfoques computacionales también se están perfeccionando y desarrollando para describir de manera integral la organización espacial y las interacciones funcionales entre las células individuales en el CRC TME.
Dado el conjunto de pruebas convincentes que respaldan el papel de la microbiota intestinal en la patogénesis y la progresión del CCR, incluidas especies como Fusobacterium nucleatum, Bacteroidetes fragilis y pks+ E. coli, los estudios de EOCRC también deben perfilar los microbiomas tumorales y fecales de los pacientes con EOCRC. Por ejemplo, se han informado diferencias en la composición, diversidad y función microbiana fecal en EOCRC en comparación con LOCRC y controles sanos de la misma edad en China (15).
Estos hallazgos deben confirmarse en poblaciones más grandes y diversas, pero revelan el potencial del microbioma en la detección temprana y la evaluación pronóstica del EOCRC. Además, los modelos experimentales de EOCRC, como cultivos de organoides derivados de pacientes y modelos animales, deberán incorporar elementos de CRC TME, como la microbiota. Sin embargo, la estandarización de protocolos que minimicen la variabilidad y la incorporación sistemática de muestras de microbioma en diseños de ensayos y cohortes prospectivas plantea desafíos logísticos sustanciales.
El camino a seguir para combatir el surgimiento de EOCRC no es ni corto ni sencillo. Las recomendaciones recientes de la Sociedad Estadounidense del Cáncer y el Grupo de trabajo de servicios preventivos de EE. UU. de comenzar la detección del CCR para la población promedio a los 45 años (frente a la edad recomendada anteriormente de 50) son un primer paso para reconocer esta epidemia. Sin embargo, la urgencia de transitar este camino, que va más allá de las perspectivas unidimensionales y considera la naturaleza multifactorial de la EOCRC, es primordial, en particular para los pacientes más jóvenes que no cumplen la edad recomendada para el cribado.
¿Qué pasos se pueden tomar para trazar este camino? El surgimiento de centros especializados de excelencia que se centren en pacientes con EOCRC establecerá un modelo de atención clínica integral para esta población, además de permitir la investigación multidisciplinaria. Se necesitan estudios de cohortes prospectivos de individuos sanos y pacientes con EOCRC. Estos deben ir acompañados de mediciones en serie del exposoma junto con colecciones de muestras biológicas. Además, el ritmo del progreso debe acelerarse mediante la formación de colaboraciones globales para facilitar la acumulación de pacientes y muestras biológicas, y mediante la implementación de modelos innovadores de reclutamiento de pacientes, como Count Me In Colorrectal Cancer Project (https://joincountmein.org/colorrectal), que se asocia directamente con pacientes en los EE. UU. y Canadá y pone todos los datos a disposición para la investigación.
Es necesario esforzarse para garantizar que se incluyan diversas poblaciones en los estudios de EOCRC, en particular las minorías subrepresentadas que soportan una carga desproporcionada de EOCRC, como lo demuestra la mayor mortalidad de los pacientes negros no hispanos de EOCRC en comparación con los pacientes blancos no hispanos (1). También se debe considerar la implementación de la detección en grupos de edad más jóvenes, así como la detección más temprana utilizando biomarcadores en sangre. Aunque cada uno de estos pasos requiere compromiso y perseverancia, es el creciente número de pacientes jóvenes que luchan valientemente contra esta enfermedad lo que será la brújula que nos mantendrá en el camino hacia una mejor comprensión, prevención y tratamiento del EOCRC.
Mensaje en breve: toda persona con familiares de primer grado que han tenido Cáncer de cólon/recto a los 30 a 50 años de edad, debe empezar a hacerse colonoscopia desde los 30-35 años de edad en adelante !!!
Referencias Bibliográficas
- N. Akimoto et al., Nat. Rev. Clin. Oncol. 18, 230 (2021).
- M. Lipsyc-Sharf et al., J. Natl. Cancer Inst. 114, 427 (2022).
- P. H. Liu et al., JAMA Oncol. 5, 37 (2019).
- H. Chen et al., Gut 70, 1147 (2021).
- L. H. Nguyen et al., JNCI Cancer Spectr. 2, pky073 (2018).
- A. N. Willauer et al., Cancer 125, 2002 (2019).
- C. H. Lieu et al., Clin. Cancer Res. 25, 5852 (2019).
- A. Cercek et al., J. Natl. Cancer Inst. 113, 1683 (2021).
- C. Gurjao et al., Cancer Discov. 11, 2446 (2021).
- C. Pleguezuelos-Manzano et al., Nature 580, 269 (2020).
- K. Pelka et al., Cell 184, 4734 (2021).
- W. R. Becker et al., Nat. Genet. 54, 985 (2022).
- J. Galon et al., Science 313, 1960 (2006).
- T. Hamada et al., J. Natl. Cancer Inst. 111, 42 (2019).
- Y. Yang et al., Nat. Commun. 12, 6757 (2021).
Cáncer colorrectal en personas más jóvenes
Factores similares aumentan el riesgo de cáncer colorrectal de inicio temprano (EOCRC) y cáncer colorrectal de inicio tardío (LOCRC), como un estilo de vida sedentario, obesidad y síndrome metabólico, pero también existen diferencias importantes. EOCRC ocurre predominantemente en el lado izquierdo del colon y el recto, mientras que LOCRC surge más comúnmente en el lado derecho del colon. El EOCRC también está menos diferenciado y, a menudo, es metastásico en el momento del diagnóstico. Se necesita investigación con urgencia para comprender la incidencia creciente de EOCRC y su fisiopatología para detectar y tratar mejor a los pacientes.
Ronald Palacios Castrillo, M.D.,PhD.