Resumen ChatGPT
MHV370 es un inhibidor oral selectivo de los receptores tipo Toll (TLR) 7 y 8, y se ha estudiado su efecto en enfermedades autoinmunes. La evidencia genética e in vivo ha sugerido que el reconocimiento aberrante de autoantígenos que contienen RNA por parte de TLR7 y TLR8 puede desencadenar enfermedades autoinmunes.
=> Recibir por Whatsapp las noticias destacadas
En estudios preclínicos, se ha observado que MHV370 inhibe la producción de citocinas dependiente de TLR7/8 en células humanas y de ratón, especialmente el interferón-α, el cual se ha validado clínicamente como un impulsor de enfermedades autoinmunes. Además, MHV370 bloquea las respuestas de células B, células dendríticas plasmocitoides, monocitos y neutrófilos aguas abajo de TLR7/8.
En experimentos in vivo, la administración profiláctica o terapéutica de MHV370 bloquea la secreción de respuestas mediadas por TLR7, incluyendo la secreción de citoquinas, la activación de células B y la expresión génica de genes estimulados por interferón. En un modelo de ratón NZB/W F1 de lupus, se ha observado que MHV370 detiene la progresión de la enfermedad.
A diferencia de la hidroxicloroquina, MHV370 muestra una potente capacidad para bloquear las respuestas de interferón desencadenadas por complejos inmunitarios específicos presentes en el suero de pacientes con lupus eritematoso sistémico. Esto sugiere que MHV370 puede diferenciarse como un tratamiento en comparación con el estándar de atención clínica.
Estos datos respaldan el avance de MHV370 a un ensayo clínico de fase 2 que se encuentra actualmente en curso.
Los datos respaldan el avance de MHV370 a ensayos clínicos de fase 2
Mi punto de vista
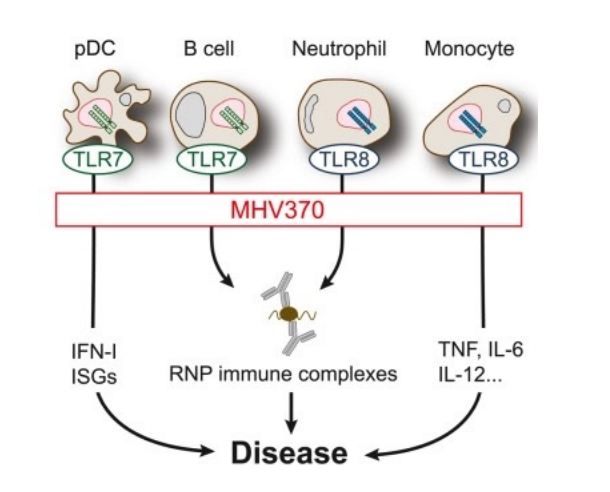
Los receptores tipo Toll TLR7 y TLR8 son receptores endosómicos para RNA monocatenario rico en GU (RNAss). En humanos, TLR7 se expresa en células B y células dendríticas plasmocitoides (pDC) productoras de interferón tipo I (IFN), y TLR8 se expresa predominantemente en monocitos, macrófagos y neutrófilos.
Las células que expresan TLR7 y TLR8 están involucradas en múltiples enfermedades autoinmunes. El vínculo genético de TLR7 con el lupus eritematoso sistémico (LES) es particularmente fuerte. Por ejemplo, el número elevado de copias de TLR7 es un factor de riesgo para el LES juvenil, y el fuerte sesgo femenino del LES se ha explicado por la expresión bialélica de TLR7 ligado al cromosoma X en las células inmunitarias de las mujeres. Además, TLR7 se sobreexpresa en células mononucleares de sangre periférica (PBMC) de pacientes que padecen LES. A nivel funcional, recientemente se encontró una ganancia de función de TLR7 en un paciente pediátrico con lupus y fue suficiente para causar una enfermedad similar al lupus cuando se introdujo en ratones. Además, los ratones deficientes en TLR7 están protegidos en múltiples modelos murinos de lupus, y la sobreexpresión de TLR7 o TLR8 humano en ratones conduce a una autoinmunidad espontánea.
Los autoanticuerpos de pacientes con LES dirigidos contra las ribonucleoproteínas (RNP) activan las pDC para producción de IFN-α de forma dependiente de TLR7. En base a estos datos, la inhibición de TLR7/8 se ha propuesto como un enfoque terapéutico para el LES y otras enfermedades autoinmunes.
Este estudio de Hastie,et.al.,(ver texto abajo) presenta MHV370, un antagonista LMW biodisponible por vía oral potente y selectivo de TLR7 y TLR8. Inhibe la secreción dependiente de TLR7/8 de múltiples citocinas de monocitos y pDC, así como la activación de células B y neutrófilos. MHV370 muestra una eficacia dependiente de la dosis en modelos de ratones agudos y crónicos. Bloquea la activación inmunitaria después de una inyección única o repetida de agonistas de TLR7/8 y la inducción de ISG después de la inyección de TMPD. En el modelo espontáneo de lupus en ratones NZB/W F1, la dosificación profiláctica o terapéutica de MHV370 interfirió con múltiples parámetros de la enfermedad. Estos resultados posicionan a MHV370 como una posible opción de tratamiento futuro para pacientes con LES.
Las enfermedades autoinmunes son condiciones crónicas que contribuyen a una morbilidad y mortalidad significativas en los pacientes afectados. Podría decirse que una de las enfermedades autoinmunes más complejas es el LES, con síntomas muy diversos y progresión heterogénea de la enfermedad. Esto ha llevado a solo dos aprobaciones por parte de la FDA para nuevos tratamientos para el LES en esta enfermedad durante los últimos 60 años. Las células que expresan TLR7 y TLR8 están involucradas en múltiples enfermedades autoinmunes. El vínculo genético de TLR7 con el lupus eritematoso sistémico (LES) es particularmente fuerte. Por ejemplo, el número elevado de copias de TLR7 es un factor de riesgo para el LES juvenil, y el fuerte sesgo femenino del LES se ha explicado por la expresión bialélica de TLR7 ligado al cromosoma X en las células inmunitarias de las mujeres. Además, TLR7 se sobreexpresa en células mononucleares de sangre periférica (PBMC) de pacientes que padecen LES. A nivel funcional, recientemente se encontró una ganancia de función de TLR7 en un paciente pediátrico con lupus y fue suficiente para causar una enfermedad similar al lupus cuando se introdujo en ratones. Además, los ratones deficientes en TLR7 están protegidos en múltiples modelos murinos de lupus, y la sobreexpresión de TLR7 o TLR8 humano en ratones conduce a una autoinmunidad espontánea.
Los autoanticuerpos de pacientes con LES dirigidos contra las ribonucleoproteínas (RNP) activan las pDC para producción de IFN-α de forma dependiente de TLR7.
En base a estos datos, la inhibición de TLR7/8 se ha propuesto como un enfoque terapéutico para el LES y otras enfermedades autoinmunes. medicamentos de anticuerpos belimumab, que interfiere con la expansión de las células B, y anifrolumab, que interfiere con la señalización de IFN tipo I. En el ensayo fundamental BLISS, belimumab condujo a una pequeña tasa de respuesta SRI (índice de respuesta al LES) del 7 % y del 14 % por encima del placebo a 1 mg/kg y 10 mg/kg, respectivamente, y anifrolumab no logró alcanzar su punto final predefinido en uno de los dos estudios de fase 3.
El presente estudio da razones para creer que MHV370 combina actividad inhibidora en las vías a las que se dirigen anifrolumab y belimumab, es decir, el eje IFN tipo I y la activación de células B, pero a diferencia de estos otros dos tratamientos, no agota ni paraliza brazos completos del sistema inmunitario.
En conjunto, el estudio de Hastie,et.al., brinda un amplio respaldo al concepto de que el antagonismo de TLR7/8 es un tratamiento potencialmente transformador para los pacientes con LES. Los ensayos clínicos en curso investigarán cómo MHV370 proporciona un beneficio tangible para el paciente.
TEXTO Editado. artículo Hastie,et.al., Cell Reports Medicine .DOI:https://doi.org/10.1016/j.xcrm.2023.101036.
Los receptores tipo Toll TLR7 y TLR8 son receptores endosómicos para RNA monocatenario rico en GU (RNAss). En humanos, TLR7 se expresa en células B y células dendríticas plasmocitoides (pDC) productoras de interferón tipo I (IFN), y TLR8 se expresa predominantemente en monocitos, macrófagos y neutrófilos. La activación de TLR7/8 conduce a la señalización de MyD88/IRAK/TRAF6 y la activación posterior de monocitos/células B principalmente a través del factor nuclear (NF)-κB, o de pDC a través de IRF7.
Las células que expresan TLR7 y TLR8 están involucradas en múltiples enfermedades autoinmunes. El vínculo genético de TLR7 con el lupus eritematoso sistémico (LES) es particularmente fuerte. Por ejemplo, el número elevado de copias de TLR7 es un factor de riesgo para el LES juvenil, y el fuerte sesgo femenino del LES se ha explicado por la expresión bialélica de TLR7 ligado al cromosoma X en las células inmunitarias de las mujeres. Además, TLR7 se sobreexpresa en células mononucleares de sangre periférica (PBMC) de pacientes que padecen LES. A nivel funcional, recientemente se encontró una ganancia de función de TLR7 en un paciente pediátrico con lupus y fue suficiente para causar una enfermedad similar al lupus cuando se introdujo en ratones. Además, los ratones deficientes en TLR7 están protegidos en múltiples modelos murinos de lupus, y la sobreexpresión de TLR7 o TLR8 humano en ratones conduce a una autoinmunidad espontánea.
Los autoanticuerpos de pacientes con LES dirigidos contra las ribonucleoproteínas (RNP) activan las pDC para producción de IFN-α de forma dependiente de TLR7.
En base a estos datos, la inhibición de TLR7/8 se ha propuesto como un enfoque terapéutico para el LES y otras enfermedades autoinmunes. En apoyo adicional de esta hipótesis, los inhibidores de oligonucleótidos de TLR7 y los inhibidores de bajo peso molecular (LMW) de TLR7/8 mostraron eficacia en modelos de lupus en ratones. Sin embargo, los datos de ensayos clínicos de antagonistas de TLR7/8 en pacientes que padecen enfermedades autoinmunes aún no están disponibles. Un estudio clínico tuvo como objetivo el bloqueo de TLR7/8/9 con un oligonucleótido inyectable en pacientes con psoriasis, pero no mostró un perfil de riesgo-beneficio aceptable. Lo más probable es que esto se deba al desafío de establecer una relación farmacocinética/farmacodinámica (PK/PD) sólida con esta modalidad, baja tolerabilidad y posiblemente un potencial promotor de la enfermedad de la inhibición de TLR9. Por lo tanto, elegimos desarrollar un antagonista de LMW selectivo contra TLR7 y TLR8 para garantizar un excelente perfil de tolerabilidad y una sólida relación PK/PD.
El antagonista oral de TLR7/8 MHV370 se identificó a través de la detección celular fenotípica y una mayor optimización basada en la estructura. Aquí mostramos que MHV370 bloqueó la producción de IFN-α y otras citocinas proinflamatorias in vitro e in vivo. MHV370 fue protector en modelos de ratones crónicos, ya que interfirió con la expresión de citoquinas y genes estimulados por interferón (ISG) después de la exposición repetida con el agonista de TLR7 R848 o después de la inyección de tetrametilpentadecano (TMPD). También previno y detuvo el desarrollo de una enfermedad similar al lupus en el modelo NZB/W F1. Además, MHV370 bloqueó la secreción de citocinas proinflamatorias desencadenadas por complejos inmunitarios derivados de sueros de pacientes con LES que expresan predominantemente autoanticuerpos contra RNP. Esto abre la posibilidad de que MHV370 se convierta en un enfoque seguro y eficaz para tratar enfermedades autoinmunes sistémicas, y actualmente se está realizando un estudio clínico de fase 2.
Este estudio presenta MHV370, un antagonista LMW biodisponible por vía oral potente y selectivo de TLR7 y TLR8. Inhibe la secreción dependiente de TLR7/8 de múltiples citocinas de monocitos y pDC, así como la activación de células B y neutrófilos. MHV370 muestra una eficacia dependiente de la dosis en modelos de ratones agudos y crónicos. Bloquea la activación inmunitaria después de una inyección única o repetida de agonistas de TLR7/8 y la inducción de ISG después de la inyección de TMPD. En el modelo espontáneo de lupus en ratones NZB/W F1, la dosificación profiláctica o terapéutica de MHV370 interfirió con múltiples parámetros de la enfermedad. Estos resultados posicionan a MHV370 como una posible opción de tratamiento futuro para pacientes con LES.
Las enfermedades autoinmunes son condiciones crónicas que contribuyen a una morbilidad y mortalidad significativas en los pacientes afectados. Podría decirse que una de las enfermedades autoinmunes más complejas es el LES, con síntomas muy diversos y progresión heterogénea de la enfermedad. Esto ha llevado a solo dos aprobaciones por parte de la FDA para nuevos tratamientos para el LES en esta enfermedad durante los últimos 60 años. Las células que expresan TLR7 y TLR8 están involucradas en múltiples enfermedades autoinmunes.
El vínculo genético de TLR7 con el lupus eritematoso sistémico (LES) es particularmente fuerte. Por ejemplo, el número elevado de copias de TLR7 es un factor de riesgo para el LES juvenil, y el fuerte sesgo femenino del LES se ha explicado por la expresión bialélica de TLR7 ligado al cromosoma X en las células inmunitarias de las mujeres. Además, TLR7 se sobreexpresa en células mononucleares de sangre periférica (PBMC) de pacientes que padecen LES. A nivel funcional, recientemente se encontró una ganancia de función de TLR7 en un paciente pediátrico con lupus y fue suficiente para causar una enfermedad similar al lupus cuando se introdujo en ratones. Además, los ratones deficientes en TLR7 están protegidos en múltiples modelos murinos de lupus, y la sobreexpresión de TLR7 o TLR8 humano en ratones conduce a una autoinmunidad espontánea.
Los autoanticuerpos de pacientes con LES dirigidos contra las ribonucleoproteínas (RNP) activan las pDC para producción de IFN-α de forma dependiente de TLR7.
En base a estos datos, la inhibición de TLR7/8 se ha propuesto como un enfoque terapéutico para el LES y otras enfermedades autoinmunes. medicamentos de anticuerpos belimumab, que interfiere con la expansión de las células B, y anifrolumab, que interfiere con la señalización de IFN tipo I. En el ensayo fundamental BLISS, belimumab condujo a una pequeña tasa de respuesta SRI (índice de respuesta al LES) del 7 % y del 14 % por encima del placebo a 1 mg/kg y 10 mg/kg, respectivamente, y anifrolumab no logró alcanzar su punto final predefinido en uno de los dos estudios de fase 3.
El presente estudio da razones para creer que MHV370 combina actividad inhibidora en las vías a las que se dirigen anifrolumab y belimumab, es decir, el eje IFN tipo I y la activación de células B, pero a diferencia de estos otros dos tratamientos, no agota ni paraliza brazos completos del sistema inmunitario. Como tal, MHV370 puede tener un perfil de seguridad ventajoso. Por ejemplo, las infecciones por el virus del herpes aumentaron en pacientes tratados con anifrolumab.
La inmunidad protectora contra los virus del herpes parece depender en gran medida de la función de TLR3 y MHV370 no bloquea TLR3. Por lo tanto, el perfil preclínico del antagonista de TLR7/8 MHV370 sugiere fuertemente que puede mostrar una eficacia transformadora y una seguridad superior en pacientes con LES e indicaciones relacionadas. De hecho, está en marcha un ensayo clínico de fase 2 para evaluar la seguridad, la tolerabilidad y la eficacia en el síndrome de Sjögren y la enfermedad mixta del tejido conjuntivo (ClinicalTrials.gov: NCT04988087), sin que se esté estudiando ningún otro antagonista de TLR7/8 en estas indicaciones.
MHV370 tiene ventajas sobre los antagonistas basados en oligonucleótidos, como el antagonista de TLR7/8/9 IMO-8400, que ha progresado hasta convertirse en un pequeño estudio de fase 2 de psoriasis. Por ejemplo, es un desafío cuantificar los fármacos oligonucleótidos en la sangre para establecer una relación PK/PD sólida, y los oligonucleótidos no se pueden dosificar por vía oral. Más recientemente, se publicaron datos preclínicos y primeros en humanos sobre un antagonista de TLR7/8 de bajo peso molecular, M5049. M5049 mostró eficacia en un modelo NZB/W F1 acelerado con IFN-α, que expresó niveles muy altos de ISG.
Sin embargo, dado que la expresión de ISG es variable en pacientes que padecen LES y otras enfermedades autoinmunes, era importante asegurarse de que MHV370 funcionaba en el modelo clásico y espontáneo NZB/W F1 para recopilar evidencia de que MHV370 puede incluso mostrar eficacia en pacientes con menor expresión de ISG. . Además, no se ha informado la eficacia de M5049 en los tejidos diana, mientras que MHV370 influye en múltiples parámetros de la enfermedad relacionada con el lupus en los riñones. Los datos preclínicos sobre la eficacia terapéutica de M5049 tampoco están disponibles, mientras que mostramos que el uso terapéutico de MHV370 durante solo 7 días en una situación de activación crónica de TLR7 normalizó múltiples vías proinflamatorias dependientes de TLR7 en ratones.
Es digno de mención que MHV370 mejoró la enfermedad renal en el modelo NZB/W F1 y redujo los autoanticuerpos contra la subunidad RNP Smith (Sm) más profundamente, mientras que no tuvo efecto sobre los autoanticuerpos anti-dsDNA. Este resultado es consistente con los datos del modelo MRL/lpr, donde la deficiencia de TLR7 mejoró la enfermedad renal y condujo a una reducción significativa de autoanticuerpos anti-Sm y anti-RNP pero no anti-dsDNA. Juntos, estos datos sugieren que TLR7 puede ser un impulsor específico de autoanticuerpos contra RNP, posiblemente de manera intrínseca a las células B. Será informativo estudiar cómo MHV370 afectará a los subtipos de autoanticuerpos en los pacientes tratados. Dado que los autoanticuerpos contra Sm están asociados con la gravedad de la enfermedad y con características patogénicas específicas, es concebible que un subconjunto de síntomas específicos del lupus impulsados por TLR7/8 mejoren más profundamente con MHV370.
Al vincular las investigaciones de modelos celulares y de ratones, nuestro estudio sobre MHV370 sugiere que la interferencia con múltiples tipos de células proinflamatorias puede resultar eficaz en enfermedades autoinmunes complejas. Nuestro resultado también sugiere cómo se puede comportar MHV370 en combinación con los tratamientos estándar para el LES. Dado que la activación de TLR7 hace que las CDp sean insensibles a los esteroides, un antagonista de TLR7/8 como MHV370 puede convertirse en un tratamiento ahorrador de esteroides. Además, nuestros datos que utilizan inmunocomplejos de sueros de pacientes con LES sugieren que MHV370 puede mostrar eficacia incluso en presencia de concentraciones clínicamente relevantes de HCQ. Esto hace que MHV370 sea atractivo para tratamientos combinados, lo que implica que MHV370 podría cambiar el paradigma actual de tratamiento farmacológico en LES.
En conjunto, nuestro estudio brinda un amplio respaldo al concepto de que el antagonismo de TLR7/8 es un tratamiento potencialmente transformador para los pacientes con LES. Los ensayos clínicos en curso investigarán cómo MHV370 proporciona un beneficio tangible para el paciente.
Limitaciones del estudio
Una limitación obvia de nuestro estudio es el hecho de que la inhibición de TLR8 no se puede estudiar en modelos de ratón de manera directa. Dependiendo del modelo de ratón, el TLR8 murino puede contribuir a una enfermedad similar al lupus o restringir la patología dependiente de TLR7. Además, el TLR8 de roedores no reconoce el mismo ligando ssRNA que el TLR8 humano.
Por lo tanto, nuestras conclusiones sobre TLR8 se basan en ensayos humanos in vitro. Nuestros datos muestran que MHV370 interfiere con la activación de las células mieloides de humanos (monocitos, neutrófilos), que expresan predominantemente TLR8. Dado que los granulocitos de baja densidad suelen estar involucrados en el LES y muchos pacientes con LES tienen una firma de granulopoiesis, es probable que el antagonismo dual de TLR7/8 muestre una eficacia superior sobre los antagonistas únicos de TLR7 o TLR8. El papel patogénico de TLR8 en humanos se sugiere además por la enfermedad inflamatoria crónica en pacientes con ganancia de función de TLR8 y por la asociación de una firma de TLR8 con el subtipo alto de ISG de pacientes con lupus.
Otra limitación de este estudio es que estudiamos MHV370 solo en modelos preclínicos de LES. Sin embargo, se ha descrito la implicación de TLR7 y TLR8 en otras enfermedades reumáticas autoinmunes sistémicas. Esto indica el amplio alcance de las indicaciones diana para MHV370, y se están realizando estudios traslacionales con MHV370 para respaldar dichas indicaciones.
Finalmente, nuestro estudio tuvo como objetivo una caracterización farmacológica detallada del antagonista de TLR7/8 MHV370 in vitro e in vivo. Para lograr esto, confiamos en sistemas experimentales robustos y bien establecidos. Esperamos que esto siente las bases para una comprensión más mecánica de la biología de TLR7 y TLR8 en el futuro.
Ronald Palacios Castrillo, M.D.,PhD.