El trasplante de órganos heterólogos es una forma eficaz de reemplazar la función de los órganos, pero está limitado por una grave escasez de órganos. Aunque generar órganos humanos en otros grandes mamíferos mediante la complementación de embriones sería una solución innovadora, enfrenta muchos desafíos, especialmente la pobre integración de las células humanas en los tejidos receptores. Para producir células humanas con una competitividad superior dentro del nicho,Wang y colaboradores (CEll Stem Cell. https://doi.org/10.1016/j.stem.2023.08.003) combinaron condiciones optimizadas de cultivo de células madre pluripotentes con la sobreexpresión inducible de dos genes que favorecen la supervivencia (MYCN y BCL2). Las células resultantes habían mejorado sustancialmente la viabilidad en el ambiente del cerdo de blastocistos quiméricos entre especies y formaron con éxito estructuras quiméricas organizadas de riñón en etapa media (mesonefros) de humano-cerdo hasta el día embrionario 28 dentro de embriones de cerdo con defectos renales que carecen de SIX1 y SALL1. Los hallazgos demuestran una prueba de principio de la posibilidad de generar un órgano primordial humanizado en cerdos con discapacidad organogénica, abriendo una vía apasionante para la medicina regenerativa y una ventana artificial para estudiar el desarrollo del riñón humano.
La escasez de donantes inmunohistocompatibles para trasplantes de órganos es un problema universal sin solución directa. Una alternativa prometedora es generar quimeras interespecies viables que involucren a grandes mamíferos con tejidos humanos mediante la complementación de embriones con células madre pluripotentes (PSC), que podrían ocupar un nicho particular en el huésped inhabilitado por la organogénesis creado mediante la edición de genes. La organogénesis entre especies se ha logrado con éxito entre ratones y ratas para órganos como el páncreas, el timo y el riñón. Los cerdos son un objetivo muy atractivo para el crecimiento de órganos humanos dadas sus similitudes con los humanos en fisiología y tamaño de órganos, así como en desarrollo embrionario. Sin embargo, obtener un alto grado de quimerismo con especies de mamíferos más allá de los roedores ha sido un desafío. Aunque se han generado endotelio humano y parches de tejido muscular esquelético dentro de embriones de cerdo nulos ETV2 o MYF5/MYOD/MYF6, hasta la fecha no se han producido órganos sólidos debido a la escasa contribución general de las células derivadas de PSC humanas a los tejidos porcinos.
Hay dos razones principales para el bajo quimerismo entre especies: (1) la competencia con las células del donante en el blastocisto y más tarde en el nicho tisular; y (2) diferencias en el estado de desarrollo entre las células derivadas de PSC humanas del donante y las células huésped, lo que impide la progresión sincronizada del desarrollo. La activación de vías de supervivencia en las PSC inyectadas se puede utilizar para estimular el quimerismo al antagonizar la apoptosis(muerte celular programada) inducida por la competencia celular. En este sentido,Wang y colaboradores (CEll Stem Cell. https://doi.org/10.1016/j.stem.2023.08.003) describen que la combinación de MYCN y BCL2 (N/B) mejora en gran medida el nivel intra-nicho, competitividad en embriones de ratón, conejo y cerdo, en comparación con la sobre-expresión de un solo factor. Además, recientemente los autores desarrollaron un nuevo medio de cultivo que permite hacer retroceder gradualmente las PSC humanas a etapas de desarrollo anteriores, sin problemas perceptibles de estabilidad del genoma en el proceso de conversión. Este medio (4CL) permitió hasta un 1% de quimerismo humano-ratón en el día embrionario 10.5 (E10.5), lo que es comparable a la eficiencia de integración de las PSC preparadas que sobreexpresan factores anti-apoptóticos.
El riñón humano es uno de los órganos sólidos más trasplantados en todo el mundo y también uno de los que aparecen más tempranamente durante la embriogénesis. Se somete a una especificación secuencial de pronefros, mesonefros y metanefros. La formación y regresión del pronefros y luego del mesonefros están bien orquestadas y van seguidas de la invasión del mesénquima metanéfrico por la yema ureteral, que inicia la formación de metanefros. Los estudios de desarrollo renal en diferentes mamíferos han demostrado que el gen SIX1 regula la formación de túbulos mesonéfricos (mesonephroi) y la ramificación de yemas ureterales para la metanefrogénesis, mientras que el gene SALL1 mantiene los progenitores de nefronas y las nefronas nacientes en el mesénquima metanéfrico. Por lo tanto, Wang y colegas postularon que al crear cerdos que carecen de los genes SIX1/SALL1-(cerdos nulos) mediante ingeniería genética y edición de los genes ;los embriones de cerdo nulos producirían un nicho nefrítico defectuoso desde el mesonefros temprano hasta el metanefros tardío, y esto podría permitir que las PSC humanas completen todo el programa de desarrollo renal. También postularon que una combinación de sobreexpresión de N/B y condiciones de cultivo de PSC optimizadas podría permitir un grado superior de quimerismo después de la complementación embrionaria y así ayudar a producir un primordio de riñón humano en estos cerdos con organogénesis discapacitada. Para optimizar aún más la alta eficiencia de las xenoquimeras, también abordaron otros posibles cuellos de botella, como el procedimiento de complementación de blastocistos.
=> Recibir por Whatsapp las noticias destacadas
Wang y colaboradores han demostrado la generación de mesonefroi(riñón) humanizados en cerdos sin riñones mediante complementación de embriones con iPSC. Su estudio demuestra la generación de un primordio de órgano sólido dentro de animales grandes mediante complementación embrionaria entre especies. El éxito de este enfoque se basó en la combinación de un cóctel de factores exógenos que facilita la competencia celular, un medio PSC humano optimizado y el uso de cerdos con organogénesis desactivada para suprimir aún más la competencia celular. Aunque la gestación terminó bastante pronto, antes de que aparecieran efectivamente los metanefros, los resultados indican que podría ser posible generar un riñón humano funcional dentro de cerdos recién nacidos, ofreciendo una alternativa atractiva para superar la escasez de órganos humanos para trasplantes. En este sentido, el xenotrasplante de órganos de grandes mamíferos como los cerdos, modificados genéticamente para reducir la antigenicidad, a humanos ha mostrado un éxito notable a corto plazo. Sin embargo, mejorar aún más la supervivencia de los órganos porcinos trasplantados no es sencillo porque el rechazo inmunológico aún no han sido abolidos a pesar de extensas modificaciones genéticas. Además, las diferencias sustanciales entre especies en fisiología aún pueden causar disfunción.
Todavía es necesario resolver una serie de obstáculos. En primer lugar, la proporción general de embriones de cerdo en degeneración es alta, y será necesario evaluar si esto está relacionado en parte con el quimerismo o con cualquier otro aspecto del procedimiento de injección. Además, debido a que la baja eficiencia de la clonación de cerdos mediante SCNT sigue siendo un gran desafío hasta la fecha, el uso de embriones fertilizados in vitro puede mejorar el potencial de desarrollo de los embriones injectados. En segundo lugar, la contribución a otros linajes, incluidos el cerebro y las células germinales, plantea serias preocupaciones éticas si los cerdos llegaran a término. Para superar esto, los genes responsables del desarrollo de estos linajes podrían eliminarse en las PSC humanas donantes. Esto ayudaría a abordar cuestiones éticas, pero es posible que también afecte la contribución al riñón. En tercer lugar, es importante considerar que los órganos están compuestos por múltiples tipos de células, incluidas células vasculares, que son esenciales para el funcionamiento normal y podrían provocar rechazo si alguna fuera de origen porcino. La supresión simultánea del desarrollo de diferentes tejidos (p. ej., riñón y endotelio) en cerdos podría resolver este problema. El trabajo de Wang y colaboradores ciertamente estimulará el debate sobre las medidas para superar estos desafíos, allanando el camino para enfoques refinados y adecuados para la práctica clínica.
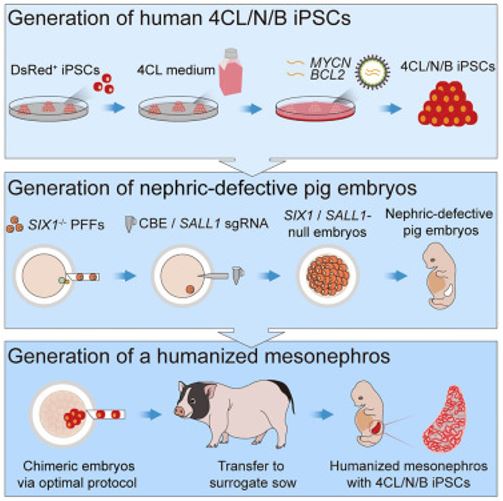
Figura. Complementación de embriones de cerdo sin riñones con iPSC 4CL/N/B humanas
(A) Representación esquemática del diseño experimental. PFF, fibroblastos fetales de cerdo; CBE, editor de bases de citosina; sgRNA, ARN de guía única.
(B) Imágenes de tinción con hematoxilina y eosina (H&E) de mesonefros en embriones nulos WT y SIX1/SALL1 en E35. Los embriones nulos de SIX1/SALL1 mostraron túbulos mesonéfricos reducidos y metanefros defectuosos. La línea de puntos amarilla en el embrión WT delinea los metanefros. Barras de escala, 200 μm.
(C) Resumen de los experimentos de complementación embrionaria.
(D) Imágenes representativas de campo brillante (izquierda) y fluorescencia estéreo (derecha) de quimeras humano-cerdo WT E28 (arriba), E25 (centro) y E28 (abajo) obtenidas inyectando iPSC 4CL/N/B humanas en SIX1 /SALL1-embriones nulos. DsRed, derivados de iPSC 4CL/N/B marcados con DsRed. Barras de escala, 2 mm.
(E) Imágenes representativas de inmunofluorescencia DsRed de secciones parasagital de quimeras WT E28, E25 y E28 que muestran la contribución quimérica a los mesonefros. DAPI (4′,6-diamidino-2-fenilindol), núcleos. DsRed, derivados 4CL/N/B iPSC. Barras de escala, 2 mm.
(F) Imágenes representativas de inmunofluorescencia de gran aumento de mesonefros quiméricos WT E28, E25 y E28. DAPI, núcleos. DsRed, derivados 4CL/N/B iPSC. Barras de escala, 100 μm.
(G) Cuantificación de túbulos mesonéfricos DsRed+. Cada punto representa el porcentaje de túbulos mesonéfricos DsRed+ en cada sección de embriones quiméricos E25 y E28. Los datos se presentan como media ± desviación estándar (DE).
(H) Imágenes representativas de H&E de mesonefros quiméricos WT E28, SIX1/SALL1-null E28, E25 y E28 indican un desarrollo normal de túbulos mesonéfricos en quimeras E28 como en embriones WT E28. Barras de escala, 200 μm.
(I) Cuantificación de túbulos mesonéfricos en embriones quiméricos WT E28, SIX1/SALL1-null E28 y E28. Cada punto representa el número de túbulos mesonéfricos en cada imagen en un área de 1 mm2 de mesonefros. Los datos se presentan como media ± DE y el valor de p se determinó mediante la prueba t de Student de dos colas.
