Ronald Palacios Castrillo, M.D.,PhD.
No existen biomarcadores de diagnóstico aprobados para la esteatohepatitis no alcohólica (NASH) en riesgo, definida por la presencia de NASH, alta actividad histológica y estadio de fibrosis ≥2, que se asocia con una mayor incidencia de eventos relacionados con el hígado y mortalidad. FNIH-NIMBLE es un proyecto de múltiples partes interesadas para apoyar la aprobación regulatoria de biomarcadores relacionados con NASH.
Se evaluó el rendimiento diagnóstico de cinco paneles sanguíneos en una cohorte observacional (NASH CRN DB2) (n = 1073) con espectro completo de enfermedad del hígado graso no alcohólico (NAFLD).
Los paneles estaban destinados a diagnosticar NASH en riesgo (NIS4), presencia de NASH (OWLiver) o estadios de fibrosis >2, >3 o 4 (prueba de fibrosis hepática mejorada (ELF), PROC3 y FibroMeter VCTE).
=> Recibir por Whatsapp las noticias destacadas
La métrica de rendimiento preespecificada fue un área bajo la curva característica operativa del receptor (AUROC) ≥0,7 y superioridad sobre la alanina aminotransferasa para la actividad de la enfermedad y la prueba FIB-4 para la gravedad de la fibrosis. múltiples biomarcadores cumplieron con estas métricas. NIS4 tuvo un AUROC de 0,81 (intervalo de confianza del 95%: 0,78–0,84) para NASH en riesgo. Los AUROC de la prueba ELF, PROC3 y FibroMeterVCTE para fibrosis clínicamente significativa (≥estadio 2), fibrosis avanzada (≥estadio 3) o cirrosis (estadio 4), respectivamente, fueron todos ≥0,8. ELF y FibroMeter VCTE superaron a FIB-4 en todos los criterios de valoración de fibrosis. Estos datos representan un hito hacia la calificación de varios paneles de biomarcadores para NASH en riesgo y también para la gravedad de la fibrosis en personas con NAFLD.
La enfermedad del hígado graso no alcohólico (NAFLD) es una de las principales causas de morbilidad y mortalidad relacionadas con el hígado.
La presencia de esteatohepatitis no alcohólica (NASH), una forma activa de NAFLD, y fibrosis hepática en etapa 2 o superior, está relacionada con una mayor incidencia de resultados clínicos adversos relacionados con el hígado y muerte, y también se la conoce como «en riesgo» NASH. La identificación de personas con NASH en riesgo para el tratamiento es una piedra angular de la atención clínica y la inclusión en ensayos terapéuticos.
La evaluación histológica de secciones de biopsia hepática es el estándar de referencia para el diagnóstico de EHNA, así como para la cuantificación de la actividad de la enfermedad y el estadio de fibrosis, pero requiere una biopsia hepática invasiva con sus riesgos y limitaciones asociados, lo que dificulta su uso generalizado.
Esto ha estimulado mucho trabajo para establecer pruebas no invasivas (NIT) para diagnosticar NASH y fibrosis, pero ninguna ha cumplido los requisitos probatorios necesarios para la calificación regulatoria. La falta de aprobación regulatoria limita la disponibilidad de estas pruebas para un uso clínico generalizado.
También dificulta el reclutamiento de pacientes en ensayos clínicos y su desarrollo posterior para el seguimiento de la respuesta al tratamiento. Desde el punto de vista de la salud pública, la falta de paneles de biomarcadores aprobados con fines de diagnóstico es, por tanto, una barrera importante para el acceso a la atención y al desarrollo de fármacos.
Aunque se han logrado avances en la evaluación comparativa retrospectiva de las NIT, aún persisten lagunas en la evidencia para una calificación completa. El desarrollo de tales NIT según los estándares regulatorios sigue siendo una importante necesidad insatisfecha en este campo.
Existen tres vías generales para la aprobación regulatoria de paneles de biomarcadores. Las herramientas de desarrollo de fármacos se desarrollan y validan en el contexto de un programa de desarrollo de fármacos específico, y la aprobación está limitada a un contexto de uso estrictamente definido.
El consenso académico es otra vía, pero está limitado por la falta de resultados estandarizados y de publicaciones basadas en estudios que no están diseñados para cumplir con los estándares regulatorios típicos.
La calificación de biomarcadores es la tercera vía. Es un proceso en el que las agencias reguladoras acuerdan que un biomarcador determinado, cuando se utiliza en un entorno clínico específico para responder a una pregunta específica, proporciona información procesable con un nivel de certeza predeterminado.
Los reguladores reconocen las iniciativas colaborativas y los consorcios como vehículo para abordar el proceso de calificación. Incluye la consideración de la solidez analítica del ensayo y una definición clara de los entornos clínicos y los límites dentro de los cuales funcionan los ensayos de biomarcadores.
Además, requiere una evaluación rigurosa de la sensibilidad y especificidad para su uso previsto y validación en poblaciones relevantes.
Finalmente, también incluye una evaluación del beneficio frente a los riesgos de una clasificación errónea. El caso de uso general está definido por el contexto de uso, que define en quién se utilizará la prueba y el entorno clínico donde se utilizará, el propósito de la prueba, la lectura y su interpretación y las decisiones que surgirán de la lectura.
La finalidad puede ser diagnóstica, pronóstica, predictiva, seguimiento de la enfermedad o evaluación de la respuesta al tratamiento. En conjunto, esto representa una cantidad sustancial de datos que, por razones logísticas prácticas, generalmente se generan en varios pasos.
La Fundación de los Institutos Nacionales para la Salud (FNIH) fue establecida por el gobierno federal de los Estados Unidos como una plataforma para permitir asociaciones público-privadas, reuniendo a múltiples agencias federales con académicos, socios industriales y otras partes interesadas relevantes para resolver problemas de gran importancia para la salud pública.
La FNIH encargó el proyecto Biomarcadores no invasivos para la enfermedad metabólica del hígado (NIMBLE) para calificar los NIT para NAFLD. representa un esfuerzo de colaboración que involucra a la FNIH, la Administración de Medicamentos y Alimentos de los EE. UU. (FDA), académicos y 14 socios de la industria para calificar biomarcadores para el enriquecimiento diagnóstico de NASH «en riesgo» y sus subcomponentes. NIMBLE tiene un flujo de trabajo de imágenes y un flujo de trabajo de biomarcadores circulantes.
El estudio actual (.Sanyal, A.J., Shankar, S.S., Yates, K.P. et al. Diagnostic performance of circulating biomarkers for non-alcoholic steatohepatitis. Nat Med (2023). https://doi.org/10.1038/s41591-023-02539-6), es el informe final de la etapa 1 del flujo de trabajo de biomarcadores circulantes del proyecto NIMBLE y representa una colaboración entre el flujo de trabajo de biomarcadores circulantes NIMBLE y los centros clínicos de adultos y el centro coordinador de datos de la Red de Investigación Clínica NASH (NASH CRN) del National Instituto de Diabetes y Enfermedades Digestivas y Renales (NIDDK) evalúa las métricas de rendimiento de varios paneles de biomarcadores para el diagnóstico de NASH, NASH en riesgo y gravedad variable de fibrosis en personas con NAFLD.
Los resultados de este estudio informarán si alguno de los biomarcadores ha cumplido con la evidencia necesaria para la calificación o si son de respaldo pero necesitan validación adicional en la etapa 2. También informarán si alguno de estos no se considera para los esfuerzos de validación final en la etapa 2 del proyecto NIMBLE.
El primer paso en el camino de la calificación de biomarcadores es la aceptación regulatoria de una carta de intención que establezca la hoja de ruta científica a seguir. La FDA aceptó una carta de intención del estudio NIMBLE para los biomarcadores circulantes en el estudio actual, un paso crítico en el proceso de calificación.
El contexto de uso propuesto fue para el enriquecimiento diagnóstico de EHNA en riesgo y sus componentes, es decir, presencia de EHNA, alta actividad histológica de la enfermedad y umbrales de fibrosis específicos, por ejemplo, fibrosis clínicamente significativa (≥estadio 2), fibrosis avanzada (≥estadio 3) o cirrosis (estadio 4), en una población con NAFLD o factores de riesgo de NAFLD.
Se espera que un biomarcador de enriquecimiento diagnóstico exitoso seleccione pacientes con una mayor probabilidad de cumplir con los criterios de NASH en riesgo en una biopsia hepática posterior, reduciendo así la cantidad de pacientes que se someten a este procedimiento innecesariamente y mejorando la eficiencia del proceso para seleccionar pacientes que necesitan intervención clínica y/o aptos para participar en ensayos clínicos de NASH.
Los paneles elegidos representan la primera ola de biomarcadores circulantes que pasan por este esfuerzo de calificación e incluyeron NIS4 (Genfit, Lille, Francia), OWLiver (One Way Lipidomics, Bilbao, España), PROC3 (Nordic Bioscience, Copenhague, Dinamarca), fibrosis hepática mejorada. (ELF) (Siemens Healthineers, Nueva Jersey, EE. UU.) y el FibroMeter VCTE (Echosense, París, Francia). Este último fue elegido como el mejor panel vinculado a elastografía transitoria controlada por vibración (VCTE) en el momento en que se diseñó NIMBLE.
Desde el diseño de NIMBLE, han surgido paneles adicionales, por ejemplo, las puntuaciones FAST, Agile y ADAPT; Se espera que la calificación de estos siga la hoja de ruta establecida por la carta de intención de NIMBLE. Ya se está llevando a cabo un esfuerzo de calificación por separado para la puntuación FAST.
El objetivo del paso actual en el proceso de calificación no era identificar nuevos biomarcadores o determinar qué biomarcador es el mejor, sino determinar rigurosamente la sensibilidad y especificidad de cada uno de los paneles de biomarcadores en una cohorte curada con una distribución equilibrada del estadio de fibrosis y comparar su desempeño con las pruebas de laboratorio comúnmente utilizadas para el mismo propósito utilizadas por la comunidad médica general.
Los datos informarían el desarrollo posterior de los biomarcadores seleccionados y proporcionarían la base para un plan de calificación completo para estos paneles que, después de la aceptación por parte de la FDA, respaldará su calificación con o sin datos adicionales de la etapa 2 como paso final. Por lo tanto, este paso crítico acerca el campo a tener NIT calificados que puedan usarse para identificar personas con NASH en riesgo y sus subcomponentes tanto para la práctica habitual como para el desarrollo de fármacos.
El estudio actual demuestra que NIS4 cumplió con los criterios preespecificados para esfuerzos de calificación adicionales para el enriquecimiento diagnóstico de NASH, para NAS alto y para NASH en riesgo. Además, la prueba ELF y FibroMeter VCTE cumplieron con los criterios para esfuerzos de calificación adicionales para el diagnóstico de fibrosis clínicamente significativa (≥ etapa 2), fibrosis avanzada (≥ etapa 3) y cirrosis (etapa 4) en personas con NAFLD.
Estos datos informan el desarrollo y aprobación del plan de calificación completo que definirá el conjunto final de estudios necesarios para la aprobación regulatoria de las herramientas de enriquecimiento de diagnóstico para NASH.
Este estudio tiene implicaciones para la aprobación de biomarcadores para la evaluación diagnóstica de NASH en riesgo y sus componentes. La definición de la sensibilidad y especificidad de cada biomarcador para cada uno de sus usos previstos en individuos con EHGNA sienta las bases para su validación en otras cohortes, retrospectivas y prospectivas, con una prevalencia variable de cada fenotipo evaluado como paso final para la calificación.
El estudio actual fue un primer paso para determinar si los paneles de biomarcadores no sólo identificaron los fenotipos relevantes en función de su uso previsto, sino también si eran superiores a algunas herramientas de laboratorio clínico de uso común, como ALT y FIB-4.
Estos servirán como criterios, que se finalizarán con la retroalimentación de la FDA, para mover los paneles con las métricas de desempeño más prometedoras a los pasos finales de calificación.
Otra implicación del estudio actual es que, junto con la carta de intención aprobada, establece una hoja de ruta para la calificación de biomarcadores para el enriquecimiento diagnóstico. Es probable que esta hoja de ruta regulatoria también sea utilizada por otros paneles, como FAST, ADAPT y Agile, que se desarrollaron después del inicio de NIMBLE y que también son fuertes candidatos para avanzar hacia la calificación.
El establecimiento de biomarcadores calificados para el enriquecimiento del diagnóstico también sentará las bases para su uso en el seguimiento de enfermedades y biomarcadores de respuesta al tratamiento, que serán de vital importancia para establecer un criterio de valoración sustituto basado únicamente en las NIT.
En este sentido, el diagnóstico de cirrosis es particularmente relevante porque la progresión a cirrosis evaluada histológicamente ya es un criterio de valoración sustituto generalmente aceptado para evaluar la eficacia terapéutica 5.
La aplicación práctica de estos datos debe considerarse en el contexto de cómo se utilizan las pruebas (Tablas de datos ampliados 4 y 5).
En atención primaria, donde la prevalencia de fibrosis avanzada es del 1%, las pruebas positivas probablemente sean falsos positivos e, incluso con una sensibilidad y especificidad excelentes, el valor predictivo positivo (VPP) será bajo. Es probable que el uso de estas pruebas para identificar pacientes para ensayos clínicos en tales entornos genere muchos falsos positivos, lo que resulta en altas tasas de fracaso en las pruebas de detección.
El valor predictivo negativo (VPN) para FIB4, así como todos los paneles de biomarcadores evaluados, osciló entre 98% y 99,7% cuando la prevalencia poblacional de fibrosis avanzada era del 1% (Tabla de datos ampliados 4). Por lo tanto, estas pruebas se pueden aplicar para la exclusión de este fenotipo tanto para el tratamiento clínico como para excluir a personas durante la selección de ensayos clínicos dirigidos a personas con EHNA en riesgo, particularmente en un entorno de atención primaria.
La prevalencia de NASH en riesgo o sus subconjuntos, NASH con fibrosis avanzada o cirrosis es mayor en las clínicas de hepatología y oscila entre el 10% y el 40%.
El alto VPN en entornos con baja prevalencia se mantuvo en estos rangos, mientras que los PPV se acercaron al 80% con una prevalencia del 40% cuando se utilizó el punto de corte de Youden (Tabla de datos ampliados 5).
En entornos de ensayos clínicos, estos datos deberían permitir la exclusión de personas sin estos fenotipos y, al mismo tiempo, limitar el sobrediagnóstico en comparación con un entorno de atención primaria. Sin embargo, una mejora adicional de la certeza para determinar la enfermedad mediante el uso del punto de corte para una especificidad del 90% (Tabla 3) se asociará con una pérdida de sensibilidad y un mayor potencial de clasificación errónea.
Es probable que una mejora adicional requiera un enfoque algorítmico que utilice paneles múltiples o el uso de pruebas basadas en imágenes para una mayor precisión en la identificación de esta población.
Se ha demostrado que la elastografía por resonancia magnética con FIB4 o aspartato transaminasa (AST) identifica a personas con EHNA y fibrosis avanzada o EHNA en riesgo, respectivamente, y puede proporcionar dichas herramientas. Sin embargo, los datos actuales no pueden compararse directamente con estos debido a diferencias metodológicas.
Para los pacientes con fibrosis avanzada o cirrosis, un diagnóstico erróneo de ausencia de estos fenotipos puede hacer que se les haga un seguimiento sin vigilancia para detectar cáncer hepatocelular o várices gastroesofágicas, que son necesarios para aquellos con cirrosis. Los elevados VPN generales sugieren que los riesgos son, en general, bajos.
Por el contrario, el sobrediagnóstico debido a VPP modestos puede dar lugar a pruebas adicionales redundantes, incluida la biopsia hepática con sus riesgos asociados. ELF y FibroMeter VCTE pueden identificar entre el 82% y el 94% de los casos de cirrosis verdaderamente positivos, pero también pueden sobrediagnosticar a algunos pacientes con cirrosis en clínicas con alta prevalencia de cirrosis (Tabla de datos ampliados 5).
Los riesgos de un sobrediagnóstico deben considerarse en el contexto de los riesgos de pasar por alto la fibrosis avanzada o la cirrosis en poblaciones específicas, tanto en la práctica clínica como para considerar su inclusión en los ensayos.
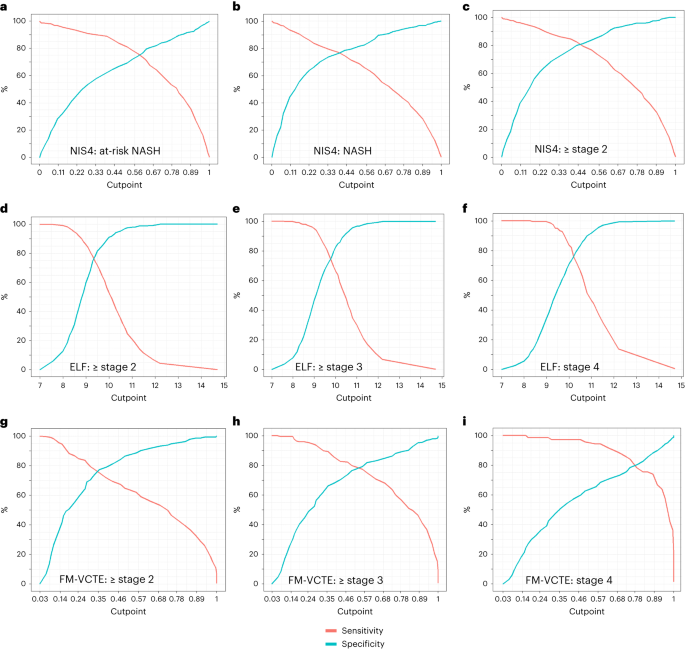
Fig. 2: Rendimiento de paneles de biomarcadores seleccionados para los usos previstos.
La sensibilidad y especificidad de los paneles NIT clave para sus respectivos usos previstos se muestran en función de las puntuaciones de corte para los NIT. a – c, Los paneles superiores demuestran cambios en la sensibilidad y especificidad en diferentes puntuaciones de corte de NIS4 para el diagnóstico de NASH en riesgo (a) y su diagnóstico de subcomponente clave de NASH (b) y fibrosis en etapa 2 o mayor (c). d – f,
Los paneles del medio muestran datos similares para la prueba ELF para el diagnóstico de fibrosis ≥ estadio 2 (d), ≥ estadio 3 (e) y estadio 4, es decir, cirrosis (f). g – i, Los paneles inferiores demuestran los cambios en la sensibilidad y especificidad en diferentes puntos de corte de puntuación de FibroMeter VCTE (FM-VCTE) para el diagnóstico de fibrosis en estadio ≥2 (g), fibrosis en estadio ≥3 (h) y fibrosis en estadio 4 (i ).
Los gráficos individuales se derivaron de 50 puntos de corte de puntuación individuales que cubrían el rango donde la sensibilidad era del 100% hasta donde la especificidad se acercaba al 100%, seguido de un suavizado del gráfico para cubrir el rango dinámico de puntuaciones para los usos previstos.
Ver las tablas (importantes datos) en los links abajo.
https://www.nature.com/articles/s41591-023-02539-6/tables/2
https://www.nature.com/articles/s41591-023-02539-6/tables/3