Ronald Palacios Castrillo, M.D.,PhD.
Las enfermedades autoinmunes son la tercera categoría de enfermedades más prevalentes, sólo superadas por el cáncer y las enfermedades cardíacas.
Cuatro de cada cinco pacientes con enfermedades autoinmunes son mujeres. Por ejemplo, en el lupus eritematoso sistémico (LES), la proporción de sexo del paciente es de 9:1 de mujeres a hombres; la proporción en la enfermedad de Sjögren es de 19:1 entre mujeres y hombres.
Aunque las hormonas se han estudiado ampliamente, la dosis del cromosoma X parece ser un factor importante del riesgo autoinmune independientemente del sexo o el estado hormonal en humanos y ratones.
Los pacientes con síndrome de Klinefelter (XXY) son fenotípicamente hombres, tienen un patrón hormonal masculino, pero tienen un riesgo elevado de enfermedad autoinmune equivalente al de las mujeres. Se han señalado genes específicos ligados al cromosoma X, como TLR7, que pueden escapar de la inactivación del cromosoma X, como contribuyentes a enfermedades autoinmunes específicas.
=> Recibir por Whatsapp las noticias destacadas
El riesgo genético subyacente a las enfermedades autoinmunes del segundo cromosoma X en conjunto sigue sin resolverse.
Además, los estudios con gemelos idénticos también han demostrado diversos grados de penetrancia de las enfermedades autoinmunes, lo que sugiere una disposición genética que también depende de factores ambientales. Por lo tanto, los desencadenantes adyuvantes, además de la predisposición genética, pueden ser iniciadores del desarrollo de enfermedades autoinmunes.
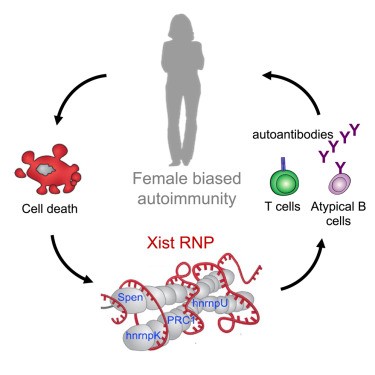
Las hembras de mamíferos tienen un genotipo XX y los machos tienen un genotipo XY. Para que la expresión genética sea aproximadamente equivalente entre mujeres y hombres, cada célula del cuerpo de una mujer silencia epigenéticamente uno de los dos cromosomas X mediante la acción del largo RNA no codificante (lncRNA) Xist. Xist es un lncRNA de aproximadamente 17 kb (19 kb en humanos) que se transcribe únicamente a partir del cromosoma X inactivo y, por lo tanto, no se expresa en los hombres.
Xist es fundamental para el establecimiento de la inactivación del cromosoma X (XCI) que se propaga desde el centro de inactivación de X y cubre todo el X inactivo en asociación con sus proteínas asociadas.
Durante el establecimiento de XCI en células madre embrionarias de ratón, Xist se asocia con 81 proteínas de unión únicas para formar un complejo de ribonucleoproteína (RNP), 10 a través de la interacción directa entre RNA y proteínas y otras mediante la interacción indirecta entre proteínas.
Xist se expresa ampliamente en tejidos somáticos adultos y se asocia con proteínas adicionales específicas de tejido. Anteriormente se había observado que varias proteínas de unión a Xist eran autoantígenos.
Los estudios en pacientes y ratones con LES demostraron que los complejos inmunes DNA-autoanticuerpo y RNA-autoantígeno, como Sm/RNP y U1A, activan las vías TLR7, TLR8 y TLR9 del sistema inmunológico innato.
El XIST RNP, que comprendía un El lncRNA, proteínas de unión a RNA unidas y atadas a fragmentos de DNA genómico, presenta cualidades que se asemejan a los complejos inmunes de ácido nucleico y autoantígeno.
Para estudiar el impacto de XIST RNP en la predilección autoinmune independientemente del cromosoma sexual o el contexto hormonal, Dou y colegas utilizaron un alelo inducible y no silenciador de Xist introducido en un autosoma en la cepa C57BL/6J autoinmune resistente y en la cepa SJL/J con tendencia autoinmune. La inducción de la formación transgénica de Xist RNP en animales machos permitió el estudio de este lncRNA específico de hembras en un entorno masculino, utilizando un modelo de LES inducido químicamente.
En los modelos de ratón con LES inducido por pristano se observaron tanto un aumento de la gravedad de la enfermedad como un aumento de las firmas de las vías de los linfocitos autorreactivos.
Al mismo tiempo, diseñaron una matriz de antígenos para probar la seroactividad de pacientes autoinmunes frente a las proteínas asociadas a XIST y detectaron una reactividad significativa hacia múltiples componentes de XIST RNP.
En conjunto, nuestros datos apuntan a un papel importante del Xist RNP como impulsor de la autoinmunidad que puede ser la base de la preponderancia femenina con sesgo sexual para el desarrollo de enfermedades autoinmunes.
Xist lncRNA como andamio de antígeno polimérico en la autoinmunidad femenina
El estudio de Dou y colegas señala a los complejos Xist RNP como desencadenantes antigénicos que subyacen a la mayor prevalencia de enfermedades autoinmunes en las mujeres.
Aunque es un hecho bien documentado que las mujeres son más propensas a enfermedades autoinmunes que los hombres, estudios previos examinaron principalmente las diferencias en la dosis de genes y los antecedentes hormonales.
Si bien estudios anteriores de Xist abordan la inactivación de X alterada y el impacto posterior del escape de XCI de genes ligados a X, este estudio investigó la inmunogenicidad del propio complejo Xist RNP.
Los investigadores han demostrado que la expresión de Xist RNP en ratones macho es suficiente para aumentar la gravedad de la enfermedad y cambiar la expresión y los perfiles epigenómicos de las células B y T efectoras de la patogénesis del LES.
Los médicos y científicos han observado desde hace mucho tiempo que muchos autoanticuerpos se dirigen a grandes complejos de proteínas y ácidos nucleicos, como la cromatina o la RNP, en las enfermedades autoinmunes humanas.
Esta característica fue aprovechada por los biólogos moleculares que utilizaron sueros de pacientes para identificar componentes del centrómero (reconocido por autoanticuerpos en la calcinosis, el fenómeno de Raynaud, la dismotilidad esofágica, la esclerodactilia, el síndrome de telangiectasia [CREST]) o el espliceosoma (LES y DM).
Los inmunólogos han explicado este fenómeno con la idea de que los grandes complejos de ácido nucleico y proteína son poliméricos y, si se exponen en el espacio extracelular, pueden agruparse y activar inmunorreceptores. Los autores proponen que XIST RNP es una de esas matrices antigénicas dominantes que es exclusiva de las mujeres.
Cada célula del cuerpo de una mujer tiene XIST, que es un polímero largo (19 kb) y recubre todo el cromosoma X inactivo en el cuerpo de Barr condensado (un polímero aún más grande).
Cuando una célula femenina muere debido a una lesión tisular, las RNP XIST invariablemente quedarán expuestas al sistema inmunológico. Nuestros datos sugieren además un modelo en el que XIST contribuye a varios pasos en la progresión hacia una enfermedad autoinmune.
En un entorno genéticamente autoinmune resistente, un nivel bajo de XIST, incluso en presencia de lesión tisular, sólo produce cambios en los subconjuntos de células T y estados de cromatina, pero no a una patología orgánica franca.
Estos cambios epigenéticos en la accesibilidad se reflejan posteriormente en los programas de expresión génica que regulan positivamente la autorreactividad y regulan negativamente la modulación inmune. Finalmente, en el contexto de un trasfondo genético permisivo y una lesión tisular repetida, la presencia de XIST RNP exacerba la patología de órganos terminales en toda regla y la activación de múltiples tipos de células inmunes.
Los estudios longitudinales de la reactividad del suero y las enfermedades autoinmunes en humanos son consistentes con este modelo.
Oportunidades para el diagnóstico y la terapia de enfermedades.
Hay más de 100 enfermedades autoinmunes conocidas que en conjunto afectan a aproximadamente 50 millones de estadounidenses y constituyen una de las diez principales causas de muerte entre mujeres menores de 65 años.
Es preocupante que los casos aumenten anualmente a escala mundial, y estudios serológicos recientes reveló un fuerte aumento en la reactividad de los ANA. Comprender los factores de riesgo y los impulsores de la autoinmunidad se ha vuelto aún más crítico en la carrera por desarrollar terapias efectivas y diagnósticos sensibles específicos para cada enfermedad autoinmune. Sin embargo, la alta heterogeneidad dentro de las enfermedades autoinmunes y los rasgos superpuestos entre las enfermedades han limitado nuestra capacidad para adaptar terapias efectivas y diagnósticos sensibles específicos para cada enfermedad autoinmune.
El descubrimiento de la seropositividad hacia múltiples proteínas asociadas a XIST en pacientes autoinmunes introduce un nuevo conjunto de antígenos con potencial clínico para mejorar la detección y el seguimiento de la enfermedad, ya que los autoanticuerpos a menudo se detectan antes o temprano en el inicio de la enfermedad.
Además, los estudios en SSc también han demostró la eficacia del análisis de autoantígenos en la estratificación de pacientes y en la identificación de vías patógenas.
Perfilar el XIST RNP en células primarias, tanto sanas como enfermas, puede ser útil para avanzar en nuestra comprensión de la autorreactividad aberrante hacia las proteínas dentro del complejo y para identificar más potencial autoantígenos.
Actualmente, existen pocas terapias dirigidas disponibles para enfermedades autoinmunes. Las terapias más comunes implican el agotamiento de las células B, pero no siempre son efectivas.
Sigue existiendo la necesidad de objetivos de leucocitos patógenos más específicos. Dou y colegas Identificaron células B atípicas como una población de células inmunes que se acumula como consecuencia de la expresión de Xist RNP.
Las células B atípicas (también conocidas como células B asociadas a la edad) son una población única de células B que se expande con una mayor señalización de TLR7 y en la autoinmunidad femenina.
En particular, las células B atípicas se acumulan en ratones hembra de edad avanzada, pero no en ratones macho de la misma edad, y las células B atípicas se enriquecen en células B humanas o de ratón que escapan de XCI y reexpresan TLR7.
Por lo tanto, las células B atípicas aparecen como el agente inmunológico nexo de dos consecuencias potenciales de la compensación de dosis en mamíferos (autoreactividad a Xist RNP y escape de XCI) y sugieren que estas consecuencias pueden sinergisarce para promover la inmunidad sesgada por las mujeres.
Los estudios futuros deberían abordar si las células B atípicas u otros tipos de células evocadas por Xist RNP contribuyen a la autoinmunidad y cómo.
Limitaciones del estudio
Este estudio emplea un Xist truncado al que le falta el RepA para modelar la acción de Xist RNP en ratones macho. La detección de autoanticuerpos contra Xist RNP en pacientes hembras y ratones hembra WT indica que tgXist modela aspectos importantes de Xist completo en hembras.
Aunque hemos confirmado que los subconjuntos de células inmunitarias, los autoanticuerpos y la penetrancia de la enfermedad de la autoinmunidad de los machos tgXist se encuentran en un nivel intermedio entre los machos WT y las mujeres WT, lo que argumenta en contra de un efecto neomórfico de Xist-ΔRepA, es formalmente posible que Xist-ΔRepA afecta otras características de la autoinmunidad.
La fragmentación de Xist RNP libre de células es la consecuencia inevitable a medida que el complejo se libera de las células moribundas y finalmente se elimina, y esta interpretación es totalmente compatible con el modelo de inmunidad sesgada por las mujeres.
El modelo transgénico expresó Xist de manera ubicua en animales machos, y el papel de los tejidos individuales o tipos de células más responsables de los fenotipos observados y la ventana de tiempo requerida de exposición a Xist RNP debe analizarse en estudios futuros.
Los modelos de enfermedades autoinmunes en ratones NO son verdaderos modelos de enfermedades autoinmunes en humanos ya que no recapitulan las enfermedades que observamos en humanos. Además, una limitación conocida de los casetes de expresión regulados por Tet es que pueden tener fugas o silenciarse con el tiempo in vivo.
Por lo tanto, es probable que exista variabilidad o disminución de la expresión de tgXist en el modelo transgénico durante el experimento; y el nivel de Xist necesario para conferir riesgo autoinmune a nivel femenino no está claro.
De manera similar, este trabajo no ha abordado si las fluctuaciones en el nivel de Xist en mujeres pueden afectar la autoinmunidad. Finalmente, este estudio empleó una cantidad modesta de animales y muestras de pacientes, y varios resultados mostraron una gran variación entre los sujetos de prueba.
Serán valiosos estudios futuros con números más grandes y un enfoque detallado sobre exactamente qué antígenos relacionados con XIST contribuyen a la inmunidad sesgada por las mujeres.
Mi interpretación:
En la actualidad sabemos que hay hasta 5 genes cuya función es deficiente en pacientes con LES. Todos estos genes participan normalmente en la identificación de células moribundas (por apoptosis o necrosis) que requieren acción de macrófagos para la identificación, engullir , digerir y destruir sobretodo al DNA y RNAs de las células muertas con la finalidad de reducir al máximo el aumento de DNA y RNA en los tejidos (llamemos basura celular para esta explicación).
Esto funciona todo el tiempo ya que miles de células mueren en el organismo de manera natural o posterior a daños (por infección, químicos,etc).
El fallo en este sistema recolector de la basura celular permite el aumento de esta en los tejidos hasta alcanzar niveles que estimulan la actividad de las respuestas inmunes tanto nativas como adquiridas. Una vez activa la respuesta inmune contra el DNA, y los diferentes tipos de RNA/proteina, hay mayor destrucción de las células del organismo en cualquier tejido u órgano (todas las células de nuestro organismo, excepto los glóbulos rojos maduros de la sangre, tienen DNA y RNA y por lo tanto son susceptibles a ataques de los linfocitos citotóxicos específicos contra esos ácidos nucleicos y de linfocitos B que producen anticuerpos contra el DNA y contra un sin número de complejos de RNA/proteinas. Los anticuerpos contra los ácidos nucleicos (ANA) se usan en el diagnóstico de varias enfermedades autoinmunes, la principal el LES.
Las infecciones y la luz solar activa el LES porque causan muerte de muchas células y por lo tanto, mayor generación de DNA y complejos RNA/proteinas en los tejidos, que funcionan como antígenos estimulantes de los linfocitos T y B en las enfermedades autoinmunes como el LES.
El trabajo de Dou y colaboradores es interesante porque propone que una estructura que se encuentra en el cromosoma X inactivado en las mujeres llamado XIST ( que contiene muchos complejos de RNA/proteinas) son una fuente extra de antígenos estimuladores de los linfocitos T y B autoreactivos en las enfermedades autoinmunes.
Como la inactivación del cromosoma X y la presencia de XIST solo ocurre en las mujeres, ellas tienen una major cantidad de RNA/complejos que los hombres y por lo tanto, una activación mucho más temprana y eficiente de los linfocitos T y B reactivos contra DNA y complejos RNA/proteinas y por lo tanto una mayor frecuencia en padecer enfermedades autoinmunes asociadas y desencadenadas por DNA y complejos RNA/proteina.
Existe también evidencia formal de que los estrógenos favorecen la activación de los linfocitos autoreactivos contra DNA y complejos RNA/proteinas y son otro de los factores identificados que hace que las varias enfermedades autoinmunes sean más frecuentes en mujeres que en hombres.