Ronald Palacios Castrillo, M.D.,PhD
Resumen
El hígado es un órgano crucial involucrado en muchos procesos inmunológicos, incluida la eliminación de patógenos, la tolerancia a autoantígenos y regulación de la inflamación. Recibe suministro sanguíneo directo a través de la vena porta intestinal, que contiene antígenos dietéticos y metabolitos del microbioma residente.
Sin embargo, estos procesos pueden verse interrumpidos por varios factores que conducen a enfermedades hepáticas. En esta revisión, hemos resumido los desarrollos recientes en fibrosis, cirrosis, enfermedades autoinmunes y enfermedades infecciosas. La fibrosis y la cirrosis se caracterizan por la acumulación de cicatrices.
Tejido en el hígado resultante de inflamación y lesión crónica. La respuesta inmune a esta lesión implica la activación de células estrelladas hepáticas, células inmunes y citocinas, lo que lleva a procesos inflamatorios y fibrosis.
=> Recibir por Whatsapp las noticias destacadas
Las enfermedades hepáticas autoinmunes, como la hepatitis autoinmune y la cirrosis biliar primaria, son el resultado de una desregulación de respuestas inmunes dirigidas contra las células del hígado. Las enfermedades infecciosas como la hepatitis A, B, C, D y E también provocan inflamación crónica de enfermedades hepáticas.
Comprender la inmunología del hígado es fundamental para el desarrollo de terapias efectivas. Los tratamientos actuales se centran en la modulación inmune y terapias antiinflamatorias.
El advenimiento de nuevas terapias, como las celulares y genéticas, han desatado el potencial de apuntar a nuevas vías en la patogénesis del hígado. Las terapias futuras pueden apuntar a vías inmunes específicas en la patogénesis inmune de la patología hepática.
Las enfermedades hepáticas siguen siendo una de las diez principales causas de morbilidad y mortalidad. Estas enfermedades son responsables de aproximadamente 2 millones de muertes al año en todo el mundo, 1 millón por complicaciones de la cirrosis y otro millón por hepatitis viral y carcinoma hepatocelular.
Las enfermedades hepáticas endógenas se clasifican en enfermedad del hígado graso no alcohólico (NAFLD) y enfermedad hepática asociada al alcohol (ALD), las cuales contribuyen a la cirrosis y el cáncer de hígado. La infección de los hepatocitos, particularmente por los virus de la hepatitis, también contribuye a importantes patologías hepáticas agudas y crónicas. Los estudios epidemiológicos realizados durante la última década han indicado un aumento de las enfermedades hepáticas autoinmunes (AILD).
El papel de la respuesta inmune en la patogénesis de las enfermedades hepáticas requiere una evaluación cuidadosa.
En esta revisión, nos hemos centrado en las enfermedades hepáticas no relacionadas con el alcohol, como la cirrosis hepática, la fibrosis, las enfermedades hepáticas autoinmunes y la hepatitis viral. También hemos comentado diferentes vías inmunes relacionadas con el hígado y terapias desarrolladas recientemente contra enfermedades hepáticas. Hemos excluido la enfermedad hepática inducida por el alcohol y el cáncer de hígado.
Estructura del hígado
El hígado es un órgano interno grande que pesa entre 1200 y 1500 g. Se encuentra adyacente al estómago. Recibe sangre de la arteria hepática y la drena hacia la vena porta hepática. Es responsable del metabolismo, la desintoxicación, la producción de bilis y la vigilancia inmunológica.
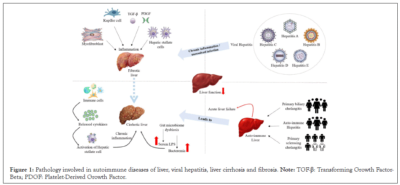
El hígado es aproximadamente triangular y consta de dos lóbulos principales: el lóbulo derecho más grande y el lóbulo derecho más pequeño. Estos lóbulos están separados por un ligamento falciforme. También consta de dos lóbulos aún más pequeños: el lóbulo caudado y el lóbulo cuadrado. Todos estos lóbulos del hígado se dividen a su vez en ocho segmentos y múltiples lóbulos. El hígado está compuesto por una amplia gama de células entre las cuales los hepatocitos son los predominantes (Figuras 1 y 2).
Los hepatocitos son células epiteliales que ayudan al metabolismo mediante la secreción de componentes biliares y el proceso de desintoxicación.
Estas células normalmente se encuentran en una etapa inactiva en un hígado sano. Las células de Kupffer son macrófagos especializados que ayudan en la homeostasis de los iones, la fagocitosis y la cicatrización de heridas. Las células estrelladas hepáticas (HSC), también conocidas como células ito, son células mesenquimales que ayudan en la fibrogénesis, así como en la absorción y regulación del retinol (vitamina A) .
Se sabe que estas células tienen propiedades similares a las de las células madre y pueden convertirse en células endoteliales o hepatocitos.
Las células endoteliales sinusoidales del hígado (LSEC) forman el endotelio y su función principal es la endocitosis eficaz mediante la cual absorben las sustancias necesarias del torrente sanguíneo.
Las células asesinas naturales hepáticas (NK) también se conocen como células pit debido a su presencia en forma de varios gránulos pequeños y peculiares. El papel en los estados ingenuos, activados y agotados de los tipos de células inmunitarias da como resultado diversos resultados tras las interacciones con las células estrelladas hepáticas.
Las complejas interacciones de estos tipos de células en el hígado desempeñan funciones fundamentales en el mantenimiento de la homeostasis inmunitaria del hígado mediante la regulación de las respuestas inflamatorias y la tolerancia inmunitaria durante la patogénesis de las enfermedades hepáticas.
Regeneración del hígado
De todos los órganos sólidos del cuerpo, la capacidad inherente del hígado para regenerarse ha sido ampliamente estudiada.
Después de una lesión hepática, el modo primario de regeneración hepática está impulsado por la proliferación de hepatocitos existentes, mientras que el modo secundario implica la desdiferenciación de los hepatocitos en células progenitoras del hígado (LPC o células ovaladas) y su posterior diferenciación en hepatocitos.
Las LPC no se encuentran en el hígado sano, pero están presentes entre el conducto biliar y las células hepáticas en el caso de daño hepático.
Estudios recientes sobre los mecanismos moleculares implicados en la regeneración hepática han demostrado alteraciones epigenéticas en los hepatocitos.
Estos eventos son impulsados por alteraciones de la cromatina que involucran heterocromatización y represión transcripcional.
La regeneración del hígado invierte estos patrones y rejuvenece múltiples aspectos moleculares y fisiológicos del metabolismo celular. Estos estudios tienen implicaciones para los nuevos regímenes de tratamiento para el tratamiento de enfermedades hepáticas.
Regulación de la inflamación mediante citocinas en el hígado.
Un hígado sano produce una variedad de citoquinas necesarias para la regulación inmune y durante la inflamación.
Las interleucinas proinflamatorias como la interleucina (IL)-6, IL-8 e IL-10 participan en la respuesta a la infección y en el reclutamiento y activación de células inmunes como los neutrófilos en los sitios de inflamación.
También ayudan en la prevención de enfermedades autoinmunes . La IL-1-b participa en la regulación positiva de las respuestas inmunitarias y la inflamación, mientras que la IL-1RA suprime la respuesta inflamatoria.
El factor de necrosis tumoral α (TNF-α) participa en la muerte celular, mientras que el IFN-α participa en la defensa contra infecciones virales. El TGF-β participa en la regulación del crecimiento, diferenciación y apoptosis celular. Las interacciones de estas citocinas con los entornos celulares del hígado regulan las actividades proinflamatorias y antiinflamatorias y mantienen la homeostasis.
Enfermedades relacionadas con el hígado
Las enfermedades relacionadas con el hígado incluyen una amplia gama de enfermedades. Varios factores ambientales y genéticos están implicados en estas enfermedades; Estos factores se denominan en conjunto exposoma.
La inflamación inmunomediada, las toxinas y las vías del eje intestino-hígado están implicadas en enfermedades como la fibrosis hepática, la cirrosis, la enfermedad del hígado graso no alcohólico (NAFLD) y la esteatohepatitis no alcohólica (NASH).
Los mecanismos inmunes proinflamatorios implicados en la patogénesis de cada una de estas enfermedades son diversos. Además de los procesos inflamatorios, el microbioma intestinal, formado por diversos microorganismos como bacterias, hongos y virus, desempeña un papel importante en la patogénesis de las enfermedades hepáticas.
La salud intestinal se ve afectada negativamente debido a una dieta inadecuada, el exceso de estrés, la exposición a diversas toxinas ambientales y el uso excesivo de antibióticos. En las siguientes secciones, analizamos la patogénesis y el tratamiento de la fibrosis, la cirrosis, las enfermedades hepáticas autoinmunes y las infecciones virales del hígado.
Fibrosis hepática
La fibrosis hepática es un proceso patológico que ocurre cuando hay una acumulación de colágeno y otras proteínas de la matriz extracelular en el tejido hepático . Esta acumulación conduce a la formación de tejido cicatricial, que perjudica la función normal del hígado.
Los mecanismos moleculares que causan la fibrosis hepática implican una interacción compleja de varios tipos de células, citocinas, factores de crecimiento y componentes de la matriz extracelular. Uno de los principales factores que desencadena la fibrosis hepática es la activación de las HSC, que suelen ser células inactivas en el hígado.
Las HSC se activan mediante diferentes estímulos, como citoquinas como el factor de crecimiento transformante beta (TGF-β) y el factor de crecimiento derivado de plaquetas (PDGF), el estrés oxidativo y los patrones moleculares asociados al daño (DAMP).
La activación de HSC juega un papel importante en este proceso; Además, diferentes vías de señalización como TGF-β/Smad, receptor de PDGF y Wnt/β-catenina participan en la activación de HSC y la síntesis de colágeno.
De manera similar, la vía del receptor PDGF induce la proliferación y migración de HSC, mientras que la vía Wnt/β-catenina regula la proliferación y diferenciación de HSC, las cuales contribuyen a la activación de HSC y la síntesis de colágeno.
Las HSC activadas secretan cantidades excesivas de proteínas de la matriz extracelular, incluido el colágeno, lo que conduce al desarrollo de fibrosis hepática.
La fibrosis hepática también es inducida por hepatocitos, células de Kupffer, células NK y células endoteliales . Estas células producen diversas citocinas, factores de crecimiento y componentes de la matriz extracelular que contribuyen a la fibrosis.
Las células de Kupffer producen TNF-α e IL-6, que son citocinas proinflamatorias que activan las HSC y desencadenan la síntesis de colágeno. Los hepatocitos, por otro lado, generan citoquinas y factores de crecimiento como TGF-β, PDGF y el factor de crecimiento endotelial vascular (VEGF), que también participan en la fibrosis hepática .
Cirrosis hepática
Las causas más comunes de cirrosis son la hepatitis viral (HV), la esteatohepatitis no alcohólica (NASH) y la enfermedad hepática alcohólica (ALD); Además, el carcinoma hepatocelular (CHC) se produce en el contexto de un hígado cirrótico.
La cirrosis hepática puede deberse a diversas causas etiológicas, todas las cuales acaban desencadenando procesos similares a la fibrosis hepática e impidiendo la función de los órganos . El deterioro de las células hepáticas provoca necrosis y, como medida compensatoria, se forma un material cicatricial fibrótico extracelular en las regiones de tejido necrotizado para sustituir el parénquima por nódulos de regeneración.
Las HSC desempeñan un papel central en la patogénesis de la cirrosis hepática. La activación de las HSC se produce en dos etapas.
La primera, denominada etapa de iniciación o preinflamatoria, se desencadena por los productos de la apoptosis celular, el estrés oxidativo y señales de las células de Kupffer, hepatocitos, plaquetas y células endoteliales. La segunda, la fase de perpetuación, implica proliferación celular y fibrogénesis acompañada de una notable respuesta inflamatoria.
Las metaloproteinasas, producidas principalmente por células estrelladas, desempeñan un papel crucial a este respecto.
Las metaloproteinasas de matriz (MMP) y sus inhibidores, inhibidores tisulares de metaloproteinasas, son proteínas esenciales para la descomposición de la matriz.
Su presencia en el daño hepático sugiere que la degradación regular de la matriz extracelular podría estar implicada en el desarrollo de la fibrosis.
Por lo tanto, varias MMP están asociadas con diversas etapas de la lesión hepática, como la resolución de la enfermedad, la inflamación, la fibrosis, la cirrosis y el carcinoma hepatocelular. Estas enzimas degradan la matriz extracelular y cuando la producción de estas enzimas es mayor que su tasa de degradación, la arquitectura de la matriz es reemplazada por tejido fibrótico.
La fibrosis hepática es, en última instancia, el resultado de una lesión prolongada del órgano. Los niveles elevados de citocinas, componentes de la matriz extracelular y productos de degradación contribuyen de forma acumulativa a casos graves de fibrosis, como fibrosis puente o cirrosis.
Las aplicaciones terapéuticas se han dirigido a la modulación de células inmunitarias y citocinas desreguladas, lo que eventualmente da como resultado la reabsorción del exceso de matriz degradada y, en consecuencia, revierte el daño hepático .
Microbioma intestinal.
Se sabe que las funciones hepáticas están influenciadas por el microbioma intestinal. El intestino y el hígado están conectados entre sí a través de la vena porta hepática.
La relación bidireccional entre el hígado y el intestino se conoce como eje intestino-hígado . Además de la vena porta hepática, el intestino y el hígado están conectados a través de varios otros vasos, incluidos el tracto biliar, la vena porta y la circulación sistémica.
Esta estrecha relación entre el tracto gastrointestinal y el hígado tiene un impacto significativo en el mantenimiento de la salud del hígado .
La disbiosis, que es una alteración del equilibrio de la microbiota intestinal, aumenta la permeabilidad intestinal. En consecuencia, esto hace que las endotoxinas se muevan hacia la vena porta y activen las citocinas inflamatorias en el hígado.
Estas endotoxinas actúan como patrones moleculares asociados a patógenos que se unen a receptores tipo TOR(TLR) y desencadenan una respuesta inmune innata con la producción de citocinas inflamatorias. TLR 4 se une a endotoxinas, mientras que TLR 2 se une a lipoproteínas y peptidoglicanos de bacterias gram-positivas. Las MMP y el microbioma están relacionados con la fibrosis y son esenciales para la remodelación de la matriz extracelular.
La patogénesis de la cirrosis y la función precisa del microbioma intestinal aún no están claras. Sin embargo, algunos estudios recientes han demostrado una mejora en animales inducidos por cirrosis hepática y en pacientes con cirrosis hepática mediante la modulación del microbioma intestinal.
Esto resalta la importancia de la modulación del microbioma intestinal en el tratamiento de enfermedades hepáticas, lo que sugiere enfoques novedosos para estrategias terapéuticas.
La modulación del microbioma intestinal mediante la adopción de una dieta saludable que ayude a la actividad microbiana intestinal y el trasplante de microbioma fecal de sujetos sanos para promover el crecimiento de microbios intestinales buenos puede mejorar la disbiosis en los pacientes y mejorar su pronóstico.
Ciertas bacterias liberan endotoxinas cuando mueren, lo que desencadena una respuesta inmune que provoca inflamación. Una exposición tan frecuente a las endotoxinas puede provocar una inflamación crónica del hígado.
La evidencia sugiere que el abuso de alcohol altera la composición intestinal y la permeabilidad intestinal. Los pacientes con cirrosis hepática demuestran disbiosis intestinal caracterizada por el desequilibrio de un crecimiento excesivo de Streptococcaceae y Enterobacteriaceae, que son potencialmente patógenas, y una disminución de Lachnospiraceae, que son bacterias buenas.
Papel de la bilis
A medida que avanza la cirrosis, los niveles de endotoxinas plasmáticas continúan aumentando y los ácidos biliares desempeñan un papel importante en este proceso.
Los ácidos biliares primarios son sintetizados por el hígado y se combinan con taurina o glicina para ser secretados en la bilis.
Posteriormente, la bilis sintetizada se almacena en la vesícula biliar y se transporta al intestino delgado . El microbioma intestinal genera ácidos biliares secundarios, incluidos el ácido desoxicólico y el ácido litocólico, mediante desconjugación y dihidroxilación; Estos ácidos biliares se reabsorben en la circulación enterohepática en el íleon.
Los ácidos biliares son importantes no sólo para la absorción de vitaminas y grasas dietéticas, sino también como ligandos para el receptor nuclear farnesoide X y el receptor acoplado a proteína G.
Por lo tanto, la estrecha interacción entre el intestino y el hígado puede ser un factor importante en la patogénesis del daño hepático y la progresión de la enfermedad hepática.
La cirrosis hepática es una enfermedad compleja con etiologías multifactoriales y vías de progresión de la enfermedad. Estas vías involucran citoquinas proinflamatorias, microbioma intestinal y bilis, que conducen a disfunción hepática. Varias terapias para la cirrosis hepática se dirigen a estas vías .
Enfermedades autoinmunes del hígado (AILD).
Las AILD son trastornos hepatobiliares inflamatorios crónicos que se definen clásicamente para incluir tres presentaciones clínicas distintivas: hepatitis autoinmune (HAI), colangitis biliar autoinmune (CBP) y colangitis esclerosante autoinmune (CEP).
Aunque las enfermedades hepáticas autoinmunes son raras, su carga clínica es desproporcionadamente alta en relación con su incidencia y prevalencia en la población.
La edad, el sexo y la raza también influyen en los resultados clínicos, y la morbilidad y mortalidad de los pacientes se reflejan en la alta demanda de servicios de gastroenterología, hepatología y trasplante de órganos.
Se informan cambios significativos en la epidemiología de las enfermedades, con una creciente incidencia y prevalencia de HAI y CEP en Europa y una creciente prevalencia de CBP en Europa, América del Norte y la región de Asia y el Pacífico.
Sin intervención, la AILD puede provocar complicaciones como cirrosis e insuficiencia hepática, así como carcinoma hepatocelular.
Un estudio familiar único a nivel nacional sobre pacientes diagnosticados médicamente ha destacado que la HAI tiene una asociación familiar con la CBP y otras enfermedades autoinmunes.
Afirmó que existía un alto riesgo de HAI entre cónyuges, que superaba el riesgo entre hermanos, sugiriendo la existencia de fuertes factores de riesgo ambientales. La HAI y la CBP también se asociaron con muchas otras AILD.
Esto hace que sea imperativo comprender la inmunopatología de las AILD para buscar opciones de tratamiento alternativas o no convencionales con mejores resultados.
Hepatitis Autoinmune(HAI)
La hepatitis autoinmune es una enfermedad hepática inflamatoria crónica caracterizada por niveles elevados de aminotransferasas, inmunoglobulina G (IgG), autoanticuerpos específicos y hepatitis de interfaz en la histología.
La incidencia anual de HAI se ha registrado entre 0,67 y 2,0 por 100.000, que varía según la región geográfica y el origen étnico. Como ocurre con la mayoría de las enfermedades autoinmunes, la HAI tiene preponderancia femenina.
Las células presentadoras de antígenos hepáticos (APC) presentan autoantígenos a las células T vírgenes en presencia de coestimulación, lo que conduce a respuestas inflamatorias y lesiones inmunes.
Además, el transporte de complejos antígeno-MHC mediante fagocitosis y vesículas extracelulares a través de las células contribuye a los mecanismos de respuestas autoinmunes amplificadas .
Las terapias para la HAI incluyen inmunosupresores generalizados, como corticosteroides, azatioprina, inhibidores de la calcineurina (sirolimus y tacrolimus) y micofenolato de mofetilo. La retirada de la inmunosupresión a menudo resulta en una recaída de la enfermedad y, en algunos casos, la terapia es ineficaz o está asociada con efectos secundarios graves.
El desequilibrio entre las células efectoras y reguladoras del sistema inmune permite la perpetuación y progresión del daño hepático en la HAI. Se ha informado de alteraciones en la expresión y regulación del grupo de diferenciación (CD) 39, una ectoenzima clave para el mantenimiento de la inmunotolerancia, en células Treg y células T auxiliares (Th17) efectoras derivadas de pacientes con HAI.
La interferencia con estas vías inmunorreguladoras alteradas puede abrir nuevas vías terapéuticas que, además de limitar las respuestas inflamatorias aberrantes, también reconstituirían la homeostasis inmunitaria.
Colangitis Biliar Autoinmune
La colangitis biliar primaria es una EIA colestásica caracterizada por una colangitis granulomatosa crónica, destructiva y no supurativa de los conductos biliares intrahepáticos de tamaño pequeño y mediano.
La CBA se caracteriza por la presencia de anticuerpos antimitocondriales (AMA) específicos de la enfermedad
La enfermedad es rara, con una incidencia estimada de aproximadamente 0,7 a 49 por millón por año. Se observa predominantemente en mujeres, con una preponderancia femenina de 10:1.
La CBA se desarrolla en pacientes con predisposición genética a la autoinmunidad en quienes los mecanismos epigenéticos silencian el intercambio Cl-/HCO3- tanto en colangiocitos como en células linfoides.
La función defectuosa del Intercambiador de Aniones-2 (AE-2) puede causar daño a las células epiteliales biliares (BEC) debido a la disminución de la secreción biliar de HCO3. Esto altera el paraguas alcalino protector que normalmente impide la penetración de sales biliares tóxicas y polares en los colangiocitos.
La disfunción AE2 también provoca un aumento del pH intracelular (pHi) en los colangiocitos, lo que lleva a la activación de la adenilil ciclasa soluble, que sensibiliza a los BEC a la apoptosis inducida por sales biliares. La deficiencia de AE2 puede alterar la mitofagia en las BEC, promoviendo así la acumulación de mitocondrias defectuosas, estrés oxidativo y presentación de antígenos mitocondriales a las células inmunes.
Como las mujeres poseen un medio endolisosomal más ácido que los hombres, la mitofagia podría verse más afectada en mujeres con antecedentes de AE2 defectuoso. Aparte de esto, la regulación negativa de AE2 en los linfocitos también puede contribuir a una regulación inmune alterada, facilitando respuestas autorreactivas de las células T .
La relación interactiva entre el intestino y el hígado, conocida como eje intestino-hígado, se establece mediante la vena porta, que permite el transporte de productos derivados del intestino directamente al hígado. La CBA puede cambiar el microbioma intestinal al provocar trastornos de la motilidad intestinal, trastornos inmunológicos, defectos de secreción de bilis e hipertensión portal. Los metabolitos de estas bacterias tienen importantes actividades inmunomoduladoras .
Colangitis esclerosante primaria(CEP).
La colangitis esclerosante primaria es una enfermedad progresiva del tracto biliar caracterizada por inflamación y cicatrización de los conductos biliares intrahepáticos y extrahepáticos, lo que conduce a cirrosis. Aproximadamente el 80% de los pacientes con CEP padecen enfermedad inflamatoria intestinal (EII), especialmente colitis ulcerosa autoinmune.
La CEP ocurre con mayor frecuencia en hombres y generalmente se diagnostica entre las edades de 30 y 40 años. Los factores genéticos contribuyen alrededor del 10% a la predisposición a la CEP y pueden explicar el mayor riesgo de CEP en familiares de primer grado de pacientes con CEP.
En un gran estudio de asociación de todo el genoma se han identificado más de 20 genes de riesgo predominantemente dentro del complejo HLA o asociados con la EII y otras enfermedades inmunomediadas en pacientes con CEP . Los mecanismos implicados en la patogénesis implican la exposición de ácidos biliares hidrofóbicos en los colangiocitos.
El ácido biliar es abundante en el intestino y sufre una transformación mediada por bacterias en moléculas bioactivas. Sus metabolitos controlan la respuesta inmune del huésped modulando el equilibrio de Th17 y las células T reguladoras.
Los ácidos biliares primarios y sus derivados aumentan en pacientes con CEP. Alternativamente, los colangiocitos activados se correlacionan con células madre del árbol biliar activadas que inducen fibrosis biliar y progresión del conducto biliar. TNF-α, TGF-β1, IL-1β e IL-6, junto con las células T CD8+ y CD4+, provocan activación de miofibroblastos y fibrosis.
Estos inducen el desarrollo de fibrosis peribiliar y la posterior cirrosis a través de interacciones con HSC. La lesión crónica puede conducir a la senescencia de los colangiocitos y a la diferenciación de las HSC que depositan matriz de los miofibroblastos y los fibroblastos portales, lo que produce cicatrización del tejido y estenosis de los conductos biliares.
Al ser la CEP parte de la manifestación hepatobiliar de la EII, las respuestas inmunes innatas y adaptativas derivadas del intestino contribuyen a la inflamación biliar crónica y progresiva. Los estudios sobre la fisiopatología de la CEP ampliados al análisis integrador entre la microbiota intestinal, la expresión génica y la respuesta inmunológica respaldan esta observación.
Terapias para la hepatitis autoinmune
Los tratamientos de primera línea actuales se centran en amplios agentes inmunosupresores y ácido ursodesoxicólico (UDCA), un fármaco protector biliar cuyo mecanismo de acción aún no se conoce bien . Existe una necesidad insatisfecha de mejores opciones de tratamiento con mayor eficacia en grupos difíciles de tratar, en particular pacientes pediátricos con HAI, pacientes con CBA refractaria y pacientes con CEP.
Inmunoterapia específica de antígeno: La inmunoterapia específica de antígeno se practica en el campo de la alergia desde hace más de 100 años.
El creciente interés en el desarrollo de enfoques específicos de antígenos para la inmunoterapia específica de enfermedades autoinmunes surge tras la evidencia de que el tratamiento de animales de experimentación con antígenos puede conducir a la mejora de la enfermedad.
Actualmente, estos enfoques apuntan al reconocimiento de autoantígenos por parte de las células T CD4+. Esto se debe a que las células T CD4+ controlan la generación de todos los mecanismos que dañan los tejidos asociados con la autoinmunidad, incluidos los autoanticuerpos patógenos, la inflamación impulsada por antígenos y las células T CD8+ específicas de autoantígeno.
Algunas de las inmunoterapias con antígenos específicos que se están ensayando para el tratamiento de enfermedades autoinmunes hepáticas se han revisado en otro lugar.
Terapias con células B y células T: se están investigando varias terapias novedosas para enfermedades hepáticas inmunomediadas que se dirigen directa o indirectamente al linaje de células B.
Estos tienen varios mecanismos de acción que incluyen la eliminación de las células B, la inhibición de la señalización directa de las células B a través de interacciones célula-célula y la inhibición de la señalización de las células B mediante la producción de citocinas.
Los agentes que se dirigen directamente a las células B incluyen anticuerpos monoclonales específicos para el receptor CD19. El tratamiento conduce a la eliminación de las células que expresan CD19, incluidas las células B y las células pre-B.
Los anticuerpos monoclonales alteran la interacción conjunta del receptor de superficie de las células B o de las células pre-B con receptores de otras células.
Estos incluyen la interrupción de la activación de las células T por parte de las células B presentadoras de antígenos mediante el bloqueo de la señalización CD80/86-CD28 y la supresión de las respuestas de las células B mediante la participación conjunta del receptor Fc-gamma IIb con CD19 .
Hepatitis viral
Según la Organización Mundial de la Salud (OMS), alrededor de 325 millones de personas padecen hepatitis crónica. Hay cinco cepas principales del virus de la hepatitis: A, B, C, D y E.
Cada cepa difiere en el modo de transmisión, la gravedad de la enfermedad, la distribución geográfica y los métodos de prevención.
El virus de la hepatitis A (VHA) y el virus de la hepatitis E (VHE) son responsables de una gran proporción de casos de hepatitis aguda, mientras que el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC) son las causas más comunes de hepatitis viral crónica.
El virus de la hepatitis D (VHD) es un virus satélite que requiere las proteínas de la envoltura del VHB para su liberación y absorción celular.
El sistema inmunológico innato del huésped forma la primera línea de defensa contra los virus de la hepatitis. Los virus de la hepatitis son detectados por receptores de reconocimiento de patógenos (PRR) específicos que posteriormente desencadenan la respuesta inmune innata y la producción de interferón (IFN). Sin embargo, los virus de la hepatitis evaden la vigilancia inmune del huésped a través de múltiples estrategias, que ayudan a comprometer la respuesta inmune innata y crean un ambiente favorable para la replicación viral.
Un concepto clínico importante es la severidad clínica de la de la hepatitis correlaciona con el grado de respuesta inmune al virus: a mayor respuesta inmune mayor destricción de hepatocitos y mayor severidad de la insuficiencia hepática; si la hepatitis es leve o asintomática indica que en esa persona (por sus genes de respuesta inmune) la actividad del sistema inmune contra los hepatocitos es baja.
Hepatitis A
El VHA es un virus de ácido ribonucleico (RNA) de cadena positiva dentro de la especie hepatoviral. Es un antiguo patógeno hepatotrópico perteneciente a la familia Picornaviridae que ha estado infectando a los humanos durante milenios.
El VHA se transmite principalmente, pero no exclusivamente, por vía fecal-oral y provoca epidemias. Además, es responsable de hepatitis esporádica, anictérica o ictérica. La epidemiología del VHA es compleja y está cambiando en los países que están mejorando la salud pública y el saneamiento.
Comprender los mecanismos implicados en la patogénesis de la disfunción hepática inducida por la infección por el VHA es fundamental para desarrollar nuevas terapias. Recientemente se ha implicado a los gangliósidos endosómicos como receptores esenciales del VHA.
Después de la traducción del genoma intracelular, el procesamiento y la replicación de poliproteínas, el virus genera un proceso inflamatorio mediado por el sistema inmune contra los hepatocitos infectados.
Luego, el VHA se libera en la sangre encerrado en una membrana protectora derivada del huésped denominada eHAV, que protege al virus circulante de los anticuerpos neutralizantes del huésped .
La vacunación contra el VHA es eficaz para prevenir la enfermedad . La memoria inmune contra el VHA después de la inyección de la vacuna persiste durante años.
Como se demostró con las vacunas inactivadas con formaldehído, la memoria inmune dura al menos 22 años sin necesidad de una dosis de refuerzo.
Sin embargo, los países donde el VHA es endémico deben monitorear de cerca su epidemiología y la carga de morbilidad de la hepatitis A para permitir la identificación oportuna de la transición hacia una endemicidad intermedia y la introducción de estrategias preventivas.
Hepatitis B
El VHB es un pequeño virus del ácido desoxirribonucleico (DNA); no es citopático y hepatotrópico y pertenece a la familia Hepadnaviridae. Tiene el potencial de causar una infección persistente que, en última instancia, conduce a cirrosis y carcinoma hepatocelular.
Las células inmunitarias innatas y adaptativas desempeñan funciones cruciales en el control de la infección por VHB.
Estas células también son responsables de la inflamación, que eventualmente resulta en patologías hepáticas. Durante la fase inicial de la infección por VHB, se activa la inmunidad innata, lo que lleva a la producción de citoquinas antivirales.
Posteriormente, se activa el sistema inmunológico adaptativo y sus componentes se reclutan dentro del hígado, lo que resulta en una eliminación exitosa del virus.
En la infección crónica por VHB se producen alteraciones significativas tanto en la inmunidad innata como en la adaptativa.
Estos incluyen la expansión de las células reguladoras, la sobreexpresión de receptores coinhibidores, la presencia de abundantes mediadores inflamatorios y modificaciones en la liberación y función de los exosomas derivados de las células inmunitarias.
Estas alteraciones dominan la respuesta antiviral, lo que lleva a una infección viral persistente. Siguen patologías inmunitarias posteriores asociadas con la progresión de la enfermedad y pueden presentarse como fibrosis, cirrosis y/o carcinoma hepatocelular .
El enfoque actual en el tratamiento de la infección crónica por VHB es utilizar una combinación de múltiples fármacos que incluyen un esqueleto de un análogo de nucleósido, uno o más nuevos fármacos antivirales de acción directa y al menos un inmunomodulador.
El objetivo de las vacunas terapéuticas es estimular la respuesta inmune del huésped para restaurar el control inmunológico específico del VHB mientras se suprime la replicación del VHB y, en última instancia, se induce la pérdida del antígeno de superficie de la hepatitis B (HBsAg).
Alternativamente, la inmunoterapia con vacunas e inhibidores de puntos de control puede estimular las funciones de las células T in vitro y, por lo tanto, puede usarse para revitalizar la respuesta alterada de las células T específicas del VHB.
Hepatitis C
El VHC es un miembro del género Hepacivirus de la familia Flaviviridae. Los únicos huéspedes conocidos son los humanos y los chimpancés.
El RNA del VHC adquiere mutaciones que permiten al virus escapar de la respuesta inmune del huésped, lo que contribuye a la diversidad y evolución del genoma del VHC.
La detección del VHC por células inmunitarias activa vías de señalización que producen interferones y desencadenan la respuesta inmune innata contra el virus, previniendo la replicación y propagación del VHC. A pesar de la activación inmune, el VHC puede evadir la respuesta del huésped y establecer una infección persistente.
El desarrollo actual de la vacuna contra el VHC se centra principalmente en subunidades débilmente inmunogénicas, como las glicoproteínas de superficie o las proteínas no estructurales. Se están desarrollando adyuvantes complejos que estimulan diferentes componentes de la inmunidad innata para mejorar su antigenicidad.
Se están realizando varios estudios para determinar los determinantes inmunológicos contra la eliminación, la persistencia y la inmunidad protectora viral . El objetivo de una vacuna eficaz es aumentar las respuestas inmunitarias humorales para inducir anticuerpos ampliamente neutralizantes que protejan contra la infección por VHC .
Hepatitis D
El virus de la hepatitis delta (VHD) es un patógeno humano y es la única especie conocida del género Deltavirus.
Es un virus de RNA satélite que depende del VHB para su propagación. Utiliza HBsAg como envoltura viral y comparte el mismo receptor de hepatocitos para la entrada viral.
El VHD se encuentra entre los virus más pequeños capaces de causar enfermedades humanas; sin embargo, la coinfección por el VHB y el VHD es la forma más grave de hepatitis viral. Alrededor del 5% de las personas infectadas por el VHB han experimentado la infección por el VHD, con mayor prevalencia en determinadas áreas geográficas y poblaciones.
Las respuestas inmunes innatas que inducen IFN son los principales mediadores de la contención temprana de la replicación viral.
Los pacientes coinfectados por VHB/VHD no tratados tienden a tener frecuencias de células NK periféricas aún mayores que los pacientes con otras infecciones por el virus de la hepatitis.
Los anticuerpos anti-VHD son detectables en títulos bajos en la infección por VHD de resolución aguda, pero en títulos más altos en la infección persistente. En pacientes con hepatitis activa, la inmunoglobulina M (IgM) anti-VHD a menudo persiste en títulos elevados .
El criterio de valoración ideal para cualquier terapia anti-VHD sería la pérdida de HBsAg con seroconversión anti-HBs.
La eliminación del RNA del VHD en replicación del hígado se demuestra realizando la reacción en cadena de la polimerasa (PCR) en muestras de suero o plasma al menos 24 semanas después de la interrupción del tratamiento. Los nuevos enfoques terapéuticos incluyen el uso de RNA de interferencia y oligonucleótidos antisentido, que conducen a una disminución sustancial de los niveles de HBsAg después de unas semanas de administración en ausencia de interferón pegilado (peg-IFN) .
Hepatitis E
El VHE es un virus de RNA monocatenario, pequeño, sin envoltura y de sentido positivo. Está clasificado como una especie de Orthohepevirus A en el género Orthohepevirus. Es una de las principales causas de hepatitis viral aguda en todo el mundo.
La infección se transmite por vía fecal-oral a través de agua contaminada y suele ser asintomática o autolimitada en la población general. Sin embargo, la infección aguda en mujeres embarazadas puede causar resultados clínicos graves, incluida insuficiencia hepática fulminante con una alta tasa de mortalidad que alcanza hasta el 20% -30%.
Revisiones recientes han propuesto ocho genotipos y 36 subtipos que infectan a los mamíferos, siendo los genotipos 1-4 una causa importante de enfermedad en humanos .
La respuesta inmune del huésped inducida por el VHE es un mecanismo importante que conduce a la lesión citopática hepática.
El análisis de las células mononucleares de sangre periférica (PBMC) de pacientes con VHE mostró que la cantidad de células NK y NKT en estos pacientes era significativamente menor que la del grupo de control sano, pero la cantidad de células NK y NKT activadas en estos pacientes era significativamente mayor que en el grupo de control sano.
El aumento en el número de células ilustra la posible infección aguda por VHE porque las células NK y NKT activadas podrían migrar desde la sangre periférica para infiltrarse en el hígado y desempeñar un papel en la destrucción de los virus en el hígado.
La regulación positiva de IFN-γ y TNF-α en el hígado de pacientes con insuficiencia hepática crónica aguda por el virus de la hepatitis E (HEV-ACLF) no se ve compensada por la IL-10 y el desequilibrio de las expresiones de citoquinas proinflamatorias y antiinflamatorias. Las citocinas en el hígado de los pacientes son el mecanismo inmunológico importante de la lesión hepática por HEV-ACLF.
El tratamiento con ribavirina durante un período de tres meses es el fármaco de elección para la hepatitis aguda grave, la insuficiencia hepática crónica aguda y las infecciones crónicas por el virus de la hepatitis E en pacientes inmunocomprometidos que no responden a una inmunosupresión reducida. El interferón α pegilado se utiliza en pacientes con trasplante de hígado resistentes a ribavirina y con hepatitis E crónica. Actualmente hay disponible en China una vacuna contra el VHE .
Papel de los inmunomoduladores en las estrategias de curación funcional de la hepatitis
Un desafío importante en el desarrollo de terapias contra la hepatitis viral es superar la respuesta inmune sesgada específica del virus debido a décadas de infecciones crónicas por hepatitis . Los análogos de nucleos(t)ide son muy eficaces para reducir la carga viral y resolver el daño hepático, lo cual es importante en la progresión de la enfermedad, pero no se dirigen al DNA. Estos agentes no logran la curación. Se requiere la activación de la respuesta inmune antivirus para un control viral eficaz, lo que se ha demostrado en el curso natural de la infección por hepatitis.
Hay cuatro categorías principales de estrategias de tratamiento actualmente en desarrollo .
- Vacunas terapéuticas que se dirigen a las respuestas de las células T y B específicas de los virus.
- Inmunomoduladores innatos que se dirigen a receptores de reconocimiento de patrones como los receptores tipo Toll (TLR), el estimulador del gen del interferón (STING) y el gen I inducible por ácido retinoico (RIG-I).
- Inhibidores de puntos de control.
- Las inmunoterapias consisten en anticuerpos monoclonales anti-HBs. Estos tienen el potencial de unirse al antígeno HBs circulante en el suero y potencialmente dirigirlo a las células inmunes, como las células dendríticas, monocitos y macrófagos, que podrían usarlo para estimular las respuestas de las células T y B .
Conclusión
Las enfermedades relacionadas con el hígado causan una morbilidad y mortalidad significativas. Hemos detallado los avances recientes en la comprensión de las funciones hepáticas normales y la patogénesis inmune de las enfermedades hepáticas en fibrosis, cirrosis, enfermedades autoinmunes y enfermedades infecciosas.
Los mecanismos multifactoriales involucran varios aspectos de las respuestas inmunes innatas y adaptativas mediadas por citoquinas inflamatorias y reguladoras e interacciones receptor-ligando.
Estos inducen la activación de vías de transducción de señales específicas y culminan en la transcripción de genes.
Comprender estos mecanismos inmunorreguladores en la patogénesis de la fibrosis hepática, la cirrosis y las enfermedades autoinmunes es fundamental para desarrollar nuevas terapias. Para comprender las características de la salud y mantener un estilo de vida saludable, hemos revisado los avances recientes en la inmunología del hígado, con énfasis en el funcionamiento del hígado normal y la patogénesis de la fibrosis, la cirrosis, las enfermedades autoinmunes y la hepatitis viral.
La acumulación de investigaciones ha indicado la asociación del eje intestino-hígado con la patogénesis de las enfermedades hepáticas. Algunos ensayos clínicos de fase 3 están abordando la extrema necesidad de tratamientos novedosos. Existe una oportunidad para utilizar inmunoterapias, terapias celulares y genéticas y terapias basadas en biología sintética para atacar patologías basadas en el eje hígado-intestinal y potencialmente revertir la patogénesis del hígado, dado el potencial regenerativo de este órgano.
Es necesario realizar estudios longitudinales mediante la recopilación de estudios de asociación de todo el genoma (GWAS), mediciones multiómicas y de alta dimensión para guiar las terapias personalizadas.