Ronald Palacios Castrillo
La esclerosis múltiple (MS) es el trastorno desmielinizante crónico más común del sistema nervioso central (SNC) y afecta a alrededor de 2,8 millones de personas en todo el mundo.
El curso de esta enfermedad es muy impredecible, probablemente impulsado por el impacto de señales genéticas y ambientales en el sistema inmunológico.
Aunque el éxito del tratamiento anti-CD20 y el papel del virus de Epstein-Barr (EBV) sitúan a las células B como impulsoras periféricas clave de la MS, no sabemos cuáles y cómo subconjuntos se ven alterados por tales señales para entrar y producir anticuerpos en el SNC. Ingelfinger,et.al., (MED.2024.https://doi.org/10.1016/j.medj.2024.02.013) demuestra la presencia de células B CXCR3+ en la circulación como una característica no hereditaria de la MS, que posiblemente sea el resultado de una infección previa por EBV, y proporcionan una nueva perspectiva sobre la heterogeneidad de la enfermedad que puede respaldar aún más el desarrollo de métodos predictivos más refinados y estrategias terapéuticas.
=> Recibir por Whatsapp las noticias destacadas
Resumen
En la esclerosis múltiple (MS), las células B se consideran los principales desencadenantes de la enfermedad, probablemente como resultado de una interacción compleja entre factores de riesgo genéticos y ambientales. Los estudios sobre gemelos monocigóticos discordantes para la MS ofrecen una forma única de reducir esta complejidad y revelar subconjuntos discrepantes.
Métodos
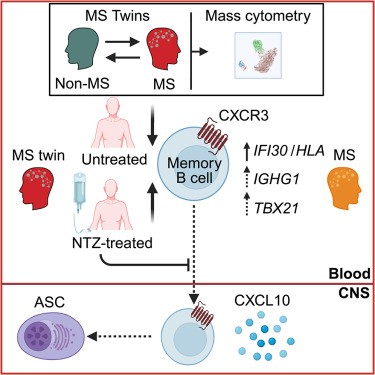
En este estudio, Ingelfinger y colegas analizaron subconjuntos de células B en muestras de sangre de gemelos monocigóticos con y sin MS utilizando datos disponibles públicamente.
Verificaron las características funcionales explorando el papel de la terapia y realizaron análisis separados en individuos no relacionados.
Las frecuencias de las células B de memoria CXCR3+ se redujeron en la sangre de gemelos genéticamente idénticos con MS en comparación con sus hermanos gemelos no afectados. Natalizumab (anticuerpo anti-VLA-4) fue el único régimen de tratamiento bajo el cual estas frecuencias se revirtieron. Las características de localización del SNC de las células B de memoria CXCR3+ fueron respaldadas por niveles elevados de CXCL10 en el líquido cefalorraquídeo de la MS y su propensión in vitro a convertirse en células secretoras de anticuerpos.
Conclusiones
Las células B de memoria CXCR3+ circulantes se ven afectadas por señales no hereditarias en personas que desarrollan MS.
Esto subraya la necesidad de factores de riesgo ambientales, como el virus de Epstein-Barr(EBV), para activar estas células B. Ingelfinger y colegas proponen que después de la entrada mediada por CXCL10 en el SNC, las células B de memoria CXCR3+ maduran y se conviertan en células secretoras de anticuerpos para impulsar la MS.
En Detalle
Cada vez se reconoce más que las células B que expresan el factor de transcripción T-box T-bet participan en las respuestas antivirales y la autoinmunidad.
La función efectora final de estas células B no sólo depende de su especificidad sino que también está determinada por su programa de diferenciación y su capacidad de infiltración tisular.
En personas con esclerosis múltiple (MS), las células B T-bet+ se diferencian en subconjuntos CXCR3+, que son propensos a infiltrarse y madurar en células secretoras de anticuerpos en el sistema nervioso central (SNC).
Esto evidentemente difiere de los individuos afectados por otras enfermedades autoinmunes, como el lupus eritematoso sistémico, en el que los (auto)anticuerpos son producidos por células B T-bet+ en la periferia.
En la MS, las células B periféricas están directamente influenciadas por impulsores genéticos y factores de riesgo ambientales (p. ej., Epstein- Barr [EBV]), que probablemente definen su diferenciación y función efectora. Los agentes que agotan las células B han sido muy eficaces en el tratamiento de la MS, aunque la comprensión funcional de su contribución a la enfermedad sigue siendo en gran medida enigmática. Por lo tanto, discernimos genéticamente predisposición por efectos no hereditarios relacionados con la enfermedad en el compartimento de células B circulantes en pares de gemelos monocigóticos discordantes para la MS.
El estudio de las células B de 57 pares de gemelos discordantes para la MS reveló que las células B de memoria CXCR3+ están cableadas por señales no hereditarias en la MS que promueven la migración al SNC y la posible diferenciación en células secretoras de anticuerpos.
Un factor importante de la enfermedad podría ser la infección por EBV, que no solo es un requisito previo para desarrollar MS en individuos genéticamente susceptibles sino que también corresponde positivamente a la expresión de CXCR3 en células B de memoria en individuos con MS. Como mecanismo subyacente, el EBV se ha propuesto como un regulador transcripcional de loci de riesgo para la MS y otras enfermedades autoinmunes, que pueden moldear el desarrollo y la función de las células B CXCR3+ incluso de una manera independiente de T-bet. Siendo la edad el principal factor de riesgo para progresar la enfermedad de MS, se podría esperar que estos tipos de células B se acumulen lentamente y se conviertan en células secretoras de anticuerpos dentro del SNC para eventualmente contribuir a la patología de la MS.
Este estudio carece de muestras de LCR para comparar los niveles de CXCL10 entre pares de gemelos discordantes para la MS. Además, la reducción observada en las frecuencias de las células B de memoria CXCR3+ circulantes en gemelos con MS (y la reversión después del tratamiento con natalizumab) respalda claramente, pero no necesariamente solidifica, el impacto de las señales no hereditarias en el reclutamiento y la maduración de este subconjunto de células B dentro del SNC. Las correlaciones entre LCR CXCL10 y las células B de memoria CXCR3+ circulantes en gemelos con MS versus gemelos sin MS habrían fortalecido esta noción.
Este estudio se habría enriquecido aún más si se hubieran tomado muestras de sangre de gemelos con MS antes y después del tratamiento modificador de la enfermedad, incluido natalizumab, y si se hubieran incluido muestras de sangre de gemelos sanos. A pesar de las similitudes genéticas, el grupo de estudio es representativo de la población total de MS (p. ej., 3:1 mujer:hombre), para la cual se utilizaron como criterios de exclusión la infección y el tratamiento con antibióticos y esteroides.