Ronald Palacios Castrillo
Resumen
La esclerosis múltiple (EM) es una enfermedad neurológica caracterizada por lesiones multifocales y patología latente. Aunque los análisis unicelulares proporcionaron información sobre la citopatología, los procesos celulares en evolución que subyacen a la EM siguen siendo poco conocidos.
Los autores investigaron la dinámica celular de la EM modelando tasas temporales y regionales de progresión de la enfermedad en encefalomielitis autoinmune experimental (EAE) en ratones.
Al realizar perfiles de expresión espacial unicelulares mediante secuenciación in situ (ISS), anotaron los vecindarios de enfermedades y encontraron una evolución centrífuga de las lesiones activas. Demostraron que la glía asociada a la enfermedad (DA) surge independientemente de las lesiones y se induce y resuelve dinámicamente a lo largo del curso de la enfermedad.
El mapeo espacial unicelular de la médula espinal de EM de archivo humano confirmó la distribución diferencial de la glía homeostática y DA, permitió la deconvolución de lesiones activas e inactivas en subcompartimentos e identificó nuevas áreas de lesión. Al establecer un recurso espacial de la neuropatología de la EM humana y de ratón con una resolución unicelular, este estudio revela la intrincada dinámica celular subyacente a la EM.
La esclerosis múltiple (EM) es una enfermedad compleja de etiología multifactorial y patología de las lesiones poco claras. Las lesiones, definidas por inflamación, gliosis, desmielinización y/o neurodegeneración, afectan la materia blanca y gris (SB y GM) del sistema nervioso central (SNC).
Su distribución y composición varían entre los pacientes y dentro de ellos, y su localización a menudo refleja los síntomas clínicos, lo que contribuye a una alta heterogeneidad clínica. Algunos pacientes desarrollan lesiones predominantemente o limitadas a regiones específicas, como la médula espinal, lo que sugiere la influencia del microambiente tisular en la especificación de la enfermedad.
Los enfoques inmunohistoquímicos tradicionales estratifican las lesiones en diferentes categorías, por ejemplo, activas, mixtas activas/inactivas e inactivas con o sin desmielinización o remielinización en curso.
Sin embargo, nuestra comprensión de las lesiones y la citopatología de la EM se basa en el tejido recolectado casi invariablemente en las etapas finales de la enfermedad, lo que dificulta la exploración de la evolución de la enfermedad. Se cree que la inflamación focal, impulsada por la infiltración inmune periférica, gobierna la neuropatología de la EM y el curso de la enfermedad.
Sin embargo, es necesaria una caracterización cronológica completa de las lesiones en diferentes cohortes de pacientes para dilucidar estos eventos.
El auge de las tecnologías de secuenciación de RNA unicelular y de un solo núcleo (RNA-seq) ha descubierto respuestas transcripcionales diferenciales dentro de poblaciones de neuronas, glía y células vasculares, en tejido de archivo humano de EM y su modelo de ratón más utilizado , encefalomielitis autoinmune experimental (EAE).
La microglía, los astrocitos (Astros) y la oligodendroglia (OLG) exhiben perfiles transcripcionales altamente heterogéneos, con distintos estados asociados a enfermedades (DA) que surgen en respuesta a la inflamación.
Por ejemplo, los DA-OLG expresan un complejo mayor de histocompatibilidad (MHC) de clase I y II, fagocitan la mielina y activan las células T mediante la presentación de antígenos en modelos de ratón con EM. Sin embargo, aún no está claro si la DA-glia desempeña funciones perjudiciales o neuroprotectoras en la etiología y progresión de la EM.
Determinar sus abundancias genuinas, distribuciones espaciales e interacciones entre células a lo largo de la enfermedad es clave para comprender sus funciones.
Para cerrar esta brecha, recientemente se implementó la transcriptómica espacial (ST) en muestras de tejido cerebral de EM post mortem. Aunque la ST es una plataforma incomparable para desentrañar la arquitectura tisular y las vías moleculares alteradas en la EM, la resolución actual (50 μm) no ha alcanzando el nivel unicelular.
La integración de ST con conjuntos de datos scRNA-seq para la deconvolución celular plantea desafíos en la investigación de paisajes celulares y interacciones basadas en proximidad.
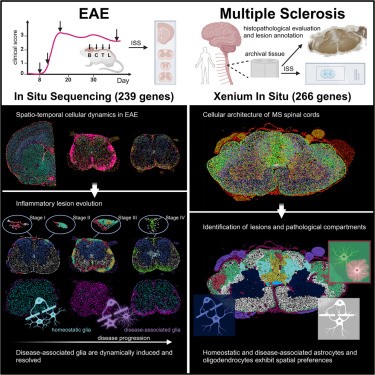
Aquí, los investigadores utilizaron la secuenciación in situ (ISS) con el kit CartaNA de alta sensibilidad (ahora parte de 10× Genomics) para caracterizar la dinámica celular espaciotemporal que subyace a la evolución de la EAE.
La resolución espacial subcelular les permitió mapear la dinámica de las interacciones entre células y establecer la secuencia de eventos celulares durante el desarrollo de la lesión de EAE. Un análisis adicional aclaró la compartimentación de la lesión definida temporalmente y la evolución centrífuga de la lesión.
Además, encontraron que los estados de DA-glial se inducen dinámicamente, no se limitan a las áreas de lesión y se resuelven de manera diferencial a lo largo de la EAE. Correlacionaron sus hallazgos con la citopatología de la EM humana de la médula espinal cervical post mortem, evaluada con la plataforma Xenium In Situ.
Pudieron identificar compartimentos patológicos de composición distinta, lo que demuestra una mayor precisión en la caracterización de las lesiones de EM en comparación con la evaluación neuropatológica.
Finalmente, descubrieron preferencias espaciales de homeostática y DA-glia dentro de muestras de médula espinal humana, alineadas con sus observaciones en ratones. Con este estudio, complementado con una plataforma de recursos interactiva (https://tissuumaps.scilifelab.se/2023_spinal_brain.html), demostraron cómo se puede aplicar la transcriptómica in situ resuelta celularmente para generar conocimientos novedosos sobre la EM y otras patologías.
La EAE se caracteriza por una evolución de la enfermedad de caudal a craneal. Los investigadores proporcionan un mapeo detallado del progreso inflamatorio en las regiones del SNC y las etapas de la enfermedad e identificaron cómo los diferentes entornos inflamatorios dan forma a los paisajes celulares.
De acuerdo con trabajos anteriores, demostraron que el cerebro del pico de EAE ejemplifica una inflamación leve y una patología tisular temprana. Por el contrario, las médulas espinales lumbares pico son las más inflamadas y afectadas por lesiones con arquitectura compleja.
Estas lesiones complejas se componen de tres compartimentos y son menos prevalentes en las regiones craneales, donde son más abundantes las lesiones con uno o dos compartimentos.
Dada la distinta distribución temporal y caudal-craneal de los tipos de lesiones, se propone un modelo de evolución de la lesión neuroinflamatoria que involucra los siguientes pasos : (1) infiltración de células inmunes, (2) formación de un PLC con una concentración focal de células periféricas inmunes y DA-glia (lesión en estadio I), (3) desarrollo de una lesión compuesta dual, donde el PLC en su núcleo pasa al LRC tras un aumento inflamatorio (lesión en estadio II), (4) desarrollo de una multi- Lesión de arquitectura compleja compuesta donde el LCC (densamente agregado por las células inmunes y algo de microglía DA) se forma en el centro y está rodeado por el LRC, y el PLC más externo (lesión en estadio III), y (5) resolución de la inflamación, reflejada en Formación de lesiones tardías, compuestas principalmente de DA-glia (lesión en estadio IV).
El borde de lesión paramagnética se asocia con un mal resultado de progresión de la EM y se ha recapitulado en el modelo EAE . El PLC y el LRC identificados surgieron en las primeras lesiones de EAE y se relocalizaron en el borde de las lesiones activas completamente desarrolladas.
Por lo tanto, los vecindarios celulares patológicos tempranos podrían tener una composición similar al borde de la lesión paramagnética, pero no pueden capturarse mediante resonancia magnética debido a la ausencia de hierro.
Queda por determinar qué desencadena la deposición de hierro en las últimas etapas dentro de estos vecindarios. Sería interesante investigar si estos vecindarios portan otros biomarcadores en etapas patológicas anteriores.
Las diferentes partes del SNC se comportan como microambientes únicos con diversas susceptibilidades a la infiltración inmune y, posiblemente, distintas respuestas celulares a la inflamación. Los autores encontraron preferencias regionales en la inducción de la patología EAE .
En el cerebro, observaron infiltrados inmunes en el CC medial y la zona ventricular, lo que sugiere que llegan al cerebro con líquido cefalorraquídeo (LCR) infiltrándose en los ventrículos. También observaron inflamación dentro y adyacente a las meninges, especialmente en ubicaciones ventrales, lo que sugiere una vía de administración alternativa.
Dentro de la médula espinal, la inflamación temprana no muestra preferencias dorsal-ventrales claras . Sin embargo, las lesiones afectan consistentemente ciertas regiones de la médula espinal y persisten durante la etapa tardía de la EAE en ubicaciones específicas, incluida la WM ventral superficial, la columna dorsal donde se ubican los tractos ascendentes y las regiones contralaterales donde discurren los tractos rubroespinales descendentes.
Es de destacar que, aunque este enfoque permitió la detección de cambios patológicos encubiertos más allá de la formación de lesiones, no se detectaron compartimentos patológicos dentro del GM.
En consecuencia, el GM en la EAE (pero no en la EM) podría transmitir señales inhibidoras que impidan la expansión de las lesiones por todo su parénquima. El MOL2 enriquecido con WM puede ser más propenso a ser atacado por la enfermedad, lo que conduce a lesiones desmielinizadas de WM, mientras que el MOL5/6 enriquecido con GM podría tener mecanismos inmunoprotectores.
La glía adquiere estados de DA en EAE y EM, posiblemente a través de mecanismos que involucran a las células T productoras de IFN-gamma.
Se establece que la DA-glia emerge localmente en respuesta a la inflamación temprana mediante la identificación de interacciones prominentes de Células T y DA-glia dentro del cerebro EAE . A medida que la inflamación se potencia, la glía se ve afectada globalmente y adquiere perfiles transcripcionales de DA en toda la médula espinal, independientemente de la carga de la lesión.
La activación de macrófagos y microglia se ha observado previamente y se ha caracterizado transcripcionalmente también fuera de las lesiones dentro del parénquima de apariencia normal. Por lo tanto, la DA-glia puede surgir independientemente de las lesiones, posiblemente antes de su formación. Además, los subtipos de DA-glia comúnmente se localizan conjuntamente, lo que indica posibles interacciones funcionales o su capacidad para regular de forma cruzada los estados de DA.
Durante el desarrollo normal, la ausencia de microglía homeostática puede provocar hipermielinización aguda e inducción de oligodendrocitos DA que expresan Serpina3n y C4b. Por lo tanto, la conversión persistente de microglia en DA-microglia puede estar asociada con la inducción de oligodendrocitos DA y, en última instancia, puede contribuir a la desmielinización de EAE.
En la inducción de la DA-glial podrían estar implicados mecanismos alternativos independientes del contacto celular. Lassmann y sus colegas proponen dos patrones distintos de inflamación en la EM: uno impulsado por factores solubles de los infiltrados meníngeos, que da lugar a lesiones corticales activas, y el otro que conduce a lesiones de expansión lenta impulsadas por factores solubles de los espacios perivasculares. Además, las venas centrales se asociaron con lesiones de EM definidas por resonancia magnética, se han detectado niveles elevados de citocinas en el suero y el LCR de pacientes con EM, y recientemente se demostró que las proteínas sanguíneas activan la microglía en el contexto de la EAE.
Los datos sugieren que los infiltrados inmunes, ya sea acumulados localmente o penetrando profundamente en la médula espinal, particularmente en el pico de EAE , podrían mediar los estados de DA-glial a través de la secreción de citocinas u otros factores en el parénquima. Además, en esta inducción también podrían participar factores solubles del plasma y/o del LCR tras su difusión a través de la BHE.
Las definiciones de enfermedad remitente-recurrente y progresiva han sido debatidas ya que la progresión no se correlaciona completamente con la carga de lesión definida por resonancia magnética.
La progresión independiente de la actividad de recaída (PIRA) se produce ya en las primeras etapas de la enfermedad, también en pacientes remitentes-recurrentes, y el curso latente de la enfermedad puede ocurrir en paralelo a la formación de lesiones. La DA-glia detectada dentro del cerebro EAE y su distribución en todo el parénquima de la médula espinal, también en las regiones cervicales pico y lumbares tempranas privadas de lesiones , se alinean con estos conceptos.
En las últimas tres décadas, avances significativos en el tratamiento de la EM mejoraron los resultados de los pacientes con recaídas-remitentes, pero abordar la EM progresiva sigue siendo un desafío.
El presente estudio proporciona información sobre la dinámica de la evolución de la enfermedad de EM, desvinculando la neuropatología global de la evolución de las lesiones y descubriendo vías celulares y moleculares que pueden constituir nuevos objetivos para las terapias de EM.