Patrones de mutación somática contrastantes en neuronas y oligodendrocitos humanos que envejecen
Resumen
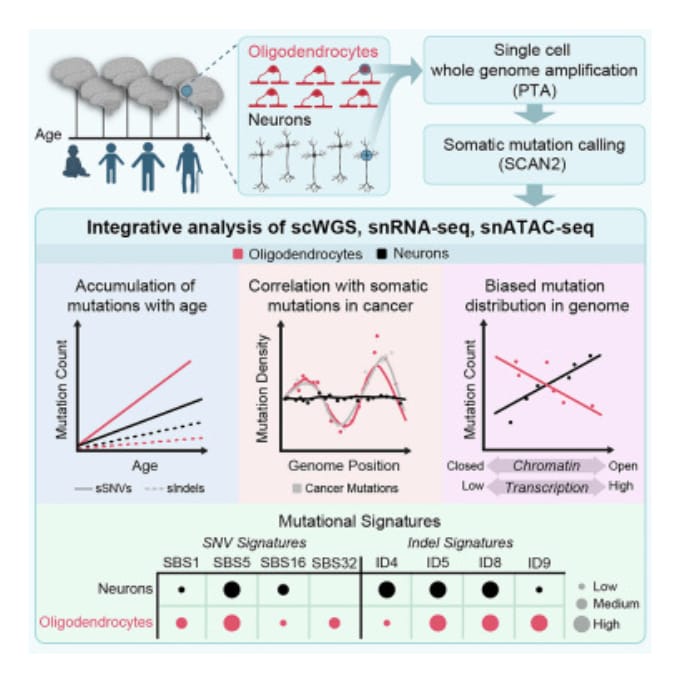
Caracterizar las mutaciones somáticas en el cerebro es importante para desentrañar los complejos mecanismos del envejecimiento, pero se sabe poco sobre los patrones mutacionales en diferentes tipos de células cerebrales. Aquí, los investigadores realizaron la secuenciación del genoma completo (WGS) de 86 oligodendrocitos individuales, 20 glías mixtas y 56 neuronas individuales de individuos neurotípicos que abarcan entre 0,4 y 104 años de edad e identificaron >92 000 variantes somáticas de un solo nucleótido (sSNV) e inserciones pequeñas eliminaciones (indeles). Aunque ambos tipos de células acumulan mutaciones somáticas linealmente con la edad, los oligodendrocitos acumularon sSNV un 81% más rápido que las neuronas y los indeles un 28% más lento que las neuronas. La correlación de las mutaciones con los perfiles de RNA de un solo núcleo y la accesibilidad a la cromatina de los mismos cerebros reveló que las mutaciones de los oligodendrocitos se enriquecen en regiones genómicas inactivas y se distribuyen por todo el genoma de manera similar a las mutaciones en los cánceres de cerebro. Por el contrario, las mutaciones neuronales se enriquecen con cromatina abierta y transcripcionalmente activa.
Las mutaciones somáticas se acumulan en todos los tejidos del cuerpo humano a lo largo de la vida, a través de mecanismos que dependen de la fisiología intrínseca del tejido y de agentes exógenos. Debido a que los tejidos humanos comprenden diversos tipos de células con propiedades únicas, se cuantifican las tasas específicas de cada tipo de célula. y los mecanismos de mutación somática es fundamental para comprender el envejecimiento y el inicio de la enfermedad a nivel tisular. Aunque estudios anteriores han abordado las mutaciones somáticas en las neuronas humanas que envejecen, aún no se han examinado las mutaciones en las células gliales, que representan más de la mitad del contenido celular del cerebro y desempeñan funciones principales en varios trastornos cerebrales.
Los oligodendrocitos (OL) son el principal tipo de células de la sustancia blanca (SB), cuya degeneración se considera un sello distintivo del envejecimiento cerebral normal y de los trastornos neurodegenerativos. Un estudio multiómico reciente en ratones informó un envejecimiento glial acelerado en regiones corticales, lo que implica a la WM como focos vulnerables durante el envejecimiento. Se han informado anomalías en los OL en trastornos psiquiátricos y relacionados con la edad, tumores cerebrales derivados de la glía y esclerosis múltiple relacionada con el sistema inmunológico. La generación de OL en humanos comienza durante el primer trimestre de la gestación, alcanza su punto máximo en el nacimiento y durante los primeros años de vida, y continúa hasta la edad adulta, aunque a un ritmo reducido con la edad. La desregulación de la proliferación y diferenciación en el linaje OL está involucrada en el cáncer cerebral, y las OPC se reconocen como la célula de origen en algunos gliomas. Por lo tanto, a diferencia de las neuronas, las OL pueden estar sujetas a procesos mutacionales relacionados a la replicación del DNA y potencialmente puede sufrir una selección positiva relevante para la aparición del cáncer. De acuerdo con esta noción, hallazgos recientes han demostrado mutaciones oncogénicas clonales enriquecidas dentro de la MT de cerebros humanos no enfermos.
En este estudio, los investigadores evaluaron las tasas y patrones de mutaciones somáticas relacionadas con el envejecimiento en todo el genoma en OL en comparación con neuronas aisladas de los mismos individuos mediante secuenciación del genoma completo unicelular (scWGS). Además, generaron un ensayo de un solo núcleo para cromatina accesible a transposasa con datos de secuenciación (snATAC-seq) de estos cerebros e integraron datos de secuenciación de RNA de un solo núcleo (snRNA-seq) nuevos y publicados de individuos de la misma cohorte . Con el análisis conjunto de estos datos, los autores infirieron tasas y patrones de acumulación de mutaciones somáticas específicos de OL y de neuronas, y la replicación y transcripción del DNA desempeñan papeles importantes en la OL y la mutagénesis neuronal, respectivamente. También encontraron características de procesos mutacionales en los OL diferenciados, así como en los OPC precursores. Es probable que las diferencias sustanciales en la tasa de mutación somática y la localización entre estos dos tipos de células adyacentes e interactuantes sean vitales para dilucidar las contribuciones específicas de cada tipo de célula a las enfermedades relacionadas con la edad.
El análisis integrador de mutaciones somáticas descubrió procesos mutacionales específicos de OL durante el envejecimiento en comparación con las neuronas; Además, las similitudes entre las ubicaciones enriquecidas de las mutaciones OL y las mutaciones cancerosas en el genoma sugieren que los procesos mutagénicos de OL pueden estar relacionados con el inicio o la progresión del cáncer. El diseño de este estudio brinda la oportunidad de explorar cómo diferentes tipos de células que comparten el mismo microambiente durante años, o incluso décadas, pueden exhibir características mutacionales contrastantes. Una ventaja adicional de este diseño es que la comparación de OL y neuronas que utilizan la misma tecnología de secuenciación de DNA unicelular ayuda a descartar la posibilidad de que las tasas de mutación diferenciales o las distribuciones genómicas reflejen artefactos técnicos o una representación sesgada de regiones genómicas específicas.
La carga de mutaciones somáticas aumenta linealmente tanto en los OL como en las neuronas con la edad; sin embargo, los OL acumulan un 81% más de sSNV y un 28% menos de indeles que las neuronas. La tasa de indel aparentemente más baja en los OL puede reflejar una alta tasa de mutagénesis de indel en las neuronas en comparación con otros tipos de células, como lo informaron estudios anteriores. Aunque algunos de los excesos de sSNV en los OL (p. ej., los atribuidos a SBS1) probablemente estén asociados con la división celular en los OPC ancestrales, no está claro qué procesos biológicos explican el exceso de carga restante de sSNV en los OL. Un estudio reciente destacó la importancia de las fuentes de mutaciones somáticas independientes de la proliferación celular en células normales y planteó la hipótesis de que la interacción entre el daño del DNA específico del tipo de célula y los procesos de reparación puede subyacer a las diferencias en la carga de mutaciones entre los tipos de células. Por lo tanto, los procesos de reparación del DNA menos eficientes en los OL, en lugar de daños adicionales en el DNA, pueden ser una explicación plausible para el exceso de carga de sSNV de OL en comparación con las neuronas. Se necesitan estudios de seguimiento que mapeen los sitios de reparación del DNA en OL frente a neuronas para abordar esta cuestión.
El análisis de firmas mutacionales fue útil para identificar algunos factores que contribuyen a la carga mutacional general y a su acumulación a lo largo del tiempo. La mutagénesis OL se caracterizó principalmente por SBS1, SBS5 y SBS32, mientras que las neuronas exhibieron principalmente SBS5 y SBS16. SBS1 era prevalente en OL y casi ausente en las neuronas, lo que coincide con caracterizaciones previas de SBS1 como un reloj mutacional dependiente de la división celular, pero en desacuerdo con un estudio reciente que estimó una tasa de SBS1 casi 10 veces mayor en neuronas humanas. SBS5 representó la mayoría de las mutaciones tanto en OL como en neuronas, pero se acumuló a tasas significativamente diferentes (14,5 frente a 22,7 sSNV/año en neuronas y OL, respectivamente) y en diferentes áreas del genoma en los dos tipos de células. Una explicación atractiva para esto es la reparación diferencial: el daño al DNA asociado a SBS5 puede ocurrir en todo el genoma, pero repararse de manera más eficiente en ciertas regiones genómicas de una manera específica para el tipo de célula. Sin embargo, las mediciones de la exposición a SBS5 pueden reflejar una deconvolución incompleta de SBS5, como se representa en el catálogo COSMIC actual. Por ejemplo, debido a que las firmas COSMIC fueron generadas principalmente por exomas y genomas de cáncer, es probable que las firmas presentes en las células postmitóticas estén subrepresentadas. Además, a pesar de las docenas de células individuales que se secuenciaron, el número total de mutaciones no es lo suficientemente grande como para identificar con seguridad firmas que están presentes en exposiciones bajas.
Los OL maduros capturan mutaciones acumuladas tanto en los OPC ancestrales (que continúan proliferando durante toda la vida, aunque a tasas más bajas que en el desarrollo temprano) como en los OL terminalmente diferenciados. El análisis de sSNV compartidos en pares OL sugiere que los primeros procesos mutagénicos en OPC presentan fuertemente SBS1, pero que procesos similares a SBS5 emergen más adelante en la vida. El SBS1 elevado en la población de glía mixta amplificada con MDA también apunta a que SBS1 es una característica de las OPC, a pesar de que sólo ~58% de esta población clasificada son OPC (es poco probable que este aumento en SBS1 se explique por diferencias en la amplificación de PTA y MDA porque SBS1 los niveles fueron similares en OL amplificados con MDA y OL con PTA). La mutagénesis específica de OPC también sugiere un papel más importante de las fuerzas selectivas durante el envejecimiento en los OL. Aunque las neuronas que envejecen y no proliferan no pueden estar sujetas a una selección positiva, y la selección negativa probablemente se limita a mutaciones altamente nocivas que inducen la muerte celular, las mutaciones observadas en las OL pero obtenidas en los ancestros OPC están sujetas a efectos selectivos tanto positivos como negativos. Por lo tanto, el subconjunto de mutaciones somáticas OL adquiridas en la etapa OPC ancestral, que pueden expandirse clonalmente y amplificar los efectos nocivos, son de particular importancia. Aunque las implicaciones de esto aún no están claras, pueden resultar pertinentes para patologías específicas del tipo de célula relacionadas con la edad en el cerebro humano.
Las mutaciones OL son más prevalentes en cromatina transcripcionalmente inactiva y/o inaccesible. Las mutaciones OL también se parecen a los patrones observados en el cáncer (incluidas firmas mutacionales activas en tumores del SNC y la distribución de mutaciones en todo el genoma, en particular para GBM, un tipo de tumor cuya célula de origen se cree que son las OPC) y otras células proliferativas, posiblemente lo que refleja la propagación de mutaciones somáticas adquiridas por células ancestrales proliferativas de OPC en OL maduras. Las asociaciones entre la densidad de mutaciones somáticas OL y las covariables genómicas generalmente no eran específicas del tipo de célula o del tejido. Las mutaciones neuronales se caracterizaron por patrones de enriquecimiento fuertemente contrastantes en la preferencia de cromatina abierta transcripcionalmente activa por las covariables genómicas medidas en el tejido cerebral, particularmente en las neuronas excitadoras, y no reflejaron la distribución genómica de las mutaciones del cáncer.