La fisiopatología de las secuelas postagudas de COVID-19 (o long COVID) aún no está clara. La evidencia sugiere que la persistencia viral, la inflamación y la desregulación inmune desempeñan un papel importante. Peluso MJ et al. (Multimodal Molecular Imaging Reveals Tissue-Based T Cell Activation and Viral RNA Persistence for Up to 2 Years Following COVID-19. MedRxiv preprint. https://www.medrxiv.org/content/10.1101/2023.07.27.23293177v1.full ) utilizaron una tomografía por emisión de positrones (PET) de cuerpo entero con un nuevo radiofármaco [18F]F-AraG (arabino-furanosil-guanina marcado con flúor-18) para localizar células T activadas en convalecientes de COVID con o sin síntomas post-COVID. También examinaron la presencia de RNA específico del virus SARS-CoV-2 en células rectosigmoideas en participantes diagnosticados con post-COVID que se sometieron a biopsias colorrectales.
Para realizar imágenes PET/CT de cuerpo entero, los autores emplearon un nuevo agente radiofarmacéutico, [18F]F-AraG (arabinfuranosilguanina marcada con flúor-18), un trazador altamente selectivo y sensible, que permite la localización anatómica de Linfocitos T CD8+ y CD4+ activados. Modelos murinos in vivo anteriores han confirmado que las células T activan la captación selectiva de [18F]F-AraG.
Sobre el estudio
=> Recibir por Whatsapp las noticias destacadas
El estudio incluyó a 24 participantes que se dividieron en dos grupos: aquellos que se encontraban en la fase postaguda temprana (menos de 90 días después del inicio de los síntomas de COVID-19, con, n=3 o sin recuperación completa, n=6 ), y aquellos que se encontraban en la fase postaguda tardía (más de 90 días después del inicio de los síntomas de COVID-19, con recuperación completa, n=3 ò con síntomas de Long COVID, n=15). La mediana de edad de los participantes fue de 39,5 años (rango de 26 a 65), 11 eran mujeres y 13 eran hombres. Durante la primera visita, los participantes completaron un cuestionario que evaluaba datos demográficos, historial médico, infección por SARS-CoV-2.
Se detectó activación de células T tisulares y RNA específico del SARS-CoV-2 en células rectosigmoideas en individuos vacunados post-COVID hasta 2,5 años después de la infección inicial .
historial de tratamiento y vacunas.
La mayoría de los participantes fueron infectados con SARS-CoV-2 antes de la aparición de las variantes de Omicron, y solo dos fueron hospitalizados durante la infección aguda. Un participante fue infectado durante la ola ancestral, pero experimentó dos reinfecciones documentadas con presuntas variantes de Omicron. Ningún otro participante presentó síntomas agudos que sugirieran infección por otro virus o reinfección por SARS-CoV-2 entre el episodio inicial de COVID-19 y la tomografía por emisión de positrones. Durante el período del estudio, ninguno de los sujetos tuvo pruebas de antígeno o PCR de COVID-19 positivas posteriores después de la prueba confirmatoria inicial.
Todos los participantes, excepto uno, habían recibido al menos una vacuna ModRNA anti-SARS-CoV-2 antes de la tomografía por emisión de positrones. La mediana del número de días desde la última dosis de vacuna hasta la inyección del marcador fue de 183 días. Los autores afirmaron que realizaron imágenes PET más de 60 días después de cualquier dosis de vacuna para minimizar el efecto de la vacunación sobre la activación de las células T. No se informó al equipo del estudio que un participante recibió una dosis de refuerzo de la vacuna 6 días antes de la obtención de imágenes.
La activación de las células T en los tejidos se determinó mediante imágenes PET/CT de cuerpo entero [18F]F-AraG en 24 participantes en momentos que oscilaron entre 27 y 910 días después de la aparición de los síntomas de COVID-19. El [18F]F-AraG se administró por vía intravenosa. Los controles prepandémicos fueron 6 participantes que se sometieron a PET con [18F]F-AraG antes de 2020.
La mediana del número de síntomas de long COVID fue de 5,5 (entre 0 y 15). La fatiga (n=16) y las molestias neurocognitivas (n=14) fueron los síntomas más frecuentes.
Los investigadores también emplearon un ensayo de PCR cuantitativo y una hibridación in situ para investigar la presencia de RNA específico del virus en células rectosigmoideas de participantes que tenían síntomas prolongados de COVID y se les habían realizado biopsias colorrectales.
Resultados
El estudio incluyó a 24 participantes que se dividieron en dos grupos: aquellos que se encontraban en la fase postaguda temprana (menos de 90 días después del inicio de los síntomas de COVID-19, con, n=3 o sin recuperación completa, n=6 ), y aquellos que se encontraban en la fase posaguda tardía (más de 90 días después del inicio de los t de COVID-19, con recuperación completa, n=3 y con síntomas de Long COVID, n=15). La mediana de edad de los participantes fue de 39,5 años (rango de 26 a 65), 11 eran mujeres y 13 eran hombres.
Resultados de la PET
Se detectó activación de células T tisulares y RNA específico del SARS-CoV-2 en células rectosigmoideas en individuos vacunados post-COVID hasta 2,5 años después de la infección inicial.
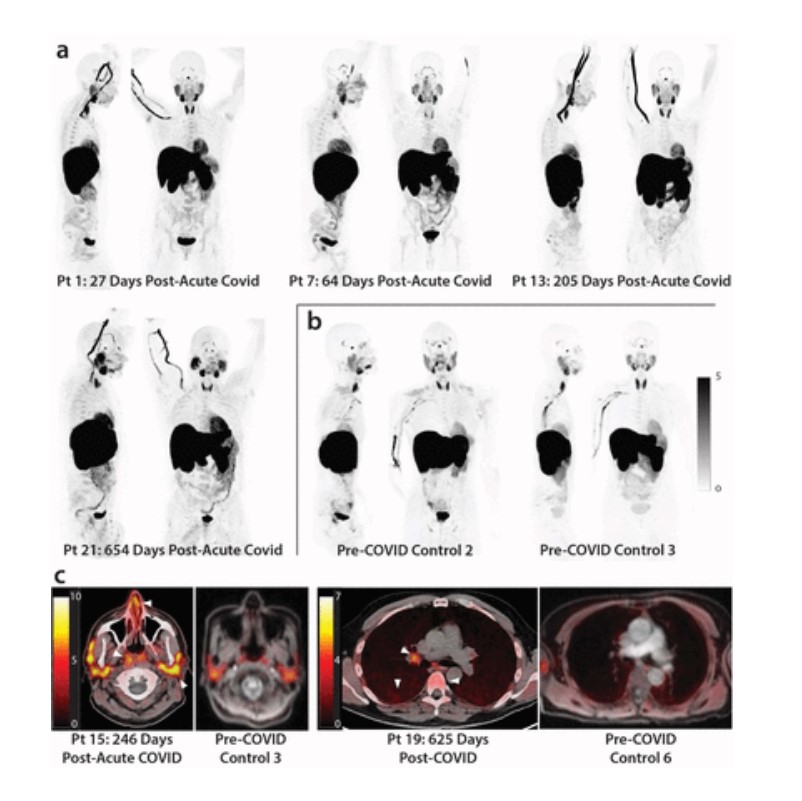
La captación de [18F]F-AraG en muchas regiones anatómicas fue mayor en el grupo de COVID postaguda, que incluía a aquellos con y sin síntomas prolongados de COVID, en comparación con el grupo prepandémico. Es importante destacar que también se observó una activación elevada de las células T en estos tejidos en numerosos individuos que no presentaban síntomas de Long COVID.
La captación de [18F]F-AraG fue mayor en la médula espinal torácica, la cola de caballo, el tronco del encéfalo (protuberancia), el arco aórtico, la arteria pulmonar y los lóbulos pulmonares inferiores que en los controles prepandémicos. También se observó un aumento en la captación de [18F]F-AraG en el tejido linfoide nasofaríngeo e hiliar, la pared proximal del colon, la pared rectal, la cresta lumbar e ilíaca, la médula ósea y las amígdalas faríngeas del grupo de COVID postagudo, en comparación con pre -controles de pandemia.
Curiosamente, después de dividir a los participantes por el tiempo desde la primera aparición de los síntomas de COVID-19, la captación de [18F]F-AraG en la pared del ventrículo derecho fue mayor en los participantes post-COVID que en los controles prepandémicos.
Los síntomas posteriores a la COVID se asociaron con una mayor captación de [18F]F-AraG en ciertos tejidos, como la médula espinal, los ganglios linfáticos hiliares y la pared del colon/rectal.
Además, los participantes que informaron más de cinco síntomas de Long COVID en el momento de la obtención de imágenes PET/CT tenían niveles más altos de marcadores inflamatorios circulantes y proteínas involucradas en las respuestas inmunes, la señalización de quimiocinas, las respuestas inflamatorias y el desarrollo del sistema nervioso, incluidos TGFb1, TANKIL7. , TANQUE, IL20RA, CCL13, SPRY2, PRKAB1, BCR y TAF2.
Los participantes con síntomas pulmonares de long COVID, como tos, dificultad para respirar o disnea, tuvieron una mayor captación de [18F]F-AraG en la parte inferior del pulmón y en las regiones de interés hiliares que los participantes que no tenían estos síntomas. Además, los sujetos con una mayor captación de [18F]F-AraG en la parte inferior del pulmón tenían grupos de productos genéticos regulados positivamente, incluidos aquellos involucrados en la respuesta inflamatoria, la transformación de fibroblastos de señalización celular y la respuesta a la estimulación mitogénica. Hubo un aumento en la expresión de IL-7, CXCL3, CD40, EGF, TRNSF14, TIMP3, CRK1, BKAP2 y PDGFB.
Curiosamente, los hombres tuvieron una mayor absorción de [18F]F-AraG en las regiones de interés hiliares que las mujeres.
Una tomografía computarizada (TC) del tórax demostró cicatrices y/o reticulación apicales leves en cuatro participantes, lo que indica fibrosis pulmonar leve. Otros participantes tuvieron tomografías computarizadas normales, excepto por hallazgos incidentales no atribuibles a antecedentes de infection COVID-19 (e.g. calcified granulomas).
The correlation analysis between the biodistribution of [18F]F-AraG and the timing of immunization revealed that the time from the most recent vaccination to PET imaging had minimal impact on the [18F]F-AraG uptake in most tissues. Interestingly, the only exception was a modestly higher uptake in the lower gut wall found in individuals who received the last COVID-19 vaccine less than 180 days before the PET imaging.
The evaluation of CD4+ and CD8+ T-cell, NK-cell, and B-cell phenotypes, including markers of activation, naive/memory phenotypes, regulatory function, and immune checkpoint/exhaustion was performed using flow cytometric analysis in peripheral blood mononuclear cells from 16 participants and in gut tissue from 5 participants who underwent colorectal biopsies. Compared to peripheral blood, higher frequencies of effector memory CD8+ and CD4+ T-cells, and similar frequencies of CD8+ and CD4+ lymphocytes expressing the activation markers CD38/HLA-DR and immune checkpoint (PD-1) were found in the gut tissue.
Rectosigmoid tissue analysis
Since many post-acute COVID participants had higher uptake of [18F]F-AraG in the proximal colon and rectal wall compared to pre-pandemic controls, the authors hypothesized that viral persistence may be responsible, at least in part, for the migration of activated T cells to the gastrointestinal tissues. Therefore, they investigated the persistence of the virus in rectosigmoid tissue collected by flexible sigmoidoscopy in five participants who underwent PET imaging 158 to 676 days after initial SARS-CoV-2 infection.
At the time of the biopsy, all five participants reported at least one symptom of long COVID. None of them had received the anti-SARS-CoV-2 vaccine in the prior month. Three out of five participants did not have detectable SARS-CoV-2 nucleocapsid IgG in a short time frame from tissue collection, which suggests that they did not have recent SARS-CoV-2 reinfections.
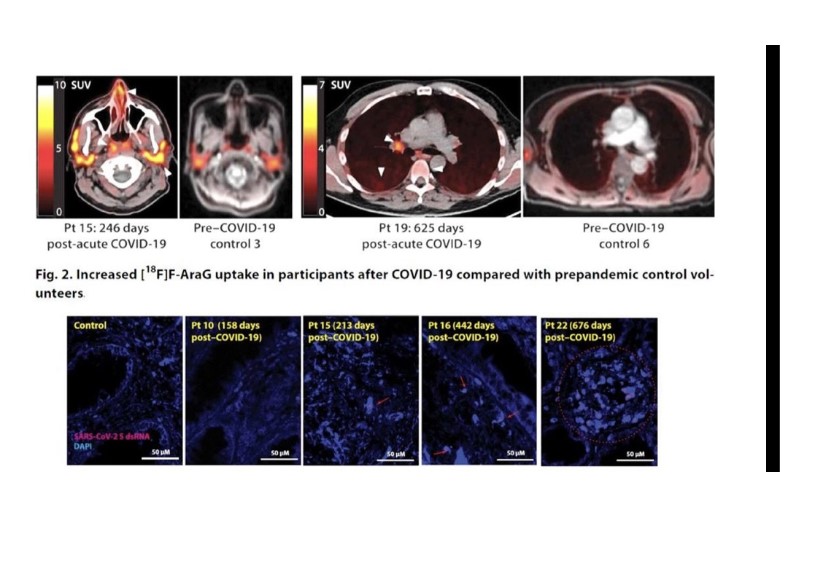
The quantitative PCR assays and in situ hybridization of SARS-CoV-2 spike RNA were conducted. All participants with long COVID symptoms who underwent biopsy had SARS- CoV-2 spike-specific RNA detected in rectosigmoid cells. Almost all of the SARS-CoV-2 spike RNA was found in cells located in the lamina propria, without any epithelial signal. PCR was also performed on RNA isolated from bulk rectal tissue lysates (separate biopsy) that targets the N1, N2, Envelope, and RNA-dependent RNA polymerase regions of SARS-CoV-2. Tissue-based T-cell activation and SARS-CoV-2-specific RNA in rectosigmoid cells were detected in vaccinated post-COVID individuals up to 2.5 years after initial infection .
RNA was detected in any participant.
A small number of spike RNA+ cells expressed CD68, a macrophage monocyte lineage marker, but many RNA+ cells did not express CD68 and none expressed CD3.
In four participants, virus-specific RNA was detected in all three tissue regions surveyed. Furthermore, the [18F]F-AraG SUVmax values in proximal colon and rectal tissue in post- acute COVID participants who underwent biopsy were at least 3 standard deviations higher than the mean SUVmax in pre-pandemic controls.
Conclusion
The post-acute COVID group had a higher uptake of [18F]F-AraG in numerous anatomical regions (increased T cell activation in these tissues) compared with pre-pandemic controls ,up to 2.5 years after initial infection. SARS-CoV-2 spike RNA was detected in the rectosigmoid lamina propria of nearly all participants who underwent biopsy.
The authors concluded that these results provide additional evidence for the role of tissue- based immune activation in contributing to the post-acute sequelae of SARS-CoV-2 infection.
Figura 1.
[18F] Imágenes F-AraG PET y PET/CT de participantes después de COVID-19 y voluntarios de control prepandémico. Se muestran proyecciones de intensidad máxima (MIP; vistas coronal y sagital de reconstrucciones tridimensionales) para cuatro participantes representativos en distintos momentos después de la infección por SARS-CoV-2 (a) y controles masculinos y femeninos no infectados (b). Las imágenes axiales de superposición de PET/CT se muestran en (c) y muestran un aumento de la señal en los cornetes nasales, las glándulas parótidas, los ganglios linfáticos hiliares, el parénquima pulmonar y la médula ósea lumbar en participantes representativos de COVID posagudo y de control prepandémico (flechas blancas).