Resumen
La enfermedad de Alzheimer es la principal causa de demencia en todo el mundo, pero las vías celulares que subyacen a su progresión patológica en las regiones del cerebro siguen siendo poco conocidas . Mathys,el.al. [Nature.Single-cell multiregion dissection of Alzheimer’s disease. Nature (2024). https://doi.org/10.1038/s41586-024-07606-7] presentaron un atlas transcriptómico unicelular de seis regiones cerebrales diferentes en el cerebro humano anciano, que cubre 1,3 millones de células de 283 muestras de cerebro humano post mortem de 48 personas con y sin enfermedad de Alzheimer. Identificaron 76 tipos de células, incluidos subtipos de astrocitos y neuronas excitadoras específicos de cada región y una población de interneuronas inhibidoras exclusiva del tálamo y distinta de las subclases inhibidoras canónicas. Identificaron poblaciones vulnerables de neuronas excitadoras e inhibidoras que están agotadas en regiones cerebrales específicas en la enfermedad de Alzheimer y proporcionan evidencia de que la vía de señalización de Reelin está involucrada en la modulación de la vulnerabilidad de estas neuronas. Desarrollaron un método escalable para descubrir módulos genéticos, que utilizaron para identificar módulos específicos de tipo celular y de región que están alterados en la enfermedad de Alzheimer y para anotar diferencias transcriptómicas asociadas con diversas variables patológicas. Identificaron un programa de astrocitos que está asociado con la resiliencia cognitiva a la patología de la enfermedad de Alzheimer, vinculando el metabolismo de la colina y la biosíntesis de poliaminas en los astrocitos con la función cognitiva preservada en una etapa avanzada de la vida. Juntos, este estudio desarrolla un atlas regional del cerebro humano que envejece y proporciona información sobre la vulnerabilidad, la respuesta y la resiliencia celular a la patología de la enfermedad de Alzheimer.
En Detalle
La enfermedad de Alzheimer (EA) se caracteriza por una agregación patológica de proteínas en un patrón estereotipado en múltiples regiones del cerebro. El diagnóstico post mortem de la EA se establece según la gravedad y la distribución de estas características patológicas: depósitos extracelulares de β-amiloide y ovillos neurofibrilares (NFT) intracelulares en las neuronas. Los ovillos se observan primero en la corteza entorrinal (CE) (estadios I-II de Braak), luego en el hipocampo y el tálamo (estadios III-IV de Braak) y finalmente en la neocorteza (estadios V-VI de Braak), una secuencia que suele ser sincrónica con deterioro cognitivo desde un deterioro cognitivo leve hasta una demencia grave. Comprender la arquitectura celular de las regiones cerebrales afectadas tiene implicaciones importantes para las intervenciones terapéuticas tempranas y específicas de la región y puede arrojar luz sobre los mecanismos moleculares subyacentes a la progresión regional de la patología. Aunque algunas regiones del cerebro relevantes para la EA se han estudiado individualmente a escala o de forma conjunta enmuestrasdeunospocos individuos, es necesario realizar una caracterización molecular integral de las diferencias específicas de cada región en la EA. Actualmente falta y podría capturar diferencias en la arquitectura molecular regional y alteraciones del subtipo neuronal y glial específicas de la región en la EA y en la resiliencia cognitiva a la patología de la EA.
=> Recibir por Whatsapp las noticias destacadas
Mathys,el.al. [Nature.Single-cell multiregion dissection of Alzheimer’s disease. Nature (2024). https://doi.org/10.1038/s41586-024-07606-7] presentan un atlas transcriptómico del cerebro humano que abarca seis regiones anatómicas distintas de personas con y sin demencia de Alzheimer como base para comprender las diferencias asociadas a la enfermedad. Perfilaron los transcriptomas de más de 1,3 millones de núcleos de la CE, el hipocampo (HC), el tálamo anterior (TH), la circunvolución angular (AG), la corteza temporal media (MT) y la corteza prefrontal (PFC) de 48 individuos, 26 de los cuales tienen un diagnóstico patológico de la EA. Anotaron la diversidad de subtipos neuronales y gliales específicos de la región, presentaron un recurso en línea para navegar por este atlas (http://compbio.mit.edu/ad_multiregion) y brindaron información mecanicista sobre la vulnerabilidad, la respuesta y la resiliencia celular a la EA.
Un atlas multirregional de AD
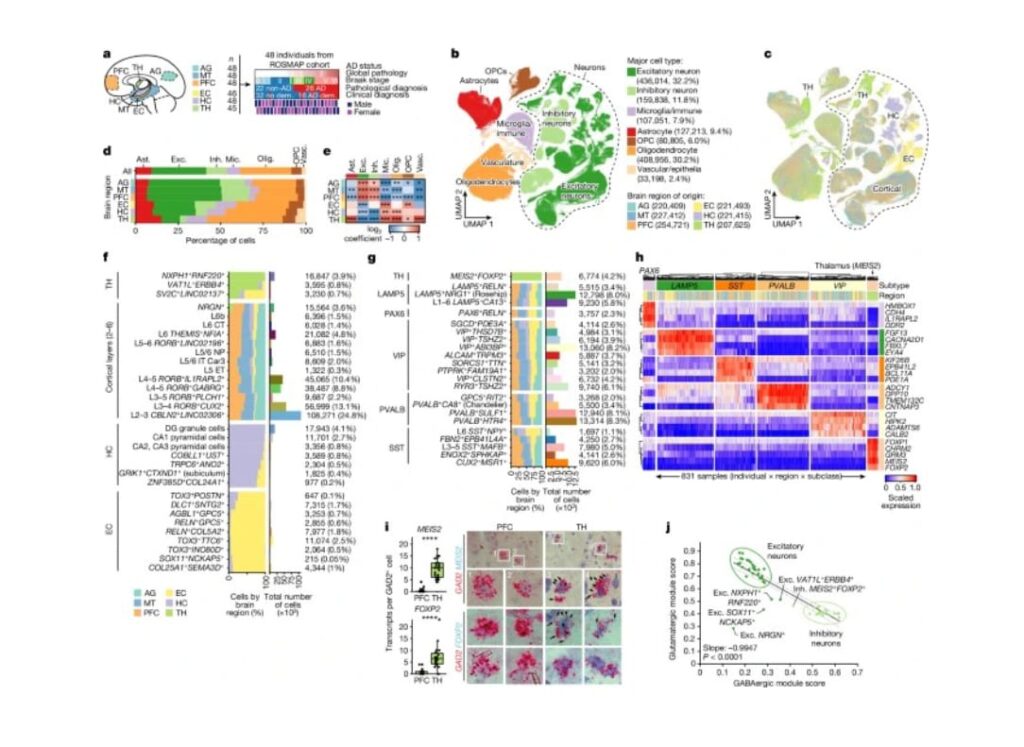
Para caracterizar la diversidad celular en el cerebro humano y los genes, vías y tipos de células que subyacen a la progresión de la EA en las regiones del cerebro, realizaron un análisis de secuenciación de RNA de un solo núcleo (snRNA-seq) de núcleos aislados de 283 muestras de cerebro post mortem en todo el mundo, seis regiones cerebrales de 48 participantes en el Estudio de Orden Religiosa (ROS) o el Proyecto Rush de Memoria y Envejecimiento (MAP)28 (en conjunto, ROSMAP; Fig. 1a). Seleccionaron a 48 participantes según el diagnóstico patológico de EA (estratificado según la puntuación NIA-Reagan de 26 (con EA) y 22 (sin EA; etiquetado como no EA)) y según el diagnóstico clínico de demencia de Alzheimer (n = 16) versus personas sin demencia (n = 32)29,30 (Fig. 1a, Datos ampliados, Fig. 1a ). De estos 48 individuos, perfilaron seis regiones del cerebro: la CE (221.493 células), que se ve afectada en la EA temprana (etapas I-II); los HC (221.415) y TH (207.625), que se ven afectados en la mitad de la EA (estadios III-IV); y el AG (220.409), MT (227.412) y PFC (254.721), que se ven afectados en la EA tardía (estadios V-VI), para un total de 1,35 millones de transcriptomas de núcleos independientes después de eliminar dobletes, células de baja calidad y altamente conglomerados específicos de la muestra. Anotaron 76 tipos de células de alta resolución en 14 grupos principales de tipos de células, incluidos 32 subtipos de neuronas excitadoras (436.014 núcleos, 32,2% del total) y 23 subtipos inhibidores (159.838 núcleos, 11,8% del total) .Caracterizaron estos tipos de células en términos de su tamaño de transcriptoma y estado proliferativo, compararon su atlas con datos publicados previamente sobre especies e identificaron una amplia identidad del tipo de célula, programas que utilizan factorización matricial no negativa (NMF) y reguladores transcripcionales que utilizan SCENIC .
Para conocer mejor la arquitectura celular del cerebro humano, investigaron las diferencias en la composición de los principales tipos de células entre las seis regiones del cerebro. La fracción de neuronas aumentó significativamente desde la TH (14,4% de neuronas) hasta la HC alocortical de tres capas (32,2%), la corteza perialocortical entorrinal (36,6%) y las regiones neocorticales de seis capas (AG, MT y PFC, 58,9%) (Fig. 1b – e ). La glía, incluidos astrocitos, oligodendrocitos, células precursoras de oligodendrocitos (OPC) y microglía/células inmunitarias, tendía a ser menos abundante en muestras neocorticales (Fig. 1b-e), de acuerdo con estudios previos en humanos y ratones. Se observaron de manera reproducible diferencias en la composición de los principales tipos de células entre regiones entre los participantes del estudio, independientemente del estado de la enfermedad del individuo ,lo que sugiere que la variabilidad en la composición de los principales tipos de células entre regiones es una característica fundamental del ser humano. cerebro y no se ve afectado por la patología de la EA.
Aquí ,se presenta un atlas transcriptómico del cerebro humano envejecido, que abarca seis regiones cerebrales de 48 individuos con y sin diagnóstico de EA, que utilizaron para anotar la diversidad celular regional, identificar programas de expresión genética y diferencias en la EA entre tipos de células, y señalar poblaciones de células específicas de una región que son vulnerables a la EA. Proporcionan un sitio web interactivo para explorar el atlas y estas anotaciones, marcadores, módulos funcionales y diferencias en la EA tanto a nivel unicelular como pseudo-masivo (http://compbio.mit.edu/ad_multiregion).
Al anotar los subtipos neuronales y gliales por región del cerebro, encontraron diferencias de composición significativas entre regiones, incluido un subtipo de neuronas talámicas GABAérgicas (MEIS2+FOXP2+) que es molecularmente distinta de las subclases canónicas de neuronas inhibidoras en la neocorteza. Utilizaron mediciones específicas de la región de la patología de la EA para identificar cambios en la expresión génica asociados con el ovillo tau neurofibrilar o la carga de placa β-amiloide, incluida la regulación positiva de la metalostasis asociada a la placa en los astrocitos y de la cadena de transporte de electrones en las neuronas excitadoras. Encontraron que los genes de riesgo de EA estaban muy perturbados en la EA (en particular para la microglía, en concordancia con su enriquecimiento para la señal GWAS68), pero pocos genes de riesgo mostraban expresión específica de la región. Para examinar más a fondo la heterogeneidad celular y regional del cerebro humano, desarrollaron un método escalable, scdemon, que utiliza la descorrelación de muestras para anotar programas de expresión genética tanto ubicuos como raros en cada tipo de célula principal, y utilizaron módulos anotados para identificar programas funcionales asociados con variables patológicas específicas, incluido un programa relacionado con la glucólisis y el metabolismo energético en la glía asociado con la carga de placa difusa.
Identificaron cinco subtipos de neuronas excitadoras que se redujeron en pacientes con EA (subtipos vulnerables) en las CE y HC1, afectadas tempranamente, incluida la capa II de la CE (L2), la L5 RORB positiva (AGBL1+GPC5+) y el hipocampo. Neuronas del subcampo CA1. En particular, las neuronas excitadoras vulnerables compartían la expresión de genes implicados en la señalización de reelina y la biosíntesis de proteoglicanos de heparán sulfato, los cuales también predecían la vulnerabilidad de las neuronas inhibidoras a la EA. Estudios de casos recientes han identificado variantes en RELN y APOE que potencialmente median la RC en la EA autosómica dominante. En particular, la variante RELN mejoró su unión a los glicosaminoglicanos (GAG) y NRP1, y la variante APOE disminuyó la unión a los GAG, lo que podría afectar su capacidad para competir por la unión al receptor. Por lo tanto, los hallazgos sugieren una convergencia de factores asociados con la vulnerabilidad celular en la EA esporádica y la resiliencia ante la EA autosómica dominante.
Finalmente, analizaron los correlatos transcriptómicos de la cognición y la patología en la EA, e identificaron un conjunto de genes de astrocitos relacionados con la CR y la patología de la EA. En particular, estos genes convergieron en las vías del metabolismo de la colina y la biosíntesis de poliaminas. Este hallazgo se alinea con estudios que muestran los beneficios de la ingesta y la suplementación de colina en la dieta sobre el rendimiento cognitivo en individuos humanos y en modelos animales. De manera similar, la suplementación dietética con poliamina espermidina prolonga la vida y la salud en varios modelos animales, y también se ha demostrado que la espermidina mejora el rendimiento de la memoria y contrarresta el deterioro cognitivo relacionado con la edad. Los hallazgos respaldan el metabolismo de la colina y la síntesis de poliaminas como objetivos atractivos para promover la RC en la EA.
Este estudio tiene varias limitaciones: el fraccionamiento isotrópico y los límites de profundidad de lectura pueden sesgar la recuperación celular en función de su contenido nuclear; Es posible que el RNA nuclear no capture completamente los estados microgliales o los cambios transcriptómicos localizados; y la carga de patología se basa en promedios por muestra en lugar de en el contexto espacial de cada celda. Individuos y modalidades de datos adicionales fortalecerán los análisis futuros de las alteraciones específicas de la región en la EA, y los datos espaciales pueden ayudar a separar aún más los cambios asociados a la patología.
a, resumen del perfil de snRNA-seq, que cubre 283 muestras en 6 regiones del cerebro de 48 participantes de ROSMAP, que muestra patología global, etapa de Braak y diagnóstico patológico (26 de EA y 22 de no EA) o clínico de EA (16 demencia de EA (dem. ) y 32 sin demencia). b, c, Aproximación y proyección de la variedad uniforme conjunta (UMAP), coloreada por tipo de célula principal (b) y región de origen (c). d, La composición regional de los principales tipos de células. e, Enriquecimiento relativo de los principales tipos de células en todas las regiones mediante regresión cuasi binomial. Los valores de P corregidos por la tasa de descubrimiento falso (FDR) se indican con asteriscos; ***P < 0.001, **P < 0.01, *P < 0.05. f,g, descomposición global, composición de la región, enriquecimiento y número de núcleos para los subtipos neuronales excitadores (f) e inhibidores (g). h, Análisis de expresión génica de los cuatro marcadores principales por subclase inhibidora, promediado en la muestra por nivel de subclase (columnas). i, validación por RNAscope de FOXP2 y MEIS2 como marcadores del subtipo único de tálamo, con cuantificación (izquierda) realizada mediante pruebas t de Student e imágenes representativas (derecha). Los puntos azules representan transcripciones de MEIS2 (arriba) o FOXP2 (abajo) y los puntos rojos representan transcripciones de GAD2. FOXP2: n = 19 (PFC) y n = 22 (TH) células; MEIS2: n = 35 (PFC) y n = 26 (TH) células; cada punto representa una célula individual, agrupada a partir de ocho muestras (cuatro individuos; cada uno tenía una muestra de PFC y una de tálamo). j, puntuaciones glutamatérgicas versus gabaérgicas para todos los subtipos de neuronas. Las líneas de puntos representan el intervalo de confianza del 95% alrededor del ajuste lineal. Los valores de P se calcularon mediante pruebas F bilaterales. Ast., astrocitos; exc., neuronas excitadoras; inh., neuronas inhibidoras; mic., microglía/células inmunitarias; olig., oligodendrocitos; vasc., células vasculares/epiteliales