Ronald Palacios Castrillo
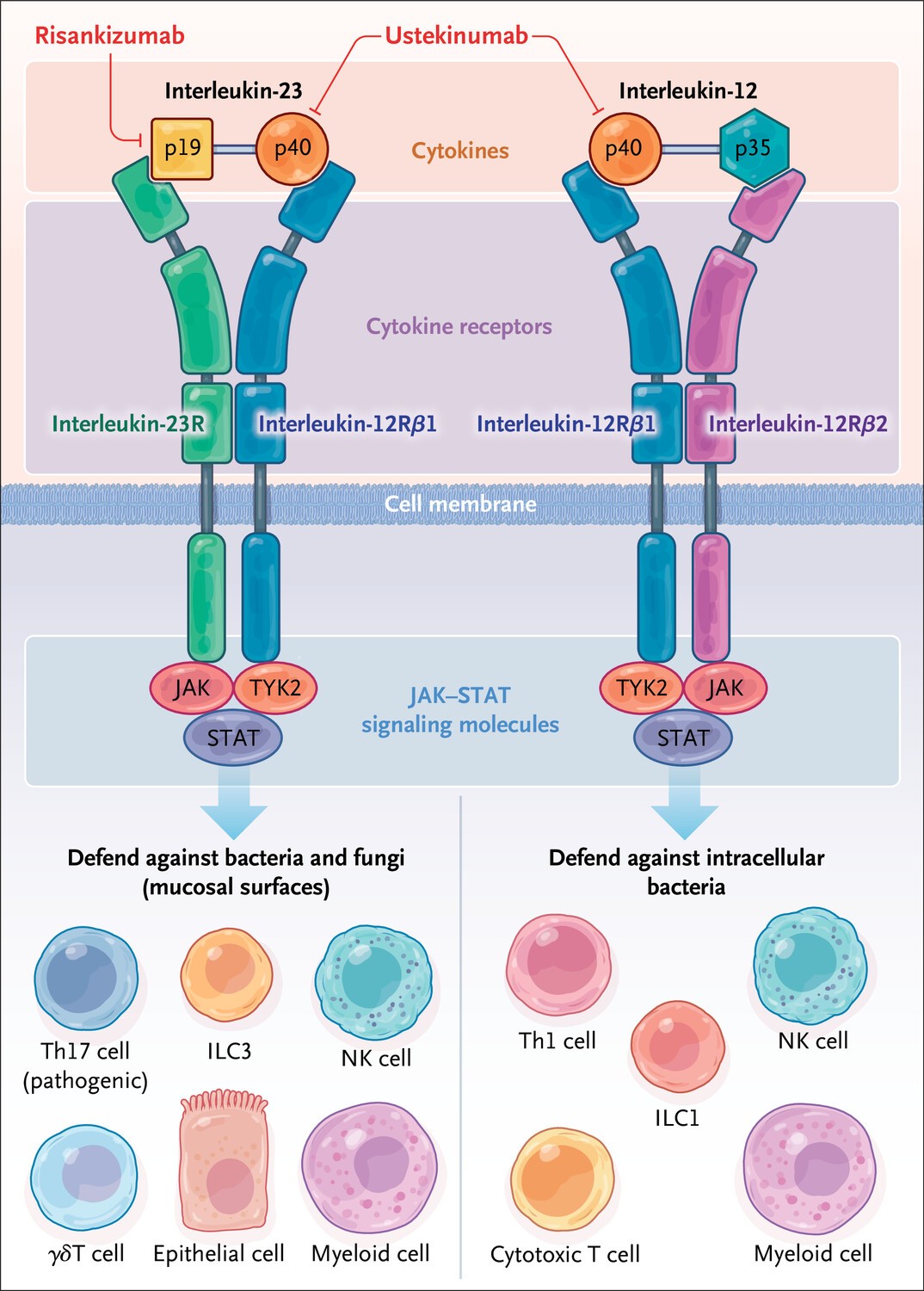
Las citocinas interleucina-12 e interleucina-23 desempeñan un papel fundamental en la homeostasis y la inflamación en el intestino y comparten varias características, incluida una subunidad común de citocina p40, una subunidad común del receptor de interleucina-12Rβ1 y un transductor de señal de Janus quinasa (JAK) y Moléculas de señalización del activador de la transcripción (STAT) que comunican funciones posteriores (Figura 1).
La Administración de Alimentos y Medicamentos aprobó las terapias que inhiben la subunidad p40 de interleucina-12 compartida o la subunidad p19 selectiva de interleucina-23 para el tratamiento de pacientes con enfermedad de Crohn.
La delimitación de cuál de estas terapias conduciría a mejores resultados ha generado considerable especulación e interés. En el ensayo clínico SEQUENCE, cuyos resultados se publican ahora en el Journal, Peyrin-Biroulet et al. han realizado un ensayo directo para evaluar la eficacia y seguridad de risankizumab (que bloquea la interleucina-23 p19) en comparación con ustekinumab (que bloquea la interleucina-12 p40) en pacientes con enfermedad de Crohn.3
Los primeros estudios preclínicos establecieron que las células T auxiliares (Th) 1 inflamatorias intestinales aumentaban en la enfermedad de Crohn; Se pensaba que estas células desempeñaban un papel dominante en este trastorno. La interleucina-12 participa en la diferenciación de células T en células Th1 (ver Figura ).
=> Recibir por Whatsapp las noticias destacadas
La terapia con anticuerpos monoclonales neutralizantes anti-interleucina-12 p40 en pacientes con enfermedad de Crohn condujo a niveles reducidos de células Th1 intestinales y redujo la inflamación.2.
Cuando los investigadores descubrieron más tarde que la interleucina-12 p40 también podría asociarse con la interleucina-23 p19 para formar interleucina- 23, se hizo necesario un reexamen de si los efectos beneficiosos del bloqueo de la interleucina-12 p40 sobre la inflamación intestinal se debían a la interleucina-12, la interleucina-23 o los efectos combinados de estas citoquinas.
La interleucina-23 expande y mantiene las células Th17, en particular en las superficies mucosas, y las células Th17 aumentan en los tejidos intestinales obtenidos de pacientes con enfermedad de Crohn.2.
Debido a que la enfermedad de Crohn implica una desregulación de las células Th1 y Th17, muchos investigadores plantearon la hipótesis de que reducir estos dos subconjuntos de células T inflamatorias apuntando a la subunidad p40 de interleucina-12 compartida daría resultados más favorables, especialmente porque estos subconjuntos de células T se regulan entre sí.
Varios estudios preclínicos respaldaron estos hallazgos y demostraron que el bloqueo de la interleucina-12 p40 tenía beneficios adicionales en la reducción de las características sistémicas de la inflamación en comparación con el bloqueo de la interleucina-23 p19(2).
Otros plantearon la hipótesis de que el bloqueo selectivo de la interleucina-23 a través de la interleucina-23 p19 conduciría a resultados más favorables porque dicho bloqueo dejaría intactas las funciones esenciales y protectoras de las vías de interleucina-12 y Th1.
Los estudios preclínicos demostraron que el bloqueo únicamente de la interleucina-12 (a través de la interleucina-12 p35) no redujo la inflamación intestinal(2), lo que respalda un papel selectivo de la interleucina-23, aunque este papel no excluye la cooperación de la interleucina-12 con la interleucina-23 en la inflamación intestinal.
A pesar de que la interleucina-17 es una citoquina clave producida por las células Th17 dependientes de la interleucina-23, el bloqueo de la interleucina-17 no fue efectivo y condujo a peores resultados en pacientes con enfermedad de Crohn más grave(2), un hallazgo que probablemente se debió a la Funciones intestinales esenciales de la interleucina-17.
Este hallazgo plantea la cuestión de por qué el bloqueo de la interleucina-23 no produce resultados igualmente pobres. Los estudios en animales, que demostraron que la interleucina-17 no está completamente ausente cuando la interleucina-23 está bloqueada (probablemente debido a subconjuntos de células intestinales que pueden producir interleucina-17 independientemente de la interleucina-23(4) pueden ayudar a explicar estos resultados.
Los ensayos clínicos comparativos proporcionan información valiosa para la toma de decisiones clínicas y son muy necesarios en el estudio de la enfermedad inflamatoria intestinal, que tradicionalmente comparaba terapias con placebo.
El actual ensayo clínico comparativo realizado por Peyrin-Biroulet et al. demostró que risankizumab no fue inferior a ustekinumab con respecto a la remisión clínica en la semana 24 (58,6 % frente a 39,5 %) y superior a ustekinumab con respecto a la remisión endoscópica en la semana 48 (31,8 % frente a 16,2 %) en pacientes con enfermedad de Crohn moderada a grave que habían tenido efectos secundarios inaceptables con inhibidores del factor de necrosis tumoral (TNF) (terapia anti-TNF) o una respuesta inadecuada a dicha terapia(3). Una limitación del ensayo es que fue abierto, lo que puede haber introducido sesgo; sin embargo, el revisor central de endoscopia desconocía las asignaciones de grupo de los pacientes
Aunque es tentador concluir que apuntar a la interleucina-23 p19 es más eficaz que apuntar a la interleucina-12 p40 en pacientes con enfermedad de Crohn, el contexto es importante.
Las posibles razones de la mayor eficacia de risankizumab sobre ustekinumab pueden incluir diferencias específicas entre fármacos con respecto a su penetración en los tejidos intestinales y su localización dentro de esos tejidos, su afinidad relativa y eficacia inhibidora de sus objetivos y su asociación con las células inmunitarias, la regulación del sistema inmunológico por células a través de la región Fc de los anticuerpos, o ambas.
La eficacia superior de risankizumab sobre ustekinumab en el ensayo SEQUENCE puede atribuirse, en parte, a una mayor función biológica de la vía de la interleucina-23 en el subgrupo de pacientes con enfermedad de Crohn que se inscribieron en ese ensayo (es decir, pacientes que habían tenido efectos secundarios inaceptables con la terapia anti-TNF o una respuesta inadecuada a dicha terapia y una duración media de la enfermedad de 7,3 años).
Los resultados de un estudio en el que participaron pacientes cuya enfermedad de Crohn era refractaria a la terapia anti-TNF respaldan esta idea; ese estudio demostró que en tales pacientes, las medidas de la vía de la interleucina-23 aumentaron y se expandió una población de células T que expresaban interleucina-23R que eran resistentes a la muerte celular inducida por anti-TNF(5).
Además, los estudios preclínicos demostraron que la interleucina-12 y la interleucina-23 pueden desempeñar diferentes funciones en diferentes momentos: la interleucina-12 desempeña un papel más importante en una etapa más temprana del curso de la enfermedad y la interleucina-23 desempeña un papel más importante más adelante(6).
Las diferentes respuestas a las terapias entre los pacientes con enfermedad de Crohn pueden verse influenciadas por el fenotipo clínico, las vías biológicas que impulsan la enfermedad, el estadio de la enfermedad y las intervenciones terapéuticas previas.
Serán importantes ensayos comparativos adicionales de interleucina-23 p19 e interleucina-12 p40 que evalúen distintas subpoblaciones de pacientes. Dichos ensayos están en curso y pueden permitir una toma de decisiones más refinada en la selección de terapias dirigidas a la interleucina-23 p19 o la interleucina-12 p40 en pacientes con enfermedad de Crohn.
Referencias Bibliográficas
1. Krueger JG, Eyerich K, Kuchroo VK, et al. IL-23 past, present, and future: a roadmap to advancing IL-23 science and therapy. Front Immunol 2024;15:1331217-1331217.
2. Verstockt B, Salas A, Sands BE, et al. IL-12 and IL-23 pathway inhibition in inflammatory bowel disease. Nat Rev Gastroenterol Hepatol 2023;20:433-446.
3. Peyrin-Biroulet L, Chapman JC, Colombel J-F, et al. Risankizumab versus ustekinumab for moderate-to-severe Crohn’s disease. N Engl J Med 2024;391:213-223.
4. Lee JS, Tato CM, Joyce-Shaikh B, et al. Interleukin-23-independent IL-17 production regulates intestinal epithelial permeability. Immunity 2015;43:727-738.
Go to Citation
5. Schmitt H, Billmeier U, Dieterich W, et al. Expansion of IL-23 receptor bearing TNFR2+ T cells is associated with molecular resistance to anti-TNF therapy in Crohn’s disease. Gut 2019;68:814-828.
Go to Citation
6. Eftychi C, Schwarzer R, Vlantis K, et al. Temporally distinct functions of the cytokines IL-12 and IL-23 drive chronic colon inflammation in response to intestinal barrier impairment. Immunity 2019;51:367-380.e4.