Resumen
La enfermedad inflamatoria intestinal (EII) se caracteriza por Inflamación en el intestino. Cada vez hay más pruebas de la existencia de un período preclínico en la enfermedad de Crohn (EC) caracterizado por cambios inmunológicos que preceden a la aparición de los síntomas y que comienzan años antes del diagnóstico.
Obtener información sobre esta fase preclínica permitirá predecir y prevenir la enfermedad. El análisis de muestras de suero preclínicas, hasta 6 años antes del diagnóstico de EII (de la cohorte PREDICTS), reveló la identificación de una firma de glicosilación única en los anticuerpos circulantes (IgG) caracterizada por niveles más bajos de galactosilación del dominio cristalizable (Fc) del fragmento de IgG que permaneció estable hasta el diagnóstico de la enfermedad.
Este rasgo específico del glicano Fc de IgG2 se correlacionó con mayores niveles de anticuerpos antimicrobianos, específicamente anti-Saccharomyces cerevisiae (ASCA), lo que señala un centro de glucoma-ASCA detectado en el suero que precede en años al desarrollo de la EC.
=> Recibir por Whatsapp las noticias destacadas
Desde el punto de vista mecanístico, Gaifem, J., . et al. [A unique serum IgG glycosylation signature predicts development of Crohn’s disease and is associated with pathogenic antibodies to mannose glycan. Nat Immunol (2024). https://doi.org/10.1038/s41590-024-01916-8] demostraron que esta glicoforma agalactosilada de ASCA IgG, detectada en la fase preclínica, desencadena una vía inmunitaria proinflamatoria a través de la activación y reprogramación de células inmunitarias innatas, como las células dendríticas y las células asesinas naturales, a través de un mecanismo dependiente de FcγR, que desencadena la señalización de NF-κB y CARD9 y conduce a la activación del inflamasoma.
Se demostró que esta función proinflamatoria de ASCA depende del reconocimiento de glicano de manosa y de los niveles de galactosilación en el dominio Fc de IgG.
Las propiedades patógenas de ASCA IgG (anti-manosa) se validaron in vivo. La transferencia adoptiva de anticuerpos contra manano (ASCA) a ratones receptores de tipo salvaje resultó en una mayor susceptibilidad a la inflamación intestinal que se recuperó en ratones receptores deficientes en FcγR.
En este trabajo, identificamos una firma de glicosilación en las IgG circulantes que precede al inicio de la EC y señalamos una vía específica de glucoma-ASCA como un factor central en el inicio de la inflamación muchos años antes del diagnóstico de la EC. Este glucocentro patogénico puede constituir un nuevo biomarcador sérico prometedor para la predicción de la EC y un objetivo potencial para la prevención de la enfermedad.
En Detalle
La inmunidad humoral, en particular las respuestas mediadas por anticuerpos, desempeña un papel fundamental en la defensa del huésped contra los patógenos extracelulares.
Cabe destacar que, durante mucho tiempo, se ha considerado que la función de la inmunoglobulina (Ig) A secretora, dada su localización en la mucosa, se limitaba a la exclusión inmunitaria, es decir, la neutralización de los patógenos luminales y la prevención de la invasión del huésped.
En la última década, con la llegada de la metagenómica microbiana y la mejora de la citometría de flujo bacteriana, los estudios murinos y humanos han arrojado nueva luz sobre el comensalismo IgA/microbiota.
Ahora se considera que la IgA desempeña un papel fundamental en el apoyo al establecimiento, la selección, la diversificación y el mantenimiento a largo plazo de una microbiota intestinal comensal saludable.
También se han atribuido nuevas funciones, aunque supuestamente, a la IgM y la IgG en la interfaz intestino-microbiota. Aunque los primeros estudios han demostrado la presencia de plasmocitos IgM en biopsias intestinales de pacientes con deficiencia de IgA (IgAd), estudios más recientes proporcionan evidencia de que la IgM secretora (sIgM) se une a una fracción de la microbiota comensal en la deficiencia de IgA, mejorando así la diversidad bacteriana.
Además, la sIgM en humanos sanos parece unirse a una fracción muy restringida de la microbiota intestinal junto con la IgA secretora.
Las consecuencias funcionales de estas observaciones no están claras, pero podrían ser clínicamente relevantes, ya que está bien establecido que los pacientes que carecen selectivamente de IgA rara vez desarrollan enfermedades inflamatorias intestinales (EII), que en cambio son más comunes y graves en aquellos que carecen de IgA e IgM.
Finalmente, las respuestas sistémicas de IgG dirigidas a las comunidades microbianas intestinales se describieron inicialmente en la EII y se consideraron meramente secundarias a las translocaciones bacterianas en relación con los defectos de la barrera intestinal. Sin embargo, recientemente se ha informado de que también se pueden obtener IgG dirigidas a antígenos bacterianos, células bacterianas completas o consorcios microbianos completos de sujetos sanos.
En este artículo, Gaifem, J., . et al. [A unique serum IgG glycosylation signature predicts development of Crohn’s disease and is associated with pathogenic antibodies to mannose glycan. Nat Immunol (2024). https://doi.org/10.1038/s41590-024-01916-8] analizaron estudios recientes en ratones y humanos en un intento de proporcionar un panorama completo de nuestro conocimiento actual sobre la interacción entre los anticuerpos intestinales y la microbiota.
La IgA secretora se une a una amplia gama de comensales.
Los primeros estudios de la microbiota intestinal revelaron que la IgA secretora recubre solo una fracción de la microbiota humana y murina.
Recientemente, una combinación de citometría de flujo bacteriana con secuenciación de alto rendimiento del gen 16S ofreció una oportunidad para identificar bacterias recubiertas de IgA ex vivo. Varios estudios de IgAseq de este tipo han descrito de forma independiente las comunidades de IgA+ en ratonesy en humanos.
A pesar de algunas variaciones, las características principales del subconjunto recubierto de IgA surgen de estos datos. En primer lugar, la IgA se une a una fracción muy diversa de la microbiota, incluidos numerosos géneros raros (generalmente <1% en frecuencia).
En segundo lugar, se detectaron los cuatro filos principales, a saber, Actinobacteria, Bacteroidetes, Firmicutes y Proteobacteria, en la microbiota recubierta de IgA. De manera consistente, la mayoría de los microbios, independientemente de su filogenia microbiana, pueden inducir IgA específica en ratones gnotobióticos monocolonizados.
Cabe destacar que múltiples taxones del filo Firmicutes, en particular los que pertenecen a la familia Lachnospiraceae, están significativamente enriquecidos dentro de la fracción IgA+ independientemente de la cohorte humana.
La frecuencia relativamente alta de estos organismos en el colon humano podría explicar su prevalencia en las fracciones IgA+. Esta observación respalda estudios anteriores que muestran que los miembros de Lachnospiraceae pueden provocar respuestas inmunitarias innatas y modular respuestas inmunitarias adaptativas en el intestino.
Si bien de cada uno de los estudios mencionados se concluyó que la IgA se une preferentemente a un subconjunto taxonómicamente distinto de toda la microbiota, sigue siendo difícil definir una comunidad central recubierta de sIgA en individuos sanos.
Se ha hecho una observación similar en grupos uniformes de pacientes. Una razón probable es que la variabilidad entre estudios podría no solo ser resultado de factores técnicos, sino también de diferentes estrategias para definir la microbiota recubierta de sIgA. Las variaciones clave en los protocolos de inmunotinción, como el uso de anticuerpos anti-IgA monoclonales o policlonales, tienen un impacto sustancial en la tinción de fondo.
Las diferencias en los métodos de secuenciación también pueden explicar las variaciones observadas entre los informes. La identificación bacteriana IgA+ generalmente se basa en la secuenciación del gen 16S, pero las clasificaciones basadas en 16S no pueden discriminar entre cepas, o incluso especies, dentro del mismo género bacteriano, que pueden diferir sustancialmente en términos de inmunogenicidad. De hecho, Geva-Zatorsky et al. encontraron que dos especies relacionadas de Bacteroides (B. thetaiotaomicron y B. vulgatus) mostraron un potencial diferencial de inducción de IgA en ratones gnotobióticos monocolonizados.
Por el contrario, la secuenciación shotgun del genoma completo ha extendido la clasificación taxonómica tanto a nivel de especie como de cepa, revelando así predilecciones de IgA en niveles taxonómicos más bajos.
Además, mientras que algunos autores centraron su análisis en la población IgAhigh, otros estudios incluyeron poblaciones IgAhigh e IgAdim en la definición de microbiota IgA+.
Más allá de estas cuestiones prácticas, las variaciones entre estudios también reflejan la considerable diversidad de la microbiota intestinal humana. Numerosos factores como la edad, la dieta, los antibióticos y los antecedentes genéticos afectan la composición de la microbiota intestinal.
Curiosamente, también se ha demostrado que los factores ambientales influyen en las respuestas de IgA a las bacterias. Por ejemplo, la exposición a antibióticos se asocia con un mayor recubrimiento de IgA de Enterococcus sp y Lactobacillales y, por lo tanto, se espera que cada individuo albergue un repertorio bacteriano recubierto de IgA distinto. Otro desafío potencial para los estudios de IgAseq es que el crecimiento encadenado, impulsado por IgA de alta afinidad, puede ejercer una presión selectiva negativa.
El crecimiento encadenado también puede contribuir a un entorno con niveles más bajos de reactivación templada de fagos. Por lo tanto, se espera que las bacterias que persisten en el intestino en presencia de IgA hayan desarrollado rasgos para evitar, evadir o beneficiarse del crecimiento encadenado (como cápsulas grandes que previenen la reticulación y protegen de la depredación de fagos, o el asentamiento de microcolonias en moco profundo inducido por el crecimiento encadenado).
Se espera que las cepas que son susceptibles al crecimiento encadenado mediado por IgA estén ausentes de los datos de IgAseq y, lógicamente, son extremadamente difíciles de identificar solo por IgAseq.
También debemos tener cuidado al interpretar los datos de presencia/ausencia de especies en términos de función: la microbiota es un ecosistema complejo y cambios menores en la abundancia o función de una especie pueden tener efectos caóticos en el resto del consorcio.
Análisis de comunidades bacterianas recubiertas de IgA para desentrañar la función de la IgA.
La identificación de bacterias recubiertas de IgA ha proporcionado nuevos conocimientos sobre el papel de la IgA secretora en la homeostasis de la mucosa..
El trabajo publicado por Palm et al. sugiere que la IgA podría recubrir un grupo de bacterias intestinales propensas a enfermedades en humanos.
Esta conclusión se basa en la transferencia de microbiota IgA+ humana a modelos murinos de enfermedad. La última visión que propone que la IgA no induciría la eliminación bacteriana, sino que podría minimizar los efectos inflamatorios de las bacterias objetivo, se ha confirmado en otros estudios en ratones.
En ratones monocolonizados con B. thetaiotaomicron, Peterson et al. demostraron que la IgA específica selecciona contra un polisacárido capsular variable en fase específico asociado con una activación inmunitaria innata intestinal reducida.
La IgA madurada por afinidad también parece necesaria para el control de patobiontes de SFB (bacterias filamentosas segmentadas), ya que los ratones deficientes en AID e IgA sufren sobrecrecimiento de SFB e inflamación intestinal.
Por lo tanto, los efectos selectivos y/o neutralizantes de la IgA podrían modular la aptitud bacteriana hacia un perfil no inflamatorio.
Otra interpretación es que las bacterias con un mejor potencial de injerto en ratones tienen un impacto más pronunciado en el sistema inmunológico y, por lo tanto, es más probable que induzcan una fuerte respuesta de IgA. Estos dos efectos probablemente coexistan in vivo.
A pesar de estas observaciones, también es posible que la IgA pueda ser beneficiosa para el crecimiento comensal y, por lo tanto, podría desempeñar un papel protector en la ecología comensal.
En línea con esta idea, se observó que las especies bacterianas que se sabe que están recubiertas de IgA en muestras humanas tienen más probabilidades de estar subrepresentadas que sobrerrepresentadas en la microbiota fecal de pacientes con sIgAd.
Por lo tanto, la IgA no necesariamente inhibe el crecimiento bacteriano, ya que bacterias como Coprococcus comes, Dorea sp. y Clostridium sp. prosperan en presencia de IgA. Este efecto promicrobiano de la IgA también se ha demostrado utilizando un sistema in vitro, en el que la IgA humana facilita la formación de biopelículas y la proliferación de bacterias entéricas.
Curiosamente, Donaldson et al. demostraron que la unión de IgA a Bacteroides fragilis facilitó la adherencia a las células epiteliales intestinales al modular los epítopos de superficie promoviendo el mantenimiento a largo plazo de esta especie en la microbiota intestinal.
Además, Nakajima et al. Se demostró que la IgA interactúa con B. thetaiotaomicron a través de los O- y N-glicanos que decoran ampliamente su componente secretor y las regiones bisagra.
Estos últimos resultados también plantean la importante cuestión de la importancia relativa de los consorcios unidos a Fab (es decir, unión canónica) frente a los unidos a Fc o glicano (es decir, unión no canónica), que actualmente no se distinguen en la mayoría de los estudios de IgAseq.
La IgA como regulador de las redes bacterianas.
Una hipótesis atractiva es que la IgA podría apoyar la simbiosis bacteriana al facilitar o modificar las redes bacterianas. La simbiosis bacteriana implica que algunas bacterias dependen de otras bacterias para su persistencia.
Dentro de dicha interdependencia, una bacteria, llamada «satélite», nunca habita independientemente de otra, llamada «huésped», en una microbiota dada.
En pacientes con sIgAd, se encontró que se perdían vínculos sustanciales entre los satélites y los hospedadores, lo que significa que las redes bacterianas se alteran en ausencia de IgA.
Se podría considerar la posibilidad de que la IgA, unida de forma no canónica o que muestra reactividad entre especies, pueda favorecer la incorporación a redes simbióticas como una extensión ecológica de su capacidad para aglutinar patógenos.
A pesar de estos interesantes conocimientos sobre el papel de la IgA en la homeostasis de la microbiota, los estudios en pacientes humanos que carecen de IgA comparten un punto débil principal: dichos pacientes fueron reclutados en el hospital y, por lo tanto, pueden no ser representativos de la mayoría de los individuos con sIgAd que son asintomáticos.
Para comprender mejor el papel fisiológico de la IgA en los seres humanos, un desafío importante será explorar una gran cantidad de individuos asintomáticos con sIgAd y diseñar estudios de intervención en pacientes sintomáticos.
Los estudios longitudinales también serían relevantes para observar el efecto de la IgA en la estabilidad de la cepa a lo largo del tiempo.
Hacia la definición de las deficiencias de IgA a nivel funcional.
El impresionante desarrollo del conocimiento en torno a los repertorios bacterianos recubiertos de IgA puede llevar a la definición de nuevas condiciones inmunopatológicas caracterizadas por patrones aberrantes de recubrimiento de IgA.
Aunque tales perturbaciones ya se han descrito en humanos, sus consecuencias clínicas necesitan ser investigadas. Inicialmente, Dzidic et al. informaron que proporciones bajas de bacterias derivadas del intestino recubiertas de IgA en bebés a los 12 meses de edad precedieron al desarrollo del asma alérgica.
Además, los repertorios de IgA+ diferían notablemente entre niños sanos y alérgicos. Aunque estos resultados siguen siendo correlativos, se podría especular que la reducción general del recubrimiento de IgA podría reflejar una estimulación más débil del sistema inmunológico de las mucosas en niños alérgicos.
Será interesante realizar un seguimiento para determinar si esto se debe a la presencia de especies menos invasivas o a un manejo alterado por parte del sistema inmunológico de niños muy pequeños con alto riesgo de atopia. Además, se midieron las fluctuaciones de la fracción de IgA+ en la microbiota fecal de la esclerosis múltiple en función del estado de la enfermedad (p. ej., remisión o recaída).
El subconjunto recubierto de IgA tendió a aumentar durante la remisión, mientras que se encontró una disminución significativa de las bacterias recubiertas de IgA en pacientes activos.
Más allá de la IgA por sí sola, los autores descubrieron que las células secretoras de IgA viajan desde el intestino hasta el cerebro para atenuar la neuroinflamación de una manera dependiente de la interleucina-10.
Trasladando este resultado de ratones a humanos, los autores especularon que una reducción en las bacterias unidas a IgA podría deberse a la salida de las células secretoras de IgA fuera del intestino.
También se han analizado patrones aberrantes de recubrimiento de IgA a nivel de familia bacteriana en niños desnutridos. Gordon et al. informó que la capa de IgA de Enterobacteriaceae discriminaba entre niños sanos y desnutridos, lo que sugiere una interrelación entre las respuestas de IgA y el estado nutricional. Se deberían realizar más investigaciones para investigar si estos cambios en la capa de IgA surgen como consecuencia de la enfermedad o juegan un papel causal.
La IgM secretora refuerza el papel de la IgA secretora.
Además de las células secretoras de IgA, la mucosa intestinal también contiene células secretoras de IgM que coexisten con células B de memoria IgM relacionadas clonalmente en humanos, pero no en ratones. Estas células B de memoria IgM recientemente descritas albergan una firma genética distinta de las células B de la zona marginal esplénica, pero que refleja la experiencia antigénica.
Tanto las células B secretoras de IgM como las de memoria IgM surgen tan pronto como 1,5 meses después del nacimiento. La cantidad de células B de memoria IgM permanece estable con el tiempo, mientras que las células secretoras de IgM se acumulan durante los primeros 10 años de vida. Las células secretoras de IgM liberan sIgM en el lumen intestinal a través del receptor de Ig polimérico (pIgR).
Mientras que la IgM pentamérica muestra una mayor afinidad por el pIgR, la exportación de la IgA dimérica se ve favorecida por un factor de 5. Esto probablemente se deba al gran tamaño de la IgM, que limita su difusión a través del estroma y su acceso al pIgR.
A diferencia de la sIgA, la parte del receptor extracelular (componente secretor, SC) se incorpora de forma no covalente a la IgM pentamérica, lo que explica por qué la sIgM no es tan resistente como la sIgA a la degradación proteolítica en el intestino. Es importante destacar que el SC libre que se libera del exceso de pIgR desocupado en la mayoría de las secreciones coopera con el SC unido para estabilizar la estructura cuaternaria de la sIgM.
Varios estudios establecieron que la sIgM desempeña un papel protector en las infecciones gastrointestinales.
Mientras que la exclusión inmunitaria se realiza principalmente por sIgA, sIgM puede unirse de manera eficiente a ciertos patógenos como Salmonella enterica Typhimurium y limitar su entrada en las placas de Peyer.
En un modelo experimental de ratón Shigella flexneri, sIgM también mostró la capacidad de modular la expresión de factores de virulencia bacterianos, preservando así la homeostasis de la superficie epitelial.
A diferencia de sIgA, sIgM puede activar el sistema del complemento, facilitando la eliminación de patógenos a través de la vía clásica y conduciendo a la formación de complejos de ataque de membrana u opsonización para fagocitosis. Kirkland et al. demostraron que la deficiencia de sIgM y del complemento se asocian con un peor curso de la enfermedad de colitis inducida por DSS, lo que respalda un papel de IgM en la homeostasis intestinal.
Sin embargo, no se estudiaron las variaciones de la microbiota en ratones WT versus mutantes en estos animales inmunodeficientes. El papel protector de sIgM se ilustra aún más en pacientes con deficiencia selectiva primaria de IgM que presentan una mayor susceptibilidad a las infecciones de las mucosas.
Durante años, se ha considerado que la producción de sIgM funciona como un mecanismo compensatorio en pacientes que carecen de IgA, lo que explica el fenotipo leve en estos últimos. De hecho, se detectaron numerosas células productoras de IgM en muestras de mucosa de pacientes con sIgAd en comparación con donantes sanos.
De manera consistente, encontraron una unión sustancial de IgM a comensales en muestras fecales de sIgAd y niveles más altos de IgM libre en heces en comparación con donantes sanos.
Sin embargo, a diferencia de sIgA, se encontró que sIgM se une de manera deficiente a las bacterias que pertenecen a la familia Enterobacteriaceae, que de hecho crecen en exceso en la microbiota de sIgAd. Estas observaciones podrían explicar la susceptibilidad a los enteropatógenos en pacientes con sIgAd.
También observamos que la unión de sIgM preserva la diversidad de Actinobacteria, que, sorprendentemente, disminuyó drásticamente en pacientes con inmunodeficiencia variable común (IDCV), que carecen tanto de IgA como de IgM, destacando así un nuevo papel de sIgM en el apoyo a la diversidad de la microbiota intestinal.
Es poco probable que la función de IgM esté restringida a un estado de enfermedad particular en humanos. De hecho, Magri et al. perfilaron las bacterias incrustadas en el moco del íleon y el colon de individuos sanos y detectaron comensales significativos unidos a IgM.
Se ha encontrado una mayor diversidad bacteriana en las comunidades recubiertas de IgM, lo que corrobora la noción de que sIgM optimiza la diversidad de la microbiota y probablemente maximiza la retención de moco de comunidades bacterianas específicas con supuestos efectos beneficiosos.
En consecuencia, la microbiota de los pacientes con IDCV se caracteriza por una reducción drástica de la diversidad bacteriana y un alto índice de disbiosis, en comparación con la microbiota de sIgAd. Además, la prevalencia de EII es mayor en los pacientes con IDCV que en los pacientes con sIgAd.
En conjunto, la sIgM parece desempeñar un papel doble en el intestino, por un lado, proporcionando protección contra los patógenos y, por otro, preservando la diversidad de la microbiota intestinal y la homeostasis intestinal, en particular en el caso de insuficiencia de barrera o de IgA.
Heterogeneidad espacial de la Ig secretora.
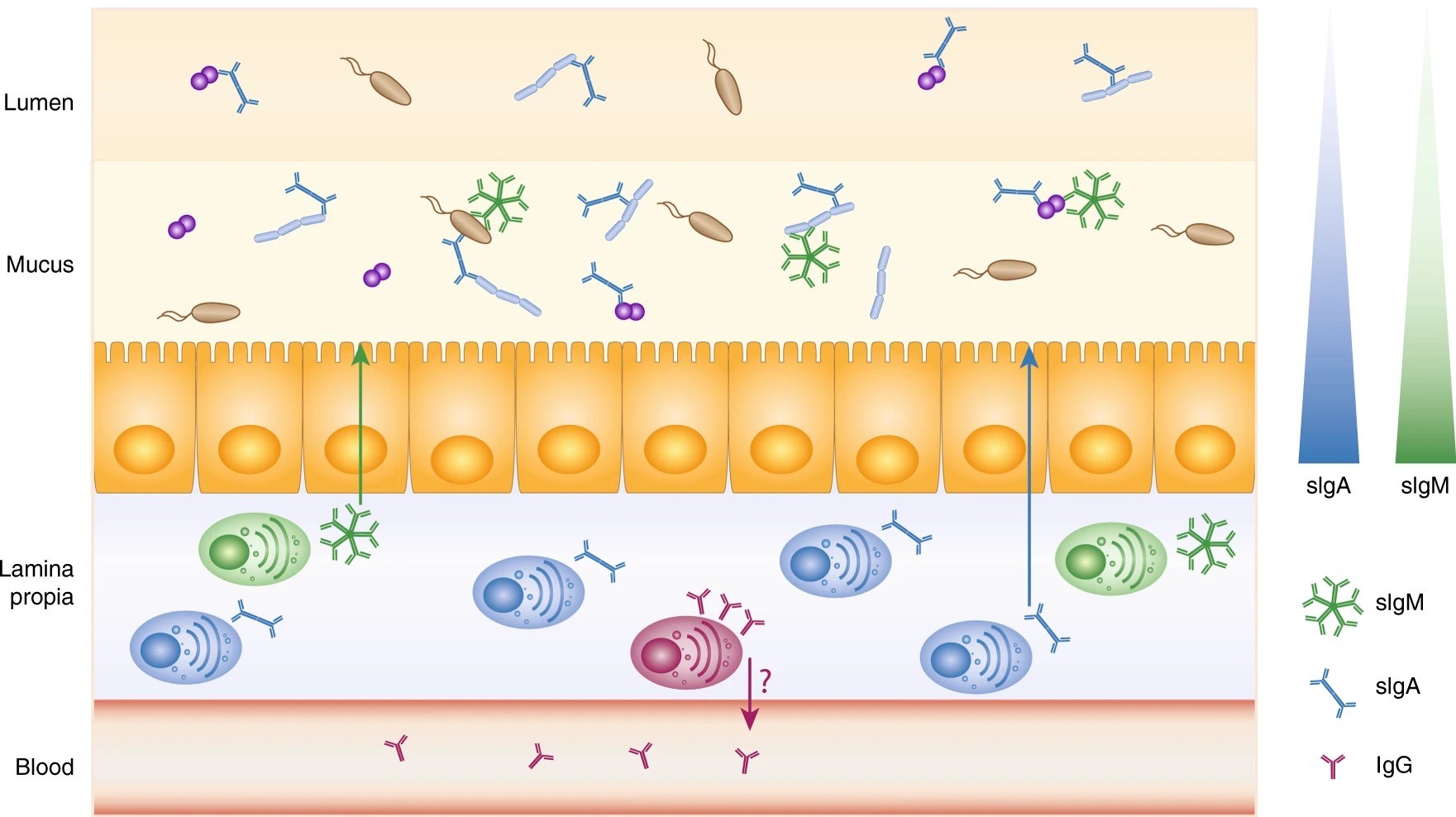
La caracterización de los comensales unidos a Ig, que se obtiene mediante citometría de flujo bacteriana, proporciona una valiosa imagen de la heterogeneidad espacial de las comunidades bacterianas y de la abundancia de anticuerpos secretores. Por ejemplo, las bacterias unidas a Ig son más frecuentes en el íleon que en el colon y en el moco en comparación con el lumen intestinal central.
La capa de moco es fina en el intestino delgado, pero se divide en dos capas distintas en el colon: una capa interna adherida y una capa externa de moco suelto. Se utilizaron muestras de hisopado o biopsia de colon para perfilar las bacterias asociadas al moco, mientras que el contenido fecal sirvió como representante del lumen intestinal central.
En la capa de moco, la microbiota sana se puede dividir en tres fracciones: comensales sIgA+sIgM+, sIgA+sIgM− y sIgA−sIgM−, aunque en el lumen intestinal central no se han detectado bacterias recubiertas de sIgM en donantes sanos. Por lo tanto, solo se pueden discriminar dos fracciones: bacterias sIgA+sIgM− y sIgA−sIgM− (Fig. 1)
Se podría especular que sIgM no se puede detectar en el lumen intestinal central debido a su difusión lenta y dependiente del tamaño a través del moco y su proteólisis rápida, aunque esto aún debe demostrarse in vivo.
La existencia de un gradiente de anticuerpos desde el epitelio hasta el lumen intestinal central y desde los compartimentos proximales hasta los distales podría complicar nuestra comprensión de la función de la Ig secretora.
La Ig secretora puede funcionar de manera diferente según la densidad bacteriana, la concentración de anticuerpos y un entorno de moco enriquecido con glicoproteínas.
Un estudio reveló que la densidad bacteriana determina cómo la sIgA aglutina las bacterias. En altas densidades de patógenos, la IgA aglutina eficazmente a los patógenos a medida que chocan aleatoriamente en el compartimento intestinal.
Sin embargo, en densidades más bajas, las colisiones de patógenos son demasiado raras y la aglutinación mediada por IgA solo puede ocurrir mediante el encadenamiento de bacterias en crecimiento (que necesariamente están en estrecha proximidad).
Debido a que la ubicación también influirá en las tasas de crecimiento bacteriano, el trabajo futuro debería determinar cómo la biogeografía podría tener implicaciones para las funciones de la Ig secretora.
Respuestas sistémicas de IgG a la microbiota.
Se pensó que la observación inicial de que los pacientes con EII presentaban altos títulos de IgG sérica contra las bacterias comensales intestinales reflejaba una barrera epitelial permeable en estos pacientes.
Sin embargo, varios estudios recientes han demostrado que también se pueden detectar niveles robustos de IgG sérica capaz de unirse a bacterias simbióticas en humanos sanos. De manera similar, las células T CD4+ periféricas específicas para el intestino están presentes en donantes sanos.
Utilizando nuevos ensayos sensibles, como matrices de proteínas microbianas y citometría de flujo bacteriana, se ha demostrado que los niveles séricos de IgG con afinidad medible por los comensales surgen a los 6 meses de edad, aumentan de los 12 a los 24 meses de edad y permanecen estables en la edad adulta. Este momento se correlaciona bien con el patrón de colonización intestinal al nacer, la diversificación de la microbiota después del destete y la estabilización de la microbiota durante edad adulta.
El análisis longitudinal dentro de un marco temporal de 5 a 6 años mostró que las respuestas de anticuerpos de unión a comensales no cambian significativamente con el tiempo en humanos.
En línea con estos datos, se han encontrado anticuerpos IgG anti-comensales en ratones naïve alojados en condiciones de estado estable. Además, un modelo elegante de colonización reversible por Escherichia coli demostró inequívocamente que las bacterias restringidas intestinalmente pueden inducir niveles persistentes de IgG específica en la periferia.
Los primeros estudios que utilizaron citometría de flujo bacteriana mostraron que la IgG sistémica se unía a una amplia gama de bacterias comensales (E. coli, Enterococcus faecalis y B. fragilis), así como a ciertos hongos comensales como Candida albicans. Recientemente informamos que aproximadamente el 1% de la microbiota intestinal de individuos sanos puede unirse a la IgG sérica.
Sorprendentemente, la IgG sérica converge con la IgA secretora hacia los mismos objetivos bacterianos y cada sujeto exhibe un conjunto privado de comensales preferidos dirigidos a la IgG. Sin embargo, surgió un repertorio de IgG «central» para comensales particulares, y los géneros pertenecientes a Proteobacteria (Serratia, Achromobacter y Delftia, por ejemplo) se enriquecen preferentemente en la fracción de la microbiota dirigida a la IgG.
Cabe destacar que varios taxones del filo Proteobacteria se han descrito previamente como objetivos de la IgA secretora en varios estudios humanos y murinos.
En conjunto, estas observaciones sugieren que la IgG sérica recubre un subconjunto particular de la microbiota, que incluye una amplia gama de bacterias, enriquecida en Proteobacteria. Debido a que el análisis de secuenciación 16S no puede resolver las variaciones de especies y subcepas que modulan directamente las respuestas de IgG, Christmann et al.
Se desarrolló un enfoque alternativo para descifrar los determinantes bacterianos de las respuestas de IgG mediante la impresión de portaobjetos con un panel de antígenos conocidos de la microbiota intestinal. Mediante esta técnica, se descubrió la reactividad de IgG a diferentes componentes bacterianos, tanto extracelulares como intracelulares, de los tres filos más destacados de la microbiota intestinal humana.
Se encontró que cuatro antígenos eran universalmente reconocidos entre la cohorte. Queda por demostrar si esto se debe a la reactividad cruzada con antígenos patógenos comunes aún no identificados, o si se puede validar la intrigante hipótesis que postula la existencia de una reactividad central de IgG que se une a la microbiota.
Los resultados de un estudio reciente respaldaron la idea de la reactividad cruzada de IgG que se une a la microbiota al mostrar que los anticuerpos monoclonales específicos para el antígeno O3 de Klebsiella, un polímero de manosa, también se unen a glicanos que contienen manosa derivados de levaduras y mamíferos.
Se ha demostrado que dichos anticuerpos se unen a una serie de comensales, probablemente compartiendo estructuras de superficie que contienen manosa.
El origen de la IgG sistémica antimicrobiota.+
Varios estudios exploraron la IgG que se une a los comensales en ratones y humanos, pero aún no está claro cómo se desarrolla esta respuesta sistémica a la microbiota intestinal. Probablemente refleje la exposición episódica a los comensales intestinales que rompen la barrera intestinal.
Se ha observado un aumento de la permeabilidad intestinal en humanos después de comidas ricas en grasas, atracones de alcohol o el uso de inhibidores de la bomba de protones y la absorción de fármacos antiinflamatorios no esteroides. Varios patógenos intestinales, incluidas las bacterias y los virus, también pueden alterar la barrera epitelial intestinal. En tales condiciones, la translocación comensal tiene lugar en un contexto inflamatorio, probablemente en presencia de citocinas que promueven la producción de IgG, en lugar de IgA, en la lámina propia. Cabe destacar que el análisis de la secuencia del gen Ig ha revelado que las células secretoras de IgG e IgA intestinales no están relacionadas clonalmente y, por lo tanto, se originan a partir de precursores independientes. De manera consistente, el cambio directo de IgM a IgA1 o IgA2 predomina en la mucosa colónica, en contraste con el raro evento secuencial durante el cual IgM cambia a IgA2 a través de IgG2, lo que refuerza la idea de que las células B IgA e IgG específicas de la microbiota surgen a través de mecanismos independientes.
Los datos experimentales en modelos de ratón han detallado la ontogenia de las células B IgG anticomensales mostrando que muchos anticuerpos de unión a comensales se generan de una manera independiente de las células T, dependiente de la señalización TLR en las células B.
Estas células B podrían derivar de células B1 en ratones, aunque la relevancia de este hallazgo para la biología humana sigue sin estar clara. La microbiota también apoya de manera no específica la producción de anticuerpos sistémicos a través de la producción de ácidos grasos de cadena corta (SCFA), los principales metabolitos microbianos de la fermentación de la fibra dietética.
Los SCFA promueven la diferenciación de las células B en células secretoras de anticuerpos y estimulan el metabolismo de las células B, lo que da como resultado la producción de anticuerpos.
El tejido linfoide asociado al intestino (GALT) es el sitio primario de inducción de IgA. Por el contrario, aún queda por determinar en qué medida el GALT contribuye al repertorio de IgG. Aunque el acervo de células B intestinales está dominado en gran medida por células productoras de IgA, entre el 3 y el 4 % de las células secretoras de anticuerpos intestinales expresan IgG en estado estacionario en humanos. Aproximadamente dos tercios de los anticuerpos monoclonales derivados de los plasmablastos IgG+ intestinales reaccionan con las bacterias intestinales comunes.
Además, la mayoría de los anticuerpos IgG anticomensales eran de la subclase IgG2 y se han detectado células secretoras de IgG2 en la lámina propia en todo el intestino. Además, se han detectado concentraciones séricas más altas de anti-E.
Los niveles de IgG de coli en pacientes con EII se asociaron con un aumento sustancial de las células B IgG+ intestinales. En ratones, los ganglios linfáticos mesentéricos también han estado implicados en la generación de respuestas IgG sistémicas a bacterias invasivas.
En conjunto, estos datos sugieren que las células B IgG+ intestinales podrían contribuir al repertorio de IgG sérica en humanos (Fig. 1). Recientemente, Wilmore et al. demostraron que los miembros de la microbiota intestinal mejoran los niveles séricos de IgA e inducen un gran número de células secretoras de IgA en la médula ósea. Sin embargo, la existencia de dicho eje intestino/médula ósea que respalde la producción de IgG anticomensal aún debe probarse tanto en humanos como en ratones.
Una razón de ser para la IgG anticomensal
La relevancia funcional de la IgG anticomensal sistémica se reveló por primera vez al producir evidencia de su papel protector en infecciones gastrointestinales y sistémicas. Los ratones que carecen de los componentes de señalización inmunitaria innata MyD88 y TRIF producen espontáneamente niveles muy altos de IgG dirigida a la microbiota. La colonización gnotobiótica demostró que estas respuestas dependían de las células T y, al menos en parte, eran capaces de brindar protección contra la sepsis.
La relevancia clínica de la IgG antimicrobiota es consistente con las observaciones de que los pacientes con IDCV, que carecen de IgG circulante, pero no de IgA intestinal, sufren sin embargo infecciones gastrointestinales y trastornos linfoproliferativos.
La IgG anticomensal también desempeña un papel en la vida temprana en la modulación del desarrollo del sistema inmunológico neonatal, con efectos tanto estimulantes como reguladores.
La IgG materna se transporta al neonato a través de la placenta mediante el receptor Fc neonatal, que también media la captación neonatal de la IgG ingerida a través de la leche materna en el intestino delgado.
La transferencia de IgG durante la gestación impulsa el desarrollo de células linfoides innatas intestinales NKp46+ (ILC3) y provoca cambios en el perfil de expresión génica intestinal, en particular los genes implicados en la secreción de moco y el metabolismo del azúcar o de xenobióticos dietéticos cuya expresión se regula positivamente de manera dependiente de anticuerpos.
Además, el estudio de Gómez de Agüero et al. indicó que los productos microbianos de la microbiota materna, probablemente unidos por la IgG, se transfirieron al neonato antes del nacimiento.
Por lo tanto, la IgG parece preparar al neonato en el útero para la colonización bacteriana masiva que ocurre después del nacimiento. La especificidad de estas IgG transferidas al neonato aún está por definir, pero es tentador especular que la IgG anticomensal es un componente importante.
También se ha descubierto que la IgG anticomensal ingerida a través de la leche materna tiene efectos reguladores en el sistema inmunológico neonatal.
La leche materna contiene IgA e IgG secretoras que cooperan para desalentar la translocación bacteriana y, por lo tanto, limitan las respuestas de las células T de la mucosa.
En ratones que carecen de anticuerpos maternos, se ha descrito una mayor frecuencia de células T auxiliares foliculares y células B del centro germinal, lo que da como resultado una mayor producción de anticuerpos destinada a restablecer la homeostasis.
La ausencia de IgA o IgG durante la succión es suficiente para alimentar respuestas inmunes aberrantes en la mucosa intestinal.
En resumen, la IgG anticomensal sistémica (i) proporciona un conjunto preexistente de anticuerpos contra una variedad de patógenos y (ii) podría desempeñar un papel crítico en la modulación del desarrollo del sistema inmunológico en la vida temprana. Aunque estos hallazgos plantean posibilidades interesantes en términos de nuevas estrategias terapéuticas, aún faltan datos humanos.
En la actualidad, múltiples ensayos clínicos no han logrado demostrar efectos beneficiosos consistentes de las IgG humanas agrupadas (IVIG) en la sepsis, lo que sugiere que las IVIG no contienen las especificidades apropiadas.
IgG anticomensal y cáncer.
La evidencia actual apoya un modelo en el que algunos comensales (potencialmente invasivos) son capaces de inducir respuestas de IgG en el contexto de una microbiota sana y una barrera intestinal intacta. Sin embargo, otros microbios podrían inducir respuestas sistémicas solo en el contexto de disbiosis o trastornos de la barrera intestinal.
Esta hipótesis ha sido ampliamente estudiada en pacientes con EII que presentaron respuestas séricas de IgG anticomensal elevadas y sesgadas.
Más recientemente, se informó que los pacientes con sIgAd tienen un nivel más alto de IgG anticomensal, lo que sugiere que la translocación bacteriana puede ocurrir con mayor frecuencia en ausencia de IgA secretora. Además, los pacientes con sIgAd (SIgAd) albergan un conjunto diferente de IgG anticomensal, en comparación con los donantes sanos, lo que es consistente con la presencia de una disbiosis leve.
Se han descrito mayores alteraciones de la composición y diversidad de la microbiota intestinal en muestras fecales de pacientes con IDCV, que carecen tanto de IgA como de IgG.
En línea con estos hallazgos, la IgG combinada de donantes sanos (IVIG) se unió pobremente a las bacterias fecales de pacientes con IDCV, lo que significa que estos anticuerpos no contienen especificidades apropiadas de IgG anticomensal para el tratamiento de pacientes disbióticos.
En el cáncer colorrectal (CCR), los cambios en el tejido intestinal dan como resultado un intestino permeable, con posibles excursiones bacterianas aberrantes. También se ha informado que el CCR colorrectal está asociado con una mayor prevalencia de Fusobacterium nucleatum, una especie bacteriana con potencial oncogénico.
Un estudio prospectivo asoció recientemente un candidato comensal, Streptococcus gallolyticus subespecie gallolyticus (SGG) con riesgo de desarrollar CCR, ya que los IgG anti-SGG estaban presentes con mayor frecuencia en individuos que desarrollaron cáncer más tarde en la vida .
Aunque no se ha demostrado un vínculo causal entre la presencia de dichas especies y el CCR, ciertas reactividades anti-IgA o IgG anti-comensales podrían constituir biomarcadores diagnósticos potenciales para el CCR.
La detección de IgG anti-comensales también podría ofrecer nuevas oportunidades para predecir la eficacia de la inmunoterapia en el tratamiento de cánceres.
Se ha demostrado que el predominio de especies comensales distintas en la microbiota intestinal, como Akkermansia muciniphila y Enterococcus hirae, impulsa cambios inmunológicos que influyen en la eficacia anticancerígena del bloqueo de la vía PD1/PDL1 en tumores epiteliales.
La detección de IgG contra estos microbios específicos antes del tratamiento podría ser más conveniente que un análisis extenso de la composición de las heces en un intento de predecir la resistencia a estos y otros inhibidores de puntos de control inmunológico.
IgG anti-comensales y autoinmunidad.
Durante años, la teoría del mimetismo molecular ha apoyado la opinión de que es probable que las homologías entre los componentes microbianos y las proteínas humanas participen en el desarrollo de enfermedades autoinmunes.
Este dogma fue apoyado por primera vez por estudios que mostraban asociaciones entre patógenos y el riesgo de desarrollar autoinmunidad, como Campylobacter jejuni y síndrome de Guillain-Barré o Streptococcus pyogenes y dermatomiositis juvenil.
Algunos estudios publicados recientemente también apuntaron a vincular la presencia de comensales e IgG anticomensales con el desarrollo de ciertas enfermedades autoinmunes.
Recientemente, Azzouz et al. encontraron que los pacientes con LES activo mostraron una expansión fecal de la cepa Ruminococcus gnavus asociada con respuestas IgG sistémicas altas y específicas hacia esta especie, lo que sugiere que algunos componentes específicos de R. gnavus son nefritogénicos por mimetismo molecular.
La magnitud de los títulos de anticuerpos séricos dirigidos contra Enterococcus gallinarum se correlacionó con la de los anticuerpos anti-RNA en suero de pacientes con lupus eritematoso sistémico.
También se propuso que las bacterias comensales que expresan ortólogos de Ro60 podrían inducir anticuerpos reactivos cruzados contra hRo60 y, por lo tanto, desencadenar la autoinmunidad en el lupus.
Para probar esta hipótesis, los autores monocolonizaron ratones propensos al lupus con bacterias que expresaban Ro60, es decir, Bacteroides thetaiotaomicron, y observaron un aumento en la producción de autoanticuerpos y una nefritis similar al lupus. Sin embargo, la mayoría de los microbios pueden inducir respuestas inmunitarias fuertes en ratones gnotobióticos monocolonizados, lo que probablemente represente un efecto de la monocolonización debido a la sobreabundancia de una sola especie o la inmadurez del sistema mucoso libre de gérmenes en el encuentro inicial con el microbio.
Además, los ratones diabéticos no obesos con tendencia autoinmune que fueron monocolonizados con B. thetaiotaomicron en realidad portaban anticuerpos reactivos cruzados hRo60 pero no desarrollaron síntomas autoinmunes, lo que indica que el desencadenamiento de la autoinmunidad podría ser consecuencia de una interacción mucho más compleja entre los comensales, la genética del huésped y los factores ambientales.
Otro paradigma, que vincula las respuestas de IgG anticomensales y las enfermedades inmunomediadas está representado por la llamada hipótesis de la higiene. Christmann et al.
Los niveles más bajos de IgG anticomensal durante la infancia se asocian con el riesgo de desarrollar alergia más adelante, lo que sugiere que las fuertes respuestas inmunitarias antimicrobiota en los primeros años de vida podrían ser protectoras contra el desarrollo posterior de enfermedades inmunomediadas.
Asimismo, la colonización temprana por microbios, como Bacteroides sp., que activan potentemente las vías inmunitarias, desempeña un papel importante en la educación inmunitaria y la disminución de la incidencia de enfermedades autoinmunes.
Es de destacar que dichos efectos beneficiosos de desviación inmunitaria inducidos no estarían mediados predominantemente por patógenos, sino que serían el resultado de la exposición a diversos consorcios comensales.
Perspectivas.
La secuenciación de fracciones de microbiota unidas a inmunoglobulina de humanos sanos y poblaciones de pacientes ha proporcionado información sobre la naturaleza de las interacciones bacterianas con el sistema inmunológico del huésped.
Los autores y otros han observado interesantes superposiciones y distinciones entre las reactividades de IgA, IgM e IgG, que pueden indicar tanto vías de inducción diferenciales como funciones diferenciales.
Por ejemplo, las cepas bacterianas que muestran una fuerte reactividad con los tres isotipos en donantes sanos pueden ser inductores particularmente fuertes de la inmunidad humoral. Sin embargo, en pacientes con sIgAd hay una ausencia contraintuitiva (paradójica) de sIgM compensatoria dirigida contra Gammaproteobacteria, a pesar del evidente sobrecrecimiento de esta clase de bacterias gramnegativas, lo que sugiere un requisito, hasta ahora desconocido, para la inducción de sIgM.
Otro desafío sigue siendo la interpretación de estos resultados con respecto al control de la microbiota. Los mecanismos por los cuales la IgA puede perjudicar selectivamente a una especie bacteriana en el lumen intestinal están bien definidos, pero si bien existe una variedad de hipótesis, todavía hay evidencia limitada de mecanismos de procolonización.
Las sugerencias actuales incluyen la generación de microcolonias incrustadas en moco o el metabolismo bacteriano alterado. También quedan preguntas muy relevantes con respecto a la función de la Ig anticomensal en la salud y la enfermedad.
Actualmente, el fenotipo clínico relativamente leve asociado con la deficiencia de IgA es difícil de conciliar con el papel crítico que desempeña la IgA en la protección contra la enfermedad en muchos modelos animales.
Además, la robustez de la microbiota está surgiendo como un parámetro importante para la salud, en el que los anticuerpos secretores podrían desempeñar papeles tanto beneficiosos como perjudiciales.
Se requerirán estudios de perturbación/recuperación, así como investigación basada en hipótesis en sistemas de modelos experimentales, para abordar estas preguntas importantes; son prioridades, necesarias para abrir el gran potencial sin explotar de los anticuerpos secretores en la modulación de la microbiota con fines diagnósticos y terapéuticos.
Las Ig secretoras y sistémicas trabajan en conjunto para controlar la microbiota intestinal. La sIgA, la sIgM y la IgG sérica convergen hacia los mismos objetivos microbianos.4,62 La sIgA y las sIgM están presentes en concentraciones decrecientes desde el moco hasta el lumen.3,4,9,15,24 Aunque las IgG están ausentes del intestino humano sano, los plasmocitos IgG se encuentran en la lámina propia70 y probablemente contribuyan a los depósitos sistémicos de IgG anticomensales, cuyo origen principal sigue sin estar claro.